La transferencia de microbiota fecal (TMF) es un tratamiento eficaz y seguro para tratar la infección recurrente por Clostridioides difficile. Es esencial extremar esfuerzos para que la TMF se realice con rigor y en base a los conocimientos científicos. La selección del donante de microbiota fecal es un punto clave del proceso para garantizar la seguridad del receptor. Es necesario disponer de protocolos de actuación que permitan a los clínicos actuar con las máximas garantías y minimizar los riesgos del procedimiento. Por este motivo se ha constituido un grupo de trabajo multidisciplinario con el objetivo de establecer unas recomendaciones para la selección del donante de microbiota fecal.
Faecal microbiota transplantation (FMT) is an effective and safe treatment of recurrent Clostridioides difficile infection. It is essential to make every effort to perform FMT rigorously and based on scientific knowledge. Selection of the faecal microbiota donor is a key part of the process to ensure recipient safety. Protocols of action must be implemented that allow clinicians to act with the maximum guarantees and to minimise the risks of the procedure. In this regard, a multidisciplinary working group has been set up with the aim of establishing recommendations for selecting the faecal microbiota donor.
En los últimos años la transferencia de microbiota fecal (TMF) ha emergido como el tratamiento de elección para tratar la infección recurrente por Clostridioides difficile, con tasas de curación global de entre el 85 y el 90%1. Su eficacia ha quedado ampliamente demostrada en múltiples estudios no controlados y en varios ensayos clínicos2-5. Por ello, las principales guías de práctica clínica y sociedades médicas recomiendan la TMF como primera opción terapéutica en la infección por C.difficile recurrente6-10.
Los continuos avances en el conocimiento del microbioma intestinal humano han demostrado que existe una asociación entre la alteración de la microbiota intestinal y un amplio espectro de trastornos y enfermedades. Estos datos han suscitado un creciente interés en la comunidad científica para establecer el papel de la TMF en otras entidades distintas a la infección recurrente por C.difficile, como la enfermedad inflamatoria intestinal, el síndrome metabólico, la colonización intestinal por microorganismos multirresistentes, el síndrome de intestino irritable, etc.
La TMF se considera un procedimiento seguro, bien tolerado y sin prácticamente efectos adversos a corto plazo si se realiza de forma correcta. Sin embargo, la evidencia disponible en cuanto a seguridad a largo plazo es limitada. Por este motivo, es esencial establecer protocolos de actuación que permitan a los clínicos actuar con las máximas garantías y minimizar los riesgos del procedimiento.
La pandemia por el virus SARS-CoV-2 causante de la COVID-19 obliga a los profesionales a tomar medidas de control adicionales en la selección del donante de microbiota fecal. Varios estudios han documentado la presencia de ARN del virus SARS-CoV-2 en heces11,12, lo que implica un potencial riesgo de transmisión del SARS-CoV-2 vía fecal-oral. En el presente documento de posicionamiento se establecen una serie de recomendaciones para mitigar el riesgo de contagio de la COVID-19 mediante la TMF, que con certeza se irán perfeccionando a medida que avancen los conocimientos científicos en este campo.
En Cataluña se ha constituido un grupo de trabajo multidisciplinar formado por especialistas en digestología, en enfermedades infecciosas, en microbiología y en endocrinología con el objetivo de establecer unas recomendaciones que sirvan para la práctica rigurosa de esta modalidad terapéutica y, al mismo tiempo, ofrecer una ayuda práctica de la metodología a seguir. Estas recomendaciones se revisarán y actualizarán de manera programada y periódica.
Selección del donanteLa selección del donante ha de ser rigurosa para garantizar la seguridad del procedimiento. El cribado del donante es vital para prevenir la transmisión de enfermedades infecciosas. Existe además el riesgo teórico de que la TMF module la susceptibilidad a presentar condiciones o enfermedades vinculadas con la microbiota intestinal. Con el objetivo de minimizar estos riesgos, previo a la donación, a cada candidato potencial se le realizará una entrevista personal así como pruebas de laboratorio que incluyan un estudio de sangre y un estudio de heces, entre otras.
Hoja informativa para el donanteTodas las personas que entren en el proceso de selección de donantes serán informadas del funcionamiento del proceso y de la finalidad de su aportación. Para ello se les entregará un documento informativo que garantice la confidencialidad y la protección de datos personales. Posteriormente se les pedirá que firmen un consentimiento informado. En el anexo 2 se adjunta un ejemplo de hoja informativa para el donante.
Entrevista personalDurante la entrevista personal se debe enfatizar y asegurar que el donante comprende la importancia de ser veraz en sus declaraciones. La entrevista ha de realizarse sin testigos, para proteger la intimidad del donante. La seguridad del receptor es la principal preocupación; por consiguiente, el donante será descartado si en la entrevista personal se detectan antecedentes médicos relevantes o comportamientos que asocien un aumento del riesgo de contraer enfermedades transmisibles. Los donantes deben disponer de los datos de contacto de los responsables del programa de transferencia de microbiota fecal para poder notificar de forma inmediata cualquier modificación de los síntomas u otros cambios relevantes que puedan presentar durante el período de selección y donación. En el anexo 2 se adjunta un ejemplo de cuestionario a realizar en la entrevista personal.
Pruebas de laboratorioTras realizar la entrevista personal se deben realizar pruebas de laboratorio. En la tabla 1 se detallan las que se consideran primordiales. Según el contexto clínico del receptor, como sería en el caso de inmunosupresión, se pueden evaluar otros patógenos adicionales si se considera oportuno. A los donantes inmigrantes se les pueden realizar serologías añadidas según los factores de riesgo o las enfermedades propias del territorio de donde provienen (p.ej., enfermedad de Chagas, esquistosomiasis, etc.).
Pruebas de laboratorio
| Sangre | Filtrado glomerular, perfil hepático, proteína C reactiva, tirotropina (TSH) y tiroxina (T4), anticuerpos antitransglutaminasa, perfil lipídico |
| Virus | Citomegalovirus Ac IgG y virus Epstein-Barr Ac IgGaHerpes simple I + II Ac IgGa |
| Virus hepatotropos: HBsAg, HBcAc, Ac VHC, VHA IgM, VHE IgM | |
| Virus de la inmunodeficiencia humana (VIH-1, VIH-2) | |
| HTLV (virus linfotrófico humano) tipo I + II (Ac)Serología para SARS-CoV-2 (Ac IgM + Ac IgG) | |
| Bacterias | Serología frente a Treponema pallidum |
| Parásitos | Strongyloides stercoralis Ac IgG (ELISA)Toxoplasma gondii Ac IgG |
| Heces | |
| Bacterias | Coprocultivo estándar (Campylobacter, Salmonella, Shigella y Yersinia) |
| Estudio para Clostridioides difficile toxigénico | |
| PCR a tiempo real de patógenos gastrointestinales o técnica disponible: Campylobacter spp., Salmonella spp., Shigella spp., Yersinia spp., Vibrio cholerae, detección de patotipos de Escherichia coli (enterotoxigénico, enteroagregativo, enterohemorrágico, enteropatogénico, enteroinvasivo) | |
| Estudio para detectar portadores de bacterias multirresistentes (frotis rectal o muestra de las heces donadas): enterobacterias productoras de beta-lactamasas de espectro extendido (BLEE), enterococo resistente a vancomicina, enterobacterias resistentes a carbapenem y Staphylococcus aureus resistente a meticilina (SARM) | |
| Helicobacter pylori en heces | |
| Virus | PCR a tiempo real para norovirus, rotavirus, adenovirusPCR en heces o frotis rectal para la detección de SARS-CoV-2 |
| Parásitos | Examen convencional de parásitosEstudio mediante PCR a tiempo real o técnica disponible (EIA, etc.) para Giardia lamblia, Cryptosporidium spp., Entamoeba histolytica, Blastocystis hominis, Dientamoeba fragilis |
| Otras determinaciones | Calprotectina fecalTest de sangre oculta en heces |
| Otras | PCR nasofaríngea para la detección de SARS-CoV-2Frotis nasal para la detección de Staphylococcus aureus resistente a meticilina (SARM) |
Los donantes serán descartados si se detectan factores de riesgo de transmisión de agentes infecciosos u otras características que preveamos puedan repercutir en la salud del receptor o afectar la composición de la microbiota intestinal.
A día de hoy se desconoce cuál es la composición ideal de la microbiota intestinal del donante para que la TMF sea eficaz, de manera que los donantes son seleccionados por un principio de exclusión más que de inclusión. Se ha de tener en cuenta que si se realiza el cribado correctamente, solo una minoría podrán finalmente servir como donantes13,14.
Criterios de exclusión del donante- •
Edad inferior a 18 años o mayor de 50 años.
- •
Haber tomado antimicrobianos (antibióticos, antivirales, antifúngicos) o probióticos en los 6meses previos a la donación.
- •
Resultado positivo de cualquier patógeno determinado en las pruebas de laboratorio durante el período de cribado (tabla 1).
- •
Hábito tabáquico (>10 cigarrillos/día).
- •
Presentar fiebre o síntomas digestivos (diarrea, náuseas, vómitos, estreñimiento, dolor abdominal, etc.).
- •
Presentar antecedentes médicos relevantes (neoplasia, enfermedades transmisibles…) y, en concreto, historia de enfermedades gastrointestinales, incluyendo enfermedad inflamatoria intestinal, enfermedad celíaca, síndrome del intestino irritable, estreñimiento crónico, diarrea crónica, historia previa de infección por C.difficile o hemorragia digestiva.
- •
Historia de enfermedades autoinmunes (p.ej., esclerosis múltiple, enfermedades del tejido conectivo, diabetes mellitus tipo1), de enfermedades relacionadas con la atopia, asma, otros tipos de diabetes mellitus, tratamiento actual con agentes inmunomoduladores, historia de síndromes de dolor crónico (p.ej., fibromialgia, fatiga crónica), de trastornos neurológicos o del desarrollo neurológico, trastornos psiquiátricos, síndrome metabólico (criterios NCEP-ATPIII), obesidad (índice de masa corporal >30kg/m2) o malnutrición (índice de masa corporal <18,5kg/m2).
- •
Historia familiar de cáncer colorrectal, de síndrome de poliposis, de enfermedad inflamatoria intestinal, de enfermedad celíaca o de enfermedades autoinmunes.
- •
Consumo de drogas ilícitas.
- •
Tomar medicación que pueda ser excretada por las heces, que pueda significar un riesgo para el receptor o que pueda provocar cambios en la microbiota intestinal o disbiosis (inhibidors de la bomba de protones, etc.).
- •
Presentar comportamientos que asocien un aumento del riesgo de contraer enfermedades transmisibles:
- ∘
Comportamiento sexual de riesgo: relaciones sexuales en los últimos 6meses con parejas anónimas, con múltiples parejas, con portadores del VIH, con personas que se hayan administrado drogas por vía intravenosa, con personas que ejerzan o hayan ejercido la prostitución.
- ∘
Tatuaje, piercing o acupuntura en los últimos 6meses.
- ∘
Historia actual o previa de encarcelamiento.
- ∘
Viaje reciente (6meses) a países tropicales, países con enfermedades diarreicas endémicas o de alto riesgo de diarrea del viajero (África, Sudeste asiático, México, Centroamérica, Sudamérica, Caribe).
- ∘
Accidente reciente por pinchazo de aguja.
- ∘
Haber recibido derivados sanguíneos en los últimos 6meses.
- ∘
Haber recibido vacunas atenuadas o vivas en los últimos 6meses.
- ∘
Individuos que trabajen con animales (riesgo de trasmisión de zoonosis).
- ∘
- •
Presentar factores de riesgo de colonización por microorganismos multirresistentes:
- ∘
Trabajadores sanitarios.
- ∘
Personas en contacto con el sistema sanitario definido como: hospitalización reciente, ingreso reciente en centros de larga estancia, asistencia regular a hospitales de día o cirugía ambulatoria.
- ∘
- •
Cirugía mayor gastrointestinal.
- •
Cirugía mayor no gastrointestinal en los últimos 4meses (p.ej., neumectomía, intervención cardíaca o cirugía torácica, fractura grave (fémur, pelvis, etc.), prótesis articular (cadera, rodilla, etc.).
- •
Presentar factores de riesgo de la enfermedad de Creutzfelt-Jakob (encefalopatía espongiforme).
- •
Presentar una infección por SARS-CoV-2 (confirmada o sospecha):
- ∘
Síntomas típicos: fiebre, fatiga, tos seca, mialgias, disnea, cefalea, diarrea, anosmia, disgeusia o erupciones cutáneas; con o sin test diagnóstico.
- ∘
Test con resultado positivo para SARS-CoV-2 con o sin síntomas de la enfermedad.
- ∘
- •
Contacto de infección por SARS-CoV-2 (confirmado o probable) en las últimas 4semanas.
Varios estudios han documentado la presencia de ARN del virus SARS-CoV-2 en heces, y su detección se puede mantener incluso cuando los resultados en las muestras respiratorias son negativos11,12, hecho que implica un potencial riesgo de transmisión del SARS-CoV-2 vía fecal-oral. Con el objetivo de mitigar el riesgo de contagio de la COVID-19 mediante la TMF se recomiendan las siguientes medidas:
- •
Descartar la infección por SARS-CoV-2 a todos los donantes mediante PCR nasofaríngea +test serológico +PCR en heces o frotis rectal.
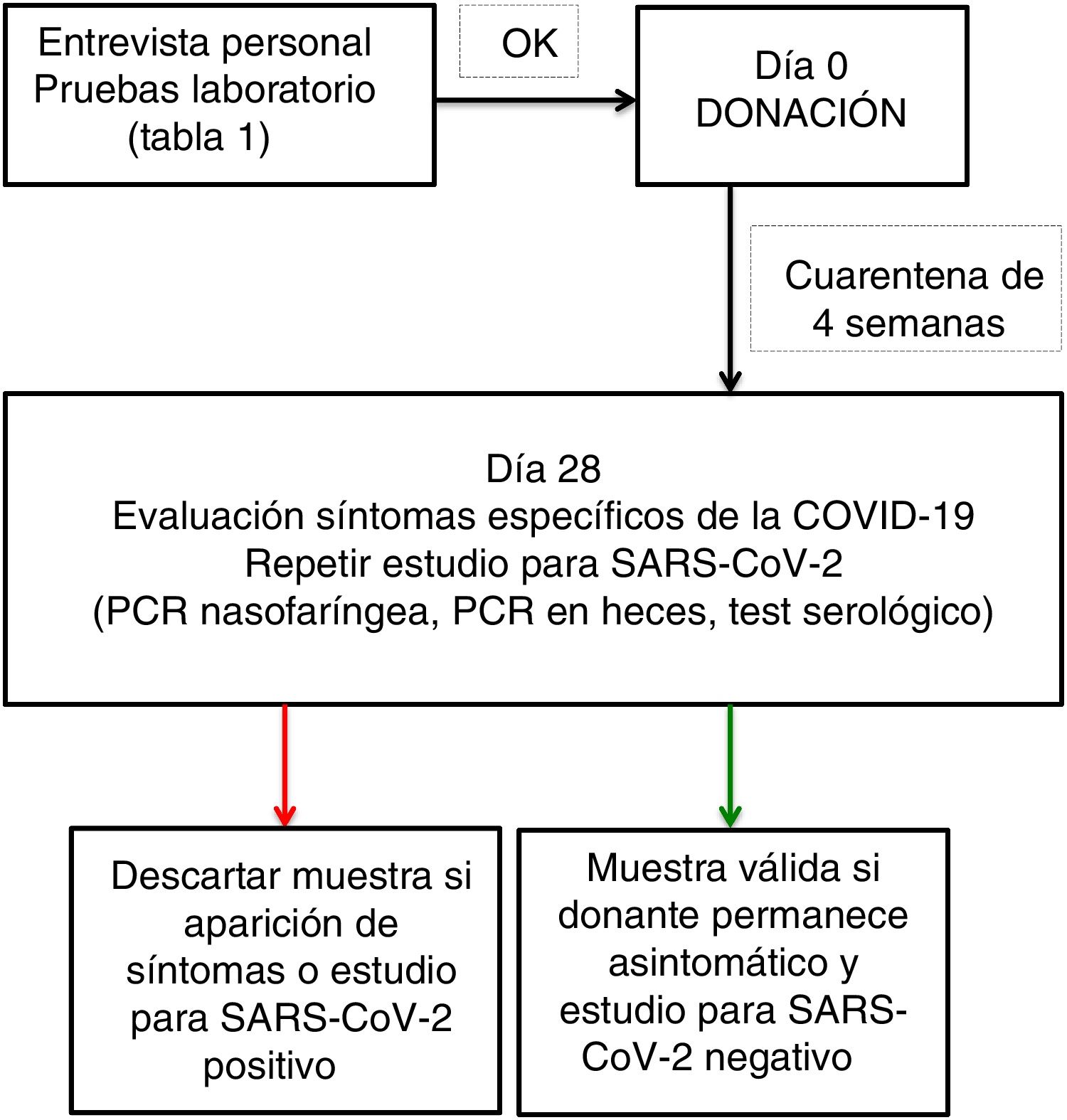
- •
Se recomienda dejar la muestra en cuarentena durante 4semanas hasta haber repetido el estudio para descartar la infección por SARS-CoV-2 (fig. 1).
- •
Cualquier resultado positivo en un test para SARS-CoV-2 o la presencia de síntomas son criterios de exclusión para la donación de microbiota fecal.
- •
Los donantes asintomáticos con IgG positiva para SARS-CoV-2 con el resto de parámetros negativos (PCR nasofaríngea, PCR en heces, IgM) no son un criterio de exclusión.
- •
Si un donante presenta síntomas de la COVID-19 o un test positivo para SARS-CoV-2, se han de destruir todas las muestras que haya dado en las últimas 4semanas.
- •
Un donante que ha presentado la COVID-19 (confirmada o sospecha) no podrá ser valorado como posible donante hasta pasadas 12 semanas de la resolución de la infección.
- •
Un donante que ha estado contacto de la COVID-19 (confirmada o sospecha) no podrá ser valorado como posible donante hasta pasadas 4semanas del contacto.
Los donantes que no presenten ningún criterio de exclusión ni en la entrevista personal ni en los resultados de las pruebas de laboratorio serán aptos para la donación. No obstante, es altamente recomendable no utilizar ninguna muestra hasta haber realizado un nuevo estudio para descartar la infección por el virus SARS-CoV-2 (PCR nasofaríngea +test serológico +PCR en heces) pasadas 4semanas de la donación (fig. 1).
Como medida adicional se aconseja mantener la donación en cuarentena de 60días hasta que el donante supere nuevamente las pruebas de laboratorio completas (independientemente de si el donante desea continuar aportando muestras o si realiza una única donación)15. Esta medida detectaría las infecciones que se encuentran en período ventana o las que no se han detectado en el estudio inicial. Las muestras que se encuentren en período de cuarentena deben conservarse a −80°C hasta su uso. Otra opción igualmente válida es conservar la muestra desecada tras el proceso de liofilización. Asimismo, y como medida de seguridad, se recomienda custodiar una alícuota de las heces del donante para en un futuro poder ser analizada, si es necesario.
Tras la primera donación, si el donante es válido y desea seguir aportando muestras se han de realizar las siguientes pruebas:
- •
Detección de cambios en el cuestionario en cada donación.
- •
Descartar la presencia de síntomas sugestivos de la COVID-19 en cada donación.
- •
PCR en heces o frotis rectal para SARS-CoV-2 en cada donación.
- •
Análisis de heces completo cada 1-2 semanas como máximo.
- •
PCR nasofaríngea para SARS-CoV-2 cada 4 semanas como máximo.
- •
Test serológico para SARS-CoV-2 cada 4 semanas.
- •
Análisis de sangre completo cada 2 meses como máximo.
No existe financiación.
Conflicto de interésLos autores declaramos que no tenemos conflicto de intereses.
Xavi Aldeguer. Servicio de Aparato Digestivo, Hospital Universitario de Girona Doctor Josep Trueta, Girona, España.
Francesc Balaguer. Servicio de Aparato Digestivo, Hospital Clínic, Barcelona, España.
Xavier Bessa i Caserras. Servicio de Aparato Digestivo, Hospital del Mar, Barcelona, España.
Natalia Borruel Sainz. Servicio de Aparato Digestivo, Hospital Universitario Vall d’Hebron, Barcelona, España.
Xavier Calvet Calvo. Servicio de Aparato Digestivo, Hospital Universitario Parc Taulí, Sabadell, Barcelona, España.
Antoni Castells. Servicio de Aparato Digestivo, Hospital Clínic, Barcelona, España.
Guillermo Cuervo. Servicio de Enfermedades Infecciosas, Hospital Universitario de Bellvitge, Hospitalet de Llobregat, Barcelona, España.
Maria Esteve Comas. Servicio de Aparato Digestivo, Hospital Universitario Mútua Terrassa, Terrassa, Barcelona, España.
Francisco Guarner Aguilar. Servicio de Aparato Digestivo, Hospital Universitario Vall d’Hebron, Barcelona, España.
José Manuel Fernández-Real. Servicio de Endocrinología, Hospital Universitario de Girona Doctor Josep Trueta, Girona, España.
Juan P Horcajada. Servicio de Enfermedades Infecciosas, Hospital del Mar, Barcelona, España.
Joaquín López-Contreras González. Servicio de Enfermedades Infecciosas, Hospital de la Santa Creu i Sant Pau, Barcelona, España.
Marc Llirós Dupré. Instituto de Investigación Biomédica de Girona (IdIBGi).
Míriam Mañosa i Ciria. Servicio de Aparato Digestivo, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona, España.
Lurdes Matas Andreu. Servicio de Microbiología Clínica, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona, España.
Ferran Navarro Risueño. Servicio de Microbiología Clínica, Hospital de la Santa Creu i Sant Pau, Barcelona, España.
Judit Orobitg Bernades. Servicio de Aparato Digestivo. Hospital Universitario de Bellvitge, Hospitalet de Llobregat, Barcelona, España.
Roger Paredes. Servicio de Enfermedades Infecciosas, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona, España.
Virginia Rodríguez-Garrido. Servicio de Microbiología Clínica, Hospital Universitario Vall d’Hebron, Barcelona, España.
José R. Santos. Servicio de Enfermedades Infecciosas, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona, España.
Nieves Sopena Galindo. Servicio de Enfermedades Infecciosas, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona, España.
German Soriano Pastor. Servicio de Aparato Digestivo, Hospital de la Santa Creu i Sant Pau, Barcelona, España.
Judith Villar-García. Servicio de Enfermedades Infecciosas, Hospital del Mar, Barcelona, España.