Determinar el valor diagnóstico del líquido libre perigástrico identificado por ecoendoscopia en pacientes con cáncer gástirico y establecer los factores relacionados con la presencia de carcinomatosis peritoneal en estos pacientes.
Material y métodosSe incluyeron de modo retrospectivo 100 pacientes con diagnóstico histológico de adenocarcinoma gástrico enviados para la realización de ecoendoscopia. Se consideró como resultado positivo la identificación por ecoendoscopia de líquido libre perigástrico. Se comparó este resultado con el estudio final basado en la laparoscopia-laparotomía exploradora. Se compararon las características histológicas y endoscópicas con respecto al resultado final.
ResultadosEn 21 pacientes (21%) se identificó la presencia de líquido libre perigástrico, en 15 de los cuales (71%) se confirmó la existencia de carcinomatosis peritoneal mediante laparoscopia (12 casos) o punción-aspiración con aguja fina (PAAF) guiada por ecoendoscopia (3 casos). En 7 de los 79 pacientes (8%) en los que no se observó la presencia de ascitis se identificaron implantes peritoneales en la laparoscopia-laparotomía exploradora. La sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y exactitud diagnóstica del líquido libre para el diagnóstico de carcinomatosis fueron del 68, 92, 71, 91 y 87%, respectivamente. No se identificaron factores histológicos o endoscópicos relacionados con la naturaleza maligna del líquido observado por ecoendoscopia.
ConclusiónEn pacientes con cáncer gástrico, el líquido libre perigástrico identificado por ecoendoscopia es un importante factor predictivo de carcinomatosis peritoneal y puede tener importantes implicaciones en el manejo de estos pacientes.
To determine the diagnostic value of free perigastric fluid identified by echoendoscopy in patients with gastric cancer and to establish the factors related to the presence of peritoneal carcinomatosis in these patients.
Material and methodsWe retrospectively included 100 patients with a histological diagnosis of gastric adenocarcinoma referred for echoendoscopy. A positive result was defined as the echoendoscopic identification of free perigastric fluid. This result was compared with the final study based on exploratory laparoscopy-laparotomy. The histological and endoscopic characteristics were compared with the final result.
ResultsFree perigastric fluid was found in 21 patients (21%). Among these, 15 (71%) showed peritoneal carcinomatosis, confirmed by laparoscopy (12 patients) or echoendoscopy-guided fine-needle-aspiration biopsy (three patients). In seven of the 79 patients (8%) not showing the presence of ascites, peritoneal implants were identified by exploratory laparoscopy-laparotomy. The sensitivity, specificity, positive predictive value and diagnostic accuracy of free fluid in the diagnosis of carcinomatosis was 68%, 92%, 71%, 91% and 87%, respectively. No histologic or endoscopic factors related to the malignancy of echoendoscopically-detected fluid were identified.
ConclusionIn patients with gastric cancer, free perigastric fluid identified by echoendoscopy is an important predictive factor of peritoneal carcinomatosis and may have significant implications in the management of these patients.
A pesar de la disminución global de la incidencia del cáncer gástrico en la última década, continúa siendo uno de los tumores gastrointestinales más frecuentes y la segunda causa de muerte por cáncer en el mundo1. En el momento actual solo el tratamiento quirúrgico es potencialmente curativo en estos pacientes y la supervivencia tras la cirugía dependerá en gran medida del estadio del cáncer en el momento de la operación. Por lo tanto, la precisión en la estadificación preoperatoria es el factor pronóstico más importante en la predicción de los resultados quirúrgicos y en la supervivencia, y será esencial cuando se plantea un tratamiento individualizado del cáncer gástrico según el estadio tumoral pudiendo evitar cirugías innecesarias en pacientes con enfermedad irresecable2.
Mediante ecoendoscopia es posible obtener imágenes de calidad de la pared gástrica y estructuras anatómicas perigástricas por lo que ha sido utilizada con alto rendimiento diagnóstico en la estadificación locorregional del cáncer gástrico3–8. Un hallazgo ecoendoscópico de difícil interpretación y que puede tener importantes implicaciones en el manejo de los pacientes con cáncer gástrico es la presencia de líquido libre perigástrico. Mientras algunos autores consideran este hallazgo como equivalente a la presencia de carcinomatosis peritoneal9,10, otros autores consideran que se trata de un hallazgo inespecífico en relación con el proceso inflamatorio perilesional y no necesariamente de naturaleza tumoral7.
El objetivo de nuestro estudio fue: a) determinar el valor diagnóstico del líquido libre perigástrico identificado por ecoendoscopia en pacientes con cáncer, y b) establecer los factores relacionados con la presencia de carcinomatosis peritoneal en estos pacientes.
Material y métodosPoblación de estudioEstudio retrospectivo realizado entre los pacientes remitidos a la Unidad de Endoscopias del Servicio de Aparato Digestivo de nuestro hospital, desde enero de 2005 a enero de 2011. Incluimos en el estudio pacientes con aceptable riesgo quirúrgico en los que tras la realización de historia clínica, exploración física, estudios analíticos, endoscopia digestiva alta con toma de biopsias, radiografía simple de tórax, ecografía abdominal y tomografía computarizada (TC) toracoabdominal habían sido diagnosticados histológicamente de adenocarcinoma gástrico en ausencia de metástasis a distancia y fueron derivados para la realización de ecoendoscopia. Se recogieron los datos epidemiológicos en estos pacientes y las características histológicas, localización y características endoscópicas y ecoendoscópicas de estos tumores. Fueron excluidos los pacientes en los que no se pudo recoger una historia clínica adecuada (un paciente), aquellos en los que no se pudo realizar la ecoendoscopia (2 pacientes con estenosis a nivel de cardias que impidió la progresión del endoscopio) o rechazaron su realización (un paciente) y aquellos en los que tras la realización de la ecoendoscopia se decidió no realizar laparoscopia-laparotomía por existir afectación ganglionar a distancia (4 casos) o afectación de órganos en vecindad (3 casos) o metástasis a distancia (2 casos).
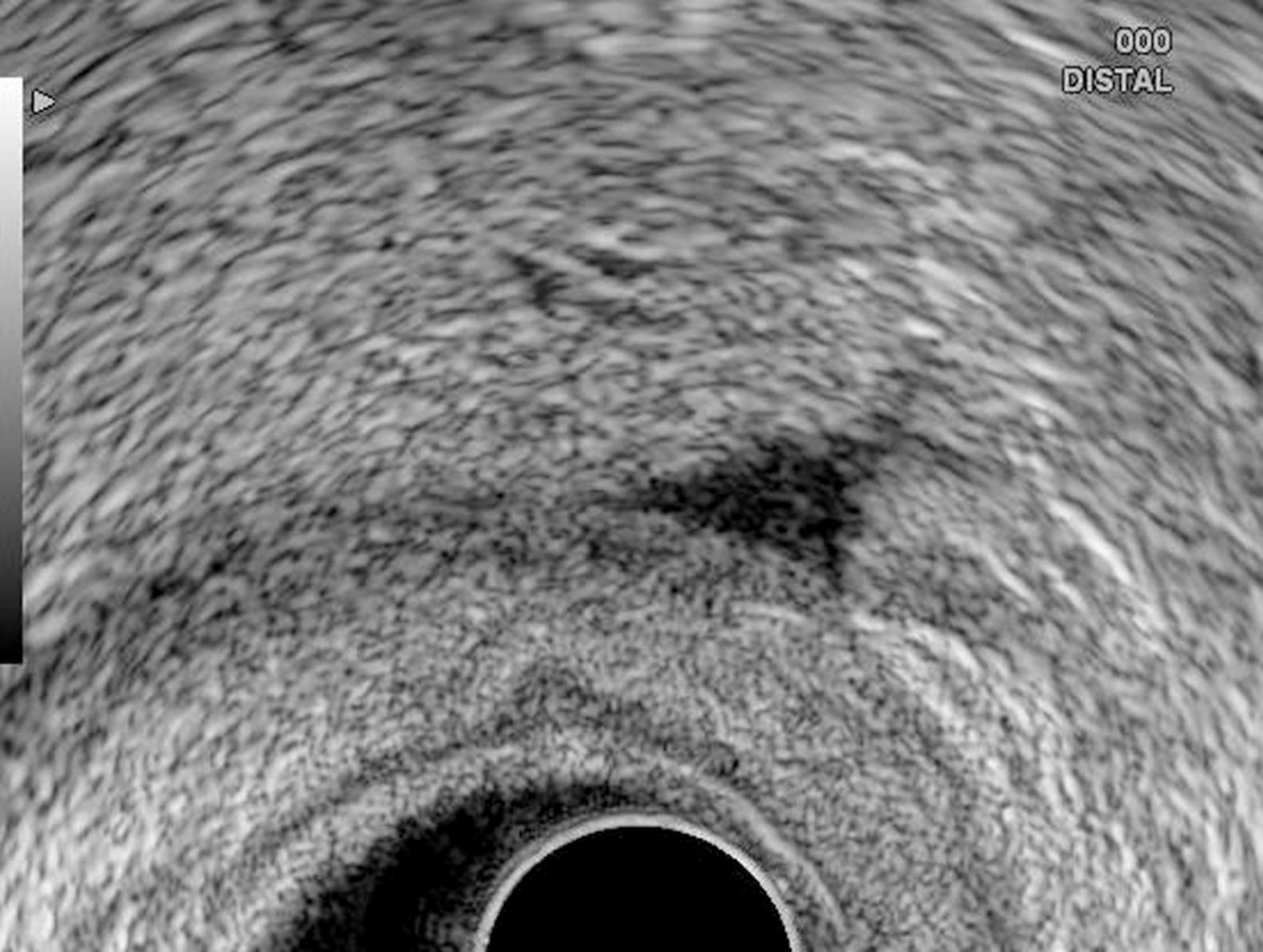
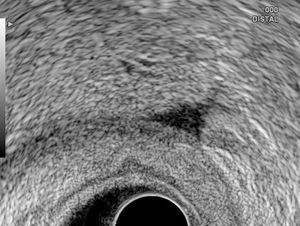
Estudio ecoendoscópicoEl equipo endoscópico empleado fue un ecoendoscopio radial Olympus modelo GF-UMQ130 (frecuencias de 7,5 y 20MHz) y, a partir de enero de 2009, un ecoendoscopio radial Pentax acoplado a ecógrafo Hitachi modelo EUB-7500A (frecuencias de 5 a 10MHz). La exploración se realizó con el paciente en decúbito lateral izquierdo utilizando sedación con midazolam o propofol. Las imágenes ecográficas de las neoplasias gástricas se obtuvieron colocando la punta del endoscopio en cuerpo y antro gástrico intentando obtener cortes ecográficos perpendiculares a la pared gástrica. Se consideraron tumores en estadio T1 aquellos con afectación exclusiva de mucosa-submucosa, en estadio T2 cuando el engrosamiento contacta con la capa correspondiente a muscular propia; en estadio T3 cuando el tumor sobrepasa la muscular propia y afecta a la adventicia, provocando irregularidad o digitaciones en el perímetro externo del tumor, y en estadio T4 si existe afectación de los órganos en vecindad. Se consideró una adenopatía como de probable naturaleza maligna cuando se identificaron al menos 2 signos ecográficos de malignidad, incluida la forma redondeada, borde bien delimitado, homogéneo y/o tamaño superior a 1cm. Se consideró como resultado positivo la identificación por ecoendoscopia de líquido libre perigástrico (fig. 1). En la realización de los estudios participaron 3 exploradores con al menos 3 años de experiencia realizando ecoendoscopia (AR, RGR y CA), en la misma unidad de trabajo y con el mismo método. En todos los pacientes se obtuvo un consentimiento informado previo a la exploración endoscópica.
Exploración de referenciaSe comparó el resultado de la ecoendoscopia, respecto a la presencia o ausencia de líquido libre, con el resultado de la exploración de referencia que fue la laparoscopia-laparotomía. Todos los pacientes fueron evaluados por un grupo multidisciplinario constituido por gastroenterólogos, cirujanos generales, oncólogos y patólogos. De forma general, tras la realización de ecoendoscopia, se planteó realizar laparoscopia diagnóstica en todos los pacientes antes de realizar un planteamiento terapéutico definitivo. Se hizo el diagnóstico de carcinomatosis peritoneal cuando se identificaron implantes peritoneales cuyo estudio histológico confirmó la naturaleza maligna de los mismos. En ausencia de implantes peritoneales la presencia de células malignas en el estudio citológico del lavado peritoneal se consideró como afectación peritoneal maligna. Se compararon las características histológicas, endoscópicas y ecoendoscópicas de los pacientes con líquido libre identificado por ecoendoscopia con respecto al resultado final obtenido en la laparoscopia-laparotomía.
Estudio estadísticoLas variables cuantitativas se indican con la media ± desviación estándar. Para la comparación de porcentajes se utilizó la prueba de la ji al cuadrado y cuando al menos más del 25% de los valores esperados eran menores de 5, mediante el test de Fisher. Se consideraron estadísticamente significativos valores de p menores de 0,05.
ResultadosSe incluyeron en el estudio 100 pacientes diagnosticados de adenocarcinoma gástrico, con una edad media de 61 ± 14 años (rango: 32-85), de los que 77 eran varones y 33 mujeres. En 50 casos se trataba de lesiones ulceradas. Existía afectación del cuerpo y/o fundus gástrico en 77 casos y del antro en 33 casos. Histológicamente en 36 casos eran tumores pobremente diferenciados y 64 moderadamente o bien diferenciados. No existieron complicaciones en relación con la ecoendoscopia.
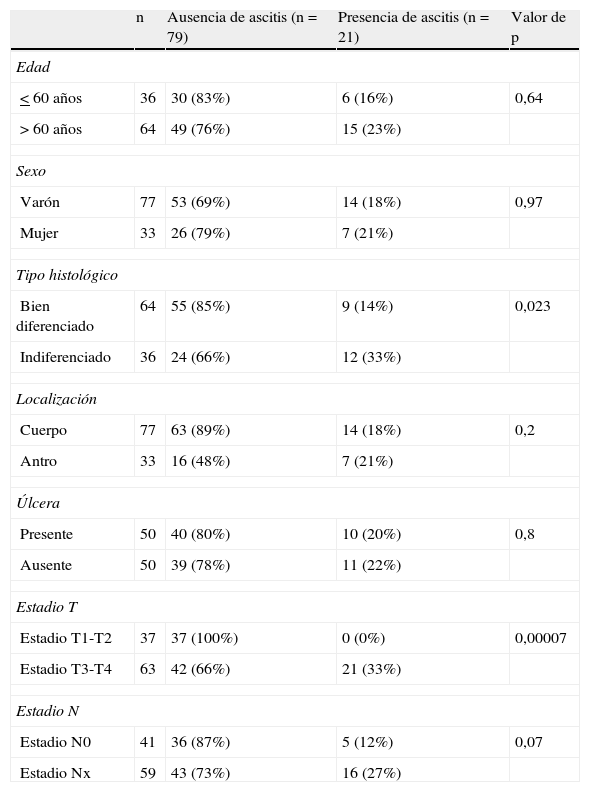
En 21 pacientes (21%) se identificó por ecoendoscopia la presencia de líquido libre perigástrico. La presencia de ascitis fue significativamente más frecuente en pacientes con tumores en estadio T3-T4 (0 frente a 33%; p=0,00007) y con tipo histológico pobremente diferenciado (14 frente a 33%; p=0,023) (tabla 1).
Características epidemiológicas y endoscópicas de 100 pacientes con cáncer gástrico estudiados por ecoendoscopia
| n | Ausencia de ascitis (n=79) | Presencia de ascitis (n=21) | Valor de p | |
| Edad | ||||
| < 60 años | 36 | 30 (83%) | 6 (16%) | 0,64 |
| > 60 años | 64 | 49 (76%) | 15 (23%) | |
| Sexo | ||||
| Varón | 77 | 53 (69%) | 14 (18%) | 0,97 |
| Mujer | 33 | 26 (79%) | 7 (21%) | |
| Tipo histológico | ||||
| Bien diferenciado | 64 | 55 (85%) | 9 (14%) | 0,023 |
| Indiferenciado | 36 | 24 (66%) | 12 (33%) | |
| Localización | ||||
| Cuerpo | 77 | 63 (89%) | 14 (18%) | 0,2 |
| Antro | 33 | 16 (48%) | 7 (21%) | |
| Úlcera | ||||
| Presente | 50 | 40 (80%) | 10 (20%) | 0,8 |
| Ausente | 50 | 39 (78%) | 11 (22%) | |
| Estadio T | ||||
| Estadio T1-T2 | 37 | 37 (100%) | 0 (0%) | 0,00007 |
| Estadio T3-T4 | 63 | 42 (66%) | 21 (33%) | |
| Estadio N | ||||
| Estadio N0 | 41 | 36 (87%) | 5 (12%) | 0,07 |
| Estadio Nx | 59 | 43 (73%) | 16 (27%) | |
En la TC abdominal realizada previamente se describía la presencia de líquido libre peritoneal en 4 casos (19%), mientras que en 17 casos (81%) este hallazgo solo se identificó por ecoendoscopia.
La demora desde la realización de la ecoendoscopia hasta la realización de la laparoscopia fue de 13±9 días. En todos los pacientes en los que se identificó por laparoscopia la presencia de implantes peritoneales pero no se observó la presencia de ascitis en la ecoendoscopia la demora fue menor de 14 días.
En 15 de los 21 pacientes (71%) en los que se observó por ecoendoscopia la presencia de líquido libre se confirmó la presencia de carcinomatosis peritoneal mediante laparoscopia (12 casos) o PAAF guiada por ecoendoscopia (3 casos). En estos últimos casos se completaron las exploraciones realizando paracentesis diagnóstica guiada por ecoendoscopia a nivel del fondo de saco de Douglas utilizando la vía transrrectal (evitando de este modo la contaminación de la muestra por células tumorales si la punción se hubiese realizado transgástrica). Fueron informadas como positivas para células malignas. En 7 de los 79 pacientes (8%) en los que no se observó la presencia de ascitis se identificaron implantes peritoneales en la laparoscopia exploradora (tabla 2). No fue posible realizar laparoscopia en 4 pacientes por la presencia de adherencias peritoneales. En ninguno de estos casos se identificó en la laparotomía la presencia de implantes peritoneales.
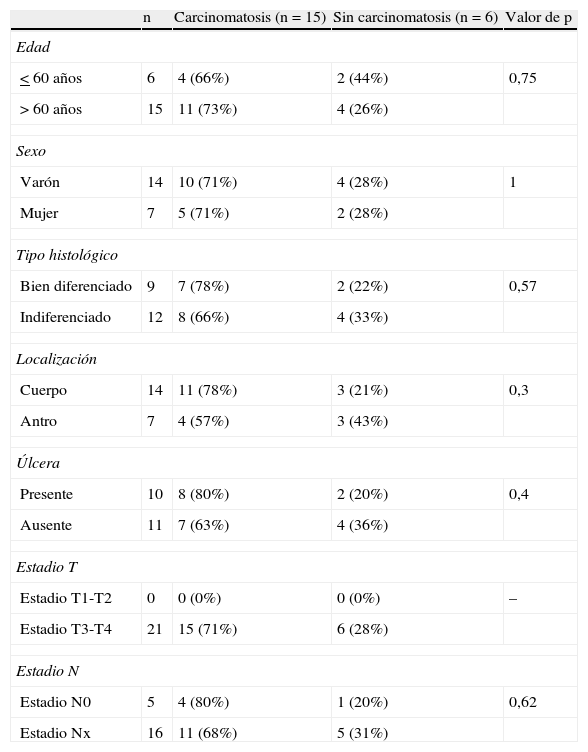
Factores relacionados con la naturaleza maligna del líquido libre peritoneal identificado por ecoendoscopia en 21 pacientes con cáncer gástrico
| n | Carcinomatosis (n=15) | Sin carcinomatosis (n=6) | Valor de p | |
| Edad | ||||
| < 60 años | 6 | 4 (66%) | 2 (44%) | 0,75 |
| > 60 años | 15 | 11 (73%) | 4 (26%) | |
| Sexo | ||||
| Varón | 14 | 10 (71%) | 4 (28%) | 1 |
| Mujer | 7 | 5 (71%) | 2 (28%) | |
| Tipo histológico | ||||
| Bien diferenciado | 9 | 7 (78%) | 2 (22%) | 0,57 |
| Indiferenciado | 12 | 8 (66%) | 4 (33%) | |
| Localización | ||||
| Cuerpo | 14 | 11 (78%) | 3 (21%) | 0,3 |
| Antro | 7 | 4 (57%) | 3 (43%) | |
| Úlcera | ||||
| Presente | 10 | 8 (80%) | 2 (20%) | 0,4 |
| Ausente | 11 | 7 (63%) | 4 (36%) | |
| Estadio T | ||||
| Estadio T1-T2 | 0 | 0 (0%) | 0 (0%) | – |
| Estadio T3-T4 | 21 | 15 (71%) | 6 (28%) | |
| Estadio N | ||||
| Estadio N0 | 5 | 4 (80%) | 1 (20%) | 0,62 |
| Estadio Nx | 16 | 11 (68%) | 5 (31%) | |
La sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la exactitud diagnóstica del líquido libre para el diagnóstico de carcinomatosis fueron del 68, 92, 71, 91 y 87%, respectivamente.
No se identificaron factores histológicos o endoscópicos relacionados con la naturaleza maligna del líquido observado por ecoendoscopia (tabla 2).
DiscusiónLa diseminación peritoneal del cáncer gástrico es frecuente, de tal modo que en el momento del diagnóstico no es posible realizar cirugía con intención curativa en el 25-50% de los pacientes con cáncer gástrico por la presencia de metástasis a distancia o peritoneales11. Habitualmente las metástasis peritoneales son pequeñas y no detectables por técnicas de imagen «convencionales», incluida la TC abdominal. Desde el interior del estómago la ecoendoscopia permite colocar la punta del endoscopio muy próxima al peritoneo y obtener imágenes de calidad de las regiones en torno a la pared gástrica, por lo que permite identificar pequeños volúmenes de líquido libre peritoneal. En este sentido se describe la presencia de ascitis no visible por otras técnicas en el 8-32% de los pacientes con cáncer gástrico explorados por ecoendoscopia9,10,12.
Aunque la ecoendoscopia permite identificar pequeños volúmenes de ascitis no visibles por otras técnicas de imagen, no permite descartar de un modo fiable la presencia de carcinomatosis peritoneal (sensibilidad del 68% en la presente serie). En este sentido se ha de tener en cuenta que los implantes peritoneales no siempre producen ascitis9,10 y en alguna serie se describe cómo hasta en el 22% de los pacientes con metástasis peritoneales de adenocarcinoma gástrico no se asocian con la presencia de ascitis10. Otros problemas técnicos influyen en estos resultados falsos negativos, como la existencia de estenosis que impidan la progresión del endoscopio y no permitan una completa estadificación tumoral o la presencia de grandes masas tumorales gástricas que no permitan identificar pequeños volúmenes de ascitis en la periferia. Es posible incluso que la sensibilidad de la ecoendoscopia en nuestra serie para este diagnóstico esté infravalorada debido a las características retrospectivas de nuestro estudio13, de tal modo que mínimos volúmenes de ascitis hayan podido pasar inadvertidos o no se hayan considerado patológicos si no ha existido una búsqueda activa de este signo como puede ocurrir en un estudio prospectivo9,10.
Con frecuencia la presencia de líquido libre perigástrico identificado por ecoendoscopia en pacientes con cáncer gástrico queda en relación con la existencia de implantes tumorales peritoneales (especificidad del 92% en la presente serie). Sin embargo, un pequeño volumen de ascitis no necesariamente es sinónimo de carcinomatosis peritoneal pues un proceso inflamatorio con afectación transmural, como puede existir en alguna neoplasia ulcerada, podría asociarse a la presencia de un pequeño volumen de líquido libre peritoneal, u otras enfermedades no tumorales incluidas cardíacas, hepáticas, renales o pancreáticas pueden ser causa de ascitis. Es por ello que este hallazgo debe interpretarse con cautela en pacientes con comorbilidad asociada. En otras ocasiones los resultados falsamente positivos probablemente correspondan a errores de la técnica considerada como de referencia, en este caso de la laparoscopia exploradora.
La laparoscopia permite visualizar directamente la cavidad peritoneal y es considerada la técnica más sensible y específica para la detección de metástasis peritoneales14,15. De tal modo que en pacientes con cáncer gástrico es posible mediante laparoscopia identificar la presencia de enfermedad metastásica no diagnóstica por TC abdominal hasta en un tercio de los casos evitando de este modo laparotomías innecesarias15. Sin embargo, algunos autores ponen en duda la utilidad de la laparoscopia como técnica de referencia en este diagnóstico y describen una menor sensibilidad diagnóstica de la laparoscopia-laparotomía (41%) que de la ecoendoscopia (87%)10. Insistiendo en las limitaciones de la laparoscopia exploradora, Sultan et al. describen en su serie que hasta en la mitad de los pacientes con cáncer gástrico y ascitis observada por ecoendoscopia pero con laparoscopia negativa existe enfermedad incurable en el momento de la laparotomía12. En 5 de los 6 pacientes de nuestra serie con líquido libre identificado por ecoendoscopia y laparoscopia negativa se pudo hacer cirugía con intención curativa. Sin embargo, en 3 de ellos existió recurrencia de la enfermedad transcurridos menos de 6 meses de la intervención quirúrgica, en 2 con ascitis evidenciada en la TC abdominal.
Al igual que lo descrito por otros autores13, en nuestra serie la presencia de ascitis en pacientes con cáncer gástrico se correlaciona con la invasión tumoral en profundidad y la pobre diferenciación histológica. Sin embargo, en pacientes con ascitis nosotros no identificamos factores técnicos o histológicos relacionados con el diagnóstico final de la carcinomatosis peritoneal en cuya presencia se pudiesen evitar otras exploraciones adicionales como la laparoscopia o la toma de biopsias.
Tras la realización de ecoendoscopia en algunos casos podría evitarse la realización de estudios adicionales, incluida la laparoscopia, en función del resultado del estudio citológico del material obtenido tras la punción peritoneal guiada por ecoendoscopia. Se trata de un procedimiento que ha demostrado ser seguro y útil en la estadificación de otras neoplasias16. Sin embargo, la punción peritoneal guiada por ecoendoscopia en los pacientes con cáncer gástrico plantea importantes limitaciones. En primer lugar la precisión global de la punción guiada por ecoendoscopia en el diagnóstico de ascitis maligna es considerada baja debido a la dificultad para aspirar suficiente volumen de líquido ascítico como para alcanzar un diagnóstico citológico concluyente17. Y en segundo lugar, con cierta frecuencia, para alcanzar el líquido peritoneal es necesario atravesar el tumor gástrico. Con ello un resultado positivo para células malignas debe ser interpretado con cautela por la posibilidad de que se trate de un resultado falso positivo y, lo más importante, el riesgo de siembra peritoneal al encontrarse el tumor en el trayecto de la aguja. Para intentar solventar estos problemas en pacientes en los que se identificó un volumen suficiente de líquido peritoneal, pero insuficiente como para realizar paracentesis percutánea, se decidió completar la exploración endoscópica realizando ecoendoscopia y punción peritoneal por vía transrectal7. A este respecto algunos autores han descrito la vía transrectal como más sensible para la detección de pequeños volúmenes de ascitis en comparación con la vía transgástrica18,19, pues permite explorar el fondo de saco de Douglas, localización en la que se puede observar la presencia de líquido libre hasta en el 38% de las neoplasias gástricas avanzadas20.
En conclusión, en el estudio por ecoendoscopia de los pacientes con cáncer gástrico la presencia de líquido libre perigástrico es un signo que debe buscarse activamente y ha de tenerse en cuenta en el posterior manejo diagnóstico-terapéutico. De tal modo que en centros en los que la laparoscopia exploradora no se realiza en todos los pacientes con cáncer gástrico, la presencia de ascitis en la ecoendoscopia debería obligar a su realización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.