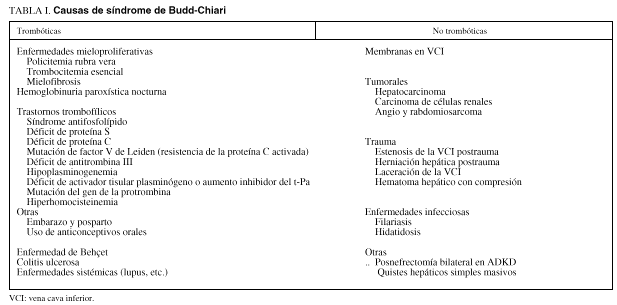
El síndrome de Budd-Chiari agrupa diferentes procesos patológicos cuyo punto común es la obstrucción parcial o completa del flujo venoso hepático. En la mayoría de las ocasiones esta obstrucción es debida a la trombosis de las venas suprahepáticas. Otras causas, más excepcionales en nuestro medio, de obstrucción al flujo venoso hepático son la presencia de membranas en la luz de la vena cava inferior, la compresión por lesiones ocupantes de espacio (tumorales o infecciosas) o por secuelas de lesiones traumáticas (tabla I).
La consecuencia de esta obstrucción venosa es el aumento de la presión hidrostática en los sinusoides hepáticos que, si es lo suficientemente intensa, ocasionará una necrosis hepatocitaria hemorrágica alrededor de la vena centrolobulillar. En caso de persistencia del proceso obstructivo, en estas zonas de necrosis aparecerán zonas de fibrosis cicatrizal uniendo las venas centrolobulillares entre sí o la vena centrolobulillar con la vena porta, pudiendo llegar a producir una cirrosis1. Excepcionalmente, la necrosis hepatocitaria afecta a una área muy extensa y da lugar a un cuadro de insuficiencia hepática fulminante.
ETIOLOGÍA
En series históricas la etiología del síndrome de Budd-Chiari se catalogaba como idiopática entre un 30 y un 50% de los casos2-4. Sin embargo, gracias al avance realizado en el diagnóstico de síndromes mieloproliferativos en forma latente y en la detección de nuevos trastornos trombofílicos, en la actualidad se establecen finalmente como idiopáticos menos del 10% de los casos. En nuestro medio, los síndromes mieloproliferativos, en especial la policitemia vera y la trombocitemia esencial, son la causa más frecuente5. Un número también importante de pacientes presenta una hemoglobinuria paroxística nocturna6 o un síndrome antifosfolípidos primario7. Menos frecuentemente, el síndrome de Budd-Chiari es ocasionado por un estado trombofílico por déficit de antitrombina III8, de proteína S o de proteína C9, por una mutación del factor V tipo Leiden (o resistencia a la proteína C activada)10 (tabla I). Se han descrito casos esporádicos de síndrome de Budd-Chiari asociado a la enfermedad de Behçet11 y a la enfermedad inflamatoria intestinal12. Los anticonceptivos orales parecen ejercer un papel, al menos como agentes coadyuvantes, en el desarrollo de la trombosis de venas suprahepáticas por cuya causa probablemente esta enfermedad predomina en las mujeres, en una proporción de 2:1 respecto a los varones13. El síndrome de Budd-Chiari también se ha diagnosticado tras el embarazo, generalmente en los primeros 2 meses posparto14 (tabla I). En una serie reciente de 21 pacientes con síndrome de Budd-Chiari estudiados en nuestra unidad pudimos llegar a un diagnóstico etiológico específico en todos menos en uno. Trece pacientes presentaban un síndrome mieloproliferativo, cuatro, una hemoglobinuria paroxística nocturna, tres, un síndrome antifosfolípido primario y tan sólo en un caso todos los estudios practicados fueron negativos y fue catalogado como idiopático. En esta serie de pacientes se investigaron de forma sistemática todos los trastornos trombofílicos conocidos en la actualidad (tabla I). Tan sólo 2 pacientes presentaban un trastorno trombofílico en forma de mutación del factor V tipo Leiden; sin embargo, ambos pacientes tenían un síndrome mieloproliferativo asociado.
CUADRO CLINICO
El curso clínico varía en función de la extensión de la obstrucción venosa y de su rapidez de instauración.
1. Forma fulminante. Es una forma clínica muy infrecuente (menos del 5%) que puede aparecer cuando la obstrucción es rápida y extensa, produciéndose una intensa necrosis hepática15. Ésta no es necesariamente la manifestación inicial del síndrome de Budd-Chiari, sino que puede aparecer en pacientes que al no recibir un tratamiento adecuado, habitualmente mediante anticoagulación, sufren fenómenos de retrombosis de las venas suprahepáticas que pueden provocar que un paciente, con una forma más o menos controlada de síndrome de Budd-Chiari, pueda presentar un brusco deterioro clínico. La clínica se inicia con dolor abdominal, vómitos, hepatomegalia dolorosa de brusca aparición, con una elevación importante de las transaminasas, ictericia, ascitis y signos de insuficiencia hepática aguda grave, con encefalopatía, insuficiencia renal y muerte. En casos excepcionales, el cuadro se inicia con dolor abdominal agudo y shock por hemoperitoneo, pudiéndose comprobar la rotura espontánea del hígado.
2. Forma subaguda. Ésta es la forma más frecuente de presentación. En ella, el cuadro clínico con dolor abdominal, desarrollo de ascitis, hepatomegalia, aumento de las transaminasas, hiperbilirrubinemia y descenso en el tiempo de protrombina se produce en un período de tiempo más prolongado que suele oscilar entre 2 semanas y 6 meses. En estos pacientes, se pueden objetivar signos de hipertensión portal como esplenomegalia y varices esofágicas que pueden sangrar. También puede existir un derrame pleural que puede ser hemorrágico. El síndrome de Budd-Chiari puede también transcurrir de forma inadvertida por ser paucisintomático y sólo ser detectado cuando se realiza un estudio diagnóstico ante el hallazgo de una hepatoesplenomegalia o alteraciones en la bioquímica hepática16.
3. Forma crónica o de cirrosis. En ésta el paciente presenta una sintomatología difícilmente distinguible de la de otros tipos de cirrosis con hipertensión portal. Quizás el dato clínico más característico sea la existencia de una ascitis rica en proteínas, de difícil tratamiento. Estos enfermos también presentan esplenomegalia y varices esofágicas. En esta fase, la biopsia hepática evidencia un parénquima hepático con importante alteración de la estructura por banda de fibrosis que unen las venas centrolobulillares (cirrosis invertida).
A menudo, el síndrome de Budd-Chiari, en cualquiera de las formas de presentación anteriores, puede asociarse a trombosis de la vena cava inferior, en cuyo caso aparecen, además, circulación colateral cava-cava, edema en extremidades inferiores y síndrome nefrótico2,15.
DATOS DE LABORATORIO
No existen alteraciones de laboratorio patognomónicas. En la forma fulminante los hallazgos son semejantes a otras formas de insuficiencia hepática aguda grave con claro aumento de las transaminasas y descenso en el tiempo de protrombina. En las formas subagudas el aumento en las transaminasas es más moderado y variable (50-200 U/l) dependiendo del grado de necrosis centrolobulillar que se esté produciendo. En las formas crónicas las alteraciones de laboratorio son semejantes a la halladas en cirrosis de otras etiologías. El líquido ascítico de los pacientes con síndrome de Budd-Chiari es rico en proteínas (más de 20-30 g/l) y la celularidad es escasa. Cuando ésta es elevada se debe sospechar la existencia de una peritonitis bacteriana espontánea, hecho que hemos observado en dos de nuestros pacientes. El hallazgo de poliglobulia y una cifra de plaquetas normales o incluso elevadas, en el contexto de un paciente con hipertensión portal, deben hacer sospechar la existencia de un síndrome mieloproliferativo subyacente2,5.
DIAGNOSTICO
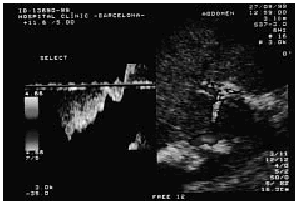
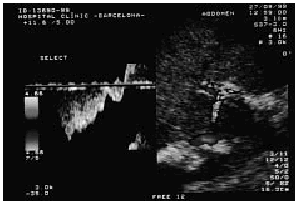
El síndrome de Budd-Chiari debe sospecharse ante la aparición, más o menos repentina, de hepatomegalia dolorosa y ascitis rica en proteínas, sobre todo si el paciente presenta una cifra normal o alta de plaquetas y hematíes. En pacientes con un síndrome mieloproliferativo el índice de sospecha de síndrome de Budd-Chiari debe ser mayor y hay que pensar en él ante cualquier dolor abdominal aunque sea inespecífico. El diagnóstico de certeza se establece mediante exploraciones complementarias. La ecografía abdominal Doppler-dúplex es la técnica de elección para el cribado del síndrome de Budd-Chiari. La ecografía abdominal, realizada por un observador experimentado, permite detectar la trombosis parcial o completa de las venas suprahepáticas; la sensibilidad diagnóstica se ve incrementada por la eco-Doppler al objetivar ausencia o anormalidades en el patrón de flujo de las venas suprahepáticas. En ocasiones, tan sólo se evidencia la presencia de una zona lineal hiperecogénica compatible con la existencia de un tracto fibroso localizado en el lugar donde debería hallarse la vena suprahepática. En fases iniciales la ecografía también permite poner de manifiesto la existencia de pequeñas cantidades de ascitis no detectables aun con la exploración clínica. En casos de mayor tiempo de evolución la ultrasonografía detecta los vasos colaterales que intentan descomprimir el sistema venoso portal (repermeabilización de la vena umbilical, anastomosis espontánea entre la rama derecha intrahepática portal y la vena cava [fig. 1], vasos colaterales intrahepáticos) y la existencia de hipertrofia del lóbulo caudado. Por último, la ecografía también nos permite evaluar la permeabilidad portal, dato que puede ser importante en el manejo posterior del paciente17-19.
Fig. 1. Imagen ecográfica que revela la existencia de una anastomosis espontánea (flecha) entre la rama portal derecha y la vena cava. (Por cortesía de la Dra. R. Gilabert.)
Otras técnicas de imagen como la TC o la RM, que también pueden objetivar la imagen de trombosis de las venas suprahepáticas20,21, no aportan ninguna ventaja sobre la ultrasonografía y por ello no deben realizarse de forma rutinaria.
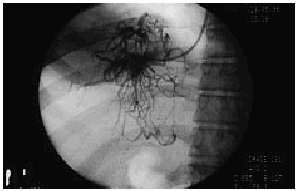
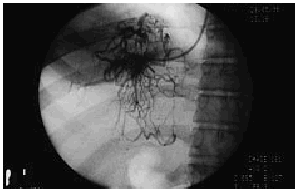
La sospecha clínica y ultrasonográfica de síndrome de Budd-Chiari debe ser confirmada mediante estudio angiográfico con cateterismo de venas suprahepáticas. El cateterismo de venas suprahepáticas permite confirmar la existencia y extensión de la lesión trombótica. Cuando el explorador experimentado no es capaz de cateterizar ninguna vena suprahepática podemos decir que la trombosis de venas suprahepáticas es completa y se extiende hasta el ostium. Cuando es posible cateterizar la vena suprahepática, la inyección de contraste objetiva una o varias de las alteraciones características del síndrome de Budd-Chiari: un patrón de vasos anormales, de disposición aracniforme (denominado en tela de araña o spiderwebs) (fig. 2) donde la obstrucción es total, estrechamiento irregular por trombosis parcial o estenosis establecidas con dilatación subestenótica. En este último caso el cateterismo permite, además, demostrar el gradiente de presión generado por la estenosis a lo largo de las vena suprahepática afectada. En nuestra experiencia, en 3 de 21 pacientes, el estudio hemodinámico con flebografía detectó en una vena suprahepática una zona estenótica bien delimitada que ocasionaba un importante gradiente hemodinámico. Estas estenosis focales son probablemente la secuela de trombosis previas parcialmente repermeabilizadas. La detección de las mismas es muy importante, ya que el tratamiento de estos pacientes, con angioplastia en el mismo procedimiento, es habitualmente más sencillo que en pacientes con una trombosis difusa.
Fig. 2. Imagen angiográfica característica en «tela de araña» o «spider-Web».
El estudio de la vena cava inferior mediante cavografía y medición de presiones reviste también gran utilidad para plantear el tratamiento. La extensión de la trombosis a la vena cava, o bien su compresión por hipertrofia del lóbulo caudado, pueden provocar una dificultad de drenaje de esta vena que impida o limite el tratamiento derivativo mediante anastomosis portocava laterolateral o mesocava22-24. Por otra parte, el cateterismo de venas suprahepáticas permite la realización de una biopsia hepática por vía transyugular, con un riesgo menor que la percutánea. La biopsia hepática revela estasis y necrosis centrolobulillar y desarrollo de fibrosis más o menos extensa en relación con el estadio evolutivo. Es conveniente realizar biopsias hepáticas separadas de los lóbulos derecho e izquierdo ya que el compromiso no suele ser uniforme, o como mínimo realizar la biopsia en la zona cuya vena suprahepática esté más afectada.
Las técnicas de imagen utilizadas para el diagnóstico y seguimiento de estos enfermos pone de manifiesto con relativa frecuencia, la existencia de imágenes nodulares en el hígado. Si bien estas imágenes ya pueden aparecer en el momento del diagnóstico con mucha más frecuencia lo hacen en el seguimiento, incluso muchos años después del diagnóstico. Estas lesiones ocupantes de espacio suelen ser múltiples, de pequeño-mediano tamaño y con aspecto hipo, iso o hiperecoico en el estudio ultrasonográfico y corresponden a zonas de hiperplasia nodular regenerativa1, aunque más recientemente se ha sugerido denominarlos «nódulos regenerativos multiacinares»25. Si bien es verdad que existen casos en la bibliografía de pacientes con síndrome de Budd-Chiari a los que se les ha diagnosticado un hepatocarcinoma1, la posibilidad de que el hígado con síndrome de Budd-Chiari tenga mayor potencial para desarrollar hepatocarcinoma no está bien establecido. No obstante, es importante establecer el diagnóstico diferencial entre estos nódulos benignos y un posible hepatocarcinoma. Un estudio reciente sugiere que nódulos múltiples, de tamaño menor a 4 cm y con valores normales de alfafetoproteína, son altamente sugestivos de ser benignos. En este estudio, de los 4 pacientes con un síndrome de Budd-Chiari, todos ellos HBsAg y anti-VHC negativo, que tenían un hepatocarcinoma, 3 de ellos presentaban valores de alfafetoproteína claramente elevados, los 4 pacientes tenían un máximo de 3 nódulos y el tamaño medio de los mismos fue de 6 cm25.
Evolución y pronóstico
La trombosis de las venas suprahepáticas es una enfermedad grave, cuya forma fulminante produce la muerte en casi todos los pacientes, por insuficiencia hepática aguda grave. Las formas subagudas son, con mucho, la forma más frecuente de presentación. Dentro de este grupo de pacientes podemos diferenciar, en la mayoría de casos de forma clara, dos comportamientos diferentes. Un grupo de pacientes presenta escasa sintomatología, fácil control de la ascitis que permite retirar los diuréticos en el seguimiento, y pequeñas alteraciones en la función hepática que tienen tendencia a revertir. Un segundo grupo presenta la sintomatología propia de una hepatopatía descompensada pero de rápida instauración, cursando con ascitis refractaria y/o progresivo deterioro de la función hepatocelular. Estos pacientes, en su evolución espontánea sufren un rápido deterioro del estado general con malnutrición, siendo las principales causas de muerte la insuficiencia hepática, la ascitis con insuficiencia renal funcional, la hemorragia digestiva o las infecciones sobreañadidas. Es evidente que el tratamiento de estas dos formas de presentación deberá ser completamente diferente. En la actualidad no disponemos de criterios pronósticos que nos permitan prever, en el momento del diagnóstico, qué forma evolutiva seguirá un determinado paciente, para realizar un tratamiento más agresivo sólo en los casos necesarios. Se ha sugerido que el grado de necrosis hepatocitaria hallado en la biopsia podría tener un valor pronóstico con implicaciones terapéuticas26. De esta forma, estos autores proponen una actitud expectante cuando únicamente se detecta congestión sin necrosis, y repetir la biopsia a los 3-6 meses. Si la congestión es grave y existe importante necrosis hepatocitaria proponen tratamiento descompresivo. No obstante, no todos los autores aceptan este hecho, ya que para la mayoría de grupos la mayor utilidad pronóstica de la biopsia hepática consiste en objetivar el grado de fibrosis hepática. Tal vez la evolución clínica del paciente sea independientemente de los hallazgos de la biopsia que están influenciados por la probabilidad de un error de muestra, el mejor determinante de la actitud terapéutica a seguir. En un estudio retrospectivo reciente, realizado en 54 pacientes con síndrome de Budd-Chiari, se identificó la edad, la cifra de creatinina, la ascitis y la puntuación de Child-Pugh, pero no el grado de lesión histológica, como variables relacionadas de forma independiente con la mortalidad27.
En los pacientes con formas crónicas (cirrosis establecida) el pronóstico suele ser semejante al de otros tipos de cirrosis, con la salvedad de que habitualmente el mayor problema es el manejo de la ascitis.
Tratamiento
El manejo del paciente con síndrome de Budd-Chiari comprende la inmediata anticoagulación del paciente para prevenir la extensión de las lesiones trombóticas, el control de la enfermedad causante de la trombosis (con la colaboración del hematólogo), el tratamiento sintomático de la ascitis o de otras complicaciones del cuadro y el tratamiento dirigido a restablecer el retorno venoso hepático.
Si el diagnóstico de síndrome de Budd-Chiari se efectúa a las pocas horas de su aparición, el tratamiento local con agentes trombolíticos, tales como el activador del plasminógeno tisular, urocinasa o estreptocinasa, mediante perfusión a través del cateterismo de las venas suprahepáticas, puede ser curativo. Sin embargo, en la práctica ésta es una opción poco aplicable ya que raramente los pacientes son diagnosticados de forma tan precoz y en realidad existen pocos trabajos que confirmen la eficacia a largo plazo de esta alternativa6,28.
En los casos habituales el diagnóstico es más tardío y las opciones terapéuticas varían en función de la gravedad del cuadro clínico y de la extensión y morfología de las lesiones de las venas suprahepáticas.
Cuando la obstrucción está ocasionada por una o varias estenosis segmentarias (afecta sólo un tramo de las venas suprahepáticas) disponemos de una técnica poco agresiva que puede conseguir la remisión del cuadro. Se trata de la angioplastia por vía transyugular o percutánea. La limitación de esta técnica es el desarrollo de reestenosis que obligaría a sucesivas angioplastias o a la colocación de una prótesis metálica en un intento de prevenir futuras reintervenciones29-31. La obstrucción localizada sólo en la vena cava y producida por una membrana es una patología también susceptible de tratamiento radiológico mediante angioplastia, pero es una patología inusual en Occidente32.
Cuando las lesiones de las venas suprahepáticas consisten en trombosis extensa, se debe individualizar el tratamiento atendiendo a su forma de presentación.
En las formas fulminantes, el tratamiento más aceptado es el trasplante hepático3,23,24. Se ha sugerido que la realización de una derivación portosistémica percutánea intrahepática, más conocida con el término anglosajón TIPS, podría ser también una opción aceptable en estos pacientes y que aumentaría las probabilidades de llegar en condiciones aceptables al momento del trasplante hepático o que incluso podría evitar la necesidad de realizar el mismo32,33. En aquellos casos con contraindicaciones al trasplante, el TIPS sería la única alternativa.
En las formas subagudas, la evolución clínica y respuesta inicial del paciente al tratamiento médico (descoagulación y tratamiento sintomático) marcará la actitud a tomar. El resultado de la biopsia hepática nos puede ofrecer información adicional útil para decidir la actitud terapéutica y sobre todo para descartar la cirrosis hepática. Cuando la biopsia sólo evidencia congestión, y sobre todo si ello se asocia a una sintomatología en remisión con escasa repercusión en los datos analíticos, es probable que el tratamiento médico conservador, con una vigilancia cuidadosa para detectar un eventual deterioro clínico, sea la mejor alternativa. En nuestra experiencia, 8 de 21 pacientes consecutivos con síndrome de Budd-Chiari, fueron paucisintomáticos y sólo precisaron tratamiento médico con anticoagulación, diuréticos y tratamiento de la enfermedad subyacente. En 3 casos se realizó, además, angioplastia sobre una estenosis predominante en una vena suprahepática. Tras un seguimiento medio de 4 años, los 8 pacientes se encuentran vivos y libres de ascitis.
Aquellos casos que presentan un progresivo deterioro clínico (ascitis refractaria, signos de insuficiencia hepática y/o complicaciones de la hipertensión portal) precisan el restablecimiento del retorno venoso hepático. Durante mucho tiempo, el tratamiento de elección para restablecer el retorno venoso ha sido la anastomosis portosistémica. En función de la experiencia del grupo quirúrgico se realizaba una anastomosis portocava laterolateral o mesocava. La compresión de la vena cava inferior por la hipertrofia del lóbulo caudado al provocar un aumento de presión en la vena cava inferior infrahepática puede dificultar la eficacia descompresiva de la anastomosis. En esta situación diversos grupos quirúrgicos aportaban soluciones en forma de intervenciones mucho más complejas y con una elevada morbimortalidad como la anastomosis entre la vena mesentérica y la aurícula derecha (anastomosis mesoatrial)35-38. Otra propuesta ha sido la dilatación y colocación de una prótesis en la zona estenótica de la vena cava antes de la realización de la anastomosis29,39. Otros autores han sugerido que, a pesar de la compresión y aumento de presión en la vena cava, la única situación que realmente contraindicaría la realización de una anastomosis portocava laterolateral o mesocava es la obstrucción completa de la vena cava inferior41. No obstante, este hecho no ha sido confirmado. Teniendo en cuenta estas dificultades y la elevada morbimortalidad de la cirugía derivativa, otros grupos han aplicado más y con mejores resultados el trasplante hepático3,4. Por otra parte, es destacable el hecho de que en una revisión retrospectiva reciente de 85 pacientes con Budd-Chiari el tratamiento quirúrgico derivativo no se asoció a un mejor pronóstico27.
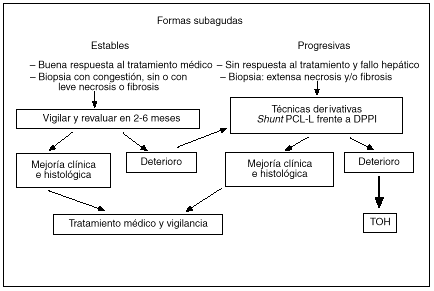
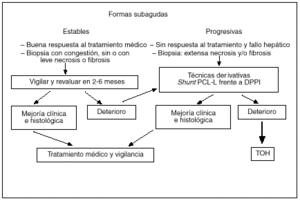
El TIPS supone una nueva alternativa, con mínima invasividad y sin los riesgos inherentes a la cirugía, en el tratamiento de estos pacientes que, al crear un shunt portosistémico que drena al tramo suprahepático de la vena cava inferior, obvia la posible estenosis de la vena cava inferior. En grupos con experiencia, el TIPS se puede colocar en más del 90% de los pacientes y los resultados publicados hasta el momento son muy esperanzadores42-45. En nuestra unidad hemos tenido la oportunidad de tratar con un TIPS a 12 pacientes con síndrome de Budd-Chiari por la progresión y gravedad del cuadro clínico (ascitis refractaria en ocho, insuficiencia hepática en tres y hemorragia digestiva por rotura de varices esofágicas en uno). En un paciente el TIPS no se logró mantener permeable y requirió la realización posterior de una anastomosis portacava laterolateral. En el seguimiento posterior los pacientes presentaron una espectacular mejoría del estado nutricional y del funcionalismo hepatocelular, así como en el control de su ascitis. Aproximadamente la mitad de los casos han precisado revisiones periódicas para mantener la permeabilidad del TIPS, y en la otra mitad de casos la oclusión total del shunt, a partir de los 6 meses de su colocación, no ha tenido consecuencias clínicas. Este último hecho sugiere que el parénquima hepático ha desarrollado suficiente circulación colateral y que sólo precisaba un shunt portosistémico de forma temporal. La evolución a largo plazo de estos pacientes no está todavía determinada. Dado el escaso número de pacientes que presentan este síndrome, es poco probable que puedan existir estudios que comparen la cirugía derivativa con el TIPS. No obstante, creemos que ésta es la opción derivativa de elección en aquellos pacientes con una función hepatocelular más deteriorada y, por tanto, con elevado riesgo quirúrgico, y que las indicaciones del TIPS se están ampliando a la mayoría de casos de síndrome de Budd-Chiari subagudo que precisan tratamiento derivativo por las ventajas comentadas anteriormente. Aquellos pacientes en los que la descompresión no sea efectiva y la enfermedad progrese a una cirrosis hepática deben ser evaluados para trasplante hepático (fig. 3).
Fig. 3. Algoritmo terapéutico en el síndrome de Budd-Chiari.
El síndrome de Budd-Chiari crónico precisa el mismo tratamiento que la cirrosis de otras etiologías. El tratamiento quirúrgico derivativo comporta una elevada morbimortalidad y, por tanto, se prefiere la opción del trasplante hepático cuando las complicaciones de la hipertensión portal lo precisen3,4,23,24. El hecho de que estos pacientes presenten, en general, un síndrome mieloproliferativo asociado no contraindica el trasplante hepático, con la excepción de los casos con un mal pronóstico de su enfermedad hematológica por evolución a mielofibrosis, mielodisplasia o leucemia23.