El síndrome hepatorrenal (SHR) es una complicación grave de los pacientes con cirrosis y ascitis1. La insuficiencia renal es de carácter funcional, ya que no hay daño estructural en el parénquima renal, por lo que es potencialmente reversible2. Ocurre en el 10% de los pacientes hospitalizados con cirrosis avanzada3. Además de en la cirrosis, el SHR también puede presentarse en otras enfermedades hepáticas asociadas con la insuficiencia hepática grave, como la hepatitis alcohólica y la insuficiencia hepática aguda4,5.
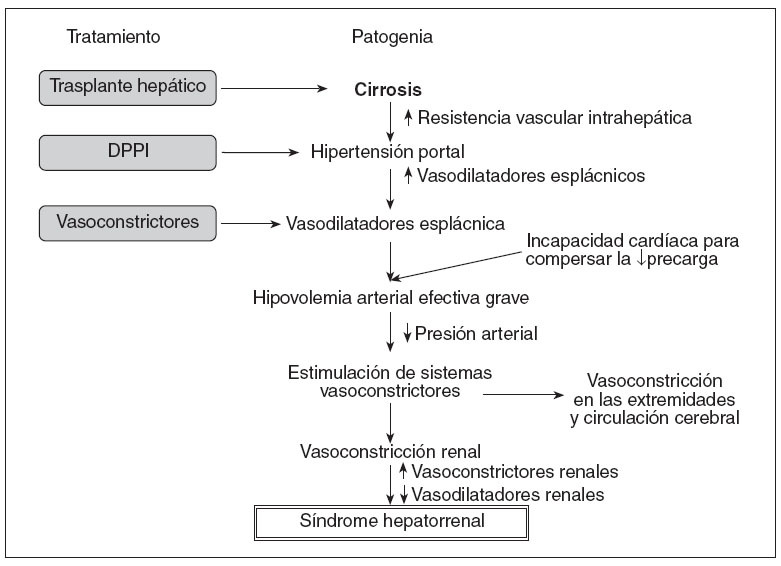
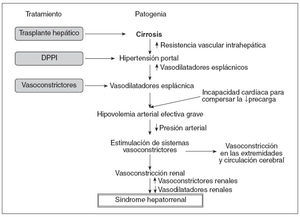
PATOGENIALa base fisiopatológica del SHR es la vasoconstricción de la circulación renal, que da lugar a una reducción importante del filtrado glomerular (FG). La teoría de la vasodilatación es actualmente la más aceptada para explicar la alteración hemodinámica que presentan estos pacientes y la patogenia del SHR6 (fig. 1). De acuerdo con esta teoría, la hipertensión portal es el evento inicial en la patogenia del SHR, que induce una vasodilatación arterial, principalmente esplácnica. Los mecanismos responsables de la vasodilatación esplácnica no están identificados en su totalidad, pero probablemente obedezcan a un aumento en los valores de sustancias vasodilatadoras, como el óxido nítrico, el monóxido de carbono, las citocinas y otros vasodilatadores. La vasodilatación arterial esplácnica provoca una disminución del volumen arterial efectivo, aumentando la actividad de los sistemas vasoconstrictores (sistema renina-angiotensina-aldosterona, sistema nervioso simpático), y de la hormona antidiurética, que determina la retención de sodio y el agua libre, respectivamente.
En estadios iniciales de la cirrosis, la perfusión renal se mantiene dentro de la normalidad debido a un aumento de la síntesis renal de los vasodilatadores, especialmente las prostaglandinas. A medida que la enfermedad hepática progresa, se produce un empeoramiento de la hipovolemia arterial efectiva que lleva a una activación extrema de los sistemas vasoconstrictores y al desarrollo de SHR. La activación de los sistemas vasoconstrictores determina también una vasoconstricción en otros territorios vasculares, como las extremidades superiores e inferiores y el ce-rebro7-9 (fig. 1). En los últimos años, se ha sugerido, además, la presencia de una disfunción cardíaca que podría participar en la alteración circulatoria que se asocia al SHR10-12. En estos estudios se ha observado que el empeoramiento de la alteración circulatoria no sólo se relaciona con la progresión de la vasodilatación arterial, sino también con una incapacidad del corazón para aumentar el gasto cardíaco en respuesta a una disminución de la precarga (fig. 1).
Fig. 1. Patogenia del síndrome hepatorrenal según la teoría de la vasodilatación y sus posibles tratamientos. DPPI: derivación percutánea portosistémica intrahepática.
CUADRO CLÍNICODe acuerdo a la forma de presentación (intensidad, forma de inicio y evolución), el SHR se clasifica en 2 tipos13. Esta clasificación es importante, ya que ambos tipos de SHR tienen pronóstico y supervivencia diferentes:
–SHR tipo 1.Se caracteriza por un deterioro notable y rápidamente progresivo de la función renal. En la mayor parte de los casos se observa oliguria progresiva. La retención de sodio es intensa, la concentración plasmática de urea, creatinina y potasio están elevadas y, generalmente, se produce una hiponatremia dilucional. La creatininemia alcanza valores superiores a 2,5 mg/dl en menos de 2 semanas. A diferencia de otras formas de insuficiencia renal, la acidosis metabólica y/o el edema pulmonar son muy infrecuentes. A menudo, el SHR tipo 1 está precedido por algún factor precipitante, como las infecciones bacterianas (particularmente la peritonitis bacteriana espontánea), la hemorragia digestiva, la paracentesis terapéutica de gran volumen sin expansión plasmática, las intervenciones quirúrgicas y/o la hepatitis aguda sobre la cirrosis. Los signos de insuficiencia hepática avanzada y de hipertensión portal acompañan a la insuficiencia renal.
–SHR tipo 2.Se caracteriza por una forma más estable de insuficiencia renal (creatinina plasmática < 2,5 mg/dl). El grado de insuficiencia hepática es generalmente de menor magnitud que el que se observa en el SHR tipo 1. El cuadro clínico predominante es la presencia de ascitis refractaria al tratamiento diurético. El SHR tipo 2 puede transformarse en SHR tipo 1 espontáneamente o ante la presencia de los mismos factores precipitantes mencionados en el párrafo anterior.
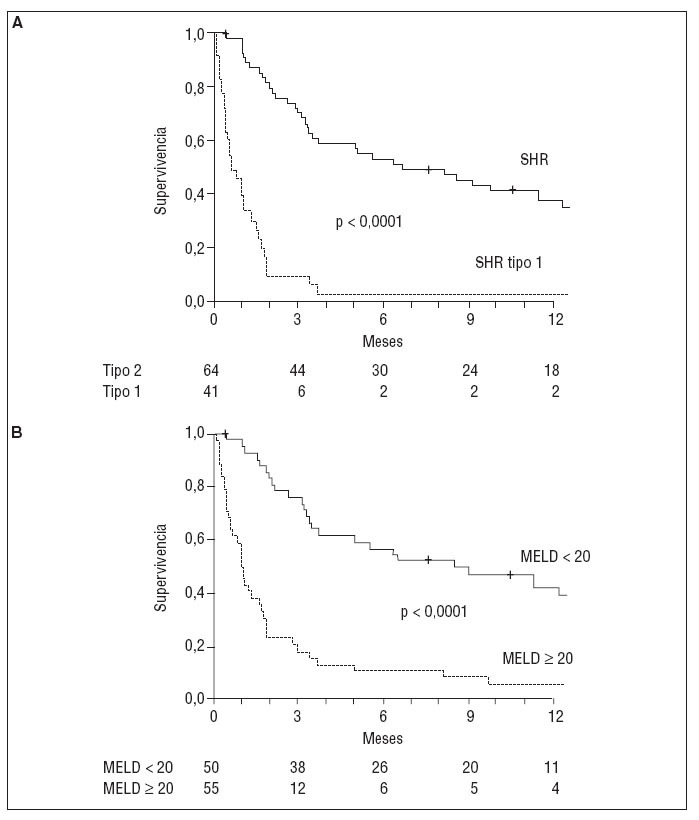
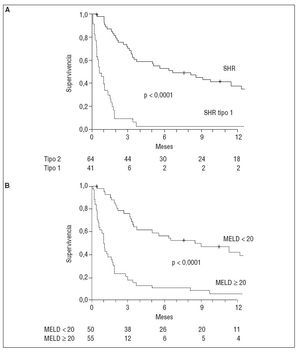
PRONÓSTICOEl SHR es la complicación de la cirrosis con peor pronóstico. La expectativa de vida depende principalmente del tipo de SHR. La sobrevida media de los pacientes con SHR tipo 1 sin tratamiento es inferior a las 2 semanas. En cambio, los pacientes con SHR tipo 2 tienen una sobrevida media de aproximadamente 6 meses3. Recientemente, un estudio mostró que la puntuación MELD (Model of End-Stage Liver Disease) y el tipo de SHR son útiles para estimar el pronóstico en los pacientes con este síndrome14 (fig. 2). Los pacientes con SHR presentan peores resultados en la puntuación MELD que otras cohortes de pacientes con cirrosis que están en lista de espera de trasplante hepático14.
Fig. 2. Probabilidad de supervivencia del los pacientes con síndrome hepatorrenal (SHR), según el tipo (A) y la puntuación MELD (B).
Otro factor determinante de supervivencia en los pacientes con SHR es la función hepática: los pacientes con SHR de clase C según la clasificación de Child-Pugh tienen peor pronóstico que los de clase B15,16.
DIAGNÓSTICOPara diagnosticar un SHR tiene que haber insuficiencia renal. La creatinina sérica es el marcador de función renal más utilizado en la práctica clínica, ya que los valores de uremia pueden alterarse en ausencia de cambios en el filtrado glomerular (p. ej., hemorragia digestiva, dieta hipo o hiperproteica). La concentración sérica de creatinina no es el parámetro ideal para medir filtrado glomerular (FG) porque los pacientes cirróticos tienen una menor producción endógena de creatinina debido a que su masa muscular se encuentra disminuida17. No obstante, dado que las técnicas más sensibles de medición del FG son dificultosas de realizar como análisis sistemático y no siempre están disponibles, la medición de creatinina sérica es el método de elección para estimar el FG en estos pacientes. El valor de creatinina que define el SHR es superior a 1,5 mg/dl y corresponde a un FG < 40 ml/min. La medición de creatinina debe repetirse en pacientes que toman diuréticos después de la suspensión de éstos, ya que en algunos pacientes la creatinina puede aumentar al suspenderse su administración, aun en ausencia de una diuresis excesiva que cause una disminución del volumen intravascular. Debido a que no se dispone de pruebas de laboratorio específicas para el diagnóstico de SHR y a que los pacientes con cirrosis pueden desarrollar insuficiencia renal por otras causas (insuficiencia prerrenal por hipovolemia, necrosis tubular aguda, infecciones bacterianas, nefrotoxicidad por fármacos y enfermedad renal intrínseca), el diagnóstico del SHR se realiza descartando otras causas posibles de insuficiencia renal. En 1996, el Club Internacional de Ascitis enunció los criterios diagnósticos para definir el SHR13. Hay criterios diagnósticos mayores y criterios adicionales (tabla I). Para definir el SHR es necesario que se cumplan todos los criterios mayores, mientras que los adicionales, si están, sólo refuerzan el diagnóstico. No obstante, recientemente el Club Internacional de Ascitis realizó una reunión de expertos para tratar de redefinir el SHR (Congreso Americano de Hepatología. AASLD 2005, San Francisco). En dicha reunión se revisaron los criterios mayores y los menores. Se expuso que la sensibilidad y la especificidad de los criterios menores es muy baja y que posiblemente no sean necesarios para definir el SHR. Dentro de los criterios mayores, se discutió la necesidad de definir el SHR asociado a la infección como la insuficiencia renal que aparece en pacientes cirróticos infectados sin shock, en los cuales la fisiopatología de la alteración renal es similar a la del SHR. Todos estos cambios se darán a conocer en el consenso actualizado de SHR, que posiblemente se publique durante este año. Por el momento, para definir el SHR debemos utilizar los criterios diagnósticos clásicos.
TABLA I. Criterios diagnósticos del síndrome hepatorrenal*
TRATAMIENTO DEL SÍNDROME HEPATORRENAL TIPO 1Medidas generalesDado que la mayoría de los pacientes con SHR tienen hiponatremia dilucional (sodio sérico < 130 mEq/l), la in-gesta diaria de líquidos debe restringirse para evitar un balance hídrico positivo que empeore la hiponatremia. En estos casos la ingesta diaria de líquidos recomendada es aproximadamente de 1.000 ml. La administración de soluciones salinas no es aconsejable porque incrementa la ascitis y los edemas. Tampoco deben administrarse diuréticos ahorradores de potasio por el riesgo de hipercalemia18. Las medidas terapéuticas recomendadas hasta la fecha se resumen en la tabla II.
TABLA II. Recomendaciones para el tratamiento del síndrome hepatorrenal tipo 1
Trasplante hepáticoEl trasplante hepático constituye el tratamiento de elección para los pacientes con cirrosis y SHR (ya que resuelve tanto la enfermedad hepática como la enfermedad renal asociada)19-22. La corta expectativa de vida y el tiempo en lista de espera (prolongado en la mayoría de los centros) son los inconvenientes más importantes para la aplicabilidad del trasplante en los pacientes con SHR. Las políticas de asignación de órganos son diferentes en cada país. Actualmente, muchos centros utilizan la puntuación MELD para la asignación de órganos23,24. Dado que su fórmula incluye valores séricos de creatinina, bilirrubina y razón internacional normalizada (INR), los pacientes con SHR tienen puntuación MELD elevada. Los pacientes con SHR sometidos a trasplante hepático tienen más complicaciones, requieren más días de hospitalización en unidades de cuidados intensivos y tiene mayor mortalidad intrahospitalaria que los pacientes trasplantados sin SHR. La supervivencia a los 3 años de los pacientes que se trasplantan con SHR es discretamente menor (60%) que la de los pacientes trasplantados sin SHR (70-90%)19-22. Recientemente, se ha demostrado que el SHR debe tratarse antes del trasplante hepático para mejorar la función renal, ya que su tratamiento reduce la morbimortalidad postrasplante25. La supervivencia y las complicaciones postras-plante de los pacientes con SHR tratados con vasoconstrictores (análogos de la vasopresina) antes del procedimiento no difieren de las de los pacientes sin SHR pretrasplante. Dado que la ciclosporina A y el tracrolimus pueden producir insuficiencia renal, se sugiere retrasar la administración de estos fármacos hasta que la función renal comience a mejorar, habitualmente 48-72 h postrasplante. Las alteraciones hemodinámicas y neurohormonales asociadas al SHR desaparecen habitualmente dentro del primer mes postrasplante26.
VasoconstrictoresEl objetivo de administrar fármacos vasoconstrictores en el tratamiento del SHR tipo 1 es que producen vasoconstricción en el territorio esplácnico que se encuentra extremadamente dilatado, lo que origina una redistribución de flujo y aumenta la perfusión renal4 (fig. 1). En estudios no controlados se han utilizado 2 tipos de fármacos: los análogos de la vasopresina (ornipresina y terlipresina) y los agonistas alfaadrenérgicos (norepinefrina y midodrina), que actúan sobre los receptores V1 de la vasopresina y los alfa-1 adrenérgicos, respectivamente15,16,27-33 (tabla III). El fármaco más utilizado actualmente es la terlipresina. Estos fármacos se administran junto con la albúmina para aumentar el efecto sobre el volumen arterial 15,16,27-30,32. La mejoría del FG se produce tras varios días de tratamiento. No obstante, un porcentaje variable de los pacientes que responden al tratamiento (2790%) presenta recidivas al suspenderlo (15%), aunque el retratamiento es efectivo en la mayoría de los casos. La frecuencia de complicaciones isquémicas por el uso de terlipresina es baja (5-10%) en comparación con otros análogos de la vasopresina, como la ornipresina (3050%). Además, los pacientes que responden a la terlipresina tienen una mayor supervivencia15,16,32. Recientemente, se han presentado los resultados de un estudio aleatorizado y controlado que valora el efecto de la terlipresina con albúmina comparado con placebo32. El porcentaje de respuesta con terlipresina fue del 34%. Sin embargo, los pacientes que respondieron al tratamiento presentaron una mayor supervivencia que los pacientes que no respondieron. Estos resultados son similares al de un estudio multicéntrico español, en el que el porcentaje de respuesta fue del 77%30. En este estudio los pacientes que respondieron también presentaron una mayor supervivencia. Esto sugiere que los pacientes con SHR deben tratarse con terlipresina, especialmente el grupo candidato a trasplante hepático. Los inconvenientes de este tratamiento son su coste elevado y la falta de disponibilidad en muchos países. Los agonistas alfaadrenérgicos (norepinefrina, midodrina) aparentemente tendrían una eficacia similar a la terlipresina. La midodrina tiene la ventaja de que puede administrarse por vía oral. Además, representan una alternativa interesante por su bajo coste31,33. Las dosis de vasoconstrictores utilizadas en los distintos estudios son: terlipresina15,16,29,30,32, 0,5-2 mg en bolos cada 4-6 h durante 15 días; noradrenalina33, 0,5-3 mg/h en infusión i.v. durante 15 días, y midodrina31, 7,5-12,5 mg cada 8 h durante un mes. La ornipresina, si bien ha demostrado ser efectiva, no se utiliza por las complicaciones isquémicas que conlleva. La dosis de albúmina es de 1 g/kg el primer día, seguida de 20-40 g/día los días posteriores16.
TABLA III. Resultados de estudios en los que se utilizaron agentes vasoconstrictores en el tratamiento del síndrome hepatorrenal
Derivación percutánea portosistémica intrahepáticaLa derivación percutánea portosistémica intrahepática (DPPI) es una prótesis que comunica la vena porta y las venas suprahepáticas. Se coloca por vía transyugular y tiene por objetivo disminuir la presión portal. En pacientes con SHR tipo 1, la DPPI mejora la función circulatoria, reduce la actividad de los sistemas vasoconstrictores y se asocia con un incremento de la perfusión renal y del FG, con una disminución de la concentración de creatinina hasta en un 60% de los pacientes34,35. La colocación de DPPI está contraindicada en pacientes con enfermedad hepática grave (puntuación de Child-Pugh mayor de 12 o encefalopatía hepática grave) por el riesgo de inducir complicaciones36,37. Se ha utilizado en forma secuencial DPPI tras el tratamiento con vasoconstrictores (midodrina más octreótida) y albúmina con resultados beneficiosos38. Sin embargo, estos resultados deben compararse en posteriores estudios. Hasta el momento no se han realizado estudios que comparen los vasoconstrictores con DPPI en el SHR tipo 1.
Otras medidas terapéuticasLa hemodiálisis se ha utilizado como tratamiento del SHR tipo 1, especialmente en pacientes candidatos a trasplante hepático39. La mayoría de los pacientes no toleran bien este procedimiento y desarrollan efectos adversos importantes, como hipotensión, diátesis hemorrágica e infecciones. La presencia de sobrecarga de volumen, la acidosis metabólica y la hipercalemia constituyen una indicación de hemodiálisis. Se han utilizado otras técnicas en casos aislados, como la hemodiafiltración o la hemofiltración arteriovenosa o venovenosa continua, y podrían ser útiles en casos de pacientes con anasarca grave, ya que producen un balance hídrico negativo sin hipotensión. Se ha descrito una cierta mejoría de la función renal y de la supervivencia en una pequeña serie de pacientes con SHR tratados con diálisis con albúmina (MARS)40. Sin embargo, estos resultados deben confirmarse en series de pacientes más amplias. También se ha empleado N-acetilcisteína en un número reducido de pacientes41, pero estos resultados necesitan ser confirmados.
TRATAMIENTO DEL SÍNDROME HEPATORRENAL TIPO 2El hallazgo clínico más frecuente de los pacientes con SHR tipo 2 es la presencia de ascitis refractaria. La restricción del sodio de la dieta (40-80 mEq/día) es importante para disminuir la formación de ascitis y edemas. Los diuréticos están indicados sólo en caso de que aumenten significativamente la natriuresis (excreción urinaria de sodio superior a 30 mEq/día). El método terapéutico de elección en casos de ascitis a tensión es la realización de paracentesis periódicas con expansión de albúmina42. Si hay hiponatremia dilucional, la ingesta diaria de fluidos debe restringirse a 1.000 ml aproximadamente. Las infecciones bacterianas deben diagnosticarse y tratarse precozmente con el fin de prevenir el desarrollo de SHR tipo 1. Las recomendaciones para el tratamiento del SHR tipo 2 se resumen en la tabla IV.
Trasplante hepáticoEl trasplante hepático es el tratamiento de elección en los pacientes con SHR tipo 2. Lo ideal es que el paciente se incluya en lista de trasplante hepático antes de desarrollar el SHR.
VasoconstrictoresLa información sobre el uso de vasoconstrictores en el SHR tipo 2 es más limitada que la existente para el SHR tipo 1, pero los datos disponibles sugieren que su utilización mejora la función renal de estos pacientes16,43.
Derivación percutánea portosistémica intrahepáticaEl uso de DPPI en pacientes con SHR tipo 2 se asocia con una mejoría de la función renal, el control de la ascitis y un menor riesgo de desarrollo de SHR tipo 135,42,44-47. Sin embargo, un subanálisis de pacientes con SHR tipo 2 incluido en un estudio aleatorizado, que comparaba DPPI con paracentesis periódicas con expansión con albúmina en pacientes con ascitis refractaria, no demostró una mejoría en la supervivencia en los pacientes tratados con DPPI42.
PREVENCIÓNDos estudios controlados y aleatorizados han demostrado que el desarrollo del SHR puede prevenirse en situaciones específicas a que están expuestos los pacientes con cirrosis: la peritonitis bacteriana espontánea (PBE) y la hepatitis alcohólica grave5,48. En pacientes con PBE, la administración de albúmina (1,5 g/kg i.v. en el momento del diagnóstico más 1 g/kg i.v. a las 48 h) asociada a la administración de cefotaximademostró una significativa reducción en el desarrollo de SHR (cefotaxima + albúmina [10%] frente a cefotaxima sin albúmina [33%]). También se observaron diferencias significativas en la incidencia de mortalidad hospitalaria (el 10 frente al 29%) y en la mortalidad a los 3 meses (el 22 frente al 41%), respectivamente48. En pacientes con hepatitis alcohólica, la administración de pentoxifilina (1.200 mg/día v.o.), un inhibidor del factor de necrosis tumoral, redujo de forma significativa la incidencia de SHR con respecto a los pacientes del grupo control (el 8 frente al 35%) y la mortalidad hospitalaria (el 24 frente al 46%), respectivamente)5.
TABLA IV. Recomendaciones para el tratamiento del síndrome hepatorrenal tipo 2
Correspondencia: M. Guevara. Servicio de Hepatología. Hospital Clínic. Villarroel, 170. 08036 Barcelona. España. Correo electrónico:
Recibido el 28-12-2006; aceptado para su publicación el 11-1-2007.