La colestasis intrahepática del embarazo (CIE) es una enfermedad hepática propia de la gestación caracterizada por prurito y colestasis. Habitualmente se presenta en el segundo o tercer trimestre, y se resuelve tras el parto. La primera descripción de la asociación entre embarazo y colestasis fue realizada por Ahlfeld1 en 1883 y posteriormente por Eppinger2 en 1937. Sin embargo, es en la década de los años cincuenta cuando empiezan a aparecer publicaciones en las que se describen con detalle las características clínicas de esta entidad. Se han propuesto diversas denominaciones para nombrar a esta enfermedad: ictericia de la gestación tardía, ictericia recurrente del embarazo o colestasis obstétrica. El término CIE es el más utilizado en el momento actual. A pesar de la intensa investigación clínica y experimental llevada a cabo para discernir los mecanismos implicados en su patogenia, ésta sigue siendo desconocida.
INCIDENCIALa incidencia de la CIE es variable según el área geográfica estudiada y oscila entre tasas tan bajas como 1-2/10.000 embarazos en Estados Unidos, Asia y Australia, y tan altas como 10-200/10.000 embarazos en Europa3,4. Estas variaciones podrían reflejar diferencias en la susceptibilidad entre distintos grupos étnicos. La incidencia más alta se encuentra en Chile y Bolivia, con un 5-15% de los embarazos, especialmente entre los indios Auracanos (24%), así como en Escandinavia y los países Bálticos (1-2%)4-6. En algunos países, como Suecia y Chile, se ha descrito incluso una influencia estacional, con tasas más elevadas en el mes de noviembre. Todo ello sugiere la influencia de factores ambientales no bien conocidos5,7. La CIE aparece en mujeres de todas las edades, tanto primíparas como multíparas, especialmente en embarazos múltiples, y puede recurrir en gestaciones posteriores.
Hay un cierto componente familiar: se ha descrito un riesgo 12 veces mayor para desarrollar la enfermedad en las hermanas de las pacientes afectadas8.
PATOGENIALa etiopatogenia de la CIE todavía no está totalmente esclarecida. La asociación familiar de la enfermedad, y su incidencia variable en diferentes regiones geográficas, sugieren efectivamente la interacción de factores genéticos y ambientales.
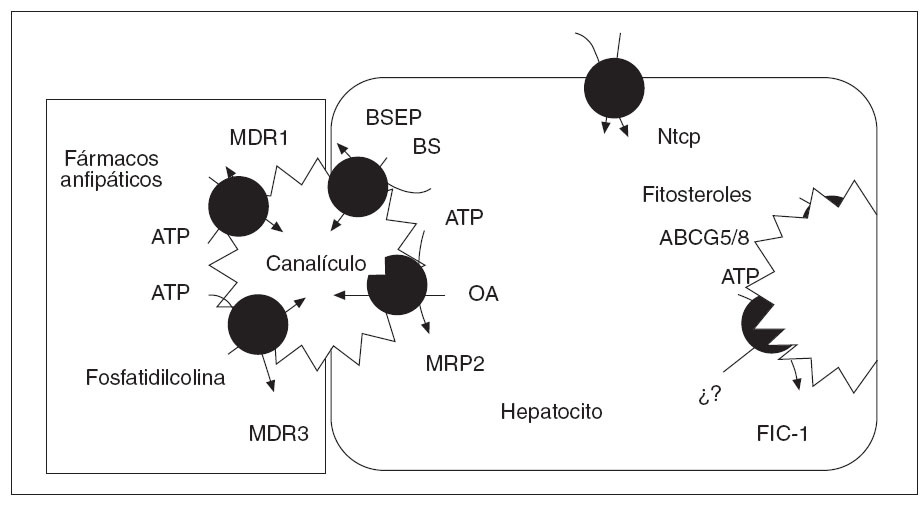
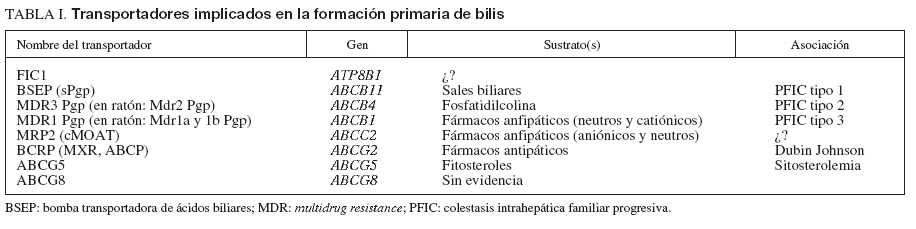
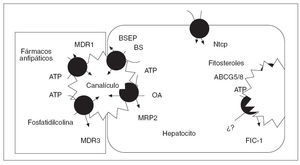
Factores genéticosLa intervención de factores genéticos en el desarrollo de la CIE se sustenta en diversos fenómenos bien constatados. Éstos incluyen la elevada incidencia de este trastorno en determinados grupos étnicos de Chile y Bolivia9,10, el carácter recidivante del trastorno8,11 y la susceptibilidad de las mujeres afectadas a la progesterona (ver más adelante). La secreción normal de bilis depende de la integridad de un conjunto de sistemas transportadores de membrana en los hepatocitos y los colangiocitos (tabla 1)6,12,13. El transporte de los 3 principales lípidos biliares (ácidos biliares, fostatidilcolina y colesterol) a través de la membrana canalicular de los hepatocitos hacia la bilis está mediado por bombas adenosín-trifosfato (ATP)-dependientes, conocidas como transportadores del ATP-binding cassette (ABC)14. Los dos transportadores principales son el ABCB4 (anteriormente conocido como multidrug resistance gene 3, MDR3), responsable de la translocación de la fosfatidilcolina (el principal fosfolípido) a través de la membrana hepatocanalicular15, y la bomba transportadora de ácidos biliares ABCB11 (antiguamente conocida como BSEP), que es el principal sistema canalicular implicado en el transporte de ácidos biliares conjugados16 (fig. 1). Hace casi una década se describieron las primeras mutaciones del gen ABCB4 en estado heterocigoto en una amplia familia consanguínea en la que algunas mujeres tuvieron episodios de colestasis durante el embarazo17,18. Desde entonces, la implicación del gen ABCB4 en la patogenia de la enfermedad se ha ido confirmando en múltiples estudios; se han descrito más de 10 mutaciones heterocigotas en pacientes con CIE de diferentes áreas geográficas18,19-24. Los estudios realizados no han identificado ningún patrón de herencia específico, ni tampoco asociaciones de esta entidad con el sistema de histocompatibilidad (HLA).
Fig. 1. Transportadores que intervienen en la formación canalicular de la bilis. En la membrana canalicular de la izquierda se representan los transportadores ABC, cuya función está bien establecida. En la membrana canalicular de la derecha se representan el heterodímero de ABCG5 y ABCG8. (Tomado de Oude Elferink.)
Factores hormonales– Estrógenos. Constituyen una causa conocida de colestasis tanto en condiciones clínicas como experimentales, y su papel patogénico en la CIE es muy probable25. La CIE ocurre principalmente durante el tercer trimestre, cuando las concentraciones séricas de estrógenos alcanzan sus valores más elevados. Por otra parte, esta entidad es más frecuente en embarazos gemelares o múltiples, que se asocian con unos valores circulantes de estrógenos más altos que los embarazos no múltiples26. Además, se ha demostrado que la colestasis se puede inducir experimentalmente mediante la administración de estrógenos, principalmente etinilestradiol, en mujeres no gestantes que habían padecido previamente una CIE durante un emba-27,28. Algunas pacientes pueden ser más susceptibles a los efectos colestásicos de los estrógenos, o bien pueden tener defectos específicos en el metabolismo estrogénico determinados genéticamente25.
TABLA I. Transportadores implicados en la formacón primaria de bilis
– Progesterona. La CIE también puede estar asociada con alteraciones en el metabolismo de la progesterona, y la administración de ésta puede ser un factor de riesgo para esta enfermedad29-31. Algunas pacientes genéticamente predispuestas con CIE presentan valores elevados de metabolitos sulfatados de la progesterona, posiblemente en relación con un mayor proceso de reducción por un metabolismo alterado. Estos metabolitos pueden saturar los sistemas transportadores hepáticos utilizados para la excreción biliar de estos compuestos. Un estudio demostró que la administración oral de progesterona (900-1.200 mg/día) en el tercer trimestre de embarazo se asociaba con una elevada concentración de ácidos biliares y alanina-aminotransferasa (ALT)31. En otro estudio de Back et al32, que incluyó a 50 mujeres francesas con CIE, se demostró que el 64% (32 pacientes) habían sido tratadas con progesterona oral para prevenir un parto prematuro. De los resultados de estos estudios se desprende que el tratamiento con progesterona debería evitarse en mujeres con historia previa de CIE, y el fármaco debe retirarse inmediatamente si aparece colestasis durante la gestación.
Factores ambientalesAlgunas características de la CIE sugieren que, además de los factores genéticos, debe de haber uno o más factores exógenos o ambientales implicados en la enfermedad. Así, aunque la recidiva de la CIE es un hecho frecuente en mujeres multíparas (45-70%), no se produce de forma sistemática30,33. Además, aunque el riesgo de recurrencia es mayor en pacientes que presentaron la enfermedad en su primera gestación, en algunas mujeres el trastorno puede aparecer después de embarazos asintomáticos34. Por otra parte, la expresión clínica y bioquímica de la CIE puede fluctuar durante un mismo embarazo y también puede variar en gestaciones posteriores35,36. Finalmente, como se ha mencionado, se han descrito variaciones estacionales en la incidencia de la CIE en Suecia y Finlandia, con mayor frecuencia en los meses de invierno7,37, y se ha observado un descenso de ésta en los últimos años en Suecia y Chile7,33.
Otros factores implicadosEn un estudio reciente, Reyes et al38 evaluaron la posible influencia de factores nutricionales en la fisiopatología de la CIE, y describieron el déficit de selenio como posible cofactor en el desarrollo de esta enfermedad. Este mismo grupo chileno ha publicado muy recientemente un trabajo en el que se describe un aumento en la permeabilidad intestinal como otro posible factor patogénico39. Los autores evaluaron la permeabilidad intestinal en 20 gestantes con CIE mediante la determinación de la excreción urinaria de sucrosa y el cociente lactulosa/ma-nitol en orina tras una sobrecarga oral estándar; y la compararon con la de 22 gestantes normales y 29 mujeres no embarazadas. La permeabilidad intestinal fue significativamente mayor en las mujeres gestantes con CIE que en los otros grupos (p < 0,01). Los autores concluyen que este factor puede participar en la patogenia de la enfermedad a través del incremento en la absorción de endotoxinas bacterianas y la circulación enterohepática de los metabolitos de hormonas sexuales y ácidos biliares que inducen colestasis. En definitiva, estos hallazgos sugieren que la CIE representa un síndrome colestásico con un trasfondo patogénico heterogéneo y aún no completamente esclarecido.
MANIFESTACIONES CLÍNICASEl síntoma principal de la CIE es el prurito, que puede preceder a las alteraciones de laboratorio40. Generalmente, aparece en el tercer trimestre de la gestación, después de la semana 30, pero en ocasiones puede iniciarse de forma más precoz, incluso a la sexta semana41,42. El prurito afecta sobre todo a las palmas de las manos y las plantas de los pies, aunque puede extenderse al tronco, las extremidades, los párpados e incluso, en casos graves, afectar también a la cavidad oral. Además, empeora por la noche, deteriorando la calidad del sueño. El dolor abdominal en el hipocondrio derecho, las náuseas y los vómitos son raros. De igual modo, la encefalopatía y otros estigmas de fallo hepático son inusuales y su presencia debe alertar sobre otras causas de enfermedad hepática. La exploración física no es específica, pero puede mostrar en ocasiones lesiones de rascado por el prurito. La ictericia ocurre en un 10-15% de los casos30, aparece unas 2 semanas después del comienzo del prurito, y se resuelve rápidamente entre uno y 40 días tras el parto. La ictericia aislada, sin prurito, es rara, y obliga a descartar con prontitud otras etiologías.
Datos de laboratorioLas concentraciones séricas de ácidos biliares totales en ayuno –medidas por un método enzimático– están aumentadas en la CIE respecto a las encontradas en una mujer con embarazo normal o no gestante (> 10 µmol/ l), y pueden ser la primera y única anormalidad analíti-32,33,43. El ácido cólico está más aumentado que otros ácidos quenodeoxicólicos, y ello condiciona un aumento del cociente ácido cólico/quenodesoxicólico comparado con el encontrado en mujeres embarazadas sin CIE44. De hecho, los predictores más sensibles antes del comienzo de los síntomas son el valor sérico aumentado de ácido cólico o un cociente ácido cólico/ácido quenodesoxicólico > 145. El cociente de glicina/taurina está disminuido. Otros hallazgos de laboratorio no específicos son las alteraciones que reflejan la colestasis. La bilirrubina total está moderadamente aumentada (< 6 mg/dl), a expensas de la fracción directa o conjugada. Los valores séricos de fosfatasa alcalina están también aumentados unas 4 veces su valor normal, pero son difíciles de interpretar debido a su incremento fisiológico durante la gestación por la producción de la isoenzima placentaria. Las concentraciones sé-ricas de gammaglutamiltranspeptidasa (GGT) suelen estar normales o poco elevados, hecho que es inusual en la mayoría de las otras enfermedades colestásicas. También aparecen elevados el colesterol y otros lípidos y la actividad aminotransferasa con valores de transaminasas que oscilan generalmente entre 2 y 10 veces el límite superior de la normalidad. En raras ocasiones se han comunicado casos con valores de ALT por encima de 500 veces el valor de la normalidad46. En tal caso resulta obligado considerar el diagnóstico diferencial con la hepatitis aguda viral o la hepatitis isquémica secundaria a un síndrome de Budd-Chiari agudo. Por último, el tiempo de protrombina, aunque suele ser normal, puede alterarse por el déficit de vitamina K debido a la colestasis o al uso de quelantes de ácidos biliares, como la colestiramina47.
DIAGNÓSTICOLa mayoría de las mujeres se diagnostican durante el segundo o el tercer trimestre del embarazo. El diagnóstico de la CIE se basa en la presencia de prurito asociado a valores elevados de ácidos biliares (> 10 µmol/l) y/o transaminasas, y la ausencia de enfermedades que puedan provocar síntomas similares. El síntoma cardinal del prurito ayuda a distinguir la CIE de otros tipos de enfermedad hepática que pueden mostrar datos de laboratorio similares (como el síndrome HELLP o la preeclampsia). Además, la desaparición completa del prurito y las alteraciones bioquímicas tras el parto es crucial para establecer el diagnóstico de CIE. La ecografía abdominal revela un parénquima hepático normal y una vía biliar no dilatada. La biopsia hepática sólo es necesaria en casos excepcionales para confirmar el diagnóstico. Los hallazgos histopatológicos más frecuentes son la presencia de pigmento biliar en los hepatocitos y en los canalículos, especialmente en el área centrolobulillar, con escasa infiltración inflamatoria en los espacios porta e hiperplasia de las células de Küpffer.
El diagnóstico diferencial se debe realizar especialmente con las hepatitis agudas virales y medicamentosas con componente colestásico. En los casos que cursan sin ictericia, hay que descartar otras causas de prurito cutáneo primario, como el herpes gestacional, el impétigo herpetiforme, la dermatitis papular del embarazo y la foliculitis pruriginosa, para lo que es imprescindible la consulta al dermatólogo48.
EVOLUCIÓNPronóstico maternoLa gravedad del prurito y de las alteraciones bioquímicas puede oscilar durante las últimas semanas de la gestación. Si la colestasis es intensa, puede haber esteatorrea, que ocasiona un déficit de vitamina K por malabsorción de vitaminas liposolubles. Ello puede verse agravado por la administración de resinas de intercambio aniónico, como la colestiramina. Este hecho tiene importancia por el riesgo de hemorragia tras el parto que comporta y obliga a corregir la hipoprotrombinemia. El pronóstico materno es bueno en la CIE. El prurito mejora inmediatamente tras el parto y generalmente desaparece por completo en pocos días, aunque excepcionalmente puede persistir algunas semanas más. Las alteraciones bioquímicas también retornan a la normalidad en menos de un mes tras el parto35,36. La CIE no contraindica la lactancia materna. Las madres que han sufrido CIE pueden presentar colestasis recidivante de gravedad variable en las gestaciones posteriores hasta en un 60-70% de los casos. El riesgo de colelitiasis por cálculos de colesterol es 2-7 veces superior.3,5,49
. A excepción de estas asociaciones, hasta la fecha se consideraba que la CIE no ocasionaba secuelas hepáticas o biliares importantes para la madre. Sin embargo, muy recientemente se ha publicado un trabajo que pone en entredicho esta creencia. Ropponen et al50 evaluaron en este estudio retrospectivo de casos y controles el riesgo de enfermedades hepatobiliares en una cohorte de 21.008 mujeres; 10.504 con historia de CIE durante los años 1972 y 2000 (casos), y 10.504 con un embarazo normal (controles). Los resultados del estudio mostraron una incidencia significativamente mayor de cirrosis no alcohólica, litiasis biliar, colecistitis y pancreatitis no alcohólica entre las mujeres con CIE frente a los controles. Los autores concluyen que algunas pacientes con CIE tienen riesgo de desarrollar cirrosis y otras enfermedades crónicas graves, lo que obliga, por consiguiente, a realizar un seguimiento de su evolución. La administración de anticonceptivos orales a las mujeres con historia de CIE, aunque puede ocasionar prurito, provoca colestasis recurrente en raras ocasiones y, por tanto, tras la normalización del perfil hepático, puede iniciarse la contracepción con dosis bajas de estrógenos. No obstante, es necesario realizar un seguimiento de las pruebas de la función hepática a los 3-6 meses del inicio del tratamiento.
Pronóstico fetalEn contraste con el pronóstico favorable de las madres, la CIE conlleva un riesgo significativo para el feto5,32. Las principales complicaciones son la prematuridad, el distrés fetal, la tinción meconial del líquido amniótico y la muerte intrauterina. La incidencia de prematuridad varía ampliamente en los diferentes estudios (6-60%), y puede reflejar en parte la elevada tasa de embarazos múltiples observada en mujeres con CIE32. En una serie de 61 niños nacidos de madres con CIE51, la incidencia de prematuridad fue del 100% en gestaciones múltiples y del 41% en embarazos no múltiples. Tres niños (5%) fallecieron. El riesgo de prematuridad parece relacionarse de forma inversa con la edad gestacional y el comienzo del prurito. La muerte fetal raramente ocurre antes del último mes de embarazo51 y su incidencia es más baja en los estudios (0,4-1,6% de los casos)5,32,43,52. La causa de este fenómeno es desconocida y no se ha podido relacionar con la gravedad de los síntomas maternos, los signos tradicionales de hipoxia intrauterina o la mala perfusión placentaria crónica, ya que el peso de los recién nacidos es acorde a su edad gestacional7. No hay un método ideal para la vigilancia fetal en la CIE. Algunos obstetras recomiendan realizar tests no estresantes o vigilancia biofísica. Sin embargo, no hay pruebas que sean capaces de predecir de forma real el riesgo de muerte fetal40,53. Se ha sugerido la hipotética utilidad de medir la concentración total de ácidos biliares séricos para la vigilancia fetal en la CIE52,54. En un estudio de 693 mujeres con CIE, la probabilidad de complicaciones fetales (definidas como parto pretérmino, acontecimientos asfícticos, tinción meconial del líquido amniótico, placenta y membranas) estuvo directamente relacionada con la concentración de ácidos biliares, incluso después de controlar otros factores de riesgo52. En este estudio, las complicaciones fetales no se observaron hasta que los valores de ácidos biliares fueron µ 40 µmol/l. Sin embargo, es necesaria la validación de estos resultados para determinar la seguridad de este punto de corte. Además, esta determinación puede tardar varios días incluso en laboratorios de referencia, lo que la convierte en una herramienta poco práctica para la estratificación inmediata del riesgo.
TRATAMIENTOTratamiento médicoSe han empleado múltiples fármacos para el tratamiento de la CIE. Los objetivos del tratamiento farmacológico incluyen reducir los síntomas de la madre (especialmente el prurito) y prevenir las complicaciones tanto de la madre como del feto. El tratamiento ideal debería conseguir los efectos beneficiosos de forma precoz (1-2 semanas), ya que en la mayoría de los casos la enfermedad se inicia al final de la gestación, y además no debería tener efectos deletéreos para la madre ni para el recién nacido. Hasta la fecha, ningún fármaco cumple todos estos requisitos. El empleo de antihistamínicos (p. ej., hidroxicina) y benzodiacepinas para el tratamiento del prurito proporciona un escaso alivio sintomático, no mejora las alteraciones bioquímicas y no modifica el pronóstico para el feto. Además, los antihistamínicos pueden agravar las dificultades respiratorias de los recién nacidos pretérmino. El fenobarbital en dosis bajas (2-5 mg/kg) logra mejorar la intensidad del prurito en el 50% de las pacientes, pero su efecto sobre la colestasis bioquímica es variable4,5,55. La dexametasona suprime la producción fetoplacentaria de estrógenos, y en un estudio se demostró que su administración durante una semana en dosis de 12 mg/día consigue reducir el prurito y disminuir la concentración plasmática de los ácidos biliares. Estos resultados, sin embargo, no se han reproducido en otros trabajos56,57. En un estudio controlado más reciente58, la dexametasona no mejoró el prurito ni los valores de ALT, y fue menos efectiva que el ácido ursodesoxicólico (AUDC) para reducir la bilirrubina y los ácidos biliares. La colestiramina (8-16 g/día) es una resina de intercambio aniónico que se une a los ácidos biliares en el intestino, reduciendo su absorción ileal e incrementando su excreción fecal. El tratamiento debe iniciarse con dosis bajas, que deben incrementarse gradualmente. La evidencia disponible pone de manifiesto que, aunque reduce el prurito en la madre, su efecto es limitado y no mejora los parámetros bioquímicos ni la evolución del feto5,59. Es más, la colestiramina puede empeorar el pronóstico maternofetal porque provoca esteatorrea, exacerbando la deficiencia de vitamina K, con el riesgo subsiguiente de coagulopatía y en algún caso de hemorragia cerebral fetal60. Por consiguiente, cuando se administra durante períodos largos es preciso realizar un seguimiento de la coagulación en la madre y, si es necesario, administrar vitamina K por vía parenteral. Como se indica más adelante, un ensayo controlado ha demostrado que su eficacia es inferior a la del AUDC. La eficacia del precursor del glutatión S-adenosil-metio-nina (SAMe) es controvertida41,42. Los estudios iniciales, en los que se demostró revertir la colestasis inducida por estrógenos en modelos de rata, propiciaron su utilización en humanos. Su mecanismo de acción consiste en reducir la inhibición del flujo biliar por el etinil-estradiol e incrementar la sulfuración de los ácidos biliares para su detoxificación. En una serie inicial no controlada, 18 mujeres con CIE recibieron tratamiento durante 20 días con SAMe (800 mg/día por vía intravenosa), con lo que se consiguió una mejoría clínica y bioquímica61. Sin embargo, algunos estudios posteriores, incluido un pequeño ensayo controlado con 18 pacientes62, no han reproducido estos resultados. Un ensayo controlado que compara SAMe con AUDC concluye que ambos son igual de eficaces para reducir el prurito, pero el AUDC es significativamente más eficaz para mejorar la concentración de ácidos biliares y otras pruebas bioquímicas hepáticas63. El AUDC es un ácido biliar terciario que modifica la composición biliar de ácidos biliares reemplazando el ácido litocólico, que es moderamente citotóxico para la membrana del hepatocito, y disminuyendo la absorción de ácido cólico y quenodesoxicólico. Además, el AUDC incrementa el flujo biliar y se ha utilizado para aliviar el prurito y mejorar las pruebas hepáticas en enfermedades colestásicas crónicas, como la cirrosis biliar primaria. Los estudios iniciales en CIE, así como los ensayos controlados, han demostrado que el AUDC mejora el prurito y los parámetros bioquímicos sin efectos adversos para la madre o el niño28,62. Un ensayo reciente incluyó 84 pacientes sintomáticas que fueron aleatorizadas para recibir AUDC (8-10 mg/kg/día) o colestiramina (8 g/día) durante 14 días64. El comienzo del prurito aconteció aproximadamente a las 31-32 semanas de gestación, y el tratamiento se inició aproximadamente a la semana 34. El grupo que recibió AUDC obtuvo una mejoría del prurito significativamente mayor y un descenso mayor en los niveles séricos de transaminasas y ácidos biliares. Además, los recién nacidos del grupo de madres que recibió AUDC nacieron a término con una frecuencia significativamente mayor. No hubo efectos adversos en el grupo que recibió AUDC, mientras que 12 pacientes del grupo tratado con colestiramina mostraron efectos secundarios (especialmente náuseas). Un segundo ensayo58 comparó la eficacia del AUDC frente a placebo y desametaxona. Se incluyeron 130 pacientes con CIE que fueron aleatorizadas para recibir AUDC (1 g/día durante 3 semanas) o dexametasona (12 mg/día durante una semana y placebo durante las semanas 2 y 3), o placebo durante 3 semanas. El uso de AUDC se asoció con una mejora de algunos parámetros bioquímicos (ALT, bilirrubina), con independencia de la gravedad de la enfermedad, mientras que la mejora del prurito y la notable reducción de los ácidos biliares séricos sólo se observó en pacientes con CIE grave (ácidos biliares µ 40 µmol/l en el momento de la inclusión). Por último, un tercer trabajo proporcionó información sobre la evolución perinatal y a largo plazo asociadas con el tratamiento con AUDC65; 32 pacientes que habían sido tratadas con AUDC (15 mg/kg/día) durante al menos 3 semanas antes del parto fueron observadas durante un período de seguimiento de 12 años, y se compararon con 16 controles históricos que no habían recibido AUDC. El tratamiento con AUDC se asoció con una mejoría del prurito, un descenso de los valores de bilirrubina, ALT y sales biliares, así como con un mayor peso al nacer y una mayor tasa de partos a término; 26 niños cuyas madres habían recibido AUDC se reexaminaron después de 1 y 12 años de seguimiento y todos ellos se encontraban sanos. Otros tratamientos utilizados en grupos reducidos de pacientes, como el carbón vegetal (charcoal), la luz ultra-violeta y los emolientes tópicos, tienen una eficacia incierta.
Manejo obstétricoEl principal objetivo de los obstetras y las pacientes es finalizar con éxito la gestación. El pronóstico fetal mejora si se realiza un diagnóstico temprano y un manejo adecuado. Éste incluye el estrecho seguimiento fetal, la inducción del parto cuando se haya conseguido la madurez pulmonar del feto, y la administración de fármacos que disminuyan los ácidos biliares. Un estudio demostró que la mortalidad perinatal con un manejo agresivo es menor cuando se compara con la obtenida con el manejo habitual66. La decisión de finalizar la gestación debe hacerse sopesando el riesgo de prematuridad asociado a un parto temprano frente al riesgo de muerte intrauterina. El momento del parto debería guiarse por los síntomas de la paciente (principalmente el prurito), la edad gestacional y las condiciones del cuello uterino53,67. En la mayoría de las pacientes el momento idóneo para el parto se estima hacia la semana 38. Sin embargo, cuando la colestasis es grave (especialmente si hay ictericia), debería considerarse la inducción del parto en la semana 36 si se ha alcanzado la madurez pulmonar, o tan pronto como ésta se consiga5. Ya se ha mencionado que puede producirse la muerte fetal súbita y que el riesgo de este desenlace es difícil de predecir con un seguimiento convencional5,43.
Correspondencia: S. Lorente. Unidad de Gastroenterología y Hepatología. Hospital San Jorge de Huesca. Avda. Martínez de Velasco, 36. 20004 Huesca. España. Correo electrónico: slorente@salud.aragon.es
Recibido el 31-1-2007; aceptado para su publicación el 16-1-2007.