La hepatitis B crónica (HBC) representa un problema de salud pública importante. En el mundo se estima que hay 400 millones de personas infectadas por el virus de la hepatitis B (VHB), y en España la hepatitis B es la tercera causa de enfermedad hepática crónica después de la hepatitis C y el alcoholismo.
En la actualidad hay en nuestro país 4 fármacos aprobados para la HBC, el interferón o interferón pegilado, la lamivudina, el adefovir divipoxil y el entecavir1,2. En abril de 2007, la European Agency for the Evaluation of Medicinal Products (EMEA) aprobó la telbivudina para el tratamiento de la hepatitis B crónica. Cada uno de estos fármacos posee ventajas y limitaciones. Los interferones son eficaces en una minoría de pacientes, sus efectos adversos limitan o contraindican su utilización y precisan su administración por vía subcutánea. Los análogos de los nucleós(t)idos son fármacos orales, en general bien tolerados, que producen una importante inhibición de la replicación viral, y deben administrarse de forma prolongada, lo que condiciona la aparición de mutantes del VHB resistentes a los antivirales1,2.
Telbivudina es el último antiviral aprobado por la Food and Drug Administration (FDA) de Estados Unidos y la EMEA, y pertenece a los nuevos antivirales con una potente acción antiviral. Telbivudina se comercializa bajo el nombre de Sebivo® (en comprimidos de 600 mg) y está indicada para el tratamiento de los pacientes con HBC con replicación viral e inflamación hepática activa. Esta indicación está basada en los resultados obtenidos en los estudios multicéntricos que demuestran la respuesta virológica, serológica, bioquímica e histológica tras un año de tratamiento con telbivudina, tanto en pacientes con HBC antígeno e de la hepatitis B (HBeAg) positivo como negativo.
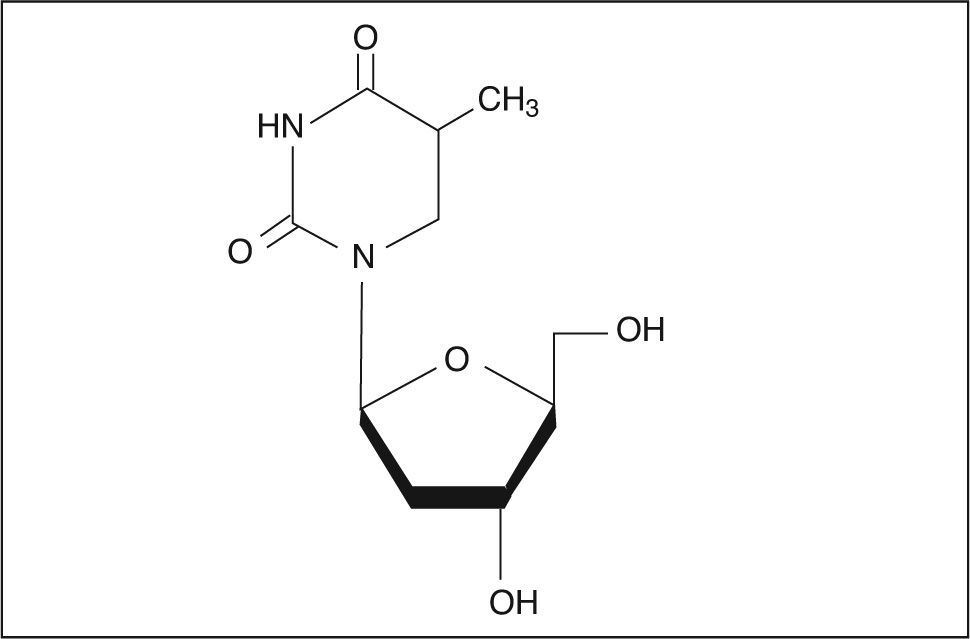
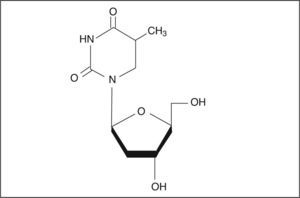
Estructura químicaTelbivudina (β-L-2’-deoxytimidina) es un nuevo β-L-nucleósido con actividad específica y selectiva frente al VHB. Telbivudina es el L-enantiómero de la timidita3. Su fórmula molecular es C10H14N2O5, a la que le corresponde un peso molecular de 242,23. Su estructura química se muestra en la figura 1.
Mecanismo de acciónTelbivudina se fosforiliza por las cinasas celulares hasta su forma trifosfato, con una vida media intracelular de 14 h. Telbivudina 5’-trifosfato inhibe la ADN polimerasa del VHB al competir con el sustrato principal, timidina 5’-trifosfato. La incorporación de telbivudina 5’-trifosfato en el ADN viral causa la finalización de la cadena de ADN, provocando la inhibición de la replicación viral.
FarmacocinéticaTelbivudina se administra por vía oral en una dosis única de 600 mg, y la concentración plasmática máxima (Cmáx) que alcanza (media ± desviación estándar) es de 3,2 ± 1,1 μg/ml, en una media de 3 h después de la dosis. El área bajo la curva de las concentraciones plasmáticas de telbivudina en función del tiempo (AUC0-?) fue de 28,0 ± 8,5 μg/h/ml. La administración de una dosis única de 600 mg con los alimentos no afectó ni a la absorción ni a la exposición a telbivudina; por tanto, puede administrase con o sin los alimentos3.
Tras alcanzar la Cmáx, la disposición plasmática de telbivudina disminuye de forma biexponencial, con una vida media de eliminación terminal (t1/2) de 41,8 ± 11,8 h. La telbivudina se elimina principalmente por excreción urinaria en forma de sustrato inalterado. Aproximadamente, el 42% de la dosis se recupera en la orina en un plazo de 7 días tras la administración de una dosis oral única de 600 mg de telbivudina. Dado que la vía de eliminación es predominantemente renal, en los sujetos con una disfunción renal moderada-grave y en los pacientes en hemodiálisis será necesario un ajuste del intervalo de dosis.
Experiencia clínica con telbivudinaEl programa de desarrollo clínico de telbivudina incluye 2 estudios en fase I-IIa de búsqueda y confirmación de la dosis óptima, y un estudio de registro (GLOBE) en pacientes con HBC.
El primer estudio realizado en pacientes con HBC fue un ensayo en fase I/II de dosis-respuesta, que incluyó a 43 pacientes adultos con HBC HBeAg positivo, y evaluó la seguridad y la eficacia de 6 dosis distintas de telbivudina y placebo. Los pacientes fueron aleatorizados a recibir 25, 50, 100, 200, 400 y 800 mg de telbivudina o placebo una vez al día durante 4 semanas, seguidos posteriormente durante 12 semanas sin tratamiento4. El estudio demostró que el fármaco se toleraba bien y que había una relación entre la dosis y la respuesta, obteniéndose la máxima reducción en los valores de ADN-VHB a las 4 semanas (3,6-3,7 log10 copias/ml) con las dosis de 400–800 mg/día. El siguiente paso fue un estudio en fase II B, aleatorizado, ciego, controlado y multicéntrico, realizado en 104 pacientes con HBC HBeAg positivo5. Los pacientes fueron aleatorizados a recibir 5 pautas de tratamiento distintas: lamivudina 100 mg/día, telbivudina 400 mg/día, telbivudina 600 mg/día, la combinación de telbivudina 400 mg y lamivudina 100 mg/día, o la combinación de telbivudina 600 mg y lamivudina 100 mg/día. Todos los pacientes fueron tratados durante 52 semanas. El objetivo primario fue la reducción en los valores de ADN-VHB en la semana 52 y los resultados fueron analizados en 3 grupos: pacientes en monoterapia con lamivudina (n = 19), pacientes en monoterapia con telbivudina (400–600 mg) (n = 44) y tratamiento combinado con lamivudina y telbivudina (400–600 mg) (n = 41). Los cambios medianos en las concentraciones de ADN-VHB respecto al valor basal fueron de –4,66 para el grupo de lamivudina, de –6,34 para el grupo de telbivudina y de –6,06 para el grupo de tratamiento combinado, y el porcentaje de pacientes con ADN-VHB indetectable por reacción en cadena de la polimerasa (PCR) en la semana 52 del 32, 61 y 49%, respectivamente. Los pacientes tratados con telbivudina en monoterapia lograron reducciones medias del ADN-VHB significativamente superiores (p < 0,05). La terapia combinada no demostró ser superior a la monoterapia con telbivudina. El tratamiento se prolongó hasta los 2 años. Al final de este período, el porcentaje de pacientes tratados con telbivudina con valores de alanino aminotransferasa (ALT) normales fue superior (el 81 frente al 41%), así como el porcentaje de pérdida de HBeAg (el 38 frente al 33%) y seroconversión a anti-HBe (el 38 frente al 22%). Basándose en los resultados de estos estudios, se seleccionó la dosis de telbivudina de 600 mg una vez al día para el estudio en fase III, denominado GLOBE.
Estudio en fase III en pacientes con hepatitis B crónica, HBeAg positivo y negativoEl GLOBE es un estudio multicéntrico, controlado y doble ciego, en el que se ha comparado la eficacia, la seguridad y la tolerabilidad de telvibudina 600 mg/día con lamivudina 100 mg/día durante un período de tratamiento de 104 semanas. En total, se incluyó a 1.367 pacientes con HBC HBeAg positivo o negativo6. Los criterios de inclusión fueron los siguientes: ausencia de tratamiento previo con análogos de nucleósidos, valores de ALT entre 1,3 y 10 veces el límite superior del intervalo de normalidad, y valores de ADN-VHB ≥ 6 log10 copias/ml. El parámetro primario de eficacia es una variable combinada denominada «respuesta terapéutica», que se define como una supresión del ADN-VHB sérico hasta valores < 5 log10 copias/ml, junto con la eliminación de HBeAg en pacientes HBeAg positivo y normalización en los valores de ALT en pacientes HBeAg negativo. Las variables secundarias de eficacia incluyen parámetros histológicos, serológicos y virológicos. La respuesta histológica se definió por la reducción de, al menos, 2 puntos del índice de necroinflamación de Knodell, sin empeoramiento de la fibrosis al año del tratamiento.
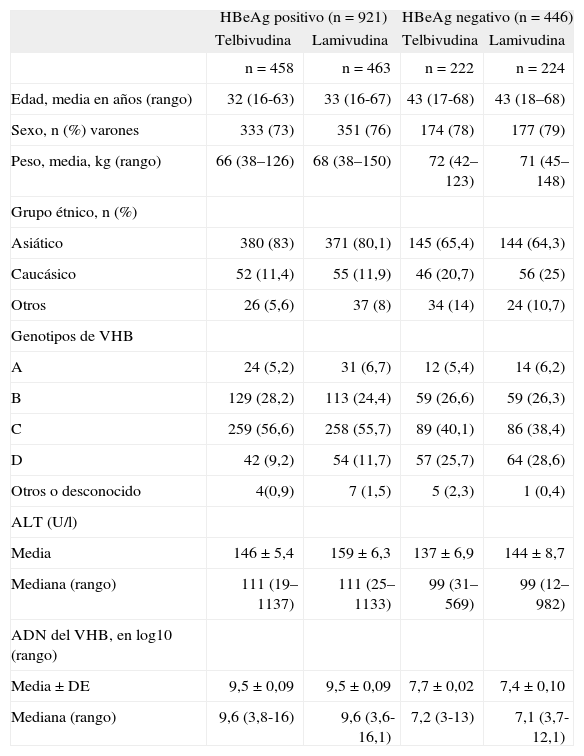
De los 1.367 pacientes seleccionados, 921 eran HBeAg positivo y los restantes HBeAg negativo. De ellos, 458 fueron aleatorizados a recibir telbivudina 600 mg/día, y 463 lamivudina 100 mg/día. De los 446 pacientes HBeAg negativo, 222 fueron aleatorizados a recibir telbivudina 600 mg/día, y 224 lamivudina 100 mg/día durante 104 semanas. La descripción de las características demográficas de los pacientes se detalla en la tabla I.
Características basales de los pacientes del estudio GLOBE
| HBeAg positivo (n = 921) | HBeAg negativo (n = 446) | |||
| Telbivudina | Lamivudina | Telbivudina | Lamivudina | |
| n = 458 | n = 463 | n = 222 | n = 224 | |
| Edad, media en años (rango) | 32 (16-63) | 33 (16-67) | 43 (17-68) | 43 (18–68) |
| Sexo, n (%) varones | 333 (73) | 351 (76) | 174 (78) | 177 (79) |
| Peso, media, kg (rango) | 66 (38–126) | 68 (38–150) | 72 (42–123) | 71 (45–148) |
| Grupo étnico, n (%) | ||||
| Asiático | 380 (83) | 371 (80,1) | 145 (65,4) | 144 (64,3) |
| Caucásico | 52 (11,4) | 55 (11,9) | 46 (20,7) | 56 (25) |
| Otros | 26 (5,6) | 37 (8) | 34 (14) | 24 (10,7) |
| Genotipos de VHB | ||||
| A | 24 (5,2) | 31 (6,7) | 12 (5,4) | 14 (6,2) |
| B | 129 (28,2) | 113 (24,4) | 59 (26,6) | 59 (26,3) |
| C | 259 (56,6) | 258 (55,7) | 89 (40,1) | 86 (38,4) |
| D | 42 (9,2) | 54 (11,7) | 57 (25,7) | 64 (28,6) |
| Otros o desconocido | 4(0,9) | 7 (1,5) | 5 (2,3) | 1 (0,4) |
| ALT (U/l) | ||||
| Media | 146 ± 5,4 | 159 ± 6,3 | 137 ± 6,9 | 144 ± 8,7 |
| Mediana (rango) | 111 (19–1137) | 111 (25–1133) | 99 (31–569) | 99 (12–982) |
| ADN del VHB, en log10 (rango) | ||||
| Media ± DE | 9,5 ± 0,09 | 9,5 ± 0,09 | 7,7 ± 0,02 | 7,4 ± 0,10 |
| Mediana (rango) | 9,6 (3,8-16) | 9,6 (3,6-16,1) | 7,2 (3-13) | 7,1 (3,7-12,1) |
Resultados demográficos por grupo de tratamiento y según la presencia o ausencia del antígeno «e» del VHB.
ADN: ácido desoxirribonucleico; ALT: alanino aminotransferasa; DE: desviación estándar; HBeAg: antígeno e de la hepatitis B; VHB: virus de la hepatitis B.
El parámetro primario de eficacia es una variable combinada denominada «respuesta terapéutica», que se define como la supresión del ADN-VHB sérico hasta valores inferiores a 5 log10 copias/ml, junto con la eliminación del HBeAg. A las 52 semanas, telbivudina demostró ser estadísticamente superior a lamivudina en la respuesta terapéutica. Una mayor proporción de los pacientes tratados con telbivudina (75,3%) presentaba respuesta terapéutica, en comparación con el grupo tratado con lamivudina (67%) (p = 0,0047). Además, los pacientes tratados con telbivudina alcanzaron mayores reducciones en los valo res de ADN-VHB a las 52 semanas que el grupo tratado con lamivudina (–6,45 frente a –5,54 log10, respectivamente; p < 0,01) y una proporción mayor de pacientes presentó valores indetectables de ADN viral en el grupo tratado con telbivudina (el 60% frente al 40% tratado con lamivudina; p < 0,01)7.
Asimismo, en los pacientes tratados con telbivudina se observó una supresión viral mucho más rápida y una reducción media de la carga viral superior a partir de la semana 12, en comparación con los pacientes tratados con lamivudina (p = 0,0157).
Los resultados del estudio GLOBE a los 2 años en los pacientes HBeAg positivo mostraron una respuesta terapéutica del 64% para telbivudina y del 48% para lamivudina (p < 0,01); el ADN-VHB fue indetectable por PCR en el 56% de los casos tratados con telbivudina frente al 39% con lamivudina (p < 0,01); las transaminasas fueron normales en el 70 y el 62% (p = 0,01), respectivamente. La pérdida del HBeAg se observó en el 35% de los tratados con telbivudina y en el 29% del grupo de lamivudina (p = 0,05), y la seroconversión a anti-HBe en el 30 y el 25% de los casos, respectivamente, si bien las diferencias no eran estadísticamente significativas (p = 0,09). La pérdida estable del HBeAg y la seroconversión a anti-HBe, una vez interrumpido el tratamiento, fue similar en ambos grupos. Treinta y nueve de los pacientes tratados con telbivudina y 20 de los tratados con lamivudina interrumpieron el tratamiento por presentar seroconversión a anti- HBe. Ésta fue persistente en el 83 y el 88% de los casos, respectivamente, tras un tiempo medio de seguimiento de 30 semanas.
Los pacientes que presentaron unos valores iniciales de ALT superiores a 2 veces el límite superior de la normali- dad tuvieron una mejor respuesta terapéutica, tanto a telbivudina como a lamivudina, tal como se muestran en la tabla II.
Resultados de eficacia a 2 años en pacientes HBeAg positivo y ALT superior a 2 veces el valor máximo aceptado
| Telbivudina | Lamivudina | |
| Pérdida de HBeAg (%)* | 42 | 32 |
| Seroconversión HBeAg (%)* | 37 | 27 |
| Respuesta terapéutica (%)* | 66 | 52 |
| Descenso medio de ADN-VHB desde el valor inicial, log10 copias* | –6,1 | –5 |
| ADN-VHB no detectable por PCR (%)* | 61 | 43 |
| Normalización de ALT (%)* | 72 | 63 |
ADN: ácido desoxirribonucleico; ALT: alanino aminotransferasa;
HBeAg: antígeno e de la hepatitis B; PCR: reacción en cadena de la polimerasa;
VHB: virus de la hepatitis B.
En resumen, en los pacientes HBeAg-positivos, telbivudina ofrece una mejor respuesta virológica, bioquímica, histológica y serológica que lamivudina, con un menor porcentaje de resistencias. Además, como se detalla en la última sección de este artículo, presenta la ventaja adicional de que a las 24 semanas de tratamiento puede predecirse mediante la cuantificación de las concentraciones de ADN-VHB la posibilidad de respuesta persistente y el riesgo de desarrollar resistencias al fármaco. Por ejemplo, la seroconversión a anti-HBe se observó en el 45% de los pacientes con ADN-VHB indetectable a las 24 semanas, comparado con sólo el 6% de los pacientes con concentraciones > 4 log10 copias/ml.
Resultados en pacientes HBeAg negativoEn los pacientes con HBC HBeAg negativo tratados con telbivudina, la respuesta terapéutica definida por la supresión del ADN-VHB sérico hasta valores < 5 log10 copias/ ml y la normalización en los valores de ALT a las 52 semanas fue similar a la observada en el grupo tratado con lamivudina (el 75,2 frente al 77,2%; p = 0,6187). Los pacientes que recibieron telbivudina alcanzaron mayores reducciones en los valores de ADN-VHB a las 52 semanas de tratamiento que los pacientes del grupo lamivudina (–5,23 frente a –4,40 log10 en el grupo de lamivudina; p < 0,01). Una proporción mayor de pacientes presentó valores indetectables de ADN viral en el grupo tratado con telbivudina (el 88% frente al 71% tratado con lamivudina; p < 0,01).
Los resultados del estudio GLOBE a los 2 años en los pacientes HBeAg negativo mostraron una respuesta terapéutica superior para telbivudina (el 78 frente al 66% para lamivudina; p < 0,01), con un ADN-VHB indetectable por PCR en el 82% de los casos tratados con telbivudina frente al 57% con lamivudina (p < 0,01) y las transaminasas fueron normales en el 78 y el 70% (p = 0,07), respectivamente.
Los resultados del estudio GLOBE para el grupo de pacientes HBeAg negativo a las 104 semanas se exponen en la tabla III.
Resultados de eficacia a 2 años en pacientes HBeAg negativo
| Telbivudina | Lamivudina | |
| n | 222 | 224 |
| Respuesta terapéutica (%)* | 78 | 66 |
| Descenso medio de ADN-VHB desde el inicio (media log10)* | –5 | –4,2 |
| ADN-VHB no detectable por PCR (%)* | 82 | 57 |
| Normalización ALT (%) | 78 | 70 |
ADN: ácido desoxirribonucleico; ALT: alanino aminotransferasa;
HBeAg: antígeno e de la hepatitis B; PCR: reacción en cadena de la polimerasa;
VHB: virus de la hepatitis B.
La respuesta virológica medida por el descenso de las concentraciones de ADN-VHB y el porcentaje de pacientes con concentraciones de ADN-VHB indetectable fue superior en el grupo tratado con telbivudina.
Efectos adversosLa mayoría de los efectos secundarios fueron de gravedad leve o moderada y, en general, comparable entre telbivudina y lamivudina. La proporción de interrupciones del tratamiento fue del 0,6% para telbivudina y el 2% para lamivudina6.
De las alteraciones analíticas, las elevaciones de las creatincinasa fueron las más relevantes. Estas fueron más frecuentes en el grupo tratado con telbivudina (el 9 frente al 3%, en elevaciones de grado 3/4), y la mayoría fueron asintomáticas. En los casos sintomáticos, el tiempo medio de resolución del evento fue superior en los pacientes tratados con telbivudina. Sólo 3 de los 680 pacientes tratados con telbivudina fueron diagnosticados de miopatía. Por otro lado, las elevaciones de los valores de ALT fueron más frecuentes en el grupo de lamivudina y en los pacientes HBeAg positivo.
Además, la experiencia con telbivudina, tanto en los estudios con animales de experimentación como en humanos, ha propiciado que la FDA lo catalogue dentro de la clasificación de seguridad B, superior a lamivudina, adefovir y entecavir; por tanto, es el único de los antivirales orales para el tratamiento de la hepatitis B que posee este excelente perfil de seguridad.
Recaídas virológicas y mutaciones del VHB asociadas a resistencias a telbivudinaEn pacientes tratados con telbivudina sólo se ha descrito una mutación específica del VHB asociada a resistencia a telbivudina en la región de la ADN polimerasa, que es la rtM204I. Esta mutación en algunos casos puede asociarse a una segunda mutación compensatoria que ocurre en la posición rtL80I/V, menos frecuente que rt180. No se ha detectado la mutación rtM204V que se asocia a la resistencia a lamivudina.
La presencia de recaídas virológicas y mutaciones del VHB asociadas a resistencia a telbivudina es inferior a la observada con lamivudina. En el estudio GLOBE, la proporción de pacientes con resistencias a telbivudina a las 52 semanas fue del 5% en el grupo de pacientes HBeAg positivo y del 2,3% en el grupo de los pacientes HBeAg negativo, porcentaje inferior comparado con el 11 y el 10,7%, respectivamente, observado con lamivudina (p < 0,01), y a los 2 años se incremento al 21 frente al 35% y del 8,6 frente al 21,9% en pacientes HBeAg positivo y negativo, respectivamente (p < 0,01).
Globalmente, la mutación M204I se detectó en 46 de los 115 pacientes tratados con telbivudina y con valores de ADN > 1.000 copias/ml a la semana 52, incluidos los que presentaron una recaída virológica). Éstos representaban el 6,8% de todos los pacientes tratados con telbivudina7. La resistencia a lamivudina se acompañó de mutaciones rt M204 I, rt M204V asociadas a L180 M.
Factores predictivos de respuesta a la telbivudinaRecientemente, se han analizado las variables basales y los factores capaces de predecir la respuesta a las 104 semanas de tratamiento. Las variables basales analizadas fueron la edad, el sexo, el índice de masa corporal (IMC), los valores de ALT, el grado de fibrosis y la actividad inflamatoria del índice de Ishak, las concentraciones de ADN-VHB y el genotipo del VHB. Los parámetros evaluados durante el tratamiento fueron los valores de ADNVHB a las semanas 12 y 24, que se han distribuido en PCR negativo, < 3 log 10 copias/ml, 3-4 log10 copias/ml y ≥ 4 log10 copias/ml. Mediante análisis de regresión lo gística se ha comprobado que en los pacientes HBeAg positivo las variables basales que se asocian a respuesta virológica a los 2 años (ADN-VHB negativo por PCR) son los valores de transaminasas elevados 2,5 veces el valor normal (odds ratio [OR] = 2,63; intervalo de confianza [IC] del 95%, 1,67-4,13), las concentraciones de ADN-VHB < 9 log10 (OR = 3,63; IC del 95%, 2,19-6,01) y el IMC < 22,5 (OR = 1,87; IC del 95%, 1,21-2,88). Éstas son las mismas variables que se asocian a seroconversión a antiHBe. En los pacientes HBeAg negativo, la variable asociada a respuesta virológica a los 2 años (ADN-VHB negativo por PCR) fue el IMC (OR = 3,34; IC del 95%, 1,32-8,41)8–10.
Durante el tratamiento, la principal variable asociada a respuesta virológica persistente, a seroconversión a anti-HBe y a una tasa mas baja de resistencia fue la ausencia de ADN-VHB a la semana 24 de tratamiento con telbivudina. La determinación de valores de ADN-VHB a las 24 semanas de tratamiento tiene un valor predictivo de desarrollo de resistencias. En los pacientes con ADN-VHB indetectable, las posibilidades de desarrollar resistencia a los 2 años son prácticamente nulas. El 88% de las resistencias a telbivudina se presentaba en pacientes con carga viral de 3 o más logaritmos a la semana 2410.
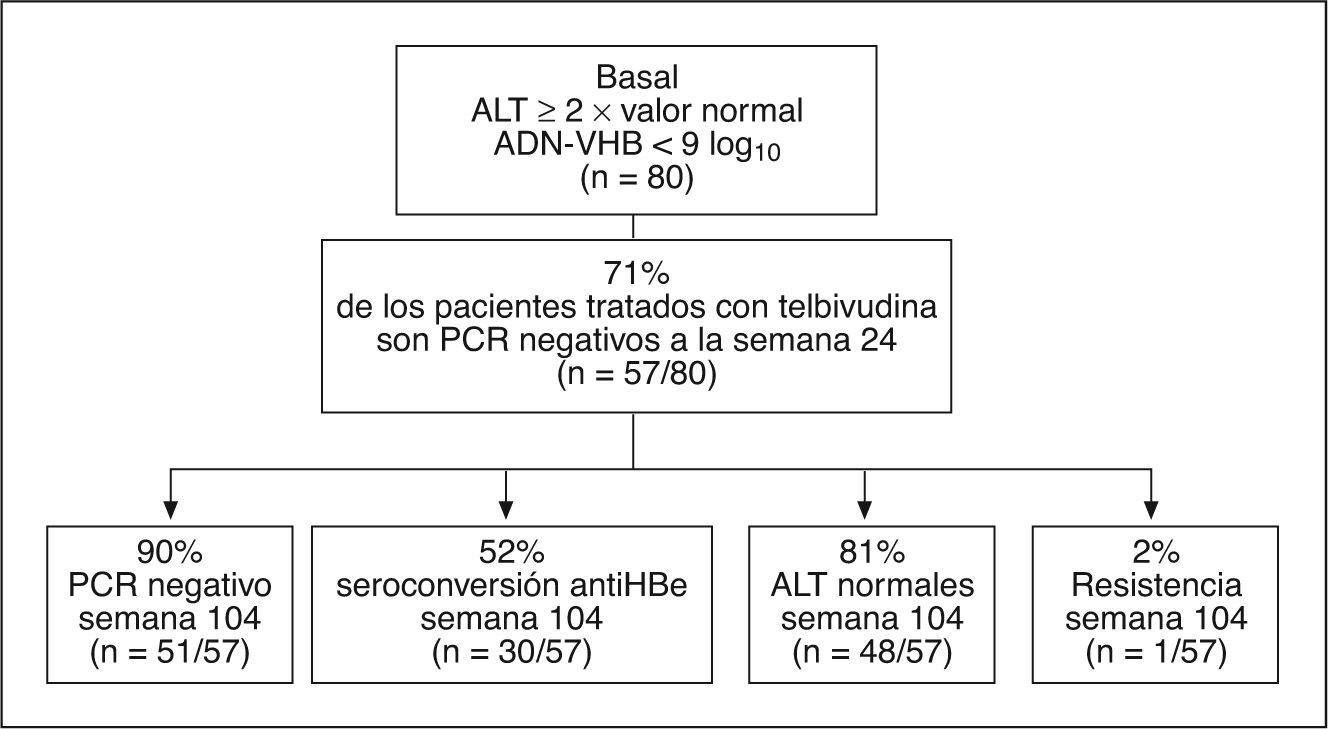
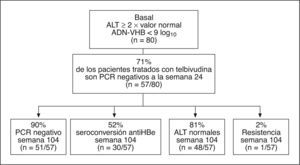
Si se analizan la negatividad del ADN a la semana 24 en los pacientes HBeAg positivo con valores basales de ALT elevados (> 2 veces los valores normales ) y concentraciones de ADN-VHB < 9 log, se observa que el 71% de los pacientes tratados con telbivudina negativizan el ADN-VHB a la semana 24, y de ellos el 90% continúa con ADN-VHB negativo por PCR a la semana 104, el 52% seroconvierte a anti-HBe y sólo el 2% desarrolla resistencia a la semana 104 (fig. 2).
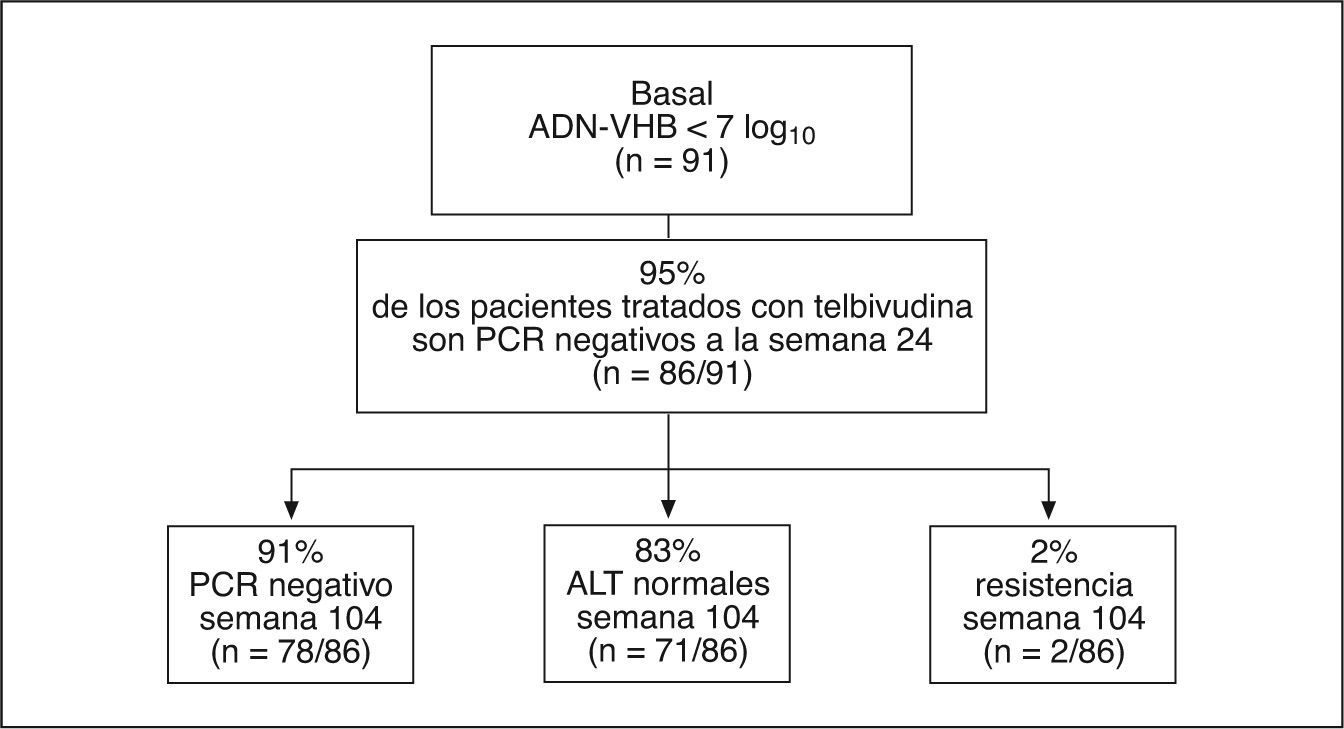
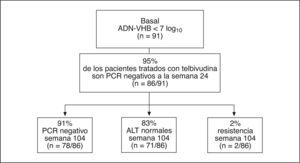
Se observan resultados excelentes en los pacientes HBeAg negativos con bajos valores de ADN-VHB (< 7 log), que son los que habitualmente tratamos en nuestro medio. El 95% de estos pacientes negativizan el ADN-VHB a la semana 24 de tratamiento con telbivudina, y la continuación del tratamiento hasta 104 semanas se asocia a respuesta virológica mantenida en el 91% de los casos con una tasa de resistencias del 2% (fig. 3).
Tratamiento de las resistencias a telbivudinaTodavía se dispone de escasos datos sobre el tratamiento de rescate de pacientes con resistencia a telbivudina. Los pacientes incluidos en el estudio GLOBE que desarrollaron resistencias a telbivudina se trataron de nuevo con adefovir. La experiencia actual es de 21 pacientes (15 HBeAg positivo y 6 HBeAg negativo) con recaída virológica y detección de la mutación M204I. De ellos, 16 fueron rescatados con adefovir en monoterapia y 5 con un tratamiento combinado de telbivudina y adefovir. Los resultados preliminares a 16 semanas de tratamiento demostraron una caída superior de 0,6 log en los pacientes tratados con ambos fármacos. Cuatro de los 16 pacientes tratados con adefovir en monoterapia negativizaron el ADN-VHB a las 16 semanas, y todos (5 de 5) de los tratados con telbivudina y adefovir11. Estos datos iniciales, junto con los resultados de los estudios in vitro, sugieren que adefovir es un buen fármaco de rescate para los pacientes con mutaciones del VHB asociadas a resistencia a telbivudina. La tolerancia y la seguridad del tratamiento combinado fueron excelentes.
Telbivudina en situaciones especialesTelbivudina se ha utilizado en pacientes con respuesta subóptima al adefovir. Un estudio comparó la eficacia antiviral de telbivudina y adefovir en pacientes HBeAg positivo. Es un estudio aleatorizado en 135 pacientes previamente no tratados con HBC HBeAg positivo. Los pacientes son aleatorizados 1:1:1 a recibir telbivudina (600 mg/día) durante 52 semanas, adefovir (10 mg/día) durante 52 semanas o adefovir durante 24 semanas, y después telbivudina durante 28 semanas. La variable de eficacia primaria es la reducción del ADN-VHB a las 24 semanas. Los pacientes tratados con telbivudina presentaron una caída media (–6,3 frente a –4,97) en los grupos de adefovir. El ADN-VHB a la semana 24 fue del 39% en el grupo de telbivudina frente al 12% en los grupos de adefovir (p < 0,001)12. En la semana 52, la reducción del ADN-VHB fue superior en los grupos que recibieron tel- bivudina frente a adefovir. EL ADN-VHB fue negativo en el 60% de los pacientes tratados con telbivudina, en el 40% de los tratados con adefovir y en el 54% de los tratados de forma secuencial con adefovir y telbivudina. La seroconversión anti-HBe se observó en el 28, 19 y 24%, respectivamente. Estos resultados demuestran que telbivudina es superior para suprimir el ADN-VHB que adefovir, especialmente en pacientes HBeAg positivo.
En resumen, telbivudina es un fármaco seguro, con una eficacia terapéutica superior a lamivudina y con un perfil de resistencias más bajo. Además, los datos de eficacia a las 24 semanas de tratamiento son capaces de predecir los resultados a los 2 años. Los pacientes que negativizan los valores de viremia a las 24 semanas mantienen la respuesta virológica y bioquímica a los 2 años y raramente desarrollan resistencias, mientras que los que continúan con elevados valores de ADN-VHB a las 24 semanas presentan un riesgo más elevado de desarrollar resistencias y menos posibilidades de alcanzar una respuesta virológica prolongada en el tratamiento a los 2 años. Este nuevo concepto, hacer un seguimiento de la respuesta virológica a las 24 semanas de tratamiento, permite individualizar el tratamiento y ofrece la posibilidad de mejorar los resultados terapéuticos, al permitir seleccionar los mejores fármacos para el tratamiento de los pacientes con HBC.