El trasplante de órganos ha avanzado enormemente en las últimas 4 décadas y es en la actualidad un tratamiento bien establecido para enfermedades terminales de riñón, hígado, páncreas, corazón y pulmón. Si bien en todos estos casos la supervivencia a corto plazo es excelente, por desgracia la supervivencia a largo plazo todavía es, en comparación, pobre: aproximadamente un 50% a los 5 años en el caso de los injertos renales. Esta cifra, que ha permanecido prácticamente inalterada desde 1975, es consecuencia de la lesión irreversible por rechazo crónico y de los efectos secundarios de la inmunodepresión están-dar 1,2 . La inducción de tolerancia, definida como una hiporrespuesta inmunológica específica para el donante mantenida en ausencia de tratamiento inmunodepresor continuado, se considera una solución potencial a estos 2 problemas que en la actualidad limitan la supervivencia de los injertos humanos. La adquisición de tolerancia inmunológica fue descrita por vez primera por Medawar et al hace más de 50 años. Desde entonces, un gran número de estrategias han mostrado ser capaces de inducir tolerancia en modelos experimentales de trasplante. Sin embargo, la mayor parte de los intentos de trasladar estas estrategias terapéuticas a la clínica han sido infructuosos. Así, si bien se han descrito casos de receptores humanos tolerantes, fundamentalmente en el trasplante hepático, carecemos todavía de un tratamiento clínicamente aplicable para inducir tolerancia en la clínica. Los linfocitos T desempeñan un papel crítico en la génesis de las respuestas aloinmunitarias y dirigen tanto los mecanismos de rechazo como la adquisición de tolerancia. El primer paso en cualquier respuesta inmunitaria aloespecífica es la presentación aloantigénica. Los linfocitos T del receptor, a través de su receptor de células T, pueden reconocer tanto péptidos alogénicos presentados en moléculas del complejo principal de histocompatibilidad (HLA) de las células presentadoras del receptor, como moléculas HLA intactas del donante expresadas en la superficie de células presentadoras del donante. La combinación de estas 2 formas de alopresentación, que se producen fundamentalmente en los ganglios linfáticos regionales, es la causante de la enorme proporción de linfocitos T efectores alorreactivos y de la potencia de la respuesta aloinmunitaria en ausencia de inmunización previa. Los linfocitos T aloactivados posteriormente se expanden, adquieren propiedades efectoras y migran al injerto, donde provocan lesiones tisulares. Algunos linfocitos, sin embargo, son también cruciales para regular o suprimir las respuestas aloinmunitarias efectoras y así inducir un estado de tolerancia específico para el donante. Este fenómeno de inmunorregulación mediado por linfocitos T se conoce desde hace años, pero sólo recientemente se ha conseguido caracterizar con detalle los linfocitos T reguladores (T reg ).
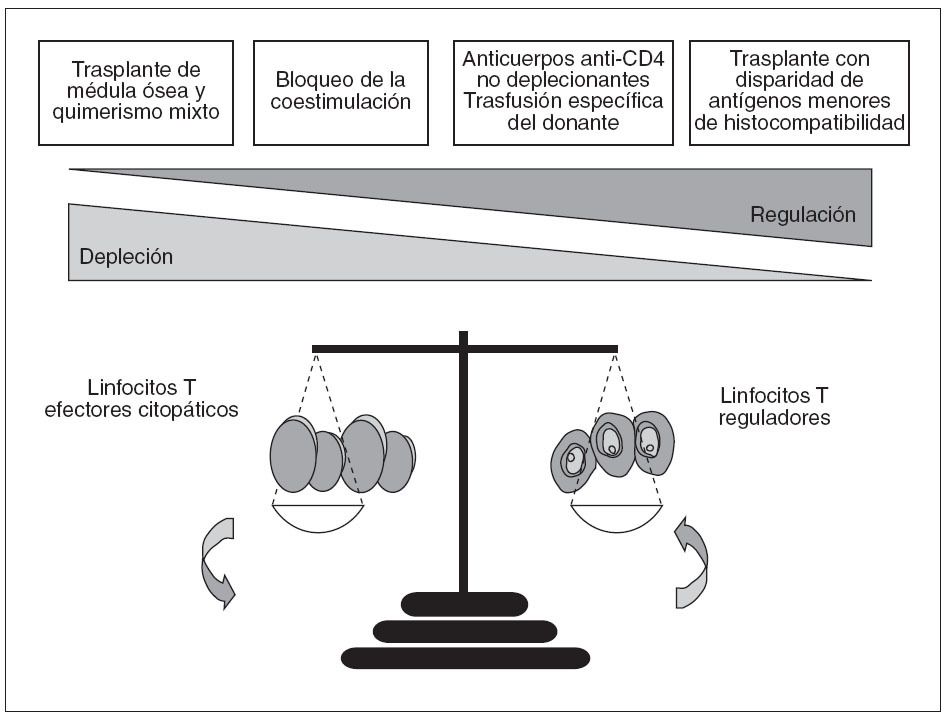
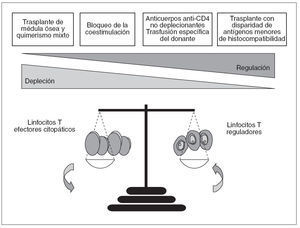
Fig. 1. Equilibrio entre depleción y regulación en la tolerancia a los aloinjertos. Aunque tanto la depleción como la regulación tienen papeles importantes en la inducción de tolerancia a los aloinjertos, la contribución cuantitativa de cada uno de estos 2 mecanismos difiere de modelo a modelo. Así, en ausencia de linfocitos T reguladores CD4+CD25+, los tratamientos basados en el bloqueo de la coestimulación no son capaces de inducir tolerancia. Por el contrario, la depleción de estos linfocitos reguladores no interfiere en el establecimiento de quimerismo mixto y tolerancia después de la administración de condicionamiento linfoablativo y médula ósea del donante, lo cual indicaría que los mecanismos inmunorreguladores no son fundamentales en este modelo de tolerancia
TABLA I. Mecanismos de tolerancia a los trasplantes
Muchas evidencias obtenidas en modelos experimentales indican que el cociente entre linfocitos aloagresivos y linfocitos reguladores es una de las claves que determinan la inducción de rechazo o de tolerancia inmunitaria (fig. 1). De hecho, la mayoría de los tratamientos inductores de tolerancia parecen actuar alterando este cociente en favor de las células reguladoras. Tal como se muestra en la figura 1, sin embargo, los mecanismos inmunorreguladores no son imprescindibles en todos los casos para inducir tolerancia, ya que en algunas circunstancias la administración de médula ósea del donante da lugar a un estado de quimerismo hematopoyético en el cual se produce la destrucción completa de todas las células T alorreactivas; se consigue así un estado de tolerancia en el cual no pueden detectarse mecanismos inmunorreguladores (tolerancia central) 3 . Así, es común distinguir entre estrategias encaminadas a la consecución de tolerancia central, lo cual requiere la administración de médula ósea del donante, y aquéllas otras basadas en la promoción de mecanismos inmunorreguladores, lo cual se conoce habitualmente como tolerancia periférica (tabla I). La presente revisión intenta presentar algunos aspectos relacionados con el papel de la inmunorregulación en la inducción de tolerancia a los trasplantes, haciendo especial mención al caso concreto de la tolerancia a los injertos hepáticos.
DEPLECIÓN E INMUNORREGULACIÓN EN LA TOLERANCIA A LOS ALOINJERTOS
En el trasplante, los aloantígenos pueden ser reconocidos por los linfocitos T del receptor a través de 2 vías. La vía de alorreconocimiento directa implica la interacción entre los receptores de células T expresados por los linfocitos T del receptor y moléculas HLA alogénicas intactas presentes en la superficie de las células presentadoras del donante. Por otra parte, en la vía indirecta, los péptidos derivados de proteínas del donante son procesados por células presentadoras del receptor y presentados en moléculas HLA propias a los linfocitos T del receptor. Tanto la vía directa como la indirecta están involucradas en el desarrollo del rechazo agudo. Ahora bien, ya que las células presentadoras del injerto (fundamentalmente células dendríticas) tienen una vida media corta, las respuestas aloinmunitarias por vía directa son importantes sobre todo en período postrasplante inmediato. En cambio, las respuestas por vía indirecta son más preeminentes más tarde, por ejemplo, durante el rechazo crónico. La combinación de alopresentación directa e indirecta da lugar a que el número de linfocitos T capaces de reconocer aloantígenos sea mucho mayor de lo que ocurre en respuestas inmunitarias frente a antígenos «convencionales»4 . Esto hace que en el trasplante, para conseguir la inducción de tolerancia sea preciso reducir drásticamente esta enorme población de linfocitos alorreactivos. Esto es así incluso en los casos en que se utilizan tratamientos que no inducen directamente la depleción de linfocitos T5 . Ahora bien, la eliminación de los linfocitos alorreactivos, a menos que sea completa, como ocurre en la inducción de quimerismo hematopoyético y tolerancia central (tímica), no es suficiente para evitar de manera indefinida que se produzca el rechazo. Así, en la mayoría de casos, la supervivencia a largo plazo de los injertos depende de que se hayan desarrollado mecanismos inmunorreguladores que se autoperpetúen y sean capaces de suprimir a los linfocitos T alorreactivos que no se hayan eliminado6-10 . Se han encontrado linfocitos T reguladores incluso en individuos que están experimentando un rechazo agudo. Esto quiere decir que la activación y expansión de los linfocitos inmunorreguladores es una parte esencial de una respuesta aloinmunitaria11 . Ahora bien, en ausencia de tratamiento, el aumento más rápido de los linfocitos citopáticos sobrepasa a los efectos protectores de los linfocitos reguladores y se produce el rechazo. Así pues, el resultado del trasplante (rechazo o tolerancia) depende de las proporciones relativas de linfocitos citopáticos y reguladores, y la reducción de los primeros es imprescindible para asegurar la viabilidad del injerto hasta que los linfocitos reguladores se expandan y controlen la respuesta aloinmunitaria12 .
IDENTIDAD DE LOS LINFOCITOS T REGULADORES EN EL TRASPLANTEVarios tipos celulares han demostrado ser capaces de mediar efectos inmunorreguladores en modelos de trasplante: linfocitos T CD4+8,13,14 , linfocitos T CD8+CD28–15 , linfocitos T natural Killer (NKT)16 , linfocitos T CD4–CD8–17 . Aunque probablemente existen interconexiones entre estos diferentes tipos celulares, en la mayor parte de modelos experimentales de tolerancia periférica las células CD4+ parecen desempeñar el papel cen-8,13,14 . Las vías inmunorreguladoras dependientes de los linfocitos T CD4+ se caracterizan por su especificidad aloantigénica y su capacidad de mediar el fenómeno de supresión ligada. Este fenómeno, característico del estado de tolerancia periférica18-20 , consiste en la capacidad de los linfocitos inmunorreguladores de suprimir respuestas inmunitarias dirigidas contra aloantígenos diferentes de los aloantígenos tolerados, siempre y cuando estos 2 tipos de aloantígenos sean presentados por la misma célula presentadora. Asimismo, en modelos de tolerancia periférica los linfocitos de los individuos tolerantes son capaces de transferir de manera aloantígeno específica su capacidad supresora a linfocitos naïve , fenómeno que se conoce como «tolerancia infecciosa»8 . El hallazgo, en 1990, de que el marcador CD25 permite identificar una subpoblación de linfocitos T CD4+ con capacidad supresora «intrínseca» ha sido un paso muy importante para comprender los mecanismos inmunorreguladores presentes en la tolerancia a los aloinjertos21,22 . Los linfocitos T CD4+CD25+ (Treg ) son supresores «por naturaleza», es decir, emergen del timo con un fenotipo supresor ya establecido, y en la periferia constituyen entre el 5 y el 10% de los linfocitos T CD4+. Además de los reg , otros linfocitos CD4+ también ejercen funciones inmunorreguladoras en el trasplante23 . Ahora bien, estas otras subpoblaciones requieren de un tratamiento tolerogénico para adquirir su fenotipo regulador y no parecen ser tan potentes como los Treg23 . Por todo ello, los linfocitos T CD4+CD25+ son los linfocitos reguladores que mejor se han caracterizado, tanto en modelos experimen-9,24,25 como en humanos26,27 . Los Treg son capaces de ejercer diversas acciones sobre los linfocitos efectores, especialmente inhibición de la proliferación celular, excreción de citocinas y producción de anticuerpos28 . La importancia de los Treg en la adquisición de tolerancia a los trasplantes se ha comprobado experimentalmente al observar que, en ausencia de Treg , diversos tratamientos fracasan en la inducción de tolerancia29,30 . De la misma forma, la capacidad de los linfocitos obtenidos de receptores tolerantes de transferir su capacidad supresora a otros receptores también desaparece si se eliminan las células CD4+CD25+9,24 . A pesar de que se ha generado mucha información recientemente sobre la biología de las células Treg31-37 , todavía no está claro si este subtipo celular es el único responsable de la especificidad por el donante que caracteriza el estado de tolerancia. Lo que parece claro es que algunos tratamientos inductores de tolerancia son capaces de aumentar la actividad supresora de los Treg de una manera aloantígeno específica30 . En cambio, la ciclosporina A, que en algunos modelos experimentales antagoniza la acción de los tratamientos inductores de tolerancia, puede neutralizar el efecto supresor de donante específico de los reg (observaciones no publicadas). En resumen, la modulación de la actividad supresora y/o de la especificidad de los Treg parece ser uno de los mecanismos por los cuales los tratamientos inductores de tolerancia ejercen sus efectos. De la misma forma que existen pocas dudas acerca de que las células CD4+CD25+ Treg desempeñan un papel central en el mantenimiento de la tolerancia a los aloinjertos, también está claro que los tratamientos inductores de tolerancia son capaces de incidir sobre los linfocitos T «convencionales» y convertirlos en linfocitos reguladores. Estos linfocitos reguladores «inducibles» son un grupo heterogéneo de subtipos celulares, y hasta el momento carecemos de marcadores fenotípicos claros. De entre todos los linfocitos reguladores inducibles, las subpoblaciones que parecen más implicadas en la tolerancia a los trasplantes son los linfocitos reguladores CD4+ productores de interleucina 10 y los linfocitos T CD8+CD128–, llamados «supresores». Por último, algunas evidencias indican que, si bien por regla general las células reguladoras CD4+CD25+ se originan centralmente en el timo, en circunstancias especiales pueden generarse en la periferia a partir de linfocitos convencionales CD4+CD25–. En resumen, los linfocitos T reguladores comprenden tanto linfocitos reguladores «naturales» CD4+CD25+, que se generan en el timo, como subpoblaciones linfocitarias inducidas en la periferia después de la administración de tratamientos tolerogénicos. Estos diferentes tipos linfocitarios parecen complementarse funcionalmente, aunque todavía desconocemos las bases celulares/moleculares de esta cooperación, así como el compartimiento anatómico preciso en el cual la supresión de las respuestas citopáticas tiene lugar.
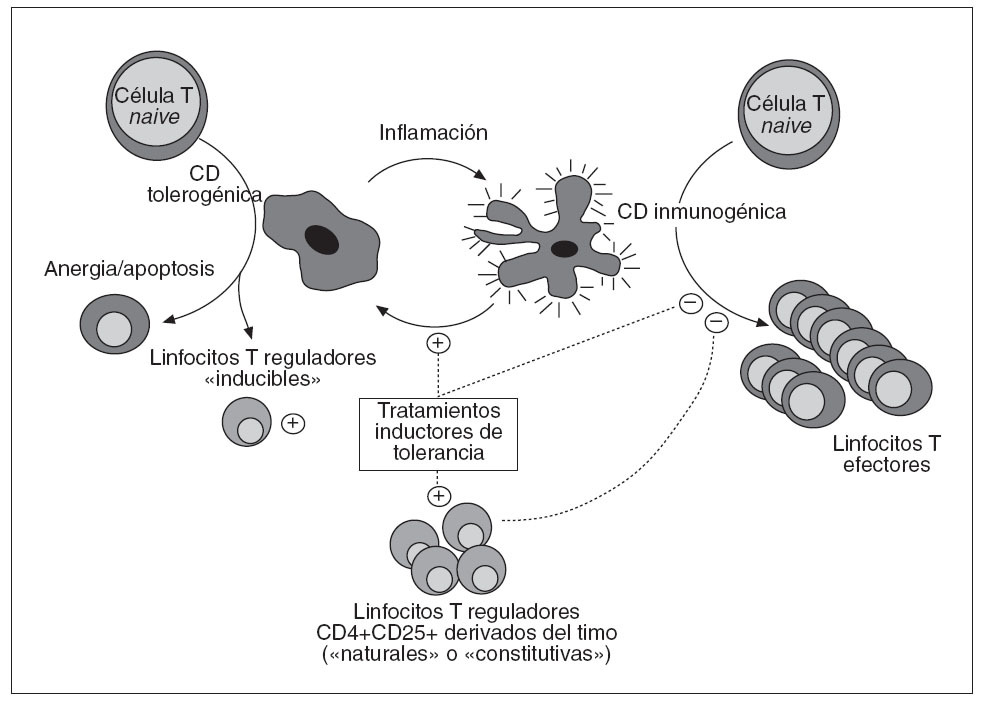
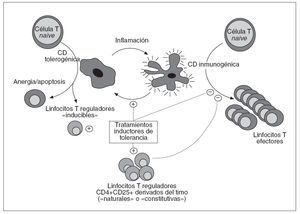
LAS CÉLULAS DENDRÍTICAS SON ESENCIALES PARA ARBITRAR EN LA DECISIÓN ENTRE INMUNIDAD Y TOLERANCIALas células dendríticas (CD) son las células presentadoras de antígeno más inmunogénicas que existen, gracias a su elevada expresión de moléculas HLA y coestimuladoras, y a su gran capacidad para procesar y presentar antígenos. Debido a estas propiedades, las CD son fundamentales para el inicio de las respuestas inmunitarias efectoras. Ahora bien, en ocasiones tienen un efecto inhibitorio sobre las respuestas inmunitarias, ya sea inactivando directamente los linfocitos T o contribuyendo a la génesis de linfocitos inmunorreguladores. Así, las CD arbitran de alguna manera la decisión entre inmunidad y tolerancia. Esta capacidad para mediar uno u otro tipo de respuesta depende en gran medida del tipo de CD involucrada, su estado de maduración o su localización anatómica. Dado este papel central de las CD en la génesis de las respuestas inmunitarias, no sorprende constatar que tanto los fármacos inmunodepresores como muchos tratamientos inductores de tolerancia median algunas de sus acciones interfiriendo bien con el desarrollo de las CD, bien con su maduración, expansión, localización anatómica o migración38 . Así pues, mientras que el equilibrio entre linfocitos citopáticos y reguladores es lo que determina en última instancia la supervivencia o no del aloinjerto, las CD son fundamentales en la regulación de este equilibrio gracias a su capacidad para modular la función de los linfocitos efectores y controlar el desarrollo de los linfocitos reguladores (fig. 2).
TOLERANCIA EN MODELOS EXPERIMENTALES DE TRASPLANTE HEPÁTICOLos injertos hepáticos son únicos en cuanto que se aceptan espontáneamente, sin tratamiento inmunodepresor, en cerdos, ratas y ratones39-41 . En estos modelos experimentales se produce el rechazo, pero se resuelve de forma espontánea, y los receptores pueden aceptar otros órganos del mismo donante, pero no de donantes que expresen antígenos de histocompatibilidad diferentes42 . Los mecanismos responsables de esta capacidad tolerogénica intrínseca no se conocen del todo, y se han propuesto múltiples hipótesis, entre las cuales se encuentran la inducción de microquimerismo, la producción de proteínas inmunorreguladoras como moléculas HLA de clase I, la depleción por apoptosis de los linfocitos T alorreactivos y el desarrollo de redes inmunorreguladoras controladas por linfocitos supresores. En cualquier caso, al igual que ocurre con la tolerancia inmunitaria frente a otros órganos, la vía común en la que todos estos distintos mecanismos confluyen es la eliminación de los clones citopáticos alorreactivos y la expansión de los linfocitos reguladores.
Fig. 2. Mecanismos inmunorre guladores activos durante la inducción de tolerancia periférica. En condiciones proinflamatorias, las células dendríticas (CD) maduran, adquieren propiedades inmunogénicas y se vuelven capaces de estimular de manera óptica a los linfocitos T. Por el contrario, las CD tolerogénicas inducen una activación incomple ta de los linfocitos T, que son así incapaces de desencadenar una respuesta inmunitaria productiva y acaban muriendo por apoptosiso se convierten en células regula-doras. Los tratamientos inductores de tolerancia bloquean la maduración de las CD e interfieren con las interacciones entre CD y linfocitos T, con lo que disminuye el contingente de linfocitos efec tores y se favorecen los mecanismos inmunorreguladores. Las propias células reguladoras amplifican estos efectos inhibiendo a su vez los linfocitos efectoresy las CD inmunogénicas.
El hígado produce grandes cantidades de moléculas HLA de clase I solubles, y en modelos experimentales estos aloantígenos han demostrado ser capaces de inducir apoptosis de linfocitos CD8+ alorreactivos tanto in vitro como in vivo y de prolongar la supervivencia de los aloinjertos hepáticos43,44 . El intercambio de leucocitos migratorios entre el injerto y el receptor, lo que da lugar a un estado de microquimerismo celular, se ha propuesto también como un posible mecanismo para explicar la tolerancia espontánea de los injertos hepáticos45 . De acuerdo con esta teoría, tras el trasplante se produce una interacción bidireccional entre los leucocitos del donante y los del receptor (respuesta del injerto contra el huésped y del huésped contra el injerto) que da lugar a la eliminación tanto de los linfocitos T alorreactivos del receptor como de los linfocitos del donante capaces de reconocer antígenos del receptor45 . Este modelo, propuesto inicialmente por Starzl et al45 , ha sido históricamente muy influyente y ha estimulado sobremanera toda la investigación en la migración de leucocitos «pasajeros». Ahora bien, aunque existen muchos datos que indican que el microquimerismo celular se da en receptores humanos de un trasplante hepático46 , no hay evidencias claras de que este fenómeno sea en realidad la causa principal de la tolerancia. En concreto, no disponemos de ninguna prueba de que el microquimerismo sea la causa y no la consecuencia del estado de tolerancia47 . En este sentido, es importante constatar que en los casos en que se ha utilizado en humanos un trasplante de médula ósea para inducir tolerancia central frente a injertos renales, sólo se detecta quimerismo durante los primeros meses después del trasplante, si bien los injertos renales se aceptan indefinidamente en ausencia de inmunodepresión48 . En los últimos años se ha especulado que determinados subtipos de CD hepáticas podrían tener una función específicamente inmunodepresora, y que podrían ser las células responsables de la capacidad tolerogénica de los leucocitos «pasajeros» de los injertos hepáticos49 . Esta última hipótesis, que conceptualmente es muy diferente del modelo bidireccional postulado por Starzl et al45 , es congruente con múltiples evidencias experimentales sobre la capacidad tolerogénica de determinados subtipos de CD tanto en modelos experimentales de autoinmunidad como de trasplante. Una interpretación alternativa para explicar las propiedades tolerogénicas del hígado se basa en la observación de que durante la aceptación de los injertos hepáticos los linfocitos T infiltran el parénquima, pero se les elimina rápidamente sin que lleguen a causar lesión en el injerto50 . Trabajos posteriores51 han mostrado que los linfocitos T alorreactivos son deplecionados por apoptosis en el hígado a través de mecanismos tanto de muerte celular pasiva como de muerte inducida por activación. Finalmente, otros procesos tolerogénicos activos en el hígado son la génesis de linfocitos reguladores CD4+ como consecuencia de la presentación aloantigénica en la superficie de las células sinusoidales o de subtipos de CD específicos del hígado52,53 . Por último, en una reciente comunicación se ha descrito que las células reguladoras CD4+CD25+ son precisas para la aceptación espontánea de injertos hepáticos en modelos murinos54 . En definitiva, las propiedades tolerogénicas de los injertos hepáticos son probablemente resultado de la combinación de múltiples mecanismos diferentes, en un contexto anatómico singular, en el que se maximiza el contacto entre las células inmunitarias del torrente circulatorio y las células hepáticas.
TOLERANCIA A LOS ALOINJERTOS HEPÁTICOS EN LA CLÍNICADe la misma manera que ocurre en modelos experimentales, también en humanos la aparición de tolerancia es mucho más común en el caso del trasplante hepático que en el de cualquier otro órgano. Por otra parte, el hígado es igualmente mucho menos susceptible al rechazo agudo que otros órganos, lo cual puede comprobarse por su capacidad de sobrevivir pese a disparidades de HLA, incompatibilidad ABO y pruebas cruzadas positivas. Si bien la retirada completa de la inmunodepresión rara vez se ha llevado a cabo de forma intencionada y protocolizada, la experiencia acumulada hasta la fecha indica que esta práctica es posible en un 25-33% de los receptores de un trasplante hepático55-58 . Se ha descrito que estos pacientes sin ningún tipo de inmmunodepresión permanecen sanos y con injertos viables en ocasiones durante más de 30 años, y por tanto se les considera tolerantes. Desgraciadamente, no ha sido posible hasta la fecha identificar qué variables son predictivas de una retirada exitosa de la medicación inmunodepresora, lo cual ha dificultado la instauración sistemática de protocolos de retirada de los fármacos. En la actualidad se están ensayando diversas técnicas de inmunomonitorización para identificar las características del estado de tolerancia inmunitaria en humanos59 . Un primer grupo de técnicas se basan en la caracterización de las respuestas de los linfocitos T frente a antígenos del donante, ya sea in vitro (ELIspot, tinción intracelular de citocinas) o trans vivo (hipersensibilidad de tipo retardado en ratones inmunodeficientes). Otro grupo de estrategias no específicas del antígeno se centran en el estudio inmunofenotípico, repertorio antigénico y expresión genética de los linfocitos T en sangre periférica. Teniendo en cuenta la enorme complejidad del sistema immunitario de los humanos, es muy probable que sea preciso utilizar una combinación de todas estas técnicas para llegar a caracterizar de manera precisa el estado de tolerancia. Aunque carecemos de técnicas que permitan identificar a los pacientes tolerantes, se han realizado ya diversos estudios piloto en humanos para intentar inducir tolerancia a órganos sólidos. En el trasplante renal se ha utilizado el trasplante simultáneo de médula ósea e injerto renal para inducir quimerismo y tolerancia central, la irradiación linfoidea total o el anticuerpo Campath-1 (dirigido tanto contra linfocitos T como B) seguido de dosis bajas de inmunodepresión. Aunque ocasionalmente estos tratamientos han tenido éxito y conseguido la aceptación de los injertos sin necesidad de administración continuada de inmunodepresores, no parece que por el momento puedan aplicarse de forma generalizada. En el trasplante hepático la principal estrategia que se ha utilizado para inducir tolerancia de forma intencionada es el protocolo diseñado por Starzl et al60 , que consiste en la administración de una única dosis de anticuerpos antilinfocitarios (timoglobulina) pretrasplante, seguida de monoterapia con tacrolimus a dosis bajas. El concepto que subyace en este protocolo es eliminar el mayor número posible de linfocitos T alorreactivos antes del trasplante para poder minimizar el uso de fármacos inmunodepresores y así facilitar las interacciones entre los leucocitos «pasajeros» del injerto y el sistema inmunitario del receptor. Los resultados publicados hasta la fecha son prometedores, y en algunos casos se ha conseguido eliminar progresivamente el tacrolimus de manera casi completa. Sin embargo, habrá que esperar a ver cuáles son los efectos a largo plazo de esta estrategia sobre la viabilidad de los injertos, sobre todo en lo que respecta al desarrollo de infecciones, neoplasias o recidiva grave por el virus de la hepatitis C.
Correspondencia: Dr. A. Sánchez-Fueyo . Hospital Clínic de Barcelona. Villarroel, 170. 08036 Barcelona. España. Correo electrónico: afueyo@clinic.ub.es
Recibido el 4-10-2004; aceptado para su publicación el 5-10-2004.