La translocación bacteriana (TB) se define como el paso de bacterias viables a través de la barrera intestinal hacia los ganglios linfáticos mesentéricos, con la posibilidad que esde allí puedan diseminarse hacia otros sistemas. La patogenia de la TB en la cirrosis se asienta en tres pilares: sobrecrecimiento bacteriano, aumento de permeabilidad intestinal y alteraciones del sistema inmunológico. Recientes hallazgos indican que el concepto de TB podría ampliarse para incluir la presencia de productos bacterianos (AND bacteriano y endotoxina) en los ganglios linfáticos mesentéricos y en otros territorios. Tanto el ADN bacteriano como la endotoxina provocan una activación sostenida del sistema inmune, con liberación de citocinas proinflamatorias y efectores, como el óxido nítrico, que agravan las alteraciones hemodinámicas presentes en pacientes con cirrosis. Este capítulo describe con mayor detalle las anomalías presentes en pacientes con cirrosis que permiten la existencia de TB y las consecuencias inmunes y clínicas de este fenómeno.
Bacterial translocation (BT) is defined as the passage of viable bacteria through the intestinal barrier toward the mesenteric lymph nodes, where they may disseminate toward other systems. The pathogenesis of BT in cirrhosis involves three main factors: bacterial overgrowth, increased intestinal permeability, and immune system alterations. Recent findings indicate that the concept of BT could be broadened to include the presence of bacterial products (bacterial DNA and endotoxin) in mesenteric lymph nodes and other territories. Both bacterial DNA and endotoxin provoke sustained activation of the immune system with release of proinflammatory cytokines and effectors such as nitric oxide, which aggravate the hemodynamic alterations present in patients with cirrhosis. This article provides a detailed description of the abnormalities present in patients with cirrhosis that allow the existence of TB and the immune and clinical repercussions of this phenomenon.
Las infecciones bacterianas son una complicación frecuente en los pacientes con cirrosis, con una incidencia en el momento del ingreso o durante la hospitalización de alrededor del 32% en los estudios prospectivos más recientes. Esta incidencia contrasta con la de infecciones intrahospitalarias de la población general, que oscila entre el 5 y el 7%. El desarrollo de una infección deteriora claramente el pronóstico de estos pacientes. De hecho, un estudio realizado en 405 pacientes cirróticos mostró que la aparición de una infección bacteriana y un mayor deterioro de la función hepática estimada por la presencia de un estadio C de Child-Pugh, eran factores pronósticos independientes de mortalidad1. Además, es un hecho conocido que las infecciones bacterianas, o el uso de antibióticos como marcador subrogado de infección, son las variables independientes más importantes asociadas con el fallo en el control de la hemorragia por varices esofágicas2. Las infecciones bacterianas, además de ser un importante factor pronóstico de la evolución de la hemorragia variceal, están claramente asociadas con su incidencia; por tanto, suponen una complicación frecuente y clínicamente relevante en la evolución de los pacientes con cirrosis.
Las infecciones más frecuentes en los pacientes cirróticos son las urinarias, la peritonitis bacteriana espontánea (PBE) y la neumonía, de las cuales el 80% están causadas por bacilos gramnegativos (BGN), principalmente Escherichia coli. Este hecho sugiere que la mayoría de las infecciones en la cirrosis son de origen entérico. La hipótesis más aceptada en la actualidad para explicar la patogenia de la mayoría de las infecciones bacterianas en los pacientes cirróticos, especialmente la bacteriemia y la PBE, es el paso de bacterias viables desde la luz intestinal hacia los ganglios linfáticos mesentéricos (GLM) y de allí hacia la circulación sanguínea y hacia otros órganos extraintestinales. Este fenómeno así descrito se define como translocación bacteriana (TB)3. Por tanto, el criterio actual de TB exige la presencia de bacterias viables en GLM, comprobada, obviamente, por la positividad de cultivos de los GLM. Se estima que la TB se presenta en un 25-30% de los pacientes cirróticos con mala función hepatocelular según los estudios clínicos4 y hasta en un 50-60% de las ratas cirróticas con ascitis5. La TB, además de ser un fenómeno clave en la patogenia de muchas de las infecciones en pacientes cirróticos, desempeña un papel en las alteraciones hemodinámicas e inmunológicas de la cirrosis mediada no sólo por el paso de bacterias viables a la circulación sistémica, sino también por sus componentes (la endotoxina y el ADN bacteriano han sido los más estudiados). En este artículo se comentarán los mecanismos implicados en la patogenia de la TB y las consecuencias de la translocación de bacterias y, especialmente, sus productos en los pacientes cirróticos.
PATOGENIA DE LA TRANSLOCACIÓN BACTERIANANuestro conocimiento de la patogenia de la TB se basa principalmente en estudios en modelos experimentales, dada la dificultad obvia de obtener GLM de pacientes cirróticos. Como hemos comentado antes, la TB se define como la presencia de un cultivo positivo en los GLM, y de acuerdo con este criterio está presente en aproximadamente el 50-60% de las ratas con cirrosis inducida por CCl4 y presencia de ascitis, mientras que este porcentaje se reduce al 0-10% en los animales control5.
Los mecanismos que influyen en la patogenia de la TB son fundamentalmente tres: sobrecrecimiento bacteriano intestinal (SBI), las alteraciones inmunológicas locales y sistémicas y, probablemente, un aumento de la permeabilidad intestinal.
Sobrecrecimiento bacteriano intestinalComo su nombre indica, se trata de un incremento de la flora bacteriana intestinal, y puede referirse tanto a la población global como a una especie bacteriana en concreto. Estudios experimentales han demostrado que en las ratas cirróticas con ascitis y TB el SBI es más frecuente que en animales sin TB6. Por el contrario, en ratas con ausencia de SBI (recuento bacteriano menor de 2 desviaciones estándar de la media del recuento bacteriano en ratas control) la TB ocurre raramente (0-11%) y es comparable a la observada en ratas control. Sin embargo, el hecho de que la TB no esté presente en un 50% de las ratas con SBI, sugiere que otros factores además del SBI intervienen en su patogenia, o que el criterio diagnóstico actual de la TB es insuficiente. El SBI es más frecuente en los pacientes cirróticos que en los controles, especialmente en los pacientes con una mayor insuficiencia hepática7 y con antecedentes de PBE8. Sin embargo, en estos estudios el SBI se estimó mediante el test del aliento, que no es un método completamente fiable para su diagnóstico. El SBI se debe principalmente a un enlentecimiento del tránsito intestinal, si bien también parecen intervenir otros factores, como la acidez gástrica, los defectos en la actividad inmune local de la mucosa intestinal y una disminución de las secreciones pancreatobiliares. A su vez, el enlentecimiento del tránsito intestinal en la cirrosis se debe, entre otros factores, a un aumento de la actividad adrenérgica6, de la síntesis de óxido nítrico8 y del estrés oxidativo de la pared intestinal. El defecto de tránsito es relevante en estos pacientes, con independencia de las causas que lo originan, puesto que la administración de procinéticos, como cisaprida, reduce considerablemente la incidencia de SBI en pacientes y animales de experimentación9.
Aumento de la permeabilidad intestinalLa barrera intestinal es una estructura física y funcional que tiene como objetivo la separación del medio externo –representado por el contenido luminal intestinal– y el medio interno. Está formada principalmente por un componente mucinoso secretado por las células epiteliales intestinales y por el epitelio intestinal per se, que forma una capa con uniones intercelulares (tight junctions, entre otros componentes intercelulares), lo que permite el paso selectivo de sustancias. La mucina secretada por las células epiteliales (3 l/día) forma una gruesa capa de glucoproteínas que impiden el contacto directo de las bacterias con la membrana microvellositaria.
La homeostasis del epitelio requiere el mantenimiento de un equilibrio entre la tolerancia y la respuesta a las poblaciones bacterianas luminales. Además de la capa mucinosa ya descrita, los factores que controlan la densidad apical de los microorganismos son dos: péptidos antimicrobianos y neutrófilos. De entre los primeros, los más relevantes son las defensinas, de tipo α y β, las catelicidinas10 y la IgA. También las secreciones biliares desempeñan un papel en la prevención de la TB inhibiendo el SBI, que ejerce un efecto trófico sobre la mucosa intestinal, neutralizando endotoxinas y, en definitiva, dificultando la TB11.
En la cirrosis se producen alteraciones estructurales y funcionales en la mucosa intestinal que podrían aumentar la permeabilidad intestinal a bacterias y sus productos, como la endotoxina. Nosotros hemos podido comprobar la existencia de dilataciones de los espacios intercelulares del duodeno distal, con un sellado completo de las áreas apicales de enterocitos, por integridad anatómica de las tight junctions12.
Por otra parte, algunos estudios funcionales han demostrado un aumento de la permeabilidad intestinal en pacientes con cirrosis, especialmente en los que presentan una hepatopatía más grave13 y en pacientes con sepsis14. Dado que la mayor parte de los estudios de permeabilidad se llevan a cabo con macromoléculas, parece razonable pensar que ambas alteraciones –incremento de permeabilidad y alteraciones ultraestructurales– estén relacionadas entre sí, puesto que el paso de las macromoléculas es probablemente paracelular, que es la zona con mayores alteraciones estructurales. No hay datos sólidos que nos permitan aventurar si las alteraciones descritas son representativas de las presentes en el fondo de las criptas, que es el lugar donde supuestamente tienen lugar los fenómenos de hipoabsorción.
El daño oxidativo de la mucosa intestinal15, así como la endotoxemia, los valores elevados de óxido nítrico y las citocinas inflamatorias probablemente ejercen un papel en el aumento de la permeabilidad intestinal16. No obstante, los datos de que disponemos en la actualidad no nos permiten concluir que el incremento de la permeabilidad a macromoléculas (fenómeno paracelular) induzca un incremento de la TB (fenómeno transcelular), por lo que el aumento de la permeabilidad por sí sola no parece ser el factor determinante en la patogenia de la TB. Los estudios experimentales efectuados en ratas han demostrado que hasta un 87% de las ratas con SBI y permeabilidad intestinal aumentada presentan TB, mientras que en ninguno de los animales con únicamente un aumento de la permeabilidad intestinal se demostró la presencia de TB16. Además, la corrección del SBI, sin interferir en la permeabilidad intestinal, consigue disminuir la tasa de TB en ratas cirróticas17. Este hecho parece sugerir que el SBI es más importante que el aumento de la permeabilidad intestinal a la hora de promover la TB. Los datos obtenidos en nuestro laboratorio apoyan esta posibilidad18.
Alteraciones inmunitarias locales y sistémicasEs necesario que haya alteraciones en la inmunidad local y sistémica para que la TB sea clínicamente relevante. De hecho, en pacientes inmunocompetentes las bacterias que translocan a los GLM o la sangre portal son habitualmente fagocitadas y neutralizadas antes de que adquieran un significado patológico. Como ya hemos comentado, la primera barrera de defensa del sistema inmunitario es el tracto digestivo. El intestino, de hecho, es un componente del sistema inmunitario, que contiene prácticamente todas las células implicadas en la respuesta establecida. El tejido linfoide asociado al intestino (MALT), el tejido inmune más grande del organismo, contiene 4 compartimentos linfoides: placas de Peyer, linfocitos de la lámina propria, linfocitos intraepiteliales y GLM, que intervienen en las respuestas adaptativa e innata. Hasta la fecha, hay pocos estudios que se centren en las alteraciones inmunológicas de la barrera intestinal que favorezcan la TB. Algunos estudios han demostrado una alteración de la capacidad proliferativa y de la síntesis de interferón gamma por parte de los linfocitos intraepiteliales en ratones cirróticos y su correlación con la tasa de TB19. Los fenómenos asociados a la cirrosis y a una alteración del sistema inmunitario son especialmente relevantes en la patogenia de la TB y en las consecuencias clínicas de la respuesta inflamatoria asociada. La cirrosis se asocia con los siguientes procesos: a) descenso de la capacidad bactericida de los macrófagos20; b) disminución de la capacidad bactericida humoral de suero y líquido ascítico, lo que predispone a los pacientes al desarrollo de episodios de PBE21,22, y c) disminución de la capacidad funcional del sistema reticuloendotelial (SRE) representado por las células de Kupffer, probablemente impedidas de hacer su función por la existencia de shunts portosistémicos, lo que favorece el desarrollo de bacteriemias espontáneas y episodios de PBE23.
La incapacidad de aclaramiento del SRE no hace referencia únicamente a las bacterias viables sino también a productos de origen bacteriano, como la endotoxina o el ADN bacteriano. Estos productos bacterianos son responsables de la respuesta inflamatoria crónica y de las alteraciones hemodinámicas observadas en la cirrosis. La respuesta inflamatoria inducida por estos y, probablemente, otros mediadores también actúa sobre la barrera intestinal favoreciendo la TB, con lo que se crea un círculo vicioso en el que la propia TB perpetúa los mecanismos patogénicos que la provocan. La síntesis de citocinas, especialmente el factor de necrosis tumoral alfa (TNFα), interleucinas y óxido nítrico agrava el daño oxidativo en la mucosa intestinal24, lo que aumenta la permeabilidad intestinal favoreciendo la TB. Nuestro grupo ha demostrado recientemente que la administración de anticuerpos monoclonales anti-TNFα a ratas cirróticas con ascitis se asoció con un disminución significativa de la tasa de TB25. Dado que, además, la capacidad de los GLM para retener y destruir las bacterias está reducida –posiblemente por la repetición de estos fenómenos–, se producen, como consecuencia lógica, fenómenos de escape de las bacterias o sus productos hacia la circulación general. Estas alteraciones inmunológicas, en su conjunto, son fundamentales no sólo para explicar la patogenia de la PBE, sino también la translocación de bacterias no viables o sus componentes, capaces de inducir una potente respuesta inflamatoria que tiene, a su vez, consecuencias clínicas y relacionadas con el pronóstico, tal como veremos a continuación.
CONSECUENCIAS DE LA TRANSLOCACIÓN DE PRODUCTOS BACTERIANOSEl componente adaptativo del sistema inmunitario está organizado alrededor de 2 tipos celulares, los linfocitos B y T, y está basado en la especificidad de cada receptor en dichos linfocitos para un determinado antígeno. Una vez un linfocito reconoce un determinado antígeno, se produce la expansión clonal de dicho linfocito, mecanismo imprescindible para la generación de una respuesta eficaz. Sin embargo, este proceso de expansión clonal y su diferenciación en células efectoras puede durar 3-4 días, tiempo más que suficiente para que los patógenos dañen al huésped. Por el contrario, el componente innato del sistema inmunitario, que incluye péptidos antimicrobianos, macrófagos, células dendríticas y la vía alternativa del complemento, se activa inmediatamente después de la infección, controlando rápidamente la replicación de los patógenos. Los receptores toll-like (TLR) son un tipo de proteínas de membrana que intervienen en la respuesta innata y reconocen diversos patrones moleculares conservados de los patógenos. Hasta la fecha, se han identificado 10 tipos de TLR, cada uno de los cuales reconoce determinadas estructuras conservadas de los patógenos. Los más estudiados en la cirrosis y la TB son el TLR-4, que reconoce a la endotoxina de los BGN, el TLR-2, que se activa ante la presencia del peptidoglucano, componente de la pared de los cocos grampositivos (CGP), y el TLR-9, que reconoce el ADN bacteriano. Estos receptores median una respuesta inflamatoria mediante la liberación de citocinas proinflamatorias, especialmente TNFα. La liberación de productos bacterianos durante la TB produce una respuesta inflamatoria mantenida en la cirrosis descompensada. Esta respuesta inflamatoria crónica asociada a la TB empeora las alteraciones hemodinámicas de la cirrosis, sobre todo la vasodilatación esplácnica y el síndrome hiperdinámico, probablemente a través del incremento de liberación de óxido nítrico, tanto como activación de la isoenzima endotelial de la óxido nítrico sintetasa como a través de la inducible.
EndotoxinaGran parte de las consecuencias de la TB se deben a la liberación de productos bacterianos que estimulan un aumento de la concentración de citocinas inflamatorias, con efectos deletéreos en las alteraciones hemodinámicas de la cirrosis. Es conocido que los pacientes cirróticos presentan unos valores elevados de endotoxina, especialmente los pacientes con ascitis26. La endotoxina es difícil de estudiar en muestras biológicas por su corta vida media y las dificultades técnicas inherentes a su detección. Dado que la endotoxina promueve la síntesis de la proteína transportadora LBP, de mayor vida media y estabilidad, se ha utilizado el estudio de esta proteína para estimar el efecto de la endotoxina en estos pacientes. Algunos estudios recientes han demostrado que aproximadamente un tercio de los pacientes cirróticos con ascitis presentan valores elevados de LBP, asociados a una clara activación del sistema inmunitario y un mayor deterioro del síndrome hiperdinámico de la cirrosis, estimado por una disminución de las resistencias vasculares sistémicas y un aumento del gasto cardíaco27. Además, en este estudio la descontaminación intestinal selectiva con norfloxacino se asociaba a un descenso en los valores de citocinas proinflamatorias y a una mejora del síndrome hiperdinámico únicamente en los pacientes con valores elevados de LBP. Sin embargo, la elevación de la LBP sólo se produce frente a un incremento de endotoxemia, por lo que fenómenos de TB por CGP, cada vez más frecuentes, pasarían teóricamente inadvertidos mediante esta técnica de estudio.
Estudios experimentales también han mostrado que la TB se asocia con un mayor deterioro de la circulación hiperdinámica de la cirrosis. Las ratas cirróticas con TB presentan una mayor actividad de la óxido nítrico sintetasa endotelial (eNOS) en la vasculatura mesentérica mediada por un aumento de los valores de TNFα y del cofactor de la eNOS tetrahidrobiopterina28. Se ha sugerido que el empeoramiento de la circulación hiperdinámica asociada a la TB puede ejercer un papel en las complicaciones de la hipertensión portal, como la hemorragia por varices esofágicas. La translocación de endotoxina se asocia a la liberación de agentes vasodilatadores, como óxido nítrico y monóxido de carbono. El aumento de la vasodilatación y la hipovolemia efectiva resultante induce, entre otros fenómenos, la liberación de endotelina-1, que es un agente que provoca la contracción de las células estrelladas hepáticas, incrementando así la resistencia intrahepática al flujo portal29. Por consiguiente, tanto las infecciones como la TB podrían provocar un aumento agudo de la presión portal en pacientes cirróticos y, a su vez, desempeñar un papel como desencadenante de la hemorragia por varices o en la evolución de ésta30.
También se ha sugerido que las alteraciones hemodinámicas de la TB pueden intervenir en el desarrollo del síndrome hepatorrenal. En un estudio reciente, se observó que la profilaxis primaria de PBE con norfloxacino en un grupo de pacientes cirróticos con ascitis y disfunción hepática significativa mejoraba notablemente la supervivencia, reduciendo el desarrollo de síndrome hepatorrenal31.
Otros estudios han sugerido que la TB puede desempeñar un papel en la patogenia de la encefalopatía hepática. Las infecciones bacterianas son frecuentemente factores desencadenantes de la encefalopatía hepática en pacientes cirróticos. Dado que la respuesta inflamatoria asociada a la TB y a la PBE, que es la infección bacteriana característica de estos pacientes, es indistinguible32, parece lógico pensar que la TB y la PBE deben producir consecuencias clínicas similares. Se ha demostrado que en los pacientes cirróticos con encefalopatía hepática hay una correlación positiva entre el grado de encefalopatía y los valores de amonio y TNFα. Estos hallazgos plantean la hipótesis de que la respuesta inflamatoria crónica o transitoria asociada a la TB en la cirrosis puede tener un papel en otras complicaciones de la hipertensión portal, como la encefalopatía hepática. Sin embargo, se requieren más estudios realizados en modelos experimentales para corroborar esta teoría.
ADN bacterianoEn los últimos años nuestro grupo ha estudiado con profundidad la presencia y los efectos del ADN bacteriano en pacientes con cirrosis y ascitis. El ADN bacteriano, a diferencia del ADN de los vertebrados, contiene múltiples series de dinucleótidos no metilados (denominados CpG motifs) que a través del TLR9 se convierten en importantes activadores de las células del sistema inmunitario innato33, induciendo la liberación de citocinas proinflamatorias y óxido nítrico, entre otros agentes.
En el primero de nuestros trabajos demostramos la presencia de ADN bacteriano en aproximadamente el 35% de los pacientes con cirrosis y ascitis, y su presencia simultánea en sangre y líquido ascítico. La secuenciación automática de los nucleótidos de la cadena aislada nos permitió comprobar que en su mayoría procedían de BGN, y principalmente E. coli34. Posteriormente, demostramos que estos fragmentos genómicos bacterianos podían persistir en la sangre durante un número considerable de horas, pudiendo aparecer y desaparecer en muestras obtenidas cada 8 h18. Este hecho, junto con la demostración de que en todos los casos en un mismo paciente la cadena de ADN bacteriana procedía de la misma especie bacteriana, nos permitía suponer que la causa principal de su presencia eran episodios repetidos de translocación, y no trastornos de la capacidad de aclaramiento hepático.
El porcentaje de estos pacientes con presencia de ADN bacteriano circulante (30-40%) es similar a la de TB en una serie reciente de pacientes cirróticos intervenidos quirúrgicamente, a los que se pudo extraer ganglios linfáticos para el cultivo4, y del porcentaje de pacientes con LBP elevada27. Todo ello sugiere que por distintos medios podemos estimar que la incidencia de TB en pacientes con cirrosis y ascitis es aproximadamente del 30-40%. Sin embargo, es probablemente la detección de ADN bacteriano el mejor método para detectar TB al ser no invasivo, y ser capaz de detectar TB tanto por BGN como por CGP35. Posteriores estudios experimentales de nuestro grupo muestran una excelente correlación entre la presencia de ADN bacteriano de una determinada bacteria en el plasma y el líquido ascítico y el cultivo de los GLM en ratas cirróticas con ascitis17, lo que confirma que la detección de fragmentos de ADN bacteriano constituye en realidad un marcador indirecto fiable de TB. En este último estudio sugerimos la posibilidad de modificar el concepto actual de TB para incluir también la presencia de productos de origen bacteriano, como el ADN bacteriano y la endotoxina, en los GLM.
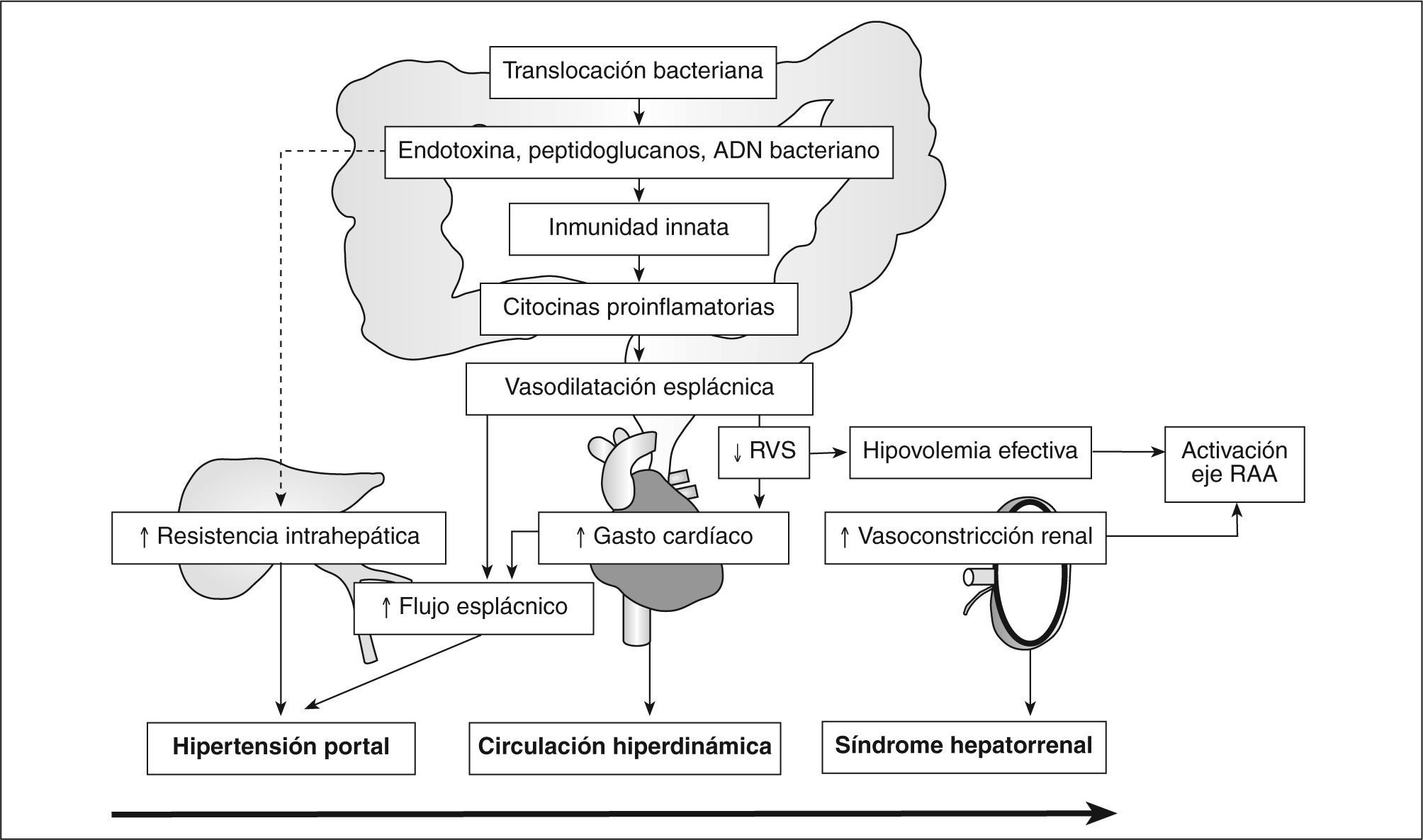
Como hemos comentado antes, el ADN bacteriano induce una potente respuesta inmune con liberación de citocinas proinflamatorias y óxido nítrico, a través de la activación de la forma inducible de la óxido nítrico sintetasa36,37. Estos hallazgos sugieren que el ADN bacteriano no es meramente un marcador inerte de TB, sino que es una molécula activa con capacidad de producir una potente respuesta inflamatoria. En un reciente estudio hemos demostrado la existencia de una correlación entre los valores de citocinas inflamatorias y la cantidad de CpG motifs (secuencia con capacidad inmunogénica) del ADN bacteriano detectado en el líquido ascítico de pacientes con cirrosis35. La liberación de óxido nítrico asociada a la presencia de ADN bacteriano también tiene consecuencias hemodinámicas (fig. 1), de tal modo que los pacientes cirróticos con ascitis y ADN bacteriano en plasma presentan una presión arterial media y una resistencia vascular sistémica significativamente inferiores a las observadas en pacientes con similar grado de Child-Pugh, pero sin presencia de ADN bacteriano38.
Consecuencias hemodinámicas sistémicas de la translocación bacteriana (TB). La activación del sistema inmune por la TB provoca una respuesta inflamatoria sostenida que conlleva un empeoramiento de las alteraciones hemodinámicas de la cirrosis, especialmente hepática, cardiovascular y renal. En la secuencia de eventos hemodinámicos de la cirrosis (hipertensión portal → síndrome hiperdinámico → síndrome hepatorrenal) parece que la TB podría desempeñar un papel importante. RAA: renina-angiotensina-aldosterona; RVS: resistencias vasculares sistémicas.
Tal como hemos comentado antes, el estado inflamatorio asociado a la presencia de ADN bacteriano y a la PBE es indistinguible32. Si tenemos en consideración la elevada mortalidad que se asocia a los episodios de PBE, incluso tras haberse curado la infección, y que los pacientes con TB no reciben tratamiento al no ser diagnosticados, parece lógico pensar que la TB debe tener consecuencias para el pronóstico. Recientemente, en un estudio multicéntrico, prospectivo y observacional, en el que se incluyeron 156 pacientes cirróticos con ascitis no neutrocítica, comprobamos que los pacientes con ADN bacteriano positivo en el líquido ascítico y el plasma presentaban un peor pronóstico que los pacientes sin presencia de ADN bacteriano en el momento de su inclusión en el estudio. La principal causa de mortalidad fue la insuficiencia hepática, y no hubo diferencias en la prevalencia de PBE entre ambos grupos39. Por tanto, la presencia de fragmentos de ADN bacteriano identifica a un grupo de pacientes con TB, con una clara respuesta inflamatoria, una mayor alteración hemodinámica sistémica y un peor pronóstico que los pacientes en quienes el ADN bacteriano no está presente.
Parece lógico pensar que junto al ADN bacteriano y la endotoxina, otras moléculas de origen bacteriano, como peptidoglucano, lipopéptidos y flagelina, por citar sólo algunos, podrían translocar simultáneamente o de forma aislada. La flagelina, que es una proteína estructural de los flagelos de E. coli y Salmonella, es capaz de producir una respuesta inflamatoria en modelos experimentales con cultivos celulares de epitelio intestinal40, por lo que es muy probable que en los pacientes induzca una respuesta similar. Sin embargo, la detección de estos productos bacterianos no resulta sencilla al no haber sistemas diagnósticos de fácil acceso. Por tanto, y hasta la fecha, no se han realizado estudios que hayan evaluado dichos productos bacterianos en modelos de TB en la cirrosis, por lo que se desconoce su papel en la fisiopatogenia de la TB y las complicaciones clínicas asociadas.
En resumen, la cirrosis avanzada se comporta como una enfermedad inflamatoria crónica, en la que el sistema inmunitario se ve expuesto a una activación continua por bacterias y productos bacterianos de origen intestinal. Esta respuesta inflamatoria está centrada especialmente en el territorio esplácnico y en el hígado, si bien las consecuencias de ésta afectan a otros sistemas del organismo. Las alteraciones inmunológicas asociadas a la cirrosis intervienen perpetuando la translocación de bacterias y sus productos y, a la vez, ejerciendo un efecto sobre otros sistemas, como el circulatorio. La aparición de marcadores indirectos de TB, como la LBP o la presencia de fragmentos de ADN bacteriano, que parece ejercer un papel directo en la respuesta inflamatoria asociada a la TB, además de ser un factor predictivo de mortalidad en pacientes con ascitis, sugiere el diseño de nuevos estudios que profundicen en el conocimiento de la fisiopatogenia de la TB y que abran nuevas vías terapéuticas para la cirrosis y la hipertensión portal.
Este trabajo se ha llevado a cabo en parte con una beca de la Fundación de Investigación del Hospital General Universitario de Alicante.