El trasplante autólogo de precursores hematopoyéticos (TPHA) es una modalidad de tratamiento aceptada para la enfermedad de Crohn (EC) refractaria.
Material y métodosSe recogen los pacientes con EC refractaria sometidos a TPHA en el hospital Universitario Ramón y Cajal de Madrid y se describen de forma retrospectiva los resultados obtenidos.
ResultadosUn total de 7 pacientes han recibido TPHA debido a EC refractaria en nuestro centro. Tres pacientes (43%) presentaron remisión clínica y endoscópica; un paciente (14%) mejoría clínica sin remisión y 3 pacientes (43%) permanecían activos con necesidad de reinicio del tratamiento en la valoración de la respuesta inicial al TPHA (a 6 meses). Los síntomas recurrieron en 5 de los 7 pacientes (71%), y todos ellos requirieron reinicio de tratamiento médico a una media de 13,8 meses (rango: 3-30 meses). Solo un paciente requirió cirugía tras el TPHA. Al final del seguimiento a una media de 48 meses (rango: 17-78 meses) 5/7 (71%) de los pacientes estaban en remisión clínica con o sin tratamiento.
ConclusiónEl TPHA puede ser una opción terapéutica prometedora para pacientes con EC refractaria. Su utilidad radica en que puede producir la remisión clínica sin tratamiento en algunos pacientes, pero también en que puede hacer la enfermedad tratable, consiguiendo respuesta a determinados tratamientos en pacientes que la habían perdido previamente.
Autologous haematopoietic stem cell transplantation (AHSCT) is an accepted treatment in refractory Crohn's disease (CD).
Material and methodsData on patients with refractory CD subjected to AHSCT are collected at the Hospital Universitario Ramón y Cajal in Madrid and the results obtained are described retrospectively.
ResultsSeven patients in total have received AHSCT due to refractory CD in our centre. Three patients (43%) presented with clinical and endoscopic remission; one patient (14%) clinical improvement without remission and three patients (43%) remained active with the need to restart treatment in the assessment of the initial response to the AHSCT (after six months). Symptoms recurred in five of the seven patients (71%) and all of them had to restart medical treatment after an average of 13.8 months (range: 3–30 months). Only one patient needed surgery after the AHSCT. At the end of the follow-up, after a mean of 48 months (range: 17–78 months), 5/7 (71%) of the patients were in clinical remission with or without treatment.
ConclusionAHSCT may be a promising therapeutic option for patients with refractory CD. Its usefulness lies in the fact that it can produce clinical remission without treatment in some patients, but also that it can make the disease treatable, obtaining a response to certain treatments in patients who had previously lost it.
La enfermedad de Crohn (EC) es una enfermedad crónica mediada inmunológicamente que se caracteriza por una inflamación intestinal episódica1. A pesar de los grandes avances y las múltiples opciones terapéuticas disponibles en la actualidad para la EC, el 25% de los pacientes son refractarios y más del 50% presentan falta de respuesta a los tratamientos disponibles2,3.
El trasplante de precursores hematopoyéticos (TPH) consiste en la administración de quimioterapia intensiva seguida de una infusión intravenosa de progenitores hemopoyéticos. El TPH autólogo (TPHA) es la modalidad aceptada para las enfermedades de origen autoinflamatorio refractarias, incluida la EC refractaria, debido a la alta mortalidad asociada al TPH alogénico que no es admisible para enfermedades de origen no tumoral4. Aunque no está completamente definido su mecanismo de acción, este se basa en producir una ablación de los linfocitos T autorreactivos del paciente mediante la administración de agentes quimioterápicos, y en la generación de un nuevo repertorio de linfocitos T tolerantes gracias al implante de células madre5,6.
La evidencia actual del uso del TPHA en la EC refractaria se basa fundamentalmente en series de casos, con aparentes beneficios clínicos y en un único estudio aleatorizado (Autologous Stem cell Transplant In Crohn's disease [ASTIC]7). Las primeras reseñas que se encuentran al respecto en la literatura incluyen casos de pacientes con EC que presentan mejoría de los síntomas de su enfermedad al recibir TPH por otra enfermedad8,9. Posteriormente, se publicaron algunas series cortas de pacientes con EC refractaria que recibían TPHA por este motivo10–12, entre las que destaca la serie publicada por Burt et al. de Chicago10. Fue en 2015 cuando se publicó el único estudio aleatorizado en este campo (ASTIC)7. Este estudio incluyó pacientes con EC activa refractaria y a todos se les sometió a la fase de movilización. Posteriormente se aleatorizaron a recibir TPHA temprano (n=23) o tardío (grupo control que continuaba con el tratamiento convencional y recibía el TPHA a un año, n=22) con el objeto de discernir si la terapia recibida en la fase de movilización podría por sí sola inducir la remisión. El objetivo primario del estudio fue alcanzar la remisión clínica (Crohn's Disease Index of Severity [CDAI]<150) con curación mucosa endoscópica a un año, en ausencia de tratamiento activo en los últimos 3 meses. El estudio no demostró beneficio en el objetivo primario del TPHA en relación con la terapia convencional. Sin embargo, ha sido ampliamente señalado que el objetivo primario del estudio era demasiado estricto, más de lo que suele exigirse en los estudios de nuevos fármacos. No obstante, sí se reportó beneficio en alguno de los objetivos secundarios como: mejoría en la actividad clínica (CDAI) y endoscópica (Simple Endoscopic activity Score in Crohn Disease), así como en la calidad de vida7. Posteriormente destaca la publicación de 2 estudios no aleatorizados13,14 con resultados beneficiosos en relación con alcanzar la remisión clínica y endoscópica sin tratamiento tras el TPHA (61% a un año13), pero también con relación a conseguir respuesta a tratamientos a los que previamente se había perdido (57%14 y 80%14 de los pacientes retratados obtuvieron respuesta).
El objetivo de este estudio retrospectivo es describir los beneficios clínicos, así como los efectos adversos de los pacientes con EC refractaria que han sido sometidos a TPHA en nuestro centro.
Pacientes y métodosSe realizó una búsqueda retrospectiva de los pacientes que han recibido TPHA por EC refractaria en el Hospital Universitario Ramón y Cajal de Madrid entre junio de 2011 y diciembre de 2017. Se describen los resultados obtenidos.
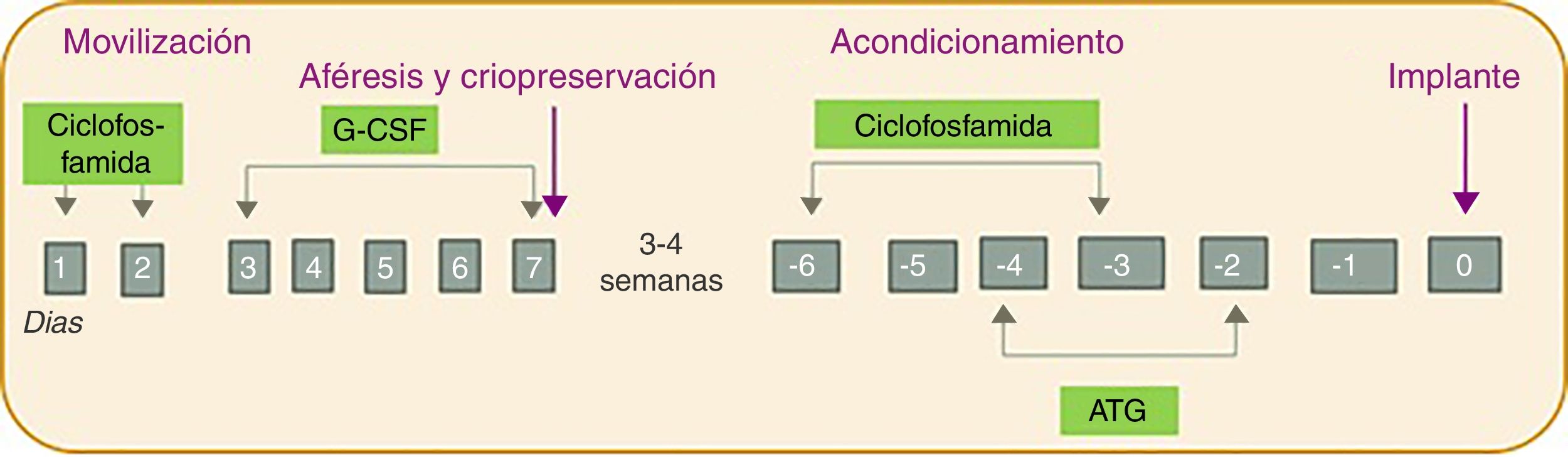
Todos ellos fueron sometidos a TPHA siguiendo el mismo esquema que incluye 4 fases: 1) movilización; 2) aféresis y criopreservación; 3) acondicionamiento; y 4) implante (fig. 1). En primer lugar la fase de movilización se realizó con la administración de ciclofosfamida (dosis de 2g/m2 durante 2 días) y factor estimulante de colonias de granulocitos (Granulocyte Colony Stimulating Factor [G-CSF]; dosis de 10μg/kg/día durante 5 días). A continuación, la fase de aféresis se llevó a cabo mediante una máquina de leucaféreis (modelo COBE Spectra) vía intravenosa con un objetivo de 2-4×106 células CD34/kg. Las células se guardaron mediante criopreservación hasta el implante. Para la fase de criopreservación las células obtenidas por leucoaféresis se mezclan con la solución crioprotectora dimetilsulfóxido (DMSO), que se prepara a una concentración final del 10%. La preparación se realiza a<4°C y en la campana de flujo laminar. El volumen final de cada bolsa no superará los 150ml y la concentración celular no debe exceder de 2×108/ml. El producto final es congelado en un congelador (modelo CM-2010), que sigue un programa de congelación controlada y programada, y almacenado a –80°C hasta que se realice el implante. Para la realización de las 2 primeras fases los pacientes permanecieron ingresados aproximadamente 2 semanas. A las 3-4 semanas se llevó a cabo la fase de acondicionamiento con la administración de ciclofosfamida (50mg/kg/día durante 4 días) y globulina antitimocítica equina o de conejo (iniciada a los 2 días tras el comienzo de la ciclofosfamida durante 3 días). Finalmente se realizó el implante de las células. Todo ello con un protocolo de tratamiento de soporte que incluyó la administración de antibióticos de amplio espectro ante el primer pico febril, antifúngicos y antivíricos profilácticos (fluconazol y aciclovir hasta que se alcanzaba la recuperación de las cifras de neutrófilos), profilaxis de Pneumocystis jirovecii (trimetoprim-sulfametoxazol durante 3 meses), así como soporte transfusional y nutricional (empleo de nutrición parenteral total durante la fase de aplasia).
ResultadosSe recogieron los pacientes con EC refractaria que han sido sometidos a TPHA en el Hospital Universitario Ramón y Cajal de Madrid de junio de 2011 (fecha de realización del primer TPHA en nuestro centro) a 31 de diciembre de 2017. Se obtuvo un total de 7 pacientes sometidos a TPHA debido a EC refractaria. Desde entonces se han llevado a cabo otros 2 procedimientos hasta un total de 9 casos, pero estos últimos no se incluyen en la presente publicación debido a su corto seguimiento.
La media de edad al trasplante fue de 26 años (rango: 16-43) y 5/7 (71%) eran mujeres. La media de tiempo desde el diagnóstico de la EC hasta el TPHA fue de 9,9 años (rango: 2,3-33,1 años).
Todos los pacientes habían recibido previamente múltiples terapias para la EC, habiendo fallado a una media de 6 terapias médicas (rango: 4-8) y el 57% había requerido cirugía. Los tratamientos previos se encuentran resumidos en la tabla 1.
Características de los pacientes, de la EC y tratamientos previos recibidos
| Sexo: F/M | 5/2 |
| Años (rango) | |
| Edad media al trasplante | 26 (16-43) |
| Tiempo medio de evolución de la EC | 16,9 (11-26) |
| Tiempo medio entre el diagnóstico y el trasplante | 9,9 (2,3-33,1) |
| N (%) | |
| Localización | |
| Ileal | 2 (29%) |
| Ileocólica | 4 (57%) |
| Gastrointestinal alta | 1 (14%) |
| Comportamiento | |
| Inflamatorio | 5 (71%) |
| Estenosante | 2 (29%) |
| Enfermedad perianal | 3(43%) |
| Cirugía previa | 4 (57%) |
| Media de número de tratamientos médicos previos | 6 (4-8) |
| Inmunosupresores previos | |
| Azatioprina | 5 (71%) |
| 6-Mercaptopurina | 2 (29%) |
| Metotrexato | 7 (100%) |
| Tacrolimus | 2 (29%) |
| Terapia biológica previa | |
| Infliximab | 7 (100%) |
| Adalimumab | 7 (100%) |
| Certolizumab | 3 (43%) |
| Ustekinumab | 3 (43%) |
| Vedolizumab | 2 (29%) |
| Natalizumab | 1 (14%) |
| Ensayo clínico previo | 3 (43%) |
EC: enfermedad de Crohn; F. femenino; M: masculino.
Todos los pacientes recibieron el TPHA siguiendo el mismo protocolo de actuación descrito en el apartado de material y métodos.
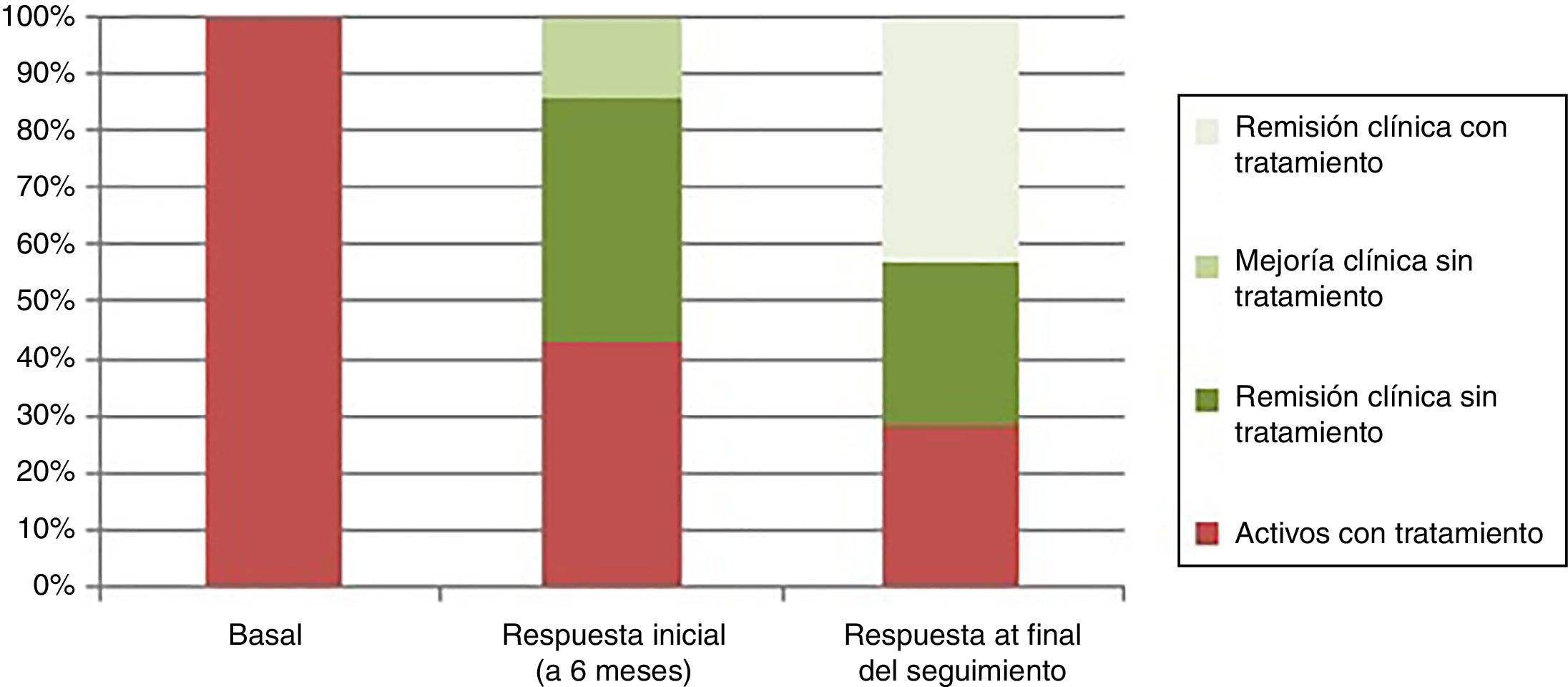
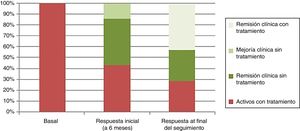
La respuesta clínica se dividió, de acuerdo a la estimación del médico tratante (Physician Global Assesment), en remisión clínica (ausencia de dolor abdominal y hábito deposicional normal), remisión clínica junto con remisión endoscópica (curación mucosa de las lesiones en la endoscopia), mejoría sin remisión (mejoría clínica del paciente sin alcanzar los criterios de remisión clínica) y enfermedad activa (empeoramiento de la clínica del paciente en relación con la sintomatología antes del trasplante). En la valoración de la respuesta inicial tras 6 meses del trasplante 3 pacientes (43%) presentaron remisión clínica y endoscópica, un paciente (14%) presentó mejoría clínica sin remisión y 3 pacientes (43%), a pesar de haber tenido una mejoría clínica inicial tras el trasplante, tras 6 meses del mismo, presentaban enfermedad activa que requirió el reinicio del tratamiento debido a que habían tenido una recidiva temprana (un paciente tras 3 meses y 2 pacientes tras 6 meses) (fig. 2).
Los pacientes que presentaron recidiva de los síntomas fueron 5/7 (71%), y todos ellos requirieron el reinicio del tratamiento médico (tabla 2). De los 3 pacientes que presentaron remisión clínica y endoscópica en la evaluación inicial 2 se mantuvieron en remisión y no requirieron reinicio del tratamiento, y uno presentó recidiva de la enfermedad tras 30 meses del TPHA, que se trató con infliximab con buena respuesta. Por otro lado, el paciente con mejoría clínica sin remisión tras 6 meses del trasplante presentó recidiva a los 24 meses del trasplante, que ha requerido múltiples tratamientos sin respuesta. De los pacientes con recidiva temprana: uno ha presentado recidiva tras 3 meses del trasplante que ha requerido tratamiento con metotrexato e infliximab con buena respuesta y 2 han presentado recidiva tras 6 meses (uno tratado con adalimumab con buena respuesta y el otro ha requerido múltiples tratamientos sin respuesta). Solo un paciente (14%) requirió cirugía por recidiva de la EC tras el TPHA.
Recurrencia y tratamientos utilizados postrasplante autólogo de precursores hematopoyéticos (TPHA)
| N (%/rango) | |
|---|---|
| Recurrencia | 5 (71%) |
| Tiempo medio de recurrencia desde el TPHA (meses) | 13,8 (3-30) |
| Cirugía post-TPHA | 1 (14%) |
| Tratamientos médicos post-TPHA | |
| Infliximab | 3 (43%) |
| Adalimumab | 2 (29%) |
| Certolizumab | 1 (14%) |
| Ustekinumab | 2 (29%) |
| Vedolizumab | 2 (29%) |
| Metotrexato | 1 (14%) |
La media de seguimiento fue de 48 meses (rango: 24-78 meses). Al final del seguimiento la respuesta se dividió en activos con tratamiento (2/7: 28,6%), remisión clínica con tratamiento (3/7: 42,8%) y remisión clínica sin tratamiento (2/7: 28,6%) (fig. 2).
Las complicaciones postrasplante más frecuentes fueron la neutropenia febril y la mucositis (6/7, 86% [tabla 3]). No se registraron complicaciones infecciosas graves, con un único caso de infección por Clostridum difficile resuelto con tratamiento con vancomicina. No se describieron casos de neoplasias o desarrollo de otras enfermedades autoinmunes tras el TPHA. Ningún paciente ha fallecido al final del seguimiento.
Complicaciones postrasplante autólogo de precursores hematopoyéticos
| N (%) | |
|---|---|
| Neutropenia febril | 6 (86%) |
| Complicaciones infecciosas | |
| Infección por Clostridium difficile | 1 (14%) |
| Complicaciones no infecciosas | |
| Mucositis | 6 (86%) |
| Reacción a la globulina antitimocítica | 1 (14%) |
| Pancitopenia con requirimiento transfusional | 1 (14%) |
| Sangrado digestivo resuelto tras transfusión | 1 (14%) |
| Metrorragia autolimitada | 1 (14%) |
En cuanto a los resultados, en relación con la presencia de enfermedad perianal, 3 pacientes habían presentado enfermedad perianal previa al trasplante y en todos estaba controlada en el momento del trasplante. Un paciente había presentado una fístula perianal simple que recibió tratamiento antibiótico y adalimumab, con buena evolución a 2 años del TPHA, y tras 3 años del TPHA no existía evidencia de fístula. Una paciente había presentado una fístula perianal compleja que requirió cirugía con buena evolución 4 años antes del TPHA, y tras un año del TPHA tampoco tenía recidiva de la enfermedad perianal. Por último, un paciente había presentado una fístula perianal simple que requirió fistulotomía un año antes del TPHA, y tras 3 años del TPHA no había evidencia de enfermedad perianal.
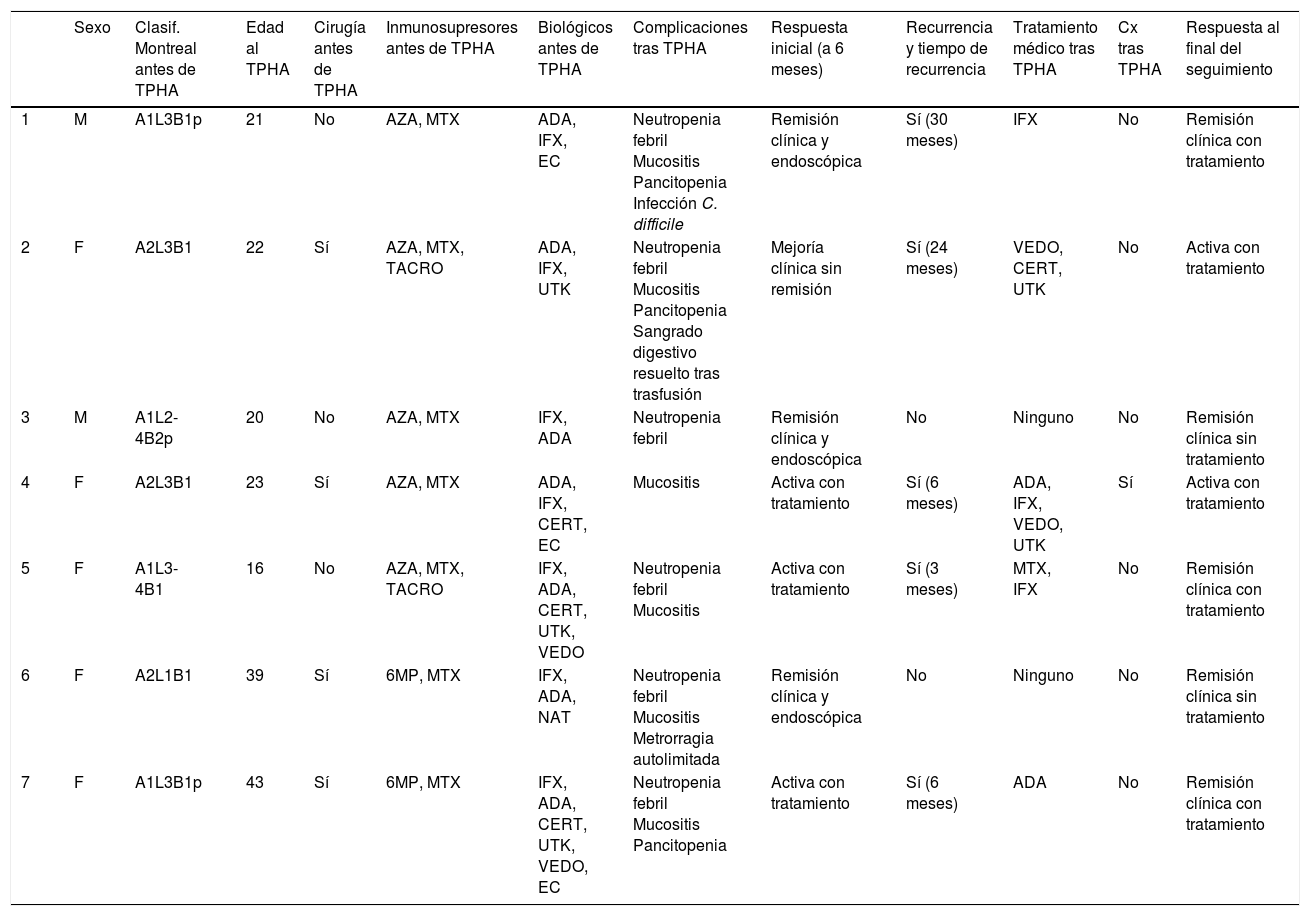
En la tabla 4 se resume la evolución de cada paciente.
Cuadro evolutivo de los pacientes incluidos
| Sexo | Clasif. Montreal antes de TPHA | Edad al TPHA | Cirugía antes de TPHA | Inmunosupresores antes de TPHA | Biológicos antes de TPHA | Complicaciones tras TPHA | Respuesta inicial (a 6 meses) | Recurrencia y tiempo de recurrencia | Tratamiento médico tras TPHA | Cx tras TPHA | Respuesta al final del seguimiento | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | A1L3B1p | 21 | No | AZA, MTX | ADA, IFX, EC | Neutropenia febril Mucositis Pancitopenia Infección C. difficile | Remisión clínica y endoscópica | Sí (30 meses) | IFX | No | Remisión clínica con tratamiento |
| 2 | F | A2L3B1 | 22 | Sí | AZA, MTX, TACRO | ADA, IFX, UTK | Neutropenia febril Mucositis Pancitopenia Sangrado digestivo resuelto tras trasfusión | Mejoría clínica sin remisión | Sí (24 meses) | VEDO, CERT, UTK | No | Activa con tratamiento |
| 3 | M | A1L2-4B2p | 20 | No | AZA, MTX | IFX, ADA | Neutropenia febril | Remisión clínica y endoscópica | No | Ninguno | No | Remisión clínica sin tratamiento |
| 4 | F | A2L3B1 | 23 | Sí | AZA, MTX | ADA, IFX, CERT, EC | Mucositis | Activa con tratamiento | Sí (6 meses) | ADA, IFX, VEDO, UTK | Sí | Activa con tratamiento |
| 5 | F | A1L3-4B1 | 16 | No | AZA, MTX, TACRO | IFX, ADA, CERT, UTK, VEDO | Neutropenia febril Mucositis | Activa con tratamiento | Sí (3 meses) | MTX, IFX | No | Remisión clínica con tratamiento |
| 6 | F | A2L1B1 | 39 | Sí | 6MP, MTX | IFX, ADA, NAT | Neutropenia febril Mucositis Metrorragia autolimitada | Remisión clínica y endoscópica | No | Ninguno | No | Remisión clínica sin tratamiento |
| 7 | F | A1L3B1p | 43 | Sí | 6MP, MTX | IFX, ADA, CERT, UTK, VEDO, EC | Neutropenia febril Mucositis Pancitopenia | Activa con tratamiento | Sí (6 meses) | ADA | No | Remisión clínica con tratamiento |
ADA: adalimumab; AZA: azatioprina; CERT: certolizumab; EC: ensayo clínico; IFX: infliximab; MTX: metotrexato; NAT: natalizumab; TACRO: tacrolimus; UTK: ustekinumab; VEDO: vedolizumab; 6MP: 6-mercaptopurina.
Aunque se trata de una serie corta de pacientes, nuestros resultados apoyan que el TPHA puede ser una opción terapéutica para pacientes con EC refractaria. Al evaluar la repuesta inicial aproximadamente la mitad de los pacientes (3/7; 43%) estaban en remisión clínica y endoscópica o presentaban mejoría clínica (1/7; 14%) sin necesidad de tratamiento. Tres pacientes (3/7; 43%) permanecían activos con necesidad de reinicio del tratamiento a los 6 meses tras el trasplante. La mayoría de los pacientes (5/7; 71%) presentaron recidiva y requirieron reinicio del tratamiento. Sin embargo, al final del seguimiento (a una media de 48 meses) la mayoría de los pacientes (5/7; 71%) estaban en remisión clínica con o sin tratamiento. En el único estudio aleatorizado7 publicado hasta la fecha no se alcanzó el objetivo primario del estudio, pero este objetivo era probablemente demasiado estricto (CDAI<150 con curación mucosa endoscópica a un año y en ausencia tratamiento activo en los últimos 3 meses); incluso más estricto que los objetivos empleados al evaluar la terapia convencional. Sin embargo, sí que parecía haber beneficio en los objetivos secundarios como: mejoría clínica (CDAI), endoscópica (Simple Endoscopic activity Score in Crohn Disease) y de calidad de vida. Posteriormente, destacan 2 estudios no aleatorizados que apoyan el uso del TPHA en la EC refractaria13,14. La única serie española y que es la mayor serie proveniente de un único centro publicada hasta la fecha13, incluyó de forma prospectiva 29 pacientes, no incluidos en el estudio ASTIC. Se obtuvo que el porcentaje de pacientes en remisión clínica y endoscópica sin tratamiento iba disminuyendo con el paso del tiempo tras el trasplante: 61% a un año, 47% a 3 años y 15% tras 5 años. Sin embargo, aquellos pacientes que presentaron recidiva fueron tratados de nuevo alcanzando un porcentaje de remisión con el tratamiento de un 80%. Tras 5 años del TPHA el 100% de los pacientes presentaban remisión con o sin tratamiento13. Datos similares se habían obtenido previamente en la serie proveniente de Chicago, siendo la proporción de pacientes sin necesidad de tratamiento de 91% a un año, 57% a 3 años y 19% tras 5 años del TPHA10. Sin embargo, tras 5 años del TPHA el 80% se mantenía en remisión con o sin tratamiento10. En un estudio reciente, presentado en el congreso de European Crohn's and Colitis Organization14 del año 2018 se han mostrado los resultados de la mayor cohorte de pacientes existente que incluye 82 pacientes provenientes de 7 países europeos no incluidos en el estudio ASTIC, obteniendo que el 67% de los pacientes presentaron remisión completa o mejoría clínica tras el TPHA (a una media de seguimiento de 3 años). La mayoría de los pacientes requirieron reintroducción del tratamiento para alcanzar la mejoría clínica y en un 57% de los pacientes se alcanzó respuesta a tratamientos a los que previamente habían perdido respuesta14. Con todo esto, parece que la utilidad del TPHA radica en que puede producir la remisión en algunos pacientes, pero también en que puede hacer que los pacientes consigan remisión clínica en respuesta a fármacos que habían sido previamente ineficaces o a los que habían perdido respuesta previamente. Cualquier consideración acerca de su eficacia debe pasar por el hecho de que los pacientes que llegan a este estado han pasado ya por la mayoría de las terapias disponibles, y no son candidatos quirúrgicos buenos por afectación extensa de la enfermedad o por intervenciones quirúrgicas previas que hacen dificultoso un nuevo abordaje quirúrgico.
La principal limitación del uso del TPHA en la EC es su toxicidad. La mortalidad del TPHA se estima del 1,2%6. En nuestro estudio las complicaciones postrasplante más frecuentes fueron leves, como la neutropenia febril y la mucositis (6/7, 86% [tabla 2]). No se registraron complicaciones letales ni complicaciones infecciosas graves, con un único caso de infección por Clostridum difficile con buena evolución con tratamiento. En el estudio ASTIC falleció un paciente por síndrome de obstrucción sinusoidal a 20 días de la fase de acondicionamiento7. En la cohorte presentada en la European Crohn's and Colitis Organization un paciente falleció por infección por citomegalovirus en el día 56 post-TPHA y otro falleció a 8 años del TPHA sin relación con el trasplante14. Del mismo modo, las infecciones fueron la complicación post-TPHA más habitual (27%), siendo las más frecuentes de origen vírico (13%)14. Este hallazgo se documentó también en la serie de Barcelona: el 38% de los pacientes presentó infección por virus de la familia herpes y se produjo la muerte de un paciente a consecuencia de una infección diseminada por citomegalovirus a los 2 meses del trasplante13. Parece que la optimización del tratamiento de soporte durante las fases de movilización y acondicionamiento puede mejorar la tasa de complicaciones infecciosas13,15. Existen pocos datos acerca de las posibles complicaciones a largo plazo del TPHA en la EC refractaria. En el estudio de Barcelona el 13% de los pacientes desarrolló otra enfermedad autoinmune, y el 6% una neoplasia durante el periodo de seguimiento tras el TPHA13. Con todo ello, parece oportuno que el TPHA se realice en centros especializados y que se lleve a cabo una selección cuidadosa de los pacientes16.
Se concluye que el TPHA parece una opción terapéutica útil en pacientes con EC refractaria, ya puede conseguir la remisión clínica y recuperar la respuesta a determinados tratamientos en pacientes que la habían perdido previamente, aunque aún son necesarios estudios aleatorizados controlados en este campo. La toxicidad del TPHA es una de sus limitaciones más importantes, por lo que se debe seleccionar bien a los pacientes y realizarlo en centros especializados. Son necesarios estudios con mayor seguimiento para aclarar los efectos secundarios a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.