INTRODUCCIÓN
Los trastornos de la deglución comprenden un grupo amplio y heterogéneo de alteraciones que afectan a las diferentes estructuras implicadas en el mecanismo de esta función. Tienen una manifestación clínica diversa, con el denominador común de presentar síntomas y/o signos que muchas veces expresan de forma inequívoca la alteración de la deglución (p. ej., dificultad para la ingesta) y en otras la sugieren (p. ej., complicaciones extradigestivas). El síntoma paradigmático es la disfagia, pero también hay casos en que el paciente no la refiere y el síndrome clínico está protagonizado por las complicaciones, como las pulmonares o la desnutrición.
Son trastornos frecuentes cuya prevalencia aumenta con la edad, lo que está directamente relacionado con su etiología1,2. Tienen importancia no sólo por su frecuencia, sino también por la morbimortalidad que condicionan, los costes sanitarios3 y su repercusión en la calidad de vida relacionada con la salud. En los casos más graves, estos trastornos pueden causar deshidratación, pérdida de peso y desnutrición, así como complicaciones pulmonares secundarias al paso de material deglutido a la vía respiratoria.
El abordaje clínico requiere habitualmente la participación de un equipo multidisciplinario. Se ha indicado que la anamnesis y la exploración física permiten conocer la causa del trastorno en el 80-85% de los casos4. En lo relativo a las exploraciones complementarias, el esofagograma baritado y la esofagoscopia son pruebas suficientes en muchos pacientes para confirmar la impresión clínica inicial, y sólo algunos casos requerirán pruebas diagnósticas complejas, en las que se incluyen estudios neurológicos, videorradiología, manometría y pHmetría esofágica.
El objetivo primario del tratamiento es la recuperación del mecanismo normal de la deglución pero, desgraciadamente no siempre es posible, por lo que el objetivo principal del tratamiento pasa a ser el restablecimiento y el mantenimiento del estado nutricional, así como la prevención del desarrollo de complicaciones, para lo cual puede ser necesario buscar vías de nutrición alternativas a la natural con carácter temporal o definitivo.
FISIOLOGÍA DE LA DEGLUCIÓN
La deglución es un proceso muy complejo que exige una perfecta coordinación de varios grupos musculares de la boca, la faringe, la laringe y el esófago, los cuales poseen una rica inervación en la que interviene el centro de la deglución y los pares craneales V, VII, IX, X y XII.
Se pueden distinguir 3 fases en la deglución perfectamente coordinadas: oral, faríngea y esofágica. La fase oral integra tres acciones básicas: la masticación, la formación del bolo alimenticio y su propulsión y paso a la faringe. A continuación acontece la fase faríngea, la cual está constituida por una serie de procesos que están altamente coordinados de manera secuencial, empezando por el cierre de la nasofaringe mediante el velo del paladar, la elevación y el cierre de la laringe, la apertura del esfínter esofágico superior (EES) y la contracción de parte de la musculatura faríngea. Todos estos procesos hacen posible el paso del bolo al esófago a la vez que impiden su entrada en la vía aérea y su reflujo hacia la nariz; es decir, supone una transformación de la orofaringe, que pasa de ser una vía respiratoria a ser una vía deglutoria, mediante la apertura de la entrada hacia el esófago y el cierre de la entrada a la laringe. Con la llegada del bolo al esófago se inicia la fase esofágica, que posibilita que el bolo alcance el estómago gracias a la contracción peristáltica del esófago y a la relajación coordinada del esfínter esofágico inferior (EEI). El desplazamiento del bolo alimentario desde la boca a la faringe es un acto voluntario, mientras que los siguientes pasos señalados son involuntarios. El inicio del mecanismo de la deglución se puede producir tanto por el estímulo de receptores localizados en la lengua, el paladar blando, la úvula, la pared posterior de faringe y la laringe como por una acción directa controlada por el sistema nervioso central5,6.
SÍNTOMAS INDICATIVOS DE LOS TRASTORNOS DE LA DEGLUCIÓN
La disfagia es el síntoma capital y más expresivo que obliga a pensar en la existencia de una alteración de la deglución. El paciente suele describir la presencia de disfagia como dificultad para el inicio de la deglución o, lo que es más común, como sensación de parada del bolo o percepción de dificultad para el paso de éste en algún lugar del cuello o de la región esternal. La anamnesis debe ser muy meticulosa para evitar errores en la interpretación de los síntomas. En muchos casos la descripción que hace el paciente es inequívoca; pero no es infrecuente asistir a pacientes que describen sensaciones similares que no corresponden a una verdadera disfagia, evocando un trastorno de la deglución que puede inducir al clínico una sospecha diagnóstica errónea. El llamado «globo faríngeo» es el paradigma de esta situación. Suele definirse como una sensación de ocupación que el paciente localiza en el cuello, de forma más o menos continua y sin relación con la deglución; de hecho, no es infrecuente, y resulta relevante para su interpretación clínica que esa sensación desaparezca en el momento de la deglución7.
Aunque los datos epidemiológicos son escasos, se ha estimado que la prevalencia de disfagia en sujetos mayores de 50 años es del 3-19%8,9. Pese a que tradicionalmente se ha considerado la disfagia como un síntoma de alarma que obliga a descartar una enfermedad neoplásica, en los últimos años se ha relativizado su importancia en ese sentido. Una razón para ello ha sido la frecuencia con la que las enfermedades benignas cursan con disfagia10; el caso más relevante, por su prevalencia, es la enfermedad por reflujo gastroesofágico. La presencia de disfagia en un paciente con criterios sintomáticos diagnósticos de esta enfermedad puede ser un síntoma más y/o estar en relación con la presencia de esofagitis11.
Se reconocen 2 tipos de disfagia, según las fases de la deglución afectadas orofaríngea y esofágica, que es muy conveniente identificar desde el inicio de la asistencia clínica, dado que hay diferencias relevantes en sus causas, consecuencias y estrategia diagnóstica y terapéutica. Para esta diferenciación, el primer dato que se debe investigar es el relativo al lugar donde el paciente localiza el obstáculo para la deglución, que suele describir como detención del bolo. Este dato tiene cierto valor para el clínico porque puede orientar sobre la topografía y la causa de la disfagia. En general, el paciente suele referirla en el mismo nivel o por encima de donde asienta la alteración causante de la disfagia. Por tanto, si se refiere la localización del trastorno por debajo del hueco supraesternal, debe sospecharse que la disfagia es de origen esofágico. Sin embargo, si éste se describe a la altura del cuello, deben investigarse otros datos que ayuden a diferenciar ambos trastornos, ya que tanto la disfagia orofaríngea como la esofágica pueden presentar esta localización. La presencia o ausencia de síntomas acompañantes puede ser de ayuda en estos casos. La disfagia oral puede ir acompañada de alteración en la formación del bolo, dificultad para iniciar la deglución, escape de la comida por la boca, sialorrea o xerostomía, deglución fraccionada o disartria. La disfagia faríngea suele ocasionar sensación inmediata de parada del bolo, regurgitación nasal, intentos repetidos de deglución, síntomas de aspiración, como tos y asfixia, coincidentes con la deglución o disfonía. La expulsión inmediata del alimento ingerido suele estar relacionada con su retención en la hipofaringe, mientras que la regurgitación tardía de comida debe hacer sospechar la presencia de un divertículo faríngeo. Por otro lado, la dificultad para la deglución puede depender de la consistencia del material ingerido. De tal forma que, habitualmente, cuando la dificultad aparece sólo con alimentos sólidos, suele estar relacionada con una causa orgánica, ya sea orofaríngea o esofágica12.
El dolor con la deglución, esté o no asociado a la disfagia, se denomina odinofagia. Es un síntoma que puede reflejar la existencia de una lesión orgánica, tanto esofágica como orofaríngea, y es frecuente su presencia ante infecciones, más habituales en estados de inmunosupresión13.
En ocasiones, los trastornos de la deglución se manifiestan por sus complicaciones, y las más frecuentes son las respiratorias14 y la impactación alimentaria. La entrada del bolo alimentario a la vía área tiene diferentes matizaciones y consecuencias, de tal modo que se ha propuesto distinguir los términos de «penetración» y «aspiración» para definir diferentes grados de alteración sobre la vía aérea que se asocian con la ingesta15. La penetración ocurre cuando el material entra en el área laríngea a la altura de las cuerdas vocales, mientras que la aspiración ocurre cuando el material se desplaza por debajo de los cuerdas vocales y entra en la tráquea16. Una de las consecuencias más graves de la aspiración son las infecciones respiratorias, de tal forma que se considera que la neumonía por aspiración es la forma más frecuente de neumonía intrahospitalaria en adultos, enfermedad que, además, conlleva una alta mortalidad (20-65%)16,17. La sospecha de aspiración es en ocasiones difícil de establecer, ya que no es infrecuente que curse de manera silente18,19. En este sentido, la presencia de tos en un paciente con alteración de la deglución debe alertar sobre esta posibilidad.
La impactación alimentaria es la causa más frecuente de cuerpo extraño esofágico y suele estar asociada a una alteración morfológica esofágica subyacente. Clínicamente, el paciente suele referir disfagia súbita con sensación de parada del bolo, acompañada en ocasiones de sialorrea, dolor torácico o cervical, odinofagia o sensación punzante. Es uno de las urgencias endoscópicas más frecuentes.
Por último, no hay que olvidar que algunos pacientes con trastornos de la deglución no presentan síntomas, tal como se ha demostrado en la enfermedad de Parkinson20, por lo que probablemente ciertas enfermedades (sobre todo las que pueden cursan con disfagia orofaríngea) requieran un protocolo de evaluación específico para investigar la presencia de trastornos de la deglución.
ALTERACIONES DE LA DEGLUCIÓN DE CAUSA OROFARÍNGEA
La disfagia orofaríngea surge cuando hay alteraciones en las estructuras que intervienen en las 2 primeras fases de la deglución. Estas alteraciones se plasman en la presencia de un obstáculo mecánico propiamente dicho o una obstrucción funcional por mala elaboración del bolo en la cavidad oral, debilidad de la contracción faríngea, alteraciones en la coordinación entre la contracción faríngea y la relajación del EES, o apertura inadecuada de este esfínter. El diagnóstico de los trastornos de la deglución de causa orofaríngea suele ser complejo y requerir un abordaje multidisciplinario. De manera simplista y esquemática, una vez establecido el diagnóstico sindrómico, la evaluación del paciente tiene tres objetivos fundamentales: identificar la causa, evaluar el riesgo de aspiración y decidir el tratamiento. Buena parte de la información necesaria puede obtenerse mediante una buena historia clínica y un examen físico minucioso. En muchos pacientes, sin embargo, se precisa la realización de exploraciones complementarias para completar la búsqueda etiológica y definir el tratamiento más adecuado.
Las causas más frecuentes de disfagia orofaríngea son las de origen neurológico12,21, con una prevalencia superior al 30% tras un accidente cerebrovascular (ACV)22, del 52-82% en la enfermedad de Parkinson23 y del 84% para la enfermedad de Alzheimer24. Además, es el primer síntoma en el 60% de los pacientes con esclerosis lateral amiotrófica, afecta a más del 30% de los pacientes con esclerosis múltiple25, al 30-80% de los afectos por una miopatía inflamatoria26-28 y es superior al 20% en las conectivopatías, como la esclerodermia, el síndrome de Sjögren o el lupus eritematoso sistémico29. Un 30-60% de los pacientes con miastenia gravis presentan disfagia en el curso clínico de su enfermedad, la cual está presente en el momento del diagnóstico en el 20% de los casos30 y es el síntoma de presentación en el 6-17%31,32. Por último, algunos estudios realizados en pacientes con trastornos metales también muestran una alta prevalencia de disfagia orofaríngea (32%)33 y no hay que olvidar que también acontece en más del 60% de los ancianos institucionalizados.
Diagnóstico etiológico
Los trastornos de la deglución de causa orofaríngea son consecuencia de alteraciones de las estructuras anatómicas y/o de los mecanismos fisiológicos implicados en las fases oral y faríngea de la deglución. Estas alteraciones comprenden tanto causas locales como enfermedades sistémicas, ya sean orgánicas o funcionales. La importancia de su identificación viene determinada por el hecho de que para algunas hay un tratamiento específico y efectivo. Las causas más comunes de disfagia orofaríngea se definen en la tabla I. A la variedad etiológica se suma la dificultad de la evaluación clínica del componente orofaríngeo de la deglución, dado que supone enfrentarse a un mecanismo neuromuscular rápido y complejo que obliga a utilizar exploraciones específicas que, entre otras cosas, requieren la cooperación del paciente, situación no siempre posible, ya que en muchas ocasiones se trata de pacientes con afecciones neurológicas.
La anamnesis debe dirigirse a profundizar en las características de la disfagia (inicio, duración y progresión), así como en la presencia de síntomas asociados, ya sea relacionados con la propia deglución como a distancia (fundamentalmente en busca de otras manifestaciones neuromusculares). Las características evolutivas de la disfagia proporcionan pistas importantes para orientar el diagnóstico etiológico y permite diferenciar en muchos casos si se trata de un trastorno benigno o maligno. Una disfagia de instauración brusca, a menudo asociada a otros síntomas y signos neurológicos, sugiere que la causa pueda ser aguda, y lo más frecuente es que se trate de un ACV. Si la disfagia presenta una progresión rápida y se acompaña de pérdida de peso debe sospecharse una neoplasia, mientras que si su evolución es lenta, las causas más probables sean las miopatías inflamatorias y degenerativas, la miastenia gravis y las enfermedades neurológicas no vasculares.
La presencia de síntomas asociados a la disfagia permite acotar las posibilidades etiológicas en el paciente con disfagia orofaríngea, dado que puede caracterizar entidades clínicas concretas. Así, por poner algunos ejemplos, la presencia de temblor y ataxia sugiere que el origen del problema puede ser la enfermedad de Parkinson; un episodio brusco de pérdida de conciencia sugiere un ACV o un tumor cerebral; una alteración generalizada del músculo esquelético obliga a pensar en una miopatía o en la miastenia gravis. Finalmente, no hay que olvidar realizar una interrogatorio dirigido a descubrir la toma de fármacos que pueden facilitar la aparición de disfagia orofaríngea (anticolinérgicos, psicofármacos o algunos que causan extrapiramidalismo, como ocurre con ciertos antieméticos) e investigar la presencia de antecedentes personales de enfermedad en la región orofaríngea, así como su tratamiento (cirugía de cabeza-cuello, radioterapia, quimioterapia)34. Se ha descrito algún caso de disfagia orofaríngea tras la inyección de toxina botulínica local y a distancia35.
La exploración física no sólo proporciona pistas útiles para el diagnóstico etiológico (p. ej., la presencia de exoftlamos, taquicardia, temblor y sudoración puede orientar hacia la existencia de un hipertiroidismo36; o la evidencia de alteraciones cutáneas como eritema en alas de mariposa, telangiectasias o púrpura obliga a descartar conectivopatías), sino que aporta información general relativa a las consecuencias de la disfagia (estado de hidratación y nutrición, signos respiratorios indicativos de complicaciones pulmonares por aspiración). Debe incluir la inspección de la cavidad oral y la orofaringe, así como la inspección y la palpación de la cabeza y el cuello; sin embargo, quizás la parte más destacable de la exploración física en el paciente con disfagia orofaríngea sea la relativa a la exploración neurológica, ya que, realizada en manos expertas, permite evaluar con bastante precisión la existencia de alguna enfermedad neurológica, muscular o neuromuscular.
Aunque la anamnesis y la exploración física permiten descifrar la causa de la disfagia en muchos pacientes, con frecuencia es necesario indicar exploraciones complementarias para alcanzar el diagnóstico etiológico. Entre ellas, cabe destacar el esofagograma baritado, la endoscopia, la videorradiología de la deglución, las técnicas de neuroimagen y la manometría esofágica.
Para la evaluación de lesiones orgánicas se pueden utilizar técnicas radiológicas o endoscópicas. La exploración endoscópica de la faringe, la laringe y el esófago superior es el mejor método para descubrir lesiones orgánicas que cursan con disfagia orofaríngea; su realización es necesaria en pacientes sin diagnóstico etiológico, y de primera elección ante la sospecha de neoplasia. El valor fundamental del esofagograma baritado es la investigación de lesiones orgánicas que pueden ser difíciles de valorar mediante endoscopia, como el divertículo de Zenker y las membranas situadas en el esófago superior, típicas del síndrome de Plummer-Vinson.
El método de elección para obtener información de la actividad funcional es la videorradiología de la deglución37, la cual permite caracterizar mejor la enfermedad, establecer el pronóstico, a la vez que posibilita la toma de decisiones terapéuticas con mayor seguridad. Consiste en la grabación por vídeo de la deglución administrando bolos de material radioopaco con diferente consistencia, lo que permite valorar diferentes aspectos de la deglución:
1. Fase oral. Analiza la masticación, la formación del bolo, la contención oral y el inicio de la deglución o transferencia del bolo hacia la faringe.
2. Fase faríngea. Valora la progresión del bolo hacia el EES, la regurgitación nasofaríngea, el paso a la vía respiratoria y la existencia de residuo faríngeo tras la deglución.
3. La apertura del EES permite el paso fácil del bolo hacia el esófago. Además, permite valorar el efecto de las modificaciones en el contenido y consistencia de la ingesta, la actitud postural durante la deglución, las maniobras de compensación y las técnicas facilitadoras para la corrección de la disfunción observada12.
La manometría esofágica tiene indicaciones muy concretas en este contexto clínico, cuya principal utilidad es la valoración de la actividad funcional del EES y su coordinación con la faringe, que puede encontrarse alterada en distintas situaciones y de diferente manera, como la acalasia cricofaríngea que frecuentemente acompaña al divertículo de Zenker. Con la metodología convencional, habitualmente utilizada, la información que ofrece la manometría relativa a la capacidad contráctil de la faringe tiene muy poca fiabilidad, pero sí es útil para valorar la relajación y la coordinación del EES y la capacidad contráctil del esófago superior38,39, que pueden estar alterada en las miopatías, como la distrofia muscular oculofaríngea40. El desarrollo de nuevas tecnologías de evaluación manométrica quizás permita realizar una valoración más fiable de esta región faringoesofágica41,42.
Para descartar una enfermedad orgánica cerebral está indicada la realización de técnicas de neurorradiología. En casos concretos, es necesaria la realización de otras exploraciones, como la electromiografía o la biopsia muscular. Por último, las pruebas de laboratorio pueden ser de utilidad en algunos casos para confirmar el diagnóstico etiológico sospechado. Así, el hipertiroidismo se confirma mediante la demostración de un aumento de los valores de hormonas tiroideas y la miastenia gravis a través de la determinación serológica de anticuerpos contra el receptor de acetilcolina, positivos en más del 85% de los casos.
Evaluación del riesgo de aspiración
Éste es el aspecto más importante en la valoración de la disfagia orofaríngea. De la existencia de aspiración se deriva en buena manera el pronóstico del cuadro clínico. Se ha estimado una elevada mortalidad anual (45%) de los pacientes con disfagia orofaríngea y aspiración21. Cuando hay un riesgo significativo de aspiración o incapacidad para la ingesta, debe optarse por un cambio en la vía de la alimentación, ya sea por sonda nasogástrica o por gastrostomía.
En principio, todo paciente con disfagia orofaríngea tiene riesgo de presentar aspiración y sus complicaciones3,43. Algunos síntomas sugieren o confirman su presencia. Entre ellos, cabe destacar la tos y/o la sensación de asfixia durante la deglución, así como el desarrollo de broncopatía crónica, neumonía o absceso pulmonar. Sin embargo, se debe tener en cuenta que los síntomas infravaloran, en general, la presencia de aspiración. Así, por ejemplo, se ha estimado que hasta una cuarta parte de los pacientes con disfagia tras un ACV presentan episodios silentes de aspiración19. Por ello, se considera en la actualidad que la videorradiología de la deglución es la prueba más adecuada para demostrar la aspiración, si bien no detecta a todos los pacientes que la padecen. Además, no sólo permite objetivar si hay aspiración, sino también estimar su gravedad, determinar el mecanismo por el cual se produce y valorar si es posible su corrección mediante cambios posturales u otras estrategias compensadoras.
Se ha propuesto la utilización de diferentes indicadores clínicos para valorar el riesgo de aspiración, entre los que se encuentra el reflejo faríngeo (gag reflex), ya que representa una respuesta protectora frente a la entrada de material en la faringe, la laringe y la tráquea. Contrariamente a lo que se pensaba en principio, se ha demostrado que la ausencia de este reflejo no tiene valor pronóstico en lo referente al riesgo de aspiración, dado que sólo el 60% de los pacientes que presentan aspiración lo tienen alterado18,44-46. En contraposición, el reflejo faríngeo está ausente en el 20-40% de los adultos sanos47. De manera análoga, la disfonía tiene una sensibilidad y un valor predictivo positivo del 91 y el 58%, respectivamente, en la evaluación de la posibilidad de aspiración en pacientes con disfagia orofaríngea. La aparición de tos o alteraciones en la voz con la ingesta de agua tiene una sensibilidad mayor al 70% y una especificidad del 22-66% para predecir la aspiración18. Por último, aunque la detección de aspiración relacionada con disfagia es una indicación para anular la alimentación, no debe olvidarse que la nutrición por sonda no elimina de forma absoluta el riesgo de neumonía por aspiración21.
Decisión del tratamiento
El objetivo primordial del tratamiento es restablecer el mecanismo normal de la deglución o, en su defecto, mejorarlo lo suficiente para que el paciente sea capaz de mantener el estado nutricional y de hidratación. Por ello, siempre que sea posible se realizará un tratamiento etiológico específico de la enfermedad causante de la disfagia orofaríngea. Otras veces, en el caso de lesiones orgánicas, se requiere aplicar diferentes modalidades de tratamiento médico, endoscópico y/o quirúrgico que permitan restablecer el tránsito normal del alimento desde la boca hacia el esófago. Cuando se trata únicamente de un trastorno de la función, sin causa orgánica, que no tiene tratamiento etiológico, hay dos opciones para mantener el estado nutricional: a) diferentes medidas que logren mantener un mecanismo de la deglución lo más fisiológico posible (como los cambios en el modo de deglución o en la consistencia de la ingesta), o b) búsqueda de formas alternativas de alimentación (sondas de nutrición).
El tratamiento etiológico es posible, aunque con efectividad variable, como en la disfagia orofaríngea secundaria al hipertiroidismo, en las miopatías inflamatorias, en las colagenosis que mejoran con corticoides y/o inmunosupresores y en la enfermedad de Parkinson con el uso de fármacos anticolinérgicos y/o dopaminérgicos que corrigen el desequilibrio entre la inervación colinérgica y dopaminérgica causante del trastorno. En el caso del ictus que cursa con disfagia, suele producirse una mejoría espontánea de la deglución durante las primeras semanas tras el episodio agudo48, por lo que es aconsejable una actitud inicial expectante antes de tomar otro tipo de decisiones terapéuticas12.
Las lesiones neoplásicas pueden tratarse mediante resección quirúrgica, radioterapia y/o quimioterapia; el diver tículo de Zenker con diverticulotomía, diverticulopexia y/o miotomía del cricofaríngeo49-52, la acalasia cricofaríngea mediante miotomía53 y las estenosis posquirúrgicas, posradioterapia y las membranas con dilatación endoscópica. En la actualidad, la miotomía del cricofaríngeo puede realizarse por vía endoscópica, técnica que en manos expertas es segura y eficaz, la cual disminuye la estancia hospitalaria y las complicaciones, y mejora la calidad de vida relacionada con la salud50,52,53.
Cuando no hay causa reconocible o se carece de un tratamiento específico, puede realizarse una miotomía u optar por acciones de rehabilitación de la deglución. La miotomía alivia aproximadamente a la mitad de los pacientes, pero no es posible predecir el resultado de forma individual12,54. Este hecho y la existencia de efectos adversos hacen poco aconsejable la realización de este tipo de tratamiento de forma indiscriminada. En estos casos, lo más apropiado es facilitar la deglución con cambios de la dieta, de la ps son las más eficaces y baratas, y se ha demostrado que disminuyen el riesgo de aspiración de forma significativa43. La tercera pretende incrementar la fuerza de los grupos musculares que participan en la deglución, y no se ha demostrado su eficacia con seguridad. El estudio de las alteraciones de la deglución con videorradiología ayuda a decidir la dieta y la postura más apropiadas. En general, son mejores las dietas de consistencia semisólida con líquidos espesados, tomadas en pequeñas cantidades43.
ALTERACIONES DE LA DEGLUCIÓN DE CAUSA ESOFÁGICA
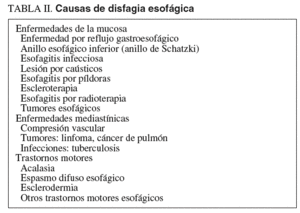
La localización de la disfagia por debajo del hueco supraesternal permite establecer que el paciente padece una disfagia como consecuencia de la alteración de la fase esofágica de la deglución55-58. Los principales retos que plantea la disfagia esofágica son la identificación de su causa (tabla II), imprescindible para poder indicar un tratamiento eficaz y seguro, y el manejo de la nutrición.
La anamnesis y la exploración física permiten realizar un diagnóstico sindrómico de la disfagia esofágica, estableciendo si se trata de una causa orgánica, benigna o maligna, o funcional. Además, posibilitan realizar una aproximación fiable al diagnóstico etiológico en un 80% de los pacientes. Para confirmar con mayor seguridad la causa, suele precisarse la realización de un esofagograma baritado, una endoscopia, una manometría o una pH-metría esofágicas.
Valoración inicial
El primer objetivo en el diagnóstico del paciente con disfagia esofágica es realizar una aproximación a la etiología, estableciendo un diagnóstico sindrómico. En la tabla III se presentan las principales características de la disfagia que permiten establecer su carácter orgánico, maligno o benigno, o funcional55,59.
El paradigma de la disfagia funcional es la acalasia esofágica. La disfagia es paradójica; aparece indistintamente y de forma variable para sólidos y líquidos, de manera que un mismo alimento es deglutido en ocasiones con normalidad y otras veces no; en ello pueden influir las situaciones que provocan estrés. Su localización puede variar en un mismo paciente. Su presentación es intermitente, aunque en pacientes con acalasia en estadios avanzados suele aparecer a diario e incluso en cada comida. La progresión suele ser lenta, en ocasiones trascurren años hasta que el paciente consulta por primera vez. La repercusión sobre el estado general del paciente es nula o escasa durante años, aunque en algunos casos puede provocar una pérdida significativa de peso en estadios avanzados.
El ejemplo más representativo de la disfagia orgánica benigna es la estenosis péptica esofágica. En esta situación se presenta una disfagia lógica, que aparece primero para alimentos sólidos y sólo si persiste durante muchos meses puede aparecer para alimentos blandos o rara vez para líquidos. Su localización es fija y su presentación constante. Progresa en el tiempo con una velocidad intermedia y suele repercutir de forma escasa o moderada en el estado general del paciente.
El carcinoma esofágico es la causa más habitual de disfagia maligna. La dificultad para la deglución aparece primero para sólidos y rápidamente también para alimentos blandos e incluso líquidos. Su localización es fija y su presentación constante. Progresa rápidamente en el tiempo y repercute significativamente en el estado general del paciente, provocando una notable pérdida de peso59,60.
Además de estos ejemplos paradigmáticos de disfagia esofágica, hay otras formas agudas o crónicas con características peculiares. La disfagia vascular o disfagia lusoria, provocada por anomalías cardiovasculares como el aneurisma ventricular o aórtico o las malformaciones vasculares, es constante y fija, aunque no progresa y no repercute en el estado general. Los anillos esofágicos y, en menor medida, la hernia hiatal pueden provocar episodios repetidos de impactación de alimentos sólidos, que en ocasiones requieren su extracción endoscópica. Estos episodios se producen separadamente (semanas, meses o años), entre los cuales el paciente no presenta disfagia55. La esofagitis, en especial de origen infeccioso, y las lesiones por «píldoras» (fármacos), por caústicos y por cuerpos extraños provocan disfagia de instauración brusca y evolución aguda, generalmente acompañada de odinofagia.
Mediante la exploración física es posible verificar cuál es la repercusión de la disfagia en el estado general del paciente. Esta información ayuda en el diagnóstico diferencial.
Valoración etiológica
Con la historia clínica se puede obtener información que permita una aproximación al diagnóstico etiológico; sin embargo, con frecuencia es necesario recurrir a pruebas diagnósticas que confirmen la impresión inicial. Ante la existencia de pirosis y regurgitación ácida de presentación previa o simultánea con la disfagia, debe sospecharse que la causa de ésta es la enfermedad por reflujo gastroesofágico. En esta situación clínica, la alteración de la deglución puede estar causada por la presencia de alteraciones motoras secundarias al reflujo gastroesofágico, por la esofagitis o por la aparición de una estenosis péptica. No es excepcional la ausencia de síntomas de reflujo gastroesofágico en pacientes con estenosis péptica61. Asimismo, es posible que los pacientes previamente tratados por una acalasia, mediante dilatación neumática o cardiomiotomía quirúrgica, presenten una estenosis péptica. También hay cierto riesgo de aparición de un adenocarcinoma esofágico en pacientes con reflujo de larga duración y esófago de Barrett62.
Los antecedentes familiares o personales de neoplasia y los hábitos tóxicos, como el tabaco y el alcohol, incrementan el riesgo de carcinoma esofágico. El tratamiento previo de un carcinoma esofágico debe hacer sospechar una recidiva tumoral, una estenosis posquirúrgica o una lesión por radioterapia.
Debe investigarse la toma de cáusticos o medicamentos, y la ingestión de un cuerpo extraño, especialmente en niños y paciente psiquiátricos63. Debe pensarse en la existencia de una esofagitis por Candida o de etiología viral (citomegalovirus o virus herpes simple) en pacientes inmunodeprimidos a causa del VIH, por una neoplasia o por haber recibido tratamiento con inmunosupresores64,65.
Los pacientes con una conectivopatía o que presentan manifestaciones que puedan sugerir su existencia, como artritis, lesiones cutáneas o fenómeno de Raynaud, pueden padecer un trastorno de la deglución, ya sea por una alteración motora66,67 o por la existencia de reflujo gastroesofágico68. La diabetes mellitus provoca con frecuencia alteraciones motoras del músculo liso esofágico que ocasionalmente pueden provocar disfagia.
En relación con los datos objetivos, el esofagograma aporta una información que puede ser complementaria con la obtenida mediante la endoscopia en la valoración de un paciente con disfagia esofágica. La información que aporta es más útil que la de la endoscopia para la existencia de anillos esofágicos, para valorar las estenosis esofágicas con un diámetro superior a 10 mm y las estenosis infranqueables con el endoscopio, así como en algunos pacientes con acalasia en quienes la endoscopia puede ser normal69-71. Además, permite obtener información útil respecto al calibre y la longitud de las estenosis esofágicas. También posibilita valorar la presencia de una fístula esofágica y descubrir la existencia de una compresión extrínseca.
La videorradiología de la deglución es poco útil en la disfagia esofágica, aunque podría servir como evaluación cualitativa del tránsito esofágico, mientras que la radiografía simple de tórax y la tomografía computarizada (TC) pueden ser útiles en algunos pacientes, en especial en los que presentan dilatación esofágica, y también para realizar la estadificación del cáncer de esófago72.
La realización de una esofagoscopia es necesaria cuando se pretende valorar la mucosa esofágica ante la sospecha de una lesión mucosa, benigna o maligna. Permite tomar muestras para citología, cultivo y estudio anatomopatológico, necesarias para el diagnóstico de esofagitis infecciosa y neoplasias. Además, posibilita el tratamiento mediante dilatación de las estenosis benignas y de la acalasia y la colocación de prótesis para el tratamiento paliativo de las neoplasias.
Mediante la manometría esofágica, se registran alteraciones en pacientes con alteración de la deglución, que son frecuentes también en individuos normales73,74. Para que una alteración motora esofágica pueda considerarse un trastorno motor debe provocar una alteración en el tránsito del bolo o en la percepción visceral esofágica39. Los únicos hallazgos manométricos que poseen un correlato funcional y pueden causar disfagia son la acalasia y, probablemente, el espasmo difuso esofágico. La confirmación de estos diagnósticos precisa la realización de una manometría esofágica. La acalasia se caracteriza por una alteración en la relajación del esfínter esofágico inferior y por la ausencia de ondas peristálticas39. El espasmo esofágico difuso se caracteriza por una alteración en la contracción del cuerpo esofágico39. Además, la manometría esofágica permite diagnosticar otros trastornos motores esofágicos, primarios o secundarios, aunque en general no condiciona un mejor manejo, ya que estas alteraciones carecen de tratamiento eficaz.
La pH-metría esofágica ambulatoria durante 24 h es, junto con la endoscopia, la prueba más útil para el diagnóstico de la enfermedad por reflujo gastroesofágico. Está indicada cuando la endoscopia es normal y en pacientes con síntomas atípicos de reflujo.
Algoritmo diagnóstico en la disfagia esofágica
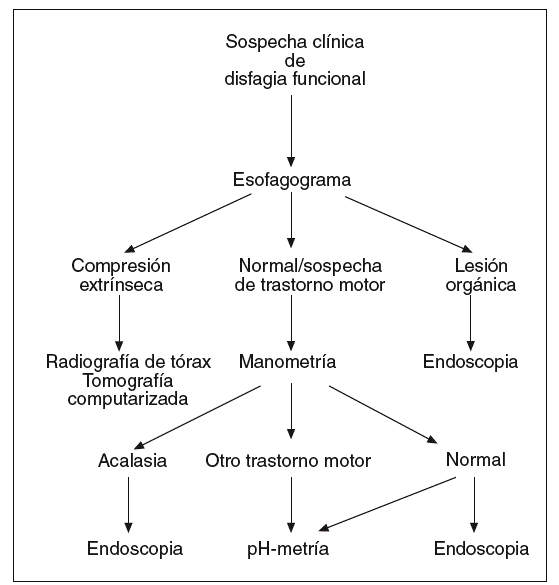
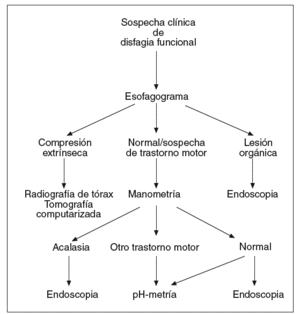
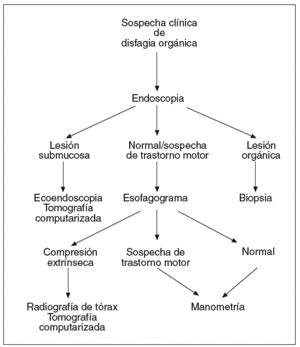
Las pruebas descritas se emplean a menudo en el diagnóstico de pacientes con disfagia esofágica. Su indicación depende de la sospecha clínica inicial. Cuando los síntomas que presenta el paciente sugieren una alteración de la deglución de carácter funcional (fig. 1), la exploración indicada en primer lugar es el esofagograma. Si hay alteraciones compatibles con una lesión orgánica, debe realizarse una endoscopia, y si se observan cambios que sugieren una compresión extrínseca, debe practicarse una radiografía de tórax y/o una TC, y también puede considerarse la ecoendoscopia. Cuando el esofagograma es normal o muestra alteraciones sugerentes de un trastorno motor esofágico, debe realizarse una manometría esofágica. Si el diagnóstico manométrico es una acalasia, debe indicarse una endoscopia para asegurar la ausencia de organicidad. En el caso de haber otras alteraciones motoras, como un patrón de espasmo difuso esofágico, de peristalsis sintomática o alteraciones motoras inespecíficas, debe descartarse la existencia de reflujo gastroesofágico mediante una pH-metría ambulatoria de 24 h. Cuando la manometría es normal puede ser necesario realizar una endoscopia y/o una pH-metría según la evolución clínica del paciente.
Fig. 1. Algoritmo diagnóstico en la disfagia funcional.
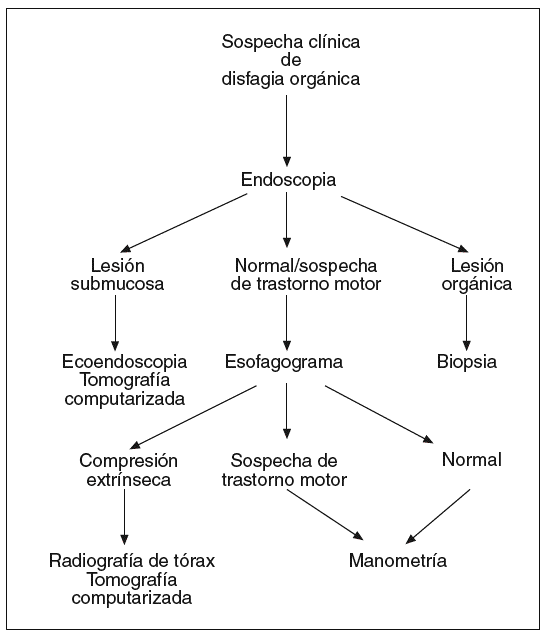
Si clínicamente se sospecha que la disfagia es orgánica (fig. 2) se iniciará el estudio con una endoscopia. Si se confirma la existencia de una lesión orgánica, ésta debe ser biopsiada para conocer su naturaleza. Si se observa una lesión submucosa, la toma de biopsias endoscópicas no suele ser útil para obtener tejido de la lesión, por lo que debe realizarse una ecoendoscopia y/o una TC. Cuando la exploración endoscópica es normal o muestra alteraciones sugerentes de un trastorno motor, un esofagograma puede aportar información adicional con utilidad clínica, aunque generalmente deberá complementarse con la realización de una manometría para evaluar la actividad motora esofágica. El esofagograma puede sugerir la existencia de una compresión esofágica extrínseca. Su naturaleza debe evaluarse mediante una radiografía simple de tórax y una TC si se considera necesario.
Fig. 2. Algoritmo diagnóstico en la disfagia orgánica.
Decisión del tratamiento
La primera decisión terapéutica debe ser garantizar la adecuada nutrición del paciente y evitar la aparición de complicaciones relacionadas con la ingesta, en particular la aspiración pulmonar y la impactación esofágica. A veces sólo es necesario suprimir la ingesta de alimentos sólidos, pero en casos extremos se requiere anular todo tipo de ingesta oral e indicar una nutrición artificial en tanto se da solución al cuadro clínico, ya sea mediante la aplicación de tratamiento efectivo, o por la instauración de medidas terapéuticas paliativas.
En ocasiones, se alcanza un diagnóstico etiológico para el que existe un tratamiento específico y eficaz. Éste es el caso de la estenosis péptica (dilataciones y tratamiento antirreflujo), la acalasia (dilatación endoscópica, cardiomiotomía), la esofagitis infecciosa, etc. En otros casos, sólo es posible un tratamiento paliativo que permita la nutrición del paciente.
SOPORTE NUTRICIONAL EN EL PACIENTE CON TRASTORNO DE LA DEGLUCIÓN
En general, en pacientes que precisan soporte nutricional, siempre que sea posible, se prefiere el uso de la nutrición enteral a la parenteral, porque tiene muchas ventajas: está asociada a un menor número de complicaciones, proporciona determinados nutrientes que no están disponibles en los preparados de nutrición parenteral y no se excluye la presencia de nutrientes en la luz intestinal, lo que permite mantener la integridad estructural y funcional del tracto gastrointestinal.
La nutrición enteral puede administrarse por vía oral o a través de sondas colocadas en el tracto digestivo; las más empleadas son las sondas nasogástricas y las sondas de gastrostomía percutánea. La elección de una u otra está directamente relacionada con diferentes factores, entre los que se incluyen el pronóstico clínico, el tiempo que se estima necesaria la nutrición enteral, la enfermedad de base, el riesgo de aspiración y las preferencias del paciente. Como norma general, en los pacientes que van a requerir nutrición enteral por sonda durante un período breve (menor de 4 semanas), se aconseja la colocación de una sonda nasogástrica blanda y fina, mientras que la gastrostomía se reserva para cuando la necesidad de soporte nutricional se prevea que vaya a ser más prolongado en el tiempo. Si bien la colocación de las sondas nasogástricas de nutrición es sencilla, sin necesidad de grandes medios (aunque en ocasiones se requiere su colocación asistida por endoscopia), la gastrostomía percutánea requiere un abordaje endoscópico, radiológico o quirúrgico.
Habitualmente, las sondas nasogástricas son peor toleradas que las de gastrostomía y tienen el inconveniente de que requieren un recambio con frecuencia. Aunque la morbimortalidad relacionada con su colocación es muy baja, su posicionamiento inadvertido en la vía área es un problema que puede tener consecuencias graves. Por el contrario, las sondas de gastrostomía son mejor aceptadas por el paciente desde el punto de vista estético y, salvo que ocurra alguna complicación, no requieren recambio en varios meses. Las complicaciones menores (desplazamiento de la sonda, infección cutánea leve y obstrucción de la sonda) son relativamente frecuentes (8%), mientras que las complicaciones mayores (hemorragia gástrica, infección de la pared abdominal, peritonitis y fístula gástrica) son infrecuentes (1%). La mortalidad relacionada con el procedimiento se ha estimado en el 0,5%75. Un metaanálisis de 7 estudios constató que la administración de una dosis única intravenosa de un antibiótico de amplio espectro es efectiva en la reducción de infecciones locales relacionadas con este procedimiento76.
Por último, las complicaciones relacionadas con ambas modalidades de nutrición enteral incluyen causas mecánicas (secundarias a la descolocación de la sonda, intubación del árbol traqueobronquial, traumatismo directo sobre las mucosas u obstrucción de la sonda), metabólicas (por alteraciones hidroelectrolíticas) y digestivas (náuseas, vómitos, dolor abdominal y diarrea).