INTRODUCCIÓN
Durante años se ha utilizado el término de osteodistrofia hepática para definir la enfermedad metabólica ósea que aparecía como consecuencia de la hepatopatía crónica avanzada y que, en general, se consideraba era una osteomalacia, es decir, una falta de mineralización ósea debida a la malabsorción intestinal de calcio y vitamina D.
La medición de la masa ósea mediante densitometría, aparecida en los últimos 20 años, y el perfeccionamiento de los métodos de análisis de la biopsia ósea han sido los elementos esenciales que han permitido concretar que la alteración ósea que presentan los pacientes hepatópatas es una osteoporosis. Esta enfermedad se caracteriza por la disminución de la masa ósea y la alteración de su microarquitectura que da lugar a una reducción de la calidad y resistencia del hueso y, en consecuencia, un aumento del riesgo de presentar fracturas por fragilidad, especialmente en la columna vertebral, cadera y muñeca1. Según la Organización Mundial de la Salud2, hay osteoporosis cuando la densidad mineral ósea es inferior a 2,5 desviaciones estándar de la observada en el adulto joven (escala T < 2-5), y hay osteopenia cuando la escala T se sitúa entre 1 y 2,5.
Tradicionalmente, en hepatología la osteoporosis se había tenido en cuenta casi exclusivamente en las enfermedades colestásicas crónicas tales como la cirrosis biliar primaria. La extensa aplicación del trasplante hepático ha renovado el interés por la patología ósea debido a la elevada incidencia de fracturas óseas después del trasplante, lo cual representa una elevada tasa de morbilidad y menor calidad de vida. Esta revisión compendia los conocimientos actuales sobre patología ósea en las enfermedades hepáticas, con especial referencia al tratamiento.
PREVALENCIA DE OSTEOPOROSIS Y FRACTURAS ANTES Y DESPUÉS DEL TRASPLANTE HEPÁTICO
Existe una cierta heterogeneidad en los datos publicados respecto a la prevalencia de osteopenia y osteoporosis en los pacientes hepatópatas crónicos que depende, en parte, de la selección de los pacientes y de los criterios diagnósticos3-22. En relación con la selección, es importante considerar si se trata de pacientes con una enfermedad muy avanzada o si tienen una colestasis crónica, que son los casos con mayor prevalencia. De forma global puede afirmarse, sin embargo, que aproximadamente el 23% de los pacientes hepatópatas tienen osteoporosis, y que esta incidencia es más elevada en los pacientes con colestasis crónicas (alrededor del 32%), que tienen 2 factores adicionales que implican un mayor riesgo: la colestasis y su presentación en mujeres de mediana edad8,9,15,18-21. Asimismo, en estos pacientes también se ha observado una mayor pérdida de masa ósea de la esperada en el transcurso de los años, particularmente cuando presentan una colestasis más pronunciada19,23.
También se ha descrito una amplia variación en la prevalencia de fracturas que oscila entre el 3 y el 44%3,5,7,8,10,12,16,19,21,24-27. Esta variabilidad depende del procedimiento utilizado para establecer el diagnóstico, pero también de la gravedad de la disfunción hepática, de la densidad ósea y del sexo. Así, en la hepatopatía crónica la prevalencia de fracturas es mayor en las mujeres posmenopáusicas (67%) que en los varones (15%) y que en las mujeres jóvenes (entre el 6 y el 14%)5. Asimismo puede influir el tratamiento, particularmente la administración de glucocorticoides de forma continuada, que explicaría una elevada prevalencia de fracturas (44%) en pacientes con hepatitis autoinmunitaria26. Existen pocos datos sobre la incidencia de fracturas en el curso de la enfermedad hepática. En pacientes con cirrosis biliar primaria, se ha comunicado una tasa que oscila entre el 5%8 y el 13%27.
El trasplante hepático es un factor importante y determinante de una mayor pérdida de masa ósea y aparición de fracturas. Se ha calculado que el 20% de los pacientes tienen una notable reducción de la masa ósea y que aproximadamente la tercera parte tiene osteoporosis en el momento del trasplante o en los casos con enfermedad terminal (entre el 24 y el 37%)28-37. En general, hay una menor afección del fémur y del antebrazo distal que de la columna lumbar.
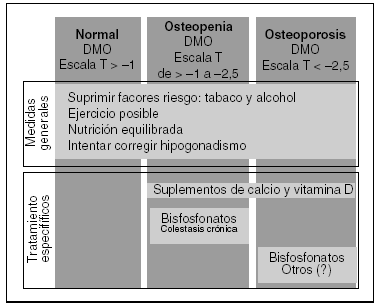
Fig. 1. Esquema de profilaxis y tratamiento de la osteoporosis en las enfermedades hepáticas. DMO: densidad mineral ósea.
La mayoría de los pacientes pierden masa ósea de una forma rápida durante el primer semestre después del trasplante23,33,38-43. La cantidad es muy variable. En un estudio que incluyó a 45 pacientes trasplantados seguidos durante 3 años, la tasa de pérdida de masa ósea lumbar fue del 6% a los 3 meses43. Después de esta pérdida inicial, hay una tendencia a mejorar la densidad ósea coincidiendo con la recuperación de la función hepática y la disminución del tratamiento inmunodepresor, en particular de los glucocorticoides. La mayor incidencia de fracturas aparece en el curso del primer año, cuando se observan en el 25-35% de los casos23,29,30,34,36,39-41,43-53. Las fracturas son más frecuentes en mujeres36,46 y pacientes de mayor edad32,36,39,53, con colestasis crónica36,39,40,46 o etiología alcohólica, y especialmente en los casos con osteoporosis y con fractura antes del trasplante46,52.
En los últimos años se ha observado una disminución de la incidencia de fracturas tras el trasplante54. Esta importante reducción se podría explicar en parte por los cambios en el tratamiento inmunodepresor y, básicamente, por la drástica disminución de la dosis de glucocorticoides. Sin embargo, también puede influir el hecho de que los pacientes se trasplantan en mejores condiciones y que proporcionalmente se trasplantan menos pacientes con colestasis crónicas, que son los que tienen una peor masa ósea antes del trasplante.
PATOGENIA DE LA OSTEOPOROSIS EN LAS ENFERMEDADES HEPÁTICAS
La cantidad de masa ósea depende del equilibrio entre 2 procesos opuestos: la formación ósea inducida por los osteoblastos, y la resorción ósea originada por los osteoclastos. En consecuencia, la pérdida de masa ósea se produce cuando hay un equilibrio negativo, en el sentido de que la cantidad de hueso resorbido supera al formado55. Varios estudios han propuesto que la anomalía inicial para el desarrollo de osteoporosis en las enfermedades hepáticas es la disminución de la formación ósea, mientras que otros han hallado una formación normal pero una resorción aumentada56. Existen datos histomorfométricos, avalados por las bajas concentraciones circulantes de osteocalcina (marcador de formación ósea)8,57, que ratifican la hipótesis de una disminución de la formación ósea24 como el factor crítico para la presencia de osteoporosis. Asimismo hay datos experimentales que avalan la hipótesis de esta baja formación, ya que la bilirrubina altera la capacidad proliferativa de los osteoblastos de una forma dependiente de la dosis58. Por otra parte, existen evidencias sobre el efecto nocivo del alcohol sobre la formación ósea, ya que la osteocalcina, que está reducida durante el consumo de alcohol, se normaliza tras la abstinencia59. Los pacientes cirróticos tienen una disminución del factor de crecimiento de la insulina13, y se ha observado que este factor trófico aumenta la densidad ósea en ratas60. Además debe tenerse en cuenta la acción propia de la enfermedad hepática, con las deficiencias nutricionales que comporta, así como con la coexistencia de hipogonadismo y el depósito de hierro en la hemocromatosis61 que puede afectar la formación ósea y producir osteoporosis.
A pesar de los datos sobre la baja formación, también hay estudios que han hallado un aumento de la resorción ósea en las enfermedades hepáticas, y se ha planteado que esta mayor resorción sería la causa de la osteoporosis62,63. Sin embargo, debe señalarse que estas observaciones se han realizado generalmente en mujeres posmenopáusicas y, en general, con una enfermedad hepática muy avanzada, en quienes la carencia evidente o subclínica de calcio y vitamina D podría provocar un hiperparatiroidismo secundario que sería el responsable del aumento del recambio óseo.
Existen otros factores que pueden contribuir a la presencia de osteoporosis en las enfermedades hepáticas. Algunos de ellos son controvertidos, como la predisposición genética determinada por polimorfismos del gen del receptor de la vitamina D18,19 o de la cadena alfa-1 del colágeno tipo I. En este sentido, se han publicado resultados contradictorios respecto al gen del receptor de la vitamina D18,19, aunque el polimorfismo Sp1 del colágeno se ha asociado con un pico menor (nivel máximo) de masa ósea en los pacientes con cirrosis biliar primaria19.
El efecto de algunos tratamientos también debe tenerse en cuenta tanto antes como después del trasplante. En este sentido, y particularmente en los pacientes trasplantados, la administración de glucocorticoides64, ciclosporina o tacrolimus es un factor muy importante que contribuye a la mayor pérdida de masa ósea o retrasa su recuperación. Así, se ha observado que el tratamiento con ciclosporina retrasa la pérdida de masa ósea en pacientes con cirrosis biliar8. El papel de la ciclosporina y de otros inhibidores de la calcineurina sobre la masa ósea en los pacientes trasplantados no está bien definido, pero hay datos experimentales que apoyarían un efecto nocivo relacionado con la pérdida de masa ósea65.
Según los cambios evolutivos de la densitometría, la tasa de fracturas y los resultados analíticos después de un trasplante ya sea hepático, de pulmón o cardíaco, parece claro que los mecanismos implicados en la patogenia de la osteopenia postrasplante son similares. Así, habría 2 fases, una que acontecería inmediatamente después del trasplante y otra a largo plazo. En la primera fase después del trasplante, en el curso de los primeros meses, hay un notable aumento del recambio óseo66, que se observa tanto en el análisis histomorfométrico de la biopsia ósea como por el aumento de los marcadores de resorción que supera al aumento de los de formación31. Además, durante este período hay una tendencia a normalizar las alteraciones del metabolismo mineral provocadas por la enfermedad hepática y la disfunción gonadal, y una recuperación de las concentraciones de 25-hidroxivitamina D43. Visto de forma conjunta, el período inicial postrasplante, de rápida pérdida de masa ósea y elevada tasa de nuevas fracturas, se asocia con un alto recambio óseo y una resorción que sobrepasa la formación ósea. La normalización de la función hepática y el efecto asociado a las dosis altas de glucocorticoides junto a los efectos sistémicos de la ciclosporina A o del tacrolimus son consistentes con la descripción de la evolución de la masa ósea durante el período inicial postrasplante67.
Seis meses después del trasplante se observa un aumento tanto de los parámetros histológicos como de los marcadores bioquímicos de formación31,43. En este momento ha cesado la pérdida de masa ósea en la zona lumbar y empieza a aumentar de forma espontánea. Por otra parte, se observa un aumento de las concentraciones de paratirina que se correlaciona con las de creatinina, y hay un aumento de la osteocalcina sérica43. Estos efectos se observan en los pacientes tratados con ciclosporina en combinación o no con corticoides. Este hiperparatiroidismo secundario, probablemente relacionado con alteraciones de la función renal, puede contribuir a la alteración del remodelado óseo especialmente con un efecto más notable en el hueso cortical, y por tanto en el fémur proximal, en el segundo período del trasplante43. La normalización de la función hepática y la reducción gradual de los corticoides, que produce un aumento de la formación ósea, así como el hiperparatiroidismo secundario relacionado con la ciclosporina, explicarían esta segunda fase en la patología ósea del postrasplante.
TRATAMIENTO DE LA ENFERMEDAD ÓSEA
Antes de considerar cualquier tipo de tratamiento es necesario evaluar de forma cuidadosa la presencia e intensidad de osteopenia u osteoporosis en los pacientes candidatos a trasplante, y discernir si existen factores de riesgo para una mayor pérdida de masa ósea o para fracturas postrasplante. En el momento actual se considera que se debe medir la densidad mineral ósea lumbar y femoral en los pacientes con hepatopatía crónica que tienen antecedentes de fracturas por fragilidad, cuando se trata de mujeres posmenopáusicas, si han recibido glucocorticoides durante más de 3 meses, cuando padecen una cirrosis biliar primaria y antes de incluirlos en la lista de trasplante hepático68 (tabla I).
Como medidas adicionales se debe hacer una radiografía de la columna dorsal y lumbar en proyección de perfil para descartar la existencia de fracturas. Además deben medirse las concentraciones séricas de calcio y fósforo sérico, así como los valores de 25-hidroxivitamina D, paratirina y testosterona (en los varones).
Medidas generales
Antes del trasplante es conveniente reducir al máximo, y dentro de lo posible, los factores que contribuyen a la pérdida de masa ósea. La dosis de glucocorticoides, si se está recibiendo este tratamiento, debe ajustarse a la mínima necesaria69. También se aconseja la mayor actividad física posible y ejercicios dirigidos a mejorar la mecánica de la columna vertebral.
Se debe prescribir una dieta equilibrada, dentro de lo posible, ya que en muchas ocasiones son pacientes con enfermedad avanzada y están inapetentes y desnutridos. En cualquier caso se deben aportar suplementos de calcio (1.000-1.500 mg/día) y de vitamina D (260 μg de 25-hidroxivitamina D cada 2 semanas), o la dosis necesaria para mantener valores normales de esta vitamina. Debe tenerse especial precaución en pacientes que reciben resinas como la colestiramina, ya que su administración puede reducir la absorción intestinal de vitamina D70.
Después del trasplante es conveniente reducir al máximo posible la dosis de glucocorticoides e inmunodepresores, y debe seguirse con las mismas medidas generales, incluido el aporte de calcio y vitamina D.
A pesar de estas recomendaciones, no existen resultados concluyentes respecto a la eficacia de los suplementos de calcio y vitamina D en los pacientes trasplantados. En un estudio no aleatorizado, sin embargo, se ha publicado que el tratamiento con calcitriol (0,25 o 0,50 μg/día), asociado o no a calcio, reduciría la pérdida ósea y la incidencia de fracturas71. También se ha señalado que la administración de calcidiol (0,5 a 1 μg/día) aumentaría la densidad ósea lumbar72. Sin embargo, otros estudios no han podido confirmar estos datos, incluso cuando el suplemento del calcidiol y calcio se acompaña de la administración de un bisfosfonato como el etidronato48.
Tratamiento hormonal sustitutivo
Existe muy poca información sobre la conveniencia de administrar tratamiento hormonal a pacientes con una enfermedad hepática avanzada. De hecho, durante muchos años se había considerado que la administración de estrógenos podría estar contraindicada en este tipo de pacientes. Sin embargo, en la actualidad existen datos que indican que este tratamiento no produce efectos adversos relevantes en relación con la enfermedad hepática, y que es suficiente para prevenir la pérdida o incluso aumentar la densidad mineral ósea en pacientes con cirrosis biliar primaria73,74 o cirrosis autoinmunitaria. En varones con hemocromatosis e hipogonadismo también se ha observado la eficacia del suplemento con testosterona75.
En pacientes trasplantados solamente se ha publicado un estudio que ha analizado la eficacia y seguridad del tratamiento hormonal a corto plazo. En este estudio se administraron 50 μg/día de estradiol por vía transdérmica a 33 pacientes posmenopáusicas. Se observó un aumento del 5% en la densidad ósea lumbar y del 3% en el cuello de fémur, así como un descenso del 47% en las concentraciones séricas de un marcador de formación ósea35. La interpretación de los datos es, no obstante, comprometida, dado que algunos pacientes recibieron simultáneamente calcio y vitamina D, y que únicamente 3 de los 7 pacientes del grupo control completaron los 2 años de tratamiento.
A pesar de estos resultados, actualmente la administración de hormonas no sería el tratamiento más adecuado, si se tiene en cuenta que para tratar la osteoporosis asociada a otras enfermedades parece más oportuno utilizar otros procedimientos que no tienen el riesgo que entraña el tratamiento hormonal.
Fluoruro sódico
Este fármaco aumenta la formación ósea y se ha utilizado en ciertas formas de osteoporosis, aunque en los últimos años se ha visto sobrepasado por los agentes antirresortivos. En enfermedades hepáticas la administración de fluoruro sódico previene la pérdida de masa ósea76, pero con una menor eficacia que el etidronato sódico77. También se ha empleado, a dosis bajas, en combinación con calcitriol y calcio a los 6 meses del trasplante hepático, momento en que se observó que se conseguían efectos mejores sobre la recuperación de la masa ósea que cuando se utilizaron únicamente suplementos de calcio y vitamina D71. En ninguno de los estudios se pudo demostrar la eficacia del fluoruro sódico para impedir las fracturas, quizá por el reducido número de casos incluidos en cada ensayo.
Calcitonina
El efecto de la calcitonina, un agente antirresortivo, en los pacientes hepatópatas es poco claro. En un estudio piloto realizado en 11 pacientes con cirrosis biliar primaria se observó que la administración combinada de calcitonina, calcio y vitamina D durante 12 meses se asociaba a una menor pérdida de masa ósea que en los pacientes no tratados78. El mismo grupo publicó que estos efectos a largo plazo eran más favorables en los pacientes con osteopenia79. Sin embargo, otros estudios han aportado resultados negativos, ya que la administración de calcitonina durante 6 meses fue incapaz de impedir la pérdida de hueso trabecular, si bien debe tenerse en cuenta que eran pacientes con intensa osteoporosis y con un período de tratamiento muy corto80.
En un estudio aletorizado efectuado en pacientes trasplantados se observó que la administración intramuscular de 40 UI/día de calcitonina durante un año se asociaba a un aumento significativo de la densidad mineral ósea, en comparación con el grupo que no recibió calcitonina28. En el grupo tratado el aumento de la densidad ósea lumbar y femoral fue del 6,4 y el 8,3%, respectivamente. Sin embargo, el efecto de la calcitonina a la hora de evitar fracturas no fue tan claro en otro estudio de 6 meses de duración en el cual este fármaco no fue eficaz para prevenir o reducir la pérdida de masa ósea y de fracturas espontáneas durante el primer año después del trasplante en pacientes con masa ósea basal baja (escala Z < 2)41.
Bisfosfonatos
Los bisfosfonatos son fármacos antirresortivos que aumentan la masa ósea y reducen la incidencia de fracturas en la osteoporosis posmenopáusica. En las enfermedades hepáticas existen datos poco concluyentes, básicamente por el escaso número de estudios y los pocos pacientes tratados27,77,81. Se ha demostrado, no obstante, que el etidronato administrado de forma cíclica es capaz de prevenir la pérdida de masa ósea a los 2 años de tratamiento, y que el alendronato aumenta la masa ósea en la cirrosis biliar primaria, de forma parecida a la que acontece en osteoporosis de otras etiologías82. Parece razonable, por tanto, la administración de estos fármacos en los pacientes osteoporóticos, antes del trasplante, si bien no hay datos sobre su efecto en la reducción del riesgo de fractura.
En los pacientes con enfermedad hepática crónica terminal se ha evaluado, antes y después del trasplante, la eficacia del pamidronato49,83,84, un bisfosfonato que se administra por vía parenteral y que tiene una marcada capacidad antirresortiva. Los 3 estudios publicados aportan resultados contradictorios respecto a la eficacia de este agente sobre la pérdida de masa ósea y la reducción de la tasa de fracturas. En el primer estudio, que incluyó a 13 pacientes con osteopenia, la administración de pamidronato disódico cada 3 meses antes del trasplante y durante 9 meses después de éste mostró una cierta disminución de la incidencia de fracturas respecto a un grupo no tratado49. En un segundo estudio se compararon los efectos de 30 mg de pamidronato disódico cada 3 meses además de calcio (1 g/día) y vitamina D (1.000 UI/día) durante 2 años, frente a un grupo retrospectivo sin pamidronato. Se observó un aumento significativo de la densidad ósea lumbar y femoral a los 2 años de tratamiento, si bien debe tenerse en cuenta que hubo un período de tiempo muy largo entre el trasplante y el tratamiento (mediana de 2-3 años)84. Un tercer estudio, que incluyó a 99 pacientes trasplantados que recibieron de forma aleatoria, antes del trasplante, 60 mg de pamidronato o fueron controles, no demostró un efecto favorable de este bisfosfonato sobre la densidad mineral ósea ni en la tasa de nuevas fracturas83. Un dato curioso de este estudio fue la ausencia de pérdida de masa ósea lumbar y una baja tasa de nuevas fracturas (8%) en el grupo no tratado, así como una clara disminución de la densidad ósea femoral que no se evitó con el pamidronato. Estos estudios con pamidronato han incluido a pocos pacientes o bien no han sido diseñados de forma oportuna para detectar la pérdida de masa ósea y la capacidad de reducir el riesgo de nuevas fracturas, por lo cual se requiere un estudio con un método y diseño adecuados para contestar estas preguntas.
CONCLUSIONES
La osteoporosis es una complicación que presentan frecuentemente los pacientes con enfermedad hepática crónica, especialmente en fase terminal y cuando hay una colestasis crónica. El problema es todavía más importante en los pacientes trasplantados, cuando se acelera el proceso de pérdida de masa ósea en el período inmediato al trasplante, lo que comporta una mayor incidencia de fracturas. En la patogenia de la osteoporosis se implica fundamentalmente un bajo nivel de formación ósea que se asocia con la gravedad de la enfermedad, la edad y, en ciertas etiologías, con la duración e intensidad de la colestasis. También se ha descrito un componente de aumento de la resorción ósea, especialmente en las mujeres con colestasis y en fases avanzadas de la enfermedad. En la osteoporosis postrasplante existen 2 fases: la inicial, particularmente relacionada con el tratamiento con glucocorticoides, y una tardía en la que intervienen los inhibidores de la calcineurina.
Para la prevención y el tratamiento de la osteoporosis se aconseja un buen aporte nutricional, suprimir los factores de riesgo de osteoporosis y administrar suplementos de calcio y vitamina D. Como medidas profilácticas se ha postulado el tratamiento hormonal, aunque en la actualidad esta indicación es discutible, incluso en pacientes no hepatópatas, por los efectos adversos de las hormonas. No existe un tratamiento específico de la osteoporosis, si bien se ha demostrado que los bisfosfonatos, especialmente el alendronato, son eficaces para aumentar la masa ósea en pacientes con colestasis crónica. Su utilización en pacientes trasplantados no está todavía suficientemente comprobada. El reducido número de pacientes incluidos en los ensayos terapéuticos ha sido un factor determinante para no poder demostrar la eficacia en la disminución de la incidencia de fracturas. En los pacientes trasplantados es capital mantener la dosis de los fármacos inmunodepresores al mínimo imprescindible.
Financiado en parte por el Instituto de Salud Carlos III (C03/02 y C03/08).