JUSTIFICACIÓN DEL SPLIT HEPÁTICO
PARA 2 ADULTOS
El trasplante hepático split es un procedimiento quirúrgico por el cual un hígado donante se divide en 2 partes a fin de obtener 2 injertos para 2 receptores. Conceptualmente procede de las técnicas de reducción hepática y se desarrolló inicialmente como un método para incrementar el número de injertos hepáticos disponibles, en especial para la población pediátrica1. En el caso del trasplante pediátrico su utilización ha ayudado claramente a resolver los problemas de la escasez de donantes2. Sin embargo, la utilización del split para 2 adultos, realizado por primera vez por Bismuth en 1989, tiene aún poco desarrollo3. Recientemente, de la mano de los avances técnicos, sobre todo por la experiencia acumulada del trasplante hepático de donante vivo, y sobre la base de la consideración anatómica de que el hígado es un órgano doble (2 hemihígados con 2 sistemas vasculobiliares), se ha potenciado la idea de utilizarlo para aumentar el número de órganos para adultos mediante la obtención de 2 injertos de un solo hígado.
España es el país del mundo con la tasa de trasplante hepático por 1.000.000 de habitantes más elevada del mundo. Probablemente por este motivo la bipartición del hígado se encuentra actualmente poco desarrollada. Sin embargo, esta técnica en España también estaría justificada por la escasez relativa de donantes parece que hemos llegado al techo de donantes que podríamos obtener y por el aumento progresivo de la mortalidad en lista de espera (8-15%)4,5. Así, en los últimos años se están alcanzando tasas de donación por 1.000.000 de habitantes en torno al 30-34%, mientras que las indicaciones del trasplante hepático están en continuo aumento. Por ello, se van buscando nuevas fuentes de órganos para trasplante, entre las que destacan el donante subóptimo, el donante vivo, el donante dominó y el donante en asistolia, independientemente de las líneas de investigación en xenotrasplante y células madre. La implantación extendida del split supondría, al menos en teoría, poder incrementar el número de hígados para trasplantar, pues de cada donante podríamos sacar 2 hemihígados y trasplantar a 2 receptores. Según las estimaciones, se podría conseguir un aumento teórico de un 8 a un 20% de injertos, lo que reduciría la mortalidad actual en lista de espera6-8.
¿POR QUÉ NO SE HA DESARROLLADO EL SPLIT PARA 2 ADULTOS?
Existen 2 hechos que justifican que el split hepático para 2 adultos no se haya generalizado como procedimiento terapéutico dentro del trasplante hepático. El primero es que los resultados iniciales con esta técnica fueron decepcionantes, con una tasa elevada de complicaciones y mortalidad respecto al trasplante de órgano completo. Ello era debido, entre otros factores, a una inadecuada selección tanto del donante como del receptor, así como a diversos problemas técnicos9-11. Además, y no menos importante, se trata de una terapéutica muy exigente desde el punto de vista organizativo y logístico, que pocos centros están en condiciones de ofrecer.
Para obtener buenos resultados es fundamental conseguir los siguientes objetivos:
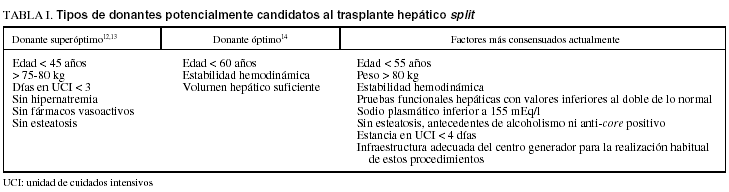
1. Adecuada selección del donante (tabla I). La experiencia existente en el trasplante hepático de órgano completo ha permitido analizar los factores del donante que son predictivos para el éxito del trasplante. De acuerdo con ellos, sólo se deberían aceptar para realizar un split hígados de donantes óptimos o muy óptimos. Para considerarlos como tales deben concurrir en ellos los factores que a continuación se explican.
Entre los factores del donante cabe destacar: a) edad inferior a 50-55 años15,16; b) peso mayor de 70 kg, pero con un índice de masa corporal menor de 30 kg/m2; c) las pruebas funcionales hepáticas deben presentar valores, como mucho, inferiores al doble de lo normal, y debe descartase la esteatosis hepática, ya que ésta incrementa el daño de isquemia-reperfusión y empeora significativamente la supervivencia del injerto y del paciente en el trasplante hepático17,18. Además, en estudios experimentales se ha demostrado que la esteatosis hepática altera la regeneración hepática19, y este hecho puede tener mayor importancia en el caso del trasplante hepático segmentario por la técnica de split; d) la estancia en la unidad de cuidados intensivos debe ser inferior a 3-4 días, ya que se ha demostrado que una estancia prolongada se asocia a una mayor tasa de disfunción del injerto20; e) los donantes deberían estar hemodinámicamente estables y carecer de antecedentes de parada cardíaca o episodios de hipotensión graves. Esto es importante porque el flujo hepático desciende con los períodos de hipotensión y la utilización de altas dosis de vasopresores predispone a la lesión isquémica hepática21,22, y f) el sodio plasmático será inferior a 150-155 mmol/l, pues su elevación suele ser consecuencia de la excesiva estancia en la unidad de cuidados intensivos, la excesiva infusión de sueros salinos, de un balance negativo excesivo en el tratamiento agresivo del edema cerebral o de una secreción inadecuada de hormona antidiurética. Existen varios estudios que correlacionan una hipernatremia mayor de 155 mmol/l con una mayor tasa de pérdida de injertos23.
Entre los factores relacionados con el injerto hepático destacan 2: a) masa o volumen hepático. La mínima masa hepática del injerto debe cumplir con la ratio peso del injerto/peso del receptor igual o mayor del 1% y un volumen estándar del hígado en torno al 40-50%24, y b) aspectos relacionados con la anatomía vasculobiliar intrahepática. El injerto hepático segmentario exige una adecuada perfusión arterial y portal, así como un correcto drenaje venoso de todo el injerto y un perfecto drenaje biliar de todo el territorio del segmento del órgano implantado25. Las técnicas de imagen como la tomografía axial computarizada y la resonancia magnética nuclear ofrecen imágenes magníficas de la vascularización hepática y anatomía biliar, que permiten establecer la factibilidad de la bipartición hepática del donante26. Este tipo de estudio diagnóstico es muy útil en el caso del donante vivo, pero en el donante split plantea serios problemas logísticos, por lo que, de manera generalizada, se emplea la evaluación con la ecografía hepática intraoperatoria y la colangiografía intraoperatoria27.
Aunque hay un consenso generalizado en la utilización de criterios muy restrictivos de calidad del donante, no existen estudios con series largas que lo confirmen. En este sentido, algunos autores ya defienden, una vez pasado el período de aprendizaje, la utilización de criterios del donante más amplios (edad mayor de 50 años, parada cardíaca mínima, etc.) con obtención de buenos resultados28, lo cual indica que poco a poco estos criterios de selección no serán tan restrictivos en un futuro inmediato.
2. Adecuada selección del receptor. Deben seleccionarse receptores estables, con función hepática buena o aceptable (Child-Pugh A o B; MELD 15-25), sin hipertensión portal grave ni trombosis portal y en los que no se prevea una hepatectomía complicada. Además, no deberían presentar enfermedad asociada grave (hipertensión pulmonar, síndrome hepatopulmonar, etc.). En este sentido, los receptores ideales serían los hepatocarcinomas sobre cirrosis en estadio Child-Pugh A o B o las enfermedades metabólicas.
El porcentaje de peso del hígado frente al peso corporal debe ser mayor de 0,8-1. Esto se debe a que un índice inferior implica un riesgo alto de desarrollar una insuficiencia hepática postrasplante29. Así, se requerirían receptores para el lóbulo derecho con pesos no superiores a 65 y 70 kg y para el lóbulo izquierdo no superiores a 55 kg. Si tomamos como ejemplo un donante joven de 75 kg de peso con un hígado de 1.200 g, su hígado derecho (aproximadamente un 60% del total: 720 ml) permitiría un receptor de 72 kg, y el hígado izquierdo (40% del global: 480 ml), uno de 48 kg. Como norma general, y asumiendo que un donante de 70-80 kg tiene aproximadamente 900 ml de parénquima hepático derecho y 600 ml de parénquima izquierdo, el injerto derecho debería utilizarse para un receptor de no más de 85 kg, y el segundo para un receptor de menos de 55 kg, a fin de tener seguridad de una función hepática correcta en el postoperatorio12,28,30.
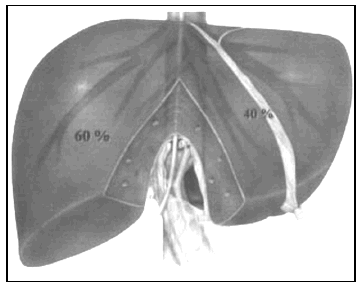
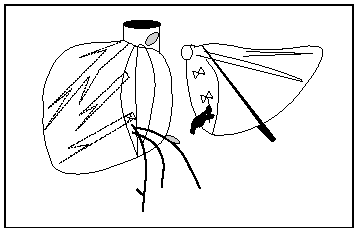
3. Experiencia en la técnica quirúrgica. Si se quiere obtener buenos resultados es fundamental que el equipo tenga experiencia contrastada en cirugía hepática y/o en trasplante hepático de donante vivo13. Además, resulta imprescindible disponer de ecografía intraoperatoria y de colangiografía, pues son decisivas para una adecuada bipartición que facilite el implante de ambos injertos. La división de los ejes vasculares es un punto crítico para el resultado funcional y existen múltiples variantes técnicas. En los últimos años se ha impuesto la técnica de división en la que la porta principal y la vía biliar común se quedan con el injerto derecho y, por el contrario, el tronco celíaco del donante va con el hígado izquierdo. La vena hepática media permanecerá con el injerto izquierdo, al que también se le adjudicará el segmento IV (fig. 1). La cava, si se preserva intacta, permanece con el injerto izquierdo31. Las variantes de la vía biliar afectan fundamentalmente a la vía biliar derecha y son fáciles de reconocer mediante la colangiografía32. La tendencia es dejar la vía biliar principal con el injerto derecho debido a los problemas iniciales de isquemia biliar cuando se dejaba la vía con el injerto izquierdo33 (fig. 2). Realmente la anatomía desempeña un discreto papel a la hora de contraindicar la partición de un hígado de cadáver, pues la mayoría de las variantes anatómicas son fáciles de solucionar sin comprometer la calidad de ambos injertos ni los resultados postoperatorios34. Por lo tanto, casi la totalidad de los injertos hepáticos son divisibles desde el punto de vista anatómico y son otras consideraciones, tanto del donante y del receptor como logísticas, las que realmente impiden la expansión de esta técnica, ideada para aumentar el número de injertos disponibles para el trasplante hepático.
Fig. 1. Línea de división para el trasplante hepático split de adulto con una proporción aproximada del 60-40% e inclusión del segmento IV en el lóbulo izquierdo.
Fig. 2. Representación esquemática de los 2 segmentos hepáticos una vez realizada la bipartición, donde pueden observarse los distintos cabos vasculares y biliares.
En sus inicios, el split se realizaba ex situ como un procedimiento de cirugía de banco en el centro y por el equipo que efectuaba el trasplante. Esta técnica, que tiene indudables ventajas logísticas al no aumentar el tiempo de extracción ni interferir con otros equipos de extracción de órganos, sin embargo alarga el tiempo de isquemia y expone el órgano a su recalentamiento, y se ha descrito una mayor tasa de complicaciones biliares en el receptor. Sin embargo, el split in situ exige mayor tiempo quirúrgico en el hospital donante, mayor experiencia del equipo extractor y una mayor coordinación con otros equipos, pero diminuye el tiempo de isquemia, se identifican mejor las estructuras vasculares y biliares durante la división del hígado, se asocia a una menor hemorragia tras la reperfusión del injerto y la tasa de complicaciones biliares en el paciente trasplantado es menor28,35. Al analizar globalmente los resultados de ambas técnicas éstos son similares9,10, excepto en la tasa de complicaciones biliares y de hemorragias36. Por ello, se acepta que la extracción in situ es el método ideal, si bien es difícil de aplicar en los centros extractores que no son también trasplantadores.
En el receptor, dadas las características de la partición hepática que hemos comentado, se requiere realizar como técnica de trasplante el piggy-back en lugar de la técnica clásica.
4. Logística intra y extrahospitalaria. La logística en este tipo de trasplante es fundamental. Así, solamente se contemplará la posibilidad del split si las circunstancias del caso y la logística del hospital donante permiten plantear una cirugía de extracción más larga y el equipo dispone de la suficiente experiencia. El centro generador dispondrá de ecografía intraoperatoria y de la posibilidad de realizar una colangiografía intraoperatoria, así como de la infraestructura y de las necesidades de personal necesarias para la realización habitual de estos procedimientos.
Hay que diferenciar que se realice en uno o en 2 centros. Si se va a llevar a cabo en un solo centro, exige la existencia de, al menos, 2 grupos de cirujanos hepáticos, uno para el donante y al menos otro para los 2 receptores. Si se realiza en 2 hospitales, el centro donde se realiza el split se quedará con el hígado izquierdo y al centro colaborador se le enviará el derecho. Como norma general, el hígado derecho debería ser adjudicado al centro con menor experiencia.
RESULTADOS ACTUALES DEL SPLIT HEPÁTICO PARA 2 ADULTOS
Los resultados iniciales fueron decepcionantes, con un gran número de complicaciones y alta mortalidad debido, por un lado, a la falta de selección tanto del donante como del receptor y, por otro, a problemas técnicos9,10. Sin embargo, los resultados de la bipartición hepática han mejorado notablemente en los últimos años gracias a una mejor selección de los pacientes y a los refinamientos de la técnica quirúrgica, que se ha visto complementada por la influencia positiva en los avances técnicos desarrollados por el trasplante hepático de donante vivo8,12,37,38. Así, la supervivencia al año en la mayoría de las series más recientes se sitúa en el 60-80% para el injerto y en el 70-90% para el paciente, resultados comparables a los obtenidos con el hígado completo (tabla II). No obstante, el porcentaje de complicaciones técnicas, de fallo primario del injerto y de retrasplante continúa siendo discretamente más elevado que en el trasplante hepático con injerto completo, y la mortalidad global postoperatoria se sitúa en torno al 10-15%.
Aunque la supervivencia al año publicada en los pocos estudios existentes hoy día es similar a la obtenida con el órgano completo (tabla II), la experiencia es muy escasa y existen unos peores resultados en el receptor del injerto izquierdo. La serie más amplia, publicada por Azoulay et al42, presenta una supervivencia al año del 74% para el injerto derecho y del 75% para el izquierdo, pero a los 2 años la supervivencia desciende al 43% para el izquierdo, mientras que permanece igual para el derecho. La tasa de fallo primario para el injerto izquierdo fue del 18%.
En cuanto a las complicaciones posquirúrgicas, debemos diferenciar las vasculares, que oscilan en torno al 5% tanto en el hígado derecho como en el izquierdo, de las biliares, que se cifran en el 15-18% pero son más altas en el izquierdo (25%) que en el derecho (12%)14. En las primeras series las complicaciones más frecuentes fueron las biliares, que acontecieron en casi el 30% de los pacientes9-11. Los refinamientos técnicos han conducido a una disminución importante del número de estenosis y fugas biliares, que se situan entre el 10 y el 15%36. Este mayor número de complicaciones no sólo se debe a un volumen hepático menor o insuficiente a veces, sino también a la necesidad de efectuar anastomosis vasculares y biliares más complejas y difíciles. A esta situación hay que añadir que las posibles variantes anatómicas que encontramos en gran porcentaje de donantes son una fuente de problemas técnicos que, resueltos con mayor o menor destreza, darán lugar a complicaciones postoperatorias más o menos graves y, en algunos casos, mortales43,44.
Además de las complicaciones generales de cualquier trasplante hepático, el trasplante split tiene algunas complicaciones específicas, como son las derivadas de la superficie de transección hepática (hemorragia, fuga biliar o infección); necrosis hepática (sobre todo del segmento 4); disparidad de tamaño, ya sea pequeño (síndrome de small for size) o grande (problemas de cierre abdominal y síndrome de hipertensión abdominal), y complicaciones debidas a reconstrucciones vasculares y biliares complejas.
Actualmente los mejores resultados se obtienen en centros con gran experiencia, donde se realizan al menos 40 splits hepáticos anuales3.
SITUACIÓN ACTUAL EN ESPAÑA
En España existe poca experiencia con el split hepático para 2 adultos. Así, hasta 2004 sólo había registrados en la Organización Nacional de Trasplantes 5 donantes sometidos a split para 2 adultos que se habían realizado en 4 centros (2 en el Hospital 12 de Octubre y uno en el Hospital Universitario Virgen de la Arrixaca, Clínico de Barcelona, y Ramón y Cajal). Los factores organizativos, de complejidad técnica y de peores resultados en las series iniciales han condicionado una escasa difusión de este procedimiento.
Sin embargo, 3 hechos hacen plantear un cambio en esta situación: a) los resultados de la bipartición hepática han mejorado notablemente en los últimos años por los factores que ya hemos explicado; b) en España ya existen centros con suficiente experiencia (ya tienen realizada la curva de aprendizaje) en cirugía hepática compleja, y c) por la presión de la lista de espera (> 600 pacientes al año) a la que están sometidos todos los grupos de trasplantes. Este cambio es posible si tenemos en cuenta que el potencial de donantes «splitables» es alto. Así, según algunas estimaciones, considerando las características de un donante a bipartición, se podría conseguir un aumento teórico de un 8 a un 20% de injertos, lo que reduciría considerablemente la mortalidad actual en lista de espera6-8. Como ejemplo, podemos citar (datos de la Organización Nacional de Trasplantes) que en el año 2002 hubo 71 donantes de menos de 45 años y más de 80 kg de peso, y 275 receptores con menos de 65 kg, de los cuales 65 presentaban un peso inferior a 55 kg. En el año 2003 los datos fueron similares, con 70 donantes con dichas características y 247 receptores con menos de 65 kg (69 con menos de 55 kg).
Sin embargo, para que esto sea una realidad es precisa una serie de cambios: a) hay que buscar formas de consenso para incentivar la actividad; b) el grupo que tenga un donante que cumpla los requisitos para ser el trasplante split debería ceder obligatoriamente el donante al grupo de split, y c) debe consensuarse la forma de compensar al equipo que cede el donante para split.
En el consenso entre equipos tiene que quedar bien claro cuáles son los pacientes «splitables» (donantes óptimos y superóptimos). Debe existir una lista nacional de receptores adultos estables de bajo peso, debe potenciarse la colaboración entre hospitales y debe existir una planificación sanitaria donde queden claros cuáles son los criterios de distribución (el hígado derecho tendría un turno normal como cualquier hígado completo, o podría cederse a un grupo de split pero con compensación posterior). Actualmente existe una propuesta en la que han participado diversos grupos españoles de trasplante hepático para iniciar un programa multicéntrico de split hepático para 2 receptores adultos o adulto-pediátrico.
Finalmente, queremos reseñar que en estos casos se hace más importante el consentimiento informado del paciente, pues sin duda es una técnica más compleja que precisa de una curva de aprendizaje larga y accesible sólo a cirujanos con gran entrenamiento y experiencia en trasplante y, sobre todo, en cirugía de resección hepática. Los resultados son peores en términos de complicaciones, mortalidad y fallo del injerto. En definitiva, estamos transformando un donante óptimo con un órgano de buena calidad en un donante marginal o de alto riesgo con 2 injertos de peor calidad. Por ello, se presenta un problema ético, ya que al paciente receptor de un hígado dividido se le está sometiendo, sin duda, a un mayor riesgo quirúrgico con la ventaja de un menor tiempo en lista de espera y, por consiguiente, a un menor deterioro general y de su función hepática. Por tanto, se necesita un consentimiento informado y detallado del receptor.
CONCLUSIÓN
Podemos decir que la bipartición hepática es una técnica escasamente difundida después de más de 15 años desde su descripción, sin que haya registros europeos ni americanos con datos verificables y fiables. Sin embargo, es una técnica cada vez más perfeccionada, con un gran potencial que aún está por explotar. Los resultados de las últimas series son muy alentadores y se aproximan cada vez más a los obtenidos con el órgano total. No obstante, hay que tener en cuenta que es un procedimiento muy exigente, que requiere un gran esfuerzo y desgaste profesional, y que no está reconocido ni incentivado por los responsables sanitarios de nuestro país. Además, es un procedimiento en evolución que necesita un mayor desarrollo, una mayor incentivación y la elaboración de registros nacionales e internacionales específicos con datos verificables y fiables. Con una adecuada política de selección y de distribución de órganos se podrían aumentar las reservas de injertos para trasplante hepático.