En los últimos años hemos presenciado grandes progresos en el diagnóstico y tratamiento del carcinoma hepatocelular (CHC). Esto ha permitido cambiar la visión nihilista que se tenía de esta enfermedad, convirtiendo el CHC en una de las áreas con investigación básica y clínica más activa en los últimos años. Posiblemente, el mayor avance ha sido la demostración de que sorafenib, un inhibidor multiquinasa con acción antiproliferativa y antiangiogénica, constituye un tratamiento eficaz capaz de aumentar la supervivencia de los pacientes afectos de CHC en estadio avanzado. Este hallazgo ha sido la demostración de que estos fármacos que actúan selectivamente sobre las vías moleculares involucradas en la progresión tumoral pueden ser eficaces en el tratamiento del CHC y abre la puerta a la evaluación de estos agentes moleculares, solos o en combinación, en el CHC.
El objetivo de este documento es realizar una revisión del tratamiento del CHC en estadio avanzado, con especial énfasis en los diferentes agentes que están actualmente en evaluación.
In the last few years, much progress has been made in the diagnosis and treatment of hepatocellular carcinoma (HCC). Due to these advances, HCC is no longer regarded as a disease with an extremely poor prognosis and has become the focus of some of the most active basic and clinical research in recent years. The most important advance is possibly the demonstration that sorafenib, a multikinase inhibitor with antiproliferative and antiangiogenic properties, is an effective treatment, able to increase survival in patients with advanced-stage HCC. This increased survival has demonstrated that these drugs, which act selectively on the molecular pathways involved in tumoral progression, can be effective in the treatment of HCC and has opened the door to the evaluation of these molecular agents, alone or in combination, in HCC.
The present article provides a review of the treatment of advanced-stage HCC, with special emphasis on the distinct agents that are currently under evaluation.
El carcinoma hepatocelular (CHC) ha sido tradicionalmente considerado una enfermedad infrecuente en países desarrollados, que rara vez se detectaba en fases iniciales y su diagnóstico solía asociarse a la presencia de síntomas y un pronóstico ominoso. Esta visión nihilista del CHC ha cambiado radicalmente en los últimos años. Se ha probado que el CHC es una neoplasia prevalente, con más de 500.000 nuevos casos diagnosticados al año, siendo la sexta causa más frecuente de cáncer a nivel mundial1. Aunque su prevalencia es mayor en países en vías de desarrollo, se ha constatado que la incidencia está aumentando dramáticamente en países industrializados2, y el desarrollo de CHC constituye actualmente la causa más frecuente de muerte en pacientes cirróticos3. Asimismo, la implementación de programas de diagnóstico precoz basados en la realización de ecografías abdominales periódicas y los avances en las técnicas de imagen ha permitido obtener el diagnóstico de esta enfermedad en fases iniciales en más de la mitad de los casos, cuando es posible aplicar tratamientos eficaces potencialmente curativos4. Finalmente, se han realizado grandes avances en el campo del tratamiento: hace 2 décadas, la única opción terapéutica era quirúrgica, aplicable en una minoría de casos. Actualmente, disponemos de múltiples tratamientos locorregionales eficaces que han demostrado un indiscutible aumento de la supervivencia5. Sin embargo, el avance más relevante en los últimos años ha sido el desarrollo de un tratamiento eficaz en pacientes afectos de CHC en fase avanzada6. En este sentido, el sorafenib, un inhibidor multiquinasa con acción antiproliferativa y antiangiogénica, es el único fármaco que ha demostrado hasta la fecha beneficio en términos de supervivencia7,8 y se ha convertido en el tratamiento de referencia en estadios avanzados5,6. Además, la demostración de la eficacia del sorafenib en el CHC ha estimulado el desarrollo y la evaluación de diferentes moléculas con acción sobre alguna de las vías de señalización alteradas en las células neoplásicas, bien como agentes únicos o bien en combinación.
Las opciones terapéuticas actualmente disponibles en el CHC han sido extensamente revisadas en un documento de consenso recientemente publicado e incluido en el catálogo oficial de Guías de práctica clínica del Sistema Nacional de Salud9.
El objetivo de este documento es realizar una revisión sobre las diferentes opciones terapéuticas evaluadas en el CHC en estadio avanzado, con especial interés en aquellos nuevos agentes desarrollados a partir del conocimiento de las vías moleculares alteradas en el proceso de carcinogénesis.
Quimioterapia sistémicaEn los últimos años se han evaluado múltiples agentes y pautas de quimioterapia, la mayoría de ellas basadas en doxorrubicina10,11. Sin embargo, a pesar de su evaluación en más de 1.000 pacientes, ninguna pauta se ha demostrado eficaz en prolongar la supervivencia de los pacientes con CHC11–13. Además, el uso de quimioterapia en pacientes afectos de hepatopatía crónica se asocia a una elevada tasa de efectos adversos severos e incluso muerte asociada directamente al tratamiento12. Por tal motivo, el uso de quimioterapia sistémica en el CHC está desaconsejada4,5,9,14,15.
Compuestos hormonalesEn el pasado, tamoxifeno u otros tratamientos hormonales han sido usados frecuentemente en el CHC avanzado. La presencia de receptores estrogénicos en una gran proporción de CHC avanzados constituyó la base racional para la valoración de estos compuestos. La excelente tolerancia clínica y la publicación de resultados positivos en ensayos clínicos preliminares convirtieron al tamoxifeno en una opción válida. Lamentablemente, múltiples ensayos clínicos, incluyendo un mayor número de pacientes16–19 y, posteriormente, un metaanálisis10, han demostrado que estos componentes no tienen ninguna acción sobre el CHC. El octreotide ha sido evaluado en tres ensayos clínicos20–22. El resultado global de estos estudios demuestra que, a pesar de su aceptable perfil de toxicidad, el octreotide ha sido incapaz de demostrar impacto en la supervivencia. Otros compuestos, tales como el megestrol23 y derivados antiandrogénicos24,25, han presentado igualmente resultados negativos. Finalmente, el seocalcitol, un análogo de la vitamina-D con acción antiproliferativa, fue evaluado en un ensayo clínico aleatorizado incluyendo 746 pacientes; lamentablemente, el seocalcitol no demostró aumento de supervivencia comparado con el grupo placebo (9,6 vs. 9,2 meses, respectivamente)26. Teniendo en cuenta todos estos resultados, el uso de estos fármacos no está recomendado en el CHC avanzado4,5,9,14,15.
Tratamientos locorregionales: radioembolizaciónEl CHC es considerado una neoplasia radiorresistente. Además, la radioterapia externa se ve limitada por la baja tolerancia a la radiación del parénquima hepático, particularmente, en aquellos pacientes afectos de hepatopatía crónica. En los últimos años se ha desarrollado tecnología basada en el uso de microesferas cargadas de yttrium-90. Este emite radiación beta lo que permite liberar radioactividad a altas dosis a nivel intratumoral con mínima exposición del parénquima no tumoral subyacente. Múltiples estudios de cohortes han evaluado esta estrategia en pacientes afectos de CHC con trombosis portal tumoral con resultados prometedores27,28. Hasta la actualidad no se ha demostrado de forma concluyente su eficacia en términos de supervivencia en estudios prospectivos y controlados, por lo que su uso debe ser reservado al ámbito experimental. Además, este tratamiento es de elevado coste económico y su ejecución es compleja, lo que limita su aplicabilidad.
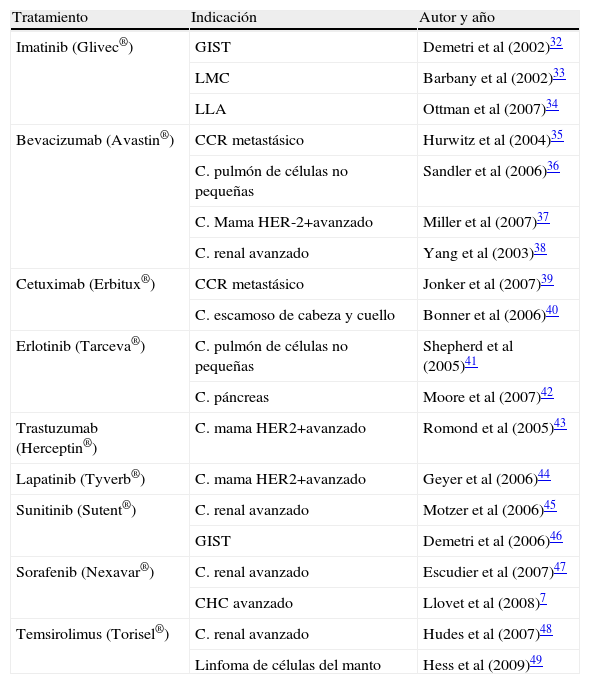
Agentes molecularesLos avances en el conocimiento de la biología del cáncer en general y del CHC, en particular, han aumentado exponencialmente en la última década29–31. Esto ha permitido el desarrollo de diferentes compuestos, que actúan específicamente sobre diversas «dianas» moleculares, particularmente, en aquellas asociadas a proliferación y neoangiogénesis. A diferencia de la quimioterapia convencional, estos nuevos fármacos actúan de forma selectiva sobre diferentes dianas moleculares específicas de células neoplásicas, minimizando la aparición de efectos adversos y ejerciendo una acción específica sobre dichas células malignas. La demostración en 2002 de la extraordinaria eficacia del imatinib en gastrointestinal stromal tumors (GIST, ‘tumores estromales gastrointestinales’)32 y en la leucemia mieloide crónica33 constituyó el punto de partida para la evaluación de estos agentes moleculares en diferentes neoplasias. Desde entonces, muchos de estos agentes moleculares han demostrado eficacia y su uso en diferentes neoplasias ha sido aprobado por la FDA y/o EMEA (tabla 1)32–49.
Agentes moleculares aprobados en Oncología
| Tratamiento | Indicación | Autor y año |
| Imatinib (Glivec®) | GIST | Demetri et al (2002)32 |
| LMC | Barbany et al (2002)33 | |
| LLA | Ottman et al (2007)34 | |
| Bevacizumab (Avastin®) | CCR metastásico | Hurwitz et al (2004)35 |
| C. pulmón de células no pequeñas | Sandler et al (2006)36 | |
| C. Mama HER-2+avanzado | Miller et al (2007)37 | |
| C. renal avanzado | Yang et al (2003)38 | |
| Cetuximab (Erbitux®) | CCR metastásico | Jonker et al (2007)39 |
| C. escamoso de cabeza y cuello | Bonner et al (2006)40 | |
| Erlotinib (Tarceva®) | C. pulmón de células no pequeñas | Shepherd et al (2005)41 |
| C. páncreas | Moore et al (2007)42 | |
| Trastuzumab (Herceptin®) | C. mama HER2+avanzado | Romond et al (2005)43 |
| Lapatinib (Tyverb®) | C. mama HER2+avanzado | Geyer et al (2006)44 |
| Sunitinib (Sutent®) | C. renal avanzado | Motzer et al (2006)45 |
| GIST | Demetri et al (2006)46 | |
| Sorafenib (Nexavar®) | C. renal avanzado | Escudier et al (2007)47 |
| CHC avanzado | Llovet et al (2008)7 | |
| Temsirolimus (Torisel®) | C. renal avanzado | Hudes et al (2007)48 |
| Linfoma de células del manto | Hess et al (2009)49 |
CCR: carcinoma colorrectal; GIST: gastrointestinal stromal tumor; LLA: leucemia linfoblástica aguda; LMC: leucemia mieloide crónica.
Tal como se ha expuesto anteriormente, el CHC era una de las pocas neoplasias sólidas en las que no existía ningún tratamiento sistémico eficaz y la única opción disponible en aquellos pacientes diagnosticados en fases avanzadas era participar en diferentes ensayos clínicos para evaluar nuevas terapias4,14. Este escenario cambió radicalmente con la demostración de la eficacia del sorafenib en el CHC avanzado7, constituyendo la prueba de que estos agentes moleculares pueden ser potencialmente eficaces en CHC.
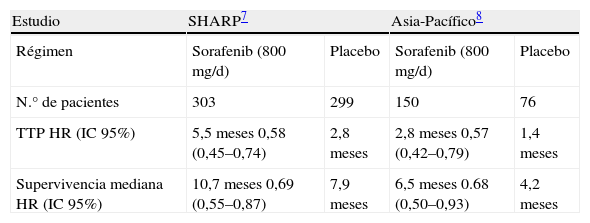
Sorafenib: tratamiento estándar del CHC avanzadoSorafenib es una molécula disponible por vía oral con capacidad inhibidora de diferentes quinasas (b-Raf, p38, VEGFR2, PDGFR, receptor c-Kit), que actúa sobre 2 vías fundamentales asociadas a la hepatocarcinogénesis, bloqueando la proliferación celular a través de la activación de la vía de señalización de Ras/MAPKK (b-Raf) y la neoangiogénesis, mediante la inhibición de VEGFR2 y PDGFR50,51. Estudios preclínicos demostraron eficacia en modelos animales de CHC50. Posteriormente, un ensayo clínico fase 2, incluyendo 137 pacientes con CHC avanzado, demostró que sorafenib, a pesar de obtener una respuesta radiológica <10%, se asoció a una supervivencia mediana de 9,7 meses. Además, fue capaz de retrasar la progresión de la enfermedad, siendo la mediana de tiempo a progresión radiológica de 5,5 meses y permaneciendo la enfermedad estable a los 4 meses en un 35% de los pacientes52. Dado estos resultados iniciales prometedores, se llevó a cabo un ensayo clínico aleatorizado, doble ciego, controlado con placebo en pacientes afectos de CHC avanzado con cirrosis hepática compensada, sin síntomas asociados a su neoplasia y que no hubieran recibido ningún tratamiento sistémico (estudio SHARP). Se incluyeron un total de 602 pacientes; 303 fueron randomizados para recibir sorafenib (400mg/12h) y 299 recibieron placebo7. El principal objetivo del estudio fue aumentar la supervivencia. El estudio fue prematuramente interrumpido en el segundo análisis intermedio planificado, tras la demostración de beneficio del sorafenib. La supervivencia mediana fue de 10,7 meses para sorafenib y 7,9 para placebo (hazard ratio, 0,69; IC95%, 0,55 a 0,87; p<0,001). A pesar de una práctica ausencia de respuesta radiológica (2,9% en el grupo sorafenib versus 0,7% en el grupo placebo), la mediana de tiempo a progresión fue de 5,5 meses con sorafenib versus 2,8 meses con placebo (hazard ratio, 0,58; IC95%, 0,45 a 0,74; p<0,001). La tasa de efectos adversos fue muy alta en ambos grupos, lo que demuestra la dificultad del manejo clínico de los pacientes con CHC. Los efectos adversos más frecuentemente asociados a sorafenib fueron; diarrea, reacción mano-pie, pérdida de peso e hipofosfatemia. De forma paralela, se realizó otro ensayo clínico de diseño similar en países del sudeste asiático8. La mayoría de los pacientes incluidos en este estudio fueron pacientes con hepatopatía crónica por VHB, y la proporción de pacientes con síntomas, invasión vascular y/o invasión extrahepática fue mayor que en el estudio SHARP, lo que justificó la menor supervivencia en el grupo control (4,2 meses respecto a 7,9 meses en el estudio SHARP). Sin embargo, a pesar del peor pronóstico de los pacientes de este estudio, sorafenib presentó el mismo grado de eficacia que en el estudio SHARP (tabla 2), confirmando la eficacia del sorafenib a nivel mundial, independientemente de la etiología de la hepatopatía crónica subyacente53. Por último, diferentes análisis post hoc han mostrado que sorafenib mantiene su eficacia en diferentes subgrupos de pacientes, por lo que hasta la fecha no se ha podido identificar ningún subgrupo de pacientes que no se puedan beneficiar del tratamiento con este fármaco.
Resumen de los resultados del estudio de Cheng et al con sorafenib, en CHC, en la región Asia-Pacífico
| Estudio | SHARP7 | Asia-Pacífico8 | ||
| Régimen | Sorafenib (800mg/d) | Placebo | Sorafenib (800mg/d) | Placebo |
| N.° de pacientes | 303 | 299 | 150 | 76 |
| TTP HR (IC 95%) | 5,5 meses 0,58 (0,45–0,74) | 2,8 meses | 2,8 meses 0,57 (0,42–0,79) | 1,4 meses |
| Supervivencia mediana HR (IC 95%) | 10,7 meses 0,69 (0,55–0,87) | 7,9 meses | 6,5 meses 0.68 (0,50–0,93) | 4,2 meses |
HR: hazard ratio; TTP: tiempo a progresión.
Los resultados de estos dos estudios han supuesto un gran avance en el manejo de esta enfermedad: sorafenib es, hasta la fecha, el único tratamiento sistémico que ha demostrado aumento de supervivencia en el CHC y, tras su aprobación por la FDA y la EMEA, constituye en el momento actual el tratamiento de referencia para el CHC avanzado. Asimismo, estos resultados positivos constituyen la prueba de que las terapias moleculares son eficaces en el CHC y abren la puerta para la investigación de nuevos agentes, como agentes únicos o combinados con sorafenib, y para la evaluación del sorafenib en otros escenarios, como es en adyuvancia tras la aplicación de tratamientos potencialmente curativos como la ablación o la resección quirúrgica, o asociado a quimioembolización en pacientes con CHC intermedio.
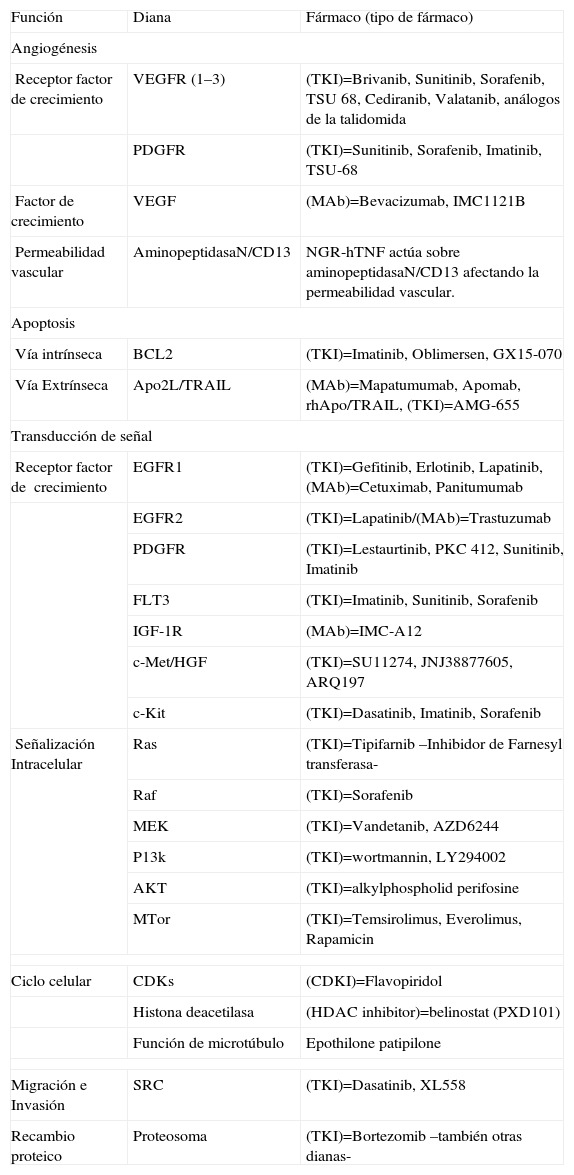
Nuevos agentes moleculares en el CHCEn los últimos años se han evaluado múltiples agentes moleculares en el CHC, con resultados en algunos casos prometedores (tabla 3).
Nuevas terapias moleculares, según función y diana terapéutica
| Función | Diana | Fármaco (tipo de fármaco) |
| Angiogénesis | ||
| Receptor factor de crecimiento | VEGFR (1–3) | (TKI)=Brivanib, Sunitinib, Sorafenib, TSU 68, Cediranib, Valatanib, análogos de la talidomida |
| PDGFR | (TKI)=Sunitinib, Sorafenib, Imatinib, TSU-68 | |
| Factor de crecimiento | VEGF | (MAb)=Bevacizumab, IMC1121B |
| Permeabilidad vascular | AminopeptidasaN/CD13 | NGR-hTNF actúa sobre aminopeptidasaN/CD13 afectando la permeabilidad vascular. |
| Apoptosis | ||
| Vía intrínseca | BCL2 | (TKI)=Imatinib, Oblimersen, GX15-070 |
| Vía Extrínseca | Apo2L/TRAIL | (MAb)=Mapatumumab, Apomab, rhApo/TRAIL, (TKI)=AMG-655 |
| Transducción de señal | ||
| Receptor factor de crecimiento | EGFR1 | (TKI)=Gefitinib, Erlotinib, Lapatinib, (MAb)=Cetuximab, Panitumumab |
| EGFR2 | (TKI)=Lapatinib/(MAb)=Trastuzumab | |
| PDGFR | (TKI)=Lestaurtinib, PKC 412, Sunitinib, Imatinib | |
| FLT3 | (TKI)=Imatinib, Sunitinib, Sorafenib | |
| IGF-1R | (MAb)=IMC-A12 | |
| c-Met/HGF | (TKI)=SU11274, JNJ38877605, ARQ197 | |
| c-Kit | (TKI)=Dasatinib, Imatinib, Sorafenib | |
| Señalización Intracelular | Ras | (TKI)=Tipifarnib –Inhibidor de Farnesyl transferasa- |
| Raf | (TKI)=Sorafenib | |
| MEK | (TKI)=Vandetanib, AZD6244 | |
| P13k | (TKI)=wortmannin, LY294002 | |
| AKT | (TKI)=alkylphospholid perifosine | |
| MTor | (TKI)=Temsirolimus, Everolimus, Rapamicin | |
| Ciclo celular | CDKs | (CDKI)=Flavopiridol |
| Histona deacetilasa | (HDAC inhibitor)=belinostat (PXD101) | |
| Función de microtúbulo | Epothilone patipilone | |
| Migración e Invasión | SRC | (TKI)=Dasatinib, XL558 |
| Recambio proteico | Proteosoma | (TKI)=Bortezomib –también otras dianas- |
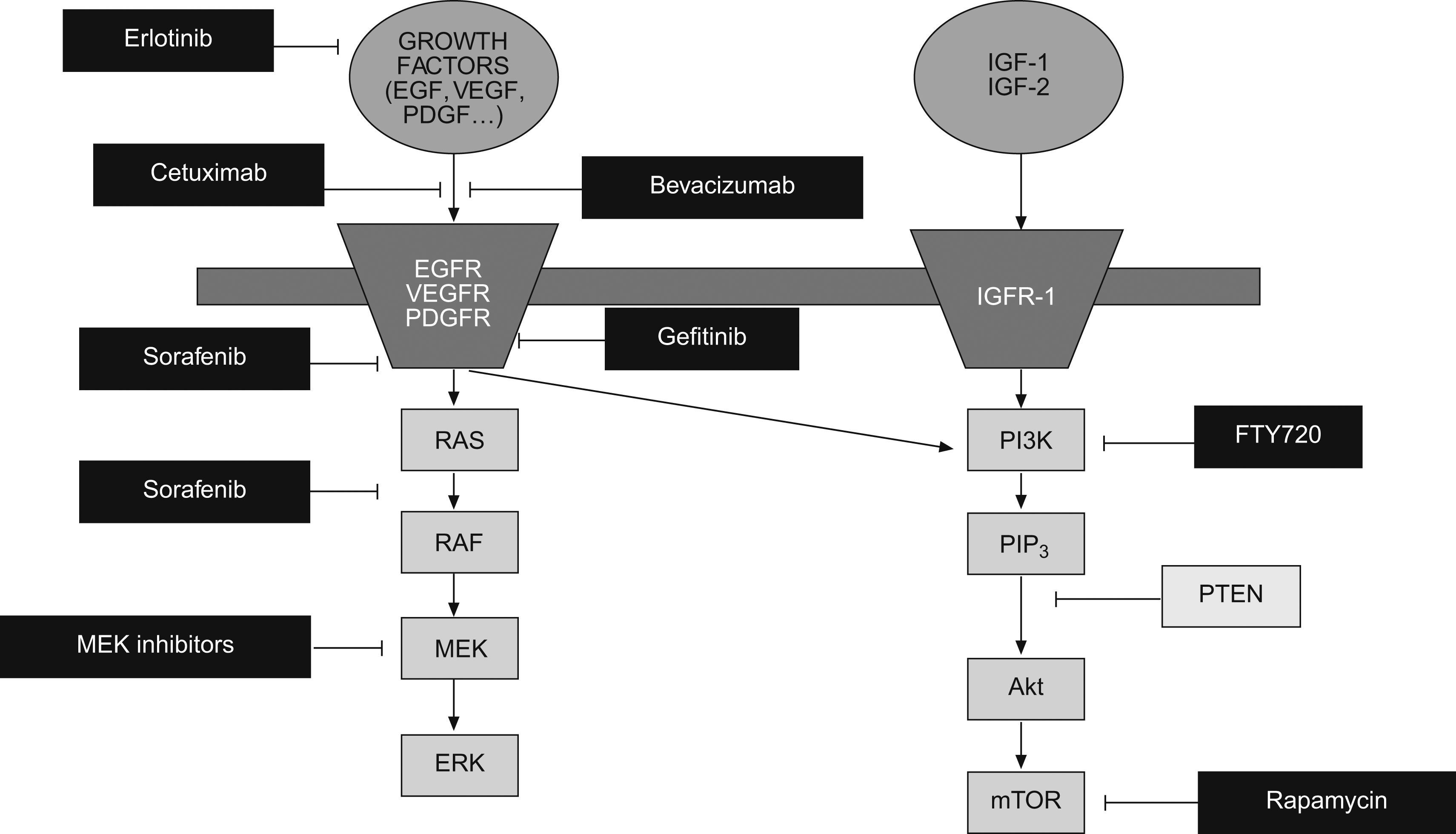
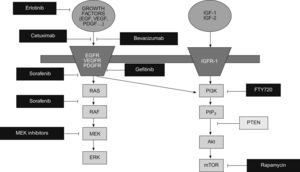
Inhibidores de la vía EGFR/Ras/Raf/MAPK: esta vía es una de las mejor caracterizadas y está activada en una alta proporción de pacientes30. En la actualidad disponemos de múltiples agentes que bloquean esta vía a diferentes niveles (fig. 1). Además del sorafenib, que inhibe la vía Ras/Raf/MAPK y ha sido ampliamente expuesto en el anterior apartado, otra estrategia para inhibir esta vía es bloquear el receptor del factor de crecimiento, bien mediante anticuerpos monoclonales como cetuximab, o bien mediante inhibidores de la actividad tirosina-quinasa de los receptores como el erlotinib, gefitinib y lapatinib. De todos estos agentes, disponemos de ensayos fase 2 con resultados variables54–57. La inclusión heterogénea de pacientes en diferentes estadios impide una correcta evaluación de la eficacia en términos de supervivencia.
Inhibidores de la vía PI3K/Akt/mTOR: es otra de las vías mejor definidas en la patogenia del CHC58. La diana más atractiva para interferir esta vía es mTOR. Los inhibidores de mTOR, rapamicina y sus análogos everolimus (RAD001) y temsirolimus son usados como agentes inmunosupresores en el transplante de órganos sólidos y como tratamiento del carcinoma renal avanzado48. El uso de inhibidores de mTOR ha mostrado eficacia in vitro y en modelos animales58–61 y, en el momento actual, se está evaluando su utilidad y seguridad en pacientes cirróticos con CHC avanzado.
Inhibidores de la angiogénesis: la angiogénesis es un proceso fundamental para el desarrollo y progresión tumoral29. Además, el CHC es una neoplasia altamente vascularizada, por lo que la inhibición de la neoangiogénesis constituye una diana muy atractiva para el tratamiento del CHC. Como hemos comentado anteriormente, sorafenib tiene una potente acción antiangiogénica mediante la inhibición de VEGFR2 y PDGFR, y su contrastada eficacia en el CHC avanzado constituye un excelente ejemplo de la idoneidad del bloqueo de la neoangiogénesis para el tratamiento del CHC. En el momento actual existen múltiples inhibidores de la angiogénesis evaluándose en estudios clínicos fase 2 y 3, destacando los siguientes:
- •
Bevacizumab: se trata de un anticuerpo monoclonal de administración endovenosa dirigido contra VEGF aprobado para los carcinomas colorrectal metastático, renal avanzado, pulmón no microcítico y mama avanzado HER-2+. Bevacizumab ha sido evaluado en el CHC tanto como agente único como en asociación con otros fármacos, como erlotinib. Los datos disponibles en la actualizad sugieren que bevacizumab es capaz de inducir una mayor respuesta tumoral que el sorafenib, pero su impacto en términos de supervivencia es desconocido62,63. Además, bevacizumab tiene menos aplicabilidad que otros agentes, ya que su uso está contraindicado en pacientes con patología cardiovascular o renal. Por último, su uso se asocia a una mayor tasa de efectos secundarios, destacando el riesgo de hemorragia gastrointestinal que en algunos casos ha conducido a la muerte del paciente62.
- •
Sunitinib: es una molécula disponible por vía oral que inhibe múltiples receptores tirosina-quinasas; PDGFR, VEGFR1-2, FLK, c-kit y FTL-3. Al igual que sorafenib, sunitinib tiene una acción dual antiproliferativa y antiangiogénica. Los resultados de ensayos fase 2 (uno realizado principalmente en Europa con ciclos de 4 semanas con 50mg/día y 2 semanas sin tratamiento64, y otro realizado en EE.UU. con 37,5mg/día65), indican que sunitinib induce una mayor respuesta radiológica que el sorafenib. El estudio evaluando la dosis de 50mg/día demostró un tiempo a progresión radiológica de 5,3 meses, muy similar al sorafenib. Lamentablemente, se asoció a una alta tasa de efectos adversos y a un 10% de muertes directamente relacionadas con el tratamiento64. La dosis de 37,5mg/día fue mejor tolerada, pero a costa de reducir su eficacia, con un tiempo a progresión radiológica de 4,1 meses65, sensiblemente inferior al inducido por sorafenib66. En el momento actual está en marcha un estudio fase 3, no doble ciego, comparando directamente sunitinib 37,5mg/día (4 semanas con medicación y 2 sin medicación) contra sorafenib a la dosis convencional (400mg/12h).
- •
Brivanib: inhibidor multiquinasa disponible por vía oral con acción específica contra el VEGFR y el FGFR. En el momento actual se está evaluando esta molécula en el tratamiento del CHC avanzado tanto en primera como en segunda línea tras fracaso con sorafenib67.
- •
Talidomida: su mecanismo de acción no es del todo conocido, pero tiene una clara acción antiangiogénica mediante inhibición de VEGFR y el FGFR y antiproliferativa. Talidomida ha sido evaluado en pacientes con CHC, pero su administración se ve limitada por la presencia de efectos secundarios tales como fatiga y somnolencia68.
Los resultados positivos de sorafenib han constituido una prueba de concepto de que los agentes moleculares son potencialmente eficaces en esta neoplasia refractaria a otras terapias sistémicas, lo que unido al mejor conocimiento de las vías moleculares asociadas al inicio y progresión del tumor y al desarrollo de múltiples agentes moleculares han determinado que en los últimos años se hayan iniciado una gran cantidad de ensayos clínicos, que evalúan estos agentes en humanos. Conceptos clásicos en Oncología, como la necesidad de disminuir la carga tumoral para lograr impacto en supervivencia, se han demostrado obsoletos y deberán establecerse nuevos criterios de respuesta para detectar posible eficacia que justifique evaluación a gran escala en estudios fase 3. En este sentido, sorafenib es capaz de aumentar de forma significativa la supervivencia sin apenas inducir respuesta radiológica convencional, de acuerdo con el cambio de tamaño de las lesiones, mientras que se vislumbró su utilidad mediante la determinación del tiempo a progresión radiológica. Posiblemente, técnicas radiológicas avanzadas, como la difusión o la perfusión sustituirán en un futuro a las medidas actuales, aunque su validación será laboriosa. Obviamente, urge desarrollar biomarcadores que nos permitan identificar buenos candidatos a tratamiento o fracaso al tratamiento indicado, lo que nos permitiría aplicar un tratamiento personalizado a la carte.
Otro aspecto importante es el manejo de efectos secundarios. No cabe duda que estos agentes biológicos, a pesar de su mecanismo de acción específico sobre las células neoplásicas, no están exentos de efectos adversos. Además, no debemos olvidar que la mayoría de los pacientes afectos de CHC padecen una cirrosis hepática asociada, dificultando aún más el manejo de estos fármacos.
También habría que destacar el posible papel que en un futuro puedan tener las terapias génicas. En este sentido, en los últimos años ha habido una investigación activa sobre el rol de los microRNA (miRNA) en el desarrollo de neoplasias69,70 y su potencial aplicabilidad terapéutica en modelos animales71.
Gracias a los avances en los últimos años, el CHC ya no debe verse como una enfermedad sin tratamiento con un pronóstico pésimo a corto plazo, sino todo lo contrario. Actualmente, el CHC es un área de la hepatología con una investigación básica y clínica muy activa72, y en los próximos años seremos testigos de grandes avances en el diagnóstico y tratamiento de esta enfermedad.
Conflicto de interesesAlejandro Forner recibe una beca del Instituto Sanitario Carlos III (FI05/00645).
Carlos Rodríguez de Lope recibe una beca del Instituto Sanitario Carlos III (FI09/00510) y de la fundación BBVA.
María Reig está parcialmente subvencionada por la fundación BBVA.
El grupo de Oncología Hepática (BCLC) está subvencionada por el CIBER para el área temática de enfermedades digestivas (CIBERehd).