INTRODUCCIÓN
Los resultados del tratamiento de la neoplasia de páncreas y región periampular han mejorado en la última década debido a diversos factores, como la mayor fiabilidad del diagnóstico preoperatorio1-5, el mejor soporte perioperatorio y anestésico, el uso de la nutrición parenteral postoperatoria, la quimioterapia y radioterapia adyuvantes4-7 y la concentración de estos enfermos en unidades quirúrgicas especializadas8-12. Nuestro objetivo ha sido comparar los resultados obtenidos en 2 grupos de pacientes tratados en nuestro hospital en períodos distintos y en el contexto de un servicio de cirugía general y del aparato digestivo o de una unidad funcional de cirugía hepatobiliopancreática.
MATERIAL Y MÉTODOS
Se ha realizado un estudio retrospectivo-prospectivo donde se comparan los resultados obtenidos en 2 grupos de pacientes tratados en períodos distintos. Los pacientes del grupo A recibieron tratamiento entre 1982 y 1992 en el contexto de un servicio de cirugía general y del aparato digestivo, mientras que los del grupo B fueron tratados entre 1998 y 2003 en el contexto de una unidad funcional de cirugía hepatobiliopancreática. Los datos de los pacientes del grupo A se recogieron de forma retrospectiva en el año 1993 y los casos de resección pancreática se limitaron a los adenocarcinomas de páncreas, excluyendo las otras neoplasias de la región periampular como los ampulomas y otros. Los datos de los pacientes del grupo B se recogieron de forma prospectiva e incluyeron todos los tumores malignos resecados del páncreas y de la región periampular. El subgrupo B-1 comprende únicamente los adenocarcinomas de páncreas para realizar algunas comparaciones con el grupo A.
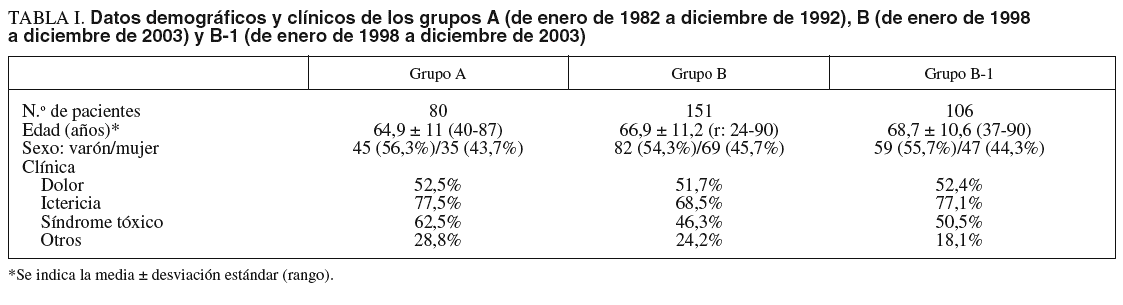
Las características de los pacientes de ambos grupos están reflejadas en la tabla I. El grupo A estuvo formado por 80 pacientes (un 56,3% varones) con una edad media (± desviación estándar) de 64,9 ± 11 años (rango, 40-87), y el grupo B por 151 pacientes (un 54,3% varones) con una edad media de 66,9 ± 11 años (rango, 24-90). El subgrupo B-1 estaba compuesto por 106 pacientes (un 55,7% varones) con una edad media de 68,7 ± 10,6 años (rango, 37-90).
La clínica de presentación fue similar: dolor abdominal en el 52,5 y el 51,7% de los pacientes, ictericia en el 77,5 y el 68,5%, síndrome tóxico en el 62,5 y el 46,3% y otros síntomas en el 28,8 y el 24,2% de los pacientes de los grupos A y B, respectivamente.
En el diagnóstico preoperatorio (tabla II) destaca que la principal prueba diagnóstica en el grupo A fue la ecografía abdominal (en el 85,5% de los pacientes) y que la tomografía computarizada se realizó sólo en el 23,8% de los pacientes de este grupo, mientras que en el grupo B la prueba de imagen más frecuente fue la tomografía computarizada, que se efectuó en casi todos los pacientes (97,1%). La colangiografía retrógrada endoscópica se realizó en el 26,3% de los pacientes del grupo A y en el 29,1% de los del grupo B. La resonancia magnética se realizó solamente en el grupo B en el 25% de los pacientes.
Se practicó drenaje biliar preoperatorio en 8 de los 75 pacientes intervenidos (10,7%) del grupo A y en 37 de los 140 intervenidos (26,4%) del grupo B.
La neoplasia estaba situada en la cabeza en 64 pacientes (80%) y en el cuerpo y cola en los restantes 16 (20%) del grupo A. En el grupo B se localizaba en la cabeza y región periampular en 131 pacientes (86,8%), con la siguiente distribución: 101 en cabeza, 21 en papila, 8 en colédoco intrapancreático y una en duodeno; en los restantes 20 pacientes (13,2%), se situaba en el cuerpo y cola.
Después de la cirugía se aplicó quimioterapia y radioterapia adyuvantes en el 48,2% de los pacientes del grupo B, mientras que sólo el 6,2% de los pacientes del grupo A recibió tratamiento adyuvante.
RESULTADOS
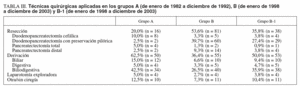
Los tratamientos realizados en ambos grupos se muestran en las tablas III y IV. La cirugía de resección se realizó en 16 pacientes del grupo A (20%), en 81 pacientes del grupo B (53,6%) y en 38 del grupo B-1 (35,8%). La duodenopancreatectomía cefálica tipo Whipple fue la técnica más frecuentemente empleada en el grupo A, mientras que en el grupo B fue la duodenopancreatectomía cefálica con preservación pilórica. Otras técnicas quirúrgicas realizadas fueron la pancreatectomía distal en el 2,5 y el 9,3% de los pacientes de los grupos A y B, respectivamente, y la pancreatectomía total en el 5 y el 1,3%.
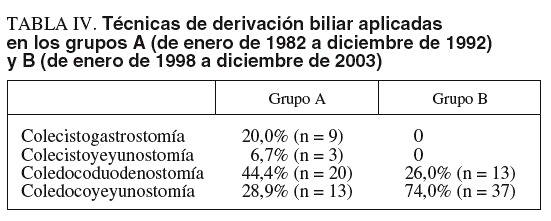
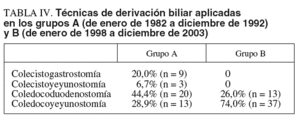
La cirugía derivativa se efectuó en 50 pacientes del grupo A (62,5%), en 55 del grupo B (36,4%) y en 53 del grupo B-1 (50,0%). La técnica de derivación biliar (tabla IV) más frecuente fue la coledocoduodenostomía en el grupo A y la coledocoyeyunostomía en el B. La utilización de la vesícula biliar para la derivación biliar sólo se utilizó en el 26,7% de los pacientes del grupo A. La laparotomía exploradora se realizó en 4 pacientes del grupo A (5%) y en 4 del B (2,7%). Se practicó otro tipo de intervención quirúrgica en 5 pacientes del grupo A (6,25%). No se operó a 5 pacientes del grupo A (6,25%) y a 11 del B (7,3%), de los que en 7 el tratamiento consistió en la colocación de prótesis biliar.
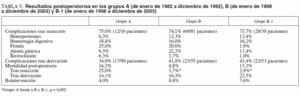
La incidencia de complicaciones postoperatorias (tabla V) fue similar después de la resección en ambos grupos (el 75 frente al 74,1%) y más elevada en el grupo B después de la derivación (el 41,8 frente a un 34,0%; p = 0,41). Las complicaciones de carácter quirúrgico más frecuentes después de la resección fueron la fístula biliopancreática (25%) y la hemorragia digestiva (18,8%) en el grupo A, mientras que en el grupo B fueron la atonía gástrica (22,2%) y la fístula biliopancreática (20%).
La mortalidad postoperatoria para los grupos A, B y B-1 fue del 16,3, el 8,8 y el 13,3%, respectivamente (A frente a B, p = 0,11). La mortalidad postoperatoria después de la resección fue del 25, el 3,7 y el 2,9%, respectivamente (A frente a B y B-1, p = 0,002), mientras que después de la derivación biliodigestiva fue del 14,1, el 16,3 y el 22,5%, respectivamente. La tasa de reintervención quirúrgica fue del 4% para el grupo A, del 8,8% para el B y del 7,6% para el B-1.
Las estancias medias (± desviación estándar) globales postoperatorias fueron de 15,1 ± 10,3 y 21,8 ± 15,9 días para los grupos A y B, respectivamente. En el grupo B la estancia postoperatoria fue de 30 ± 17,9 días después de la resección de los tumores de cabeza y periampulares, de 21,7 ± 13,9 días después de la resección de los tumores de cuerpo y cola, y de 14,1 ± 7,3 días tras la cirugía derivativa.
La anatomía patológica de la neoplasia de los pacientes del grupo A sometidos a resección pancreática fue de adenocarcinoma en todos ellos. En el grupo B, los tipos histológicos de las 81 neoplasias resecadas fueron: en 63 casos, adenocarcinomas (34 en cabeza, 17 en papila, 7 en colédoco, uno en duodeno y 4 en cuerpo-cola); en 4, tumores quísticos (uno en cabeza y 3 en cuerpo-cola); en 11, tumores neuroendocrinos (uno en cabeza, 3 en papila, uno en cabeza-cuerpo-cola y 6 en cuerpo-cola), y en 3, otras neoplasias.
La supervivencia global fue de 7,0 ± 7,1 meses para el grupo A, de 14,1 ± 15,3 meses para el grupo B (A frente a B, p = 0,001) y de 9,6 ± 10,4 meses para el grupo B-1 (A frente a B-1, p = 0,053). La supervivencia después de la resección fue de 11,8 ± 9,8, de 18,7 ± 15,8 y de 15,7 ± 12,9 meses para los grupos A, B y B-1, respectivamente (A frente a B, p = 0,09; A frente a B-1, p = 0,28). La supervivencia después de la resección en el grupo B según los tipos histológicos fue: 17,7 ± 14,7 meses en los pacientes con adenocarcinoma, 34,5 ± 31,3 meses en los tumores quísticos, 21,5 ± 18,9 meses en los tumores neuroendocrinos y 13,0 ± 11,3 meses en los otros tipos. La supervivencia después de la resección en los pacientes del grupo B según el lugar de localización del adenocarcinoma fue: 16,1 ± 13,2 meses para los localizados en la cabeza del páncreas, 22,5 ± 18,6 meses para los de papila, 12,2 ± 8,3 meses para los de colédoco distal y 10,0 ± 2,8 para los de cuerpo-cola.
La supervivencia después de la derivación fue de 6,0 ± 6,0, de 5,6 ± 5,7 y de 5,7 ± 5,8 meses para los grupos A, B y B-1, respectivamente.
La supervivencia después de la resección del adenocarcinoma pancreático en el grupo B-1 fue de 17,5 ± 14,3 meses para los pacientes que recibieron tratamiento adyuvante y de 14,3 ± 10,9 meses para los que no lo recibieron (p = 0,56).
DISCUSIÓN
Los avances en el diagnóstico y en la estadificación preoperatoria1-3,13, junto con el desarrollo de técnicas paliativas no quirúrgicas5,14,15 en los últimos años, han modificado el tratamiento de la neoplasia de páncreas y de la región periampular. Asimismo, los resultados de la cirugía de resección de tumores pancreáticos han mejorado en la última década. Hasta la década de los ochenta la duodenopancreatectomía cefálica se asociaba a una alta tasa de complicaciones (del 40 al 70%) y una alta mortalidad postoperatoria (hasta el 20%16), lo que propiciaba una actitud nihilista en algunos cirujanos. En centros experimentados la tasa de mortalidad ha disminuido de forma sustancial hasta conseguir en algún centro una tasa del 0%12,17-19. Sin embargo, las tasas de complicaciones post-operatorias han permanecido elevadas.
La morbimortalidad postoperatoria depende de varios factores como el estadio de la neoplasia, la gravedad de la ictericia, el estado nutricional, la presencia de infección y la alteración de la función renal. Además, diversos estudios han demostrado la influencia del volumen de pacientes que trata un hospital en la tasa de mortalidad, de manera que después de la cirugía pancreática ésta es significativamente menor en los hospitales con elevado volumen de pacientes en comparación con aquellos con bajo volumen8-11. Además, esto se traduce en una menor estancia hospitalaria y un menor coste sanitario, datos muy valorados por los actuales gestores sanitarios de corte economicista. La mayoría de estos estudios se han realizado en centros extranjeros y en nuestro país sólo existe un trabajo20 que confirma la relación entre volumen de pacientes tratados en un hospital y resultados después de la cirugía. Todo ello indica que dicha cirugía debería hacerse en centros con equipamiento adecuado y cirujanos con experiencia contrastada que puedan cumplir con los estándares apropiados a dicha cirugía21,22.
En nuestro hospital, con el cambio de servicios de cirugía independientes por unidades funcionales, con el consiguiente aumento del volumen y la concentración de estos pacientes en la unidad hepatobiliopancreática, hemos logrado reproducir la mejoría de la tasa de mortalidad postoperatoria, del 25 al 3,7% después de la resección. Sin embargo, la mortalidad postoperatoria después de la cirugía derivativa ha permanecido casi igual. Otros datos a destacar en nuestro estudio son el aumento de la tasa de resección y la disminución de la indicación de la derivación quirúrgica, atribuibles no sólo a la mayor experiencia de los cirujanos, sino también a la mejor estadificación preoperatoria con el empleo de la tomografía computarizada en casi todos los pacientes del grupo B. Asimismo, las tasas de complicaciones postoperatorias han permanecido elevadas y apenas han variado con el cambio de política hospitalaria de distribución de los pacientes, pero sorprende el aumento de las complicaciones después de la derivación en el grupo más reciente. Este hecho podría explicarse, porque se trata de una población con más enfermedades asociadas y, por tanto, con mayor incidencia de enfermedades médicas, así como por la recogida prospectiva de este tipo de complicaciones respecto a los pacientes del grupo A, en quienes los datos se recogieron retrospectivamente.
También hemos observado cambios en la elección de la técnica operatoria con la concentración de esta enfermedad en una unidad de cirugía pancreática, principalmente en la elección de la derivación biliar paliativa, de modo que ha aumentado el empleo de la coledocoyeyunostomía y se ha descartado totalmente el empleo de la vesícula biliar por el mayor riesgo que presenta de recidiva de la ictericia obstructiva por progresión de la neoplasia.
Actualmente, la cirugía paliativa se emplea principalmente en los pacientes en los que se determina la irresecabilidad durante la laparotomía y la mortalidad postoperatoria es algo mayor que la obtenida después de la resección quirúrgica23. A los pacientes que requieren tratamiento de una ictericia obstructiva y no son candidatos a una posible resección quirúrgica se les debería tratar mediante la colocación endoscópica de una prótesis metálica expandible5,14,15.
Por tanto, la cirugía de la neoplasia de páncreas y región periampular, y sobre todo la de resección, debería realizarse en centros con unidades específicas para ofrecer a los pacientes los mejores resultados, expresados en menor mortalidad postoperatoria, aunque la incidencia de complicaciones postoperatorias permanezca invariable. La política de aplicar quimiorradioterapia adyuvante después de la cirugía de resección podría explicar la mejoría de la supervivencia media en el grupo de pacientes tratados más recientemente, aunque el estudio estadístico no encuentre diferencias significativas entre los pacientes que recibieron el tratamiento adyuvante y los que no.