La combinación de interferón pegilado (IFN-Peg) con ribavirina es el tratamiento de elección de la hepatitis C crónica (HCC). Aunque infrecuentes, se han descrito diferentes eventos vasculares asociados con el uso de IFN estándar o IFN-Peg, como el fenómeno de Raynaud, la púrpura trombótica trombocitopénica, el síndrome hemolítico urémico o la trombosis de la vena central de la retina. Presentamos 2 casos de pacientes con HCC que, estando en tratamiento con IFN-Peg más ribavirina, consultaron por una descompensación de su enfermedad hepática, en cuyas pruebas radiológicas se demostró la presencia de una trombosis portal aguda. Tras el diagnóstico, se inició tratamiento anticoagulante con resolución de la trombosis portal.
The combination of pegylated interferon and ribavirin is the first option treatment for chronic hepatitis C (HCC). Although not frequent, several vascular adverse events, such as Raynaud’s phenomenon, thrombotic thrombocytopenic purpura, hemolytic uremic syndrome and central retinal vein occlusion, have been associated with the use of pegylated and standard interferon. We report the cases of two patients with HCC who, while receiving treatment with pegylated interferon and ribavirin, developed decompensated liver disease. Radiological tests revealed acute portal thrombosis. After the diagnosis was established, anticoagulant therapy was started, which resolved the portal thrombosis.
Los interferones son una familia de proteínas compuesta de 5 tipos diferenciados, empleados como tratamiento antineoplásico y antiviral. Su función se realiza a través de la unión a receptores de membrana específicos en la superficie celular, desencadenándose la inducción de varios genes que se consideran implicados en su capacidad de inhibir la replicación viral, suprimir la proliferación celular y modular el sistema inmunitario1,2.
La pegilación del interferón conlleva su unión a una cadena de polietilenglicol que le confiere una absorción sostenida, mayor vida media en suero y menor aclaramiento sistémico, con lo que se consiguen concentraciones séricas más estables, que permiten una acción continua sobre el virus y una administración más cómoda2,3. Actualmente, la combinación de interferón pegilado (IFN-Peg) y ribavirina se considera el tratamiento de elección de la hepatitis C crónica (HCC)3.
Dentro de los efectos secundarios de la terapia combinada son frecuentes, entre otros, el síndrome seudogripal, las alteraciones psiquiátricas y las hematológicas, pero también, aunque de forma infrecuente, se han observado eventos vasculares de diversa índole, incluidos los de tipo trombótico3. Recientemente, hemos asistido a 2 pacientes con HCC en los que se diagnosticó, por técnicas radiológicas, una trombosis portal aguda mientras recibían tratamiento con IFN-Peg y ribavirina.
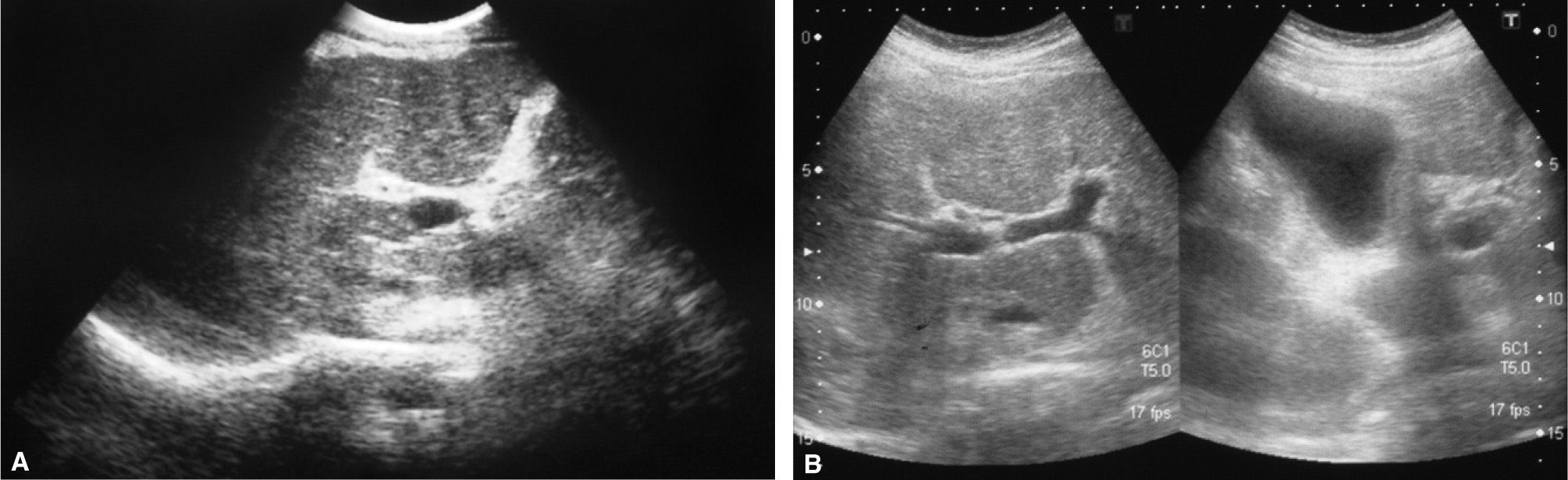
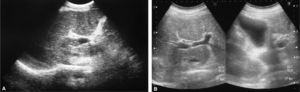
OBSERVACIÓN CLÍNICACaso 1Varón de 44 años de edad, con antecedentes de cirugía por úlcera duodenal, diagnosticado de HCC con una coinfección por el virus de la hepatitis B y una cirrosis hepática instaurada demostrada mediante biopsia. Se indicó tratamiento con IFN-Peg y ribavirina, pero el paciente presentó intolerancia y anorexia, una notable pérdida de peso y un gran deterioro de su calidad de vida. Al cuarto mes de tratamiento, el paciente acudió al servicio de urgencias por presentar un incremento del perímetro abdominal y edemas en los miembros inferiores. Analíticamente, se puso de manifiesto un deterioro de la función hepática (raón normalizada internacional de 1,45; bilirrubina de 4 mg/dl); además, destacaban otras alteraciones de laboratorio: plaquetas 30.000/µl, leucocitos 1.500/µl, GOT 172 U/l, GPT 58 U/l, fosfatasa alcalina 515 U/l y GGT 320 U/l. En la eco-Doppler abdominal realizada se puso de manifiesto una imagen sugestiva de trombosis en el tronco portal, que se extendía a las ramas portales derecha e izquierda (fig. 1A). Tras el diagnóstico de trombosis portal aguda como causante del cuadro de descompensación hepática, se inició tratamiento con heparina de bajo peso molecular (HBPM) y se solicitó un estudio de la diátesis protrombótica. Dada la intolerancia al tratamiento antiviral del paciente, éste se suspendió. Se realizó un estudio de la diátesis protrombótica, en el que se detectó una mutación en homocigosis para el gen MTHFR, con la presencia del polimorfismo C677T, asociado a una hiperhomocistinemia moderada, que se corrigió con tratamiento con ácido fólico. A los 9 meses de la instauración del tratamiento anticoagulante se observó en la eco-Doppler abdominal de control, un tronco y unas ramas portales permeables, por lo que se interrumpió el tratamiento anticoagulante (fig. 1B).
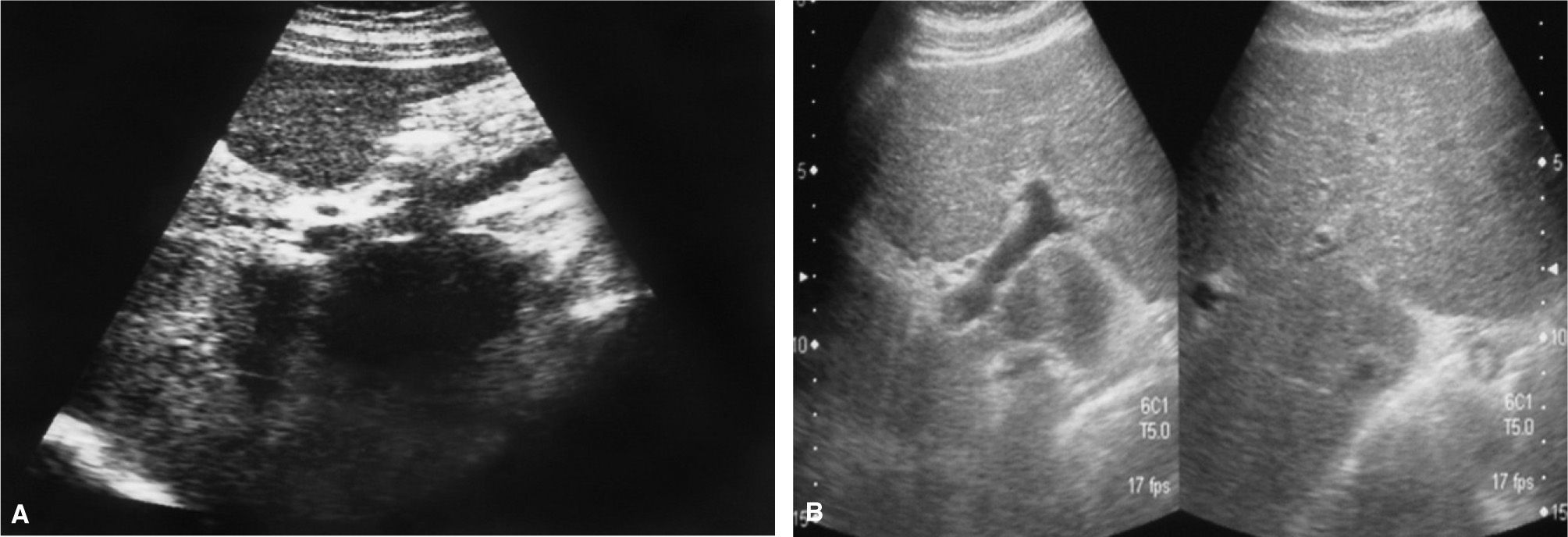
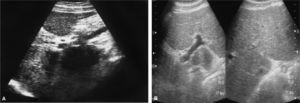
Caso 2Varón de 39 años de edad, con antecedentes de HCC y esplenectomía secundaria a esferocitosis hereditaria en la infancia. En el estudio basal no se realizó una biopsia hepática, aunque los datos clínicos, radiológicos y analíticos no hacían sospechar una hepatopatía evolucionada. Se inició tratamiento con IFN-Peg y ribavirina, sin efectos secundarios relevantes, hasta que en la semana 46 de tratamiento el paciente acudió al servicio de urgencias por presentar un dolor abdominal posprandial intenso, irradiado al hipocondrio derecho, junto con vómitos y fiebre de hasta 39 °C. Analíticamente, destacaba bilirrubina 1,7 mg/dl, GOT 190 U/l, GPT 200 U/l y plaquetas 503.000/µl. Se realizó una tomografía computarizada y una eco-Doppler abdominal urgente, en las que se observaba una trombosis portal del tronco y las ramas derecha e izquierda (fig. 2A). Con el diagnóstico de trombosis portal aguda, se inició anticoagulación con enoxaparina subcutánea y, posteriormente, con anticoagulantes orales. A los 9 meses de instauración del tratamiento anticoagulante se demostró una repermeabilización prácticamente completa de todo el eje esplenoportal (fig. 2B). En el estudio de la diátesis protrombótica no se detectaron datos de patología trombofílica. Ante estos hallazgos, y por recomendación del servicio de hematología, se suspendió el tratamiento anticoagulante, sin constatarse datos de retrombosis en el seguimiento hasta el momento. El paciente consiguió una respuesta virológica sostenida, que mantiene 18 meses después de terminar el tratamiento antiviral.
DISCUSIÓNLa trombosis portal benigna es el resultado de la concurrencia de múltiples factores, genéticos (deficiencias de proteína C, proteína S y antitrombina, o mutaciones, como la FVR506Q, factor V Leiden o G20210A de la protrombina), sistémicos adquiridos (presencia de infección intraabdominal, incluida la peritonitis, o de anomalías de la vena porta, como estenosis o atresia) y precipitantes locales del área portal y hepática4. Esta enfermedad puede dividirse en aguda y crónica. Ambas formas tienen un amplio espectro de manifestaciones clínicas que van desde el paciente asintomático a su diagnóstico en el seno de complicaciones relativas a la hipertensión portal secundaria, como la hemorragia variceal. Otros síntomas incluyen el hiperesplenismo que se asocia con trombopenia, dolor abdominal, ascitis, anorexia, astenia o pérdida de peso. La repermeabilización espontánea es infrecuente. La anticoagulación se recomienda en las trombosis agudas, en la que la completa o parcial repermeabilización del eje esplenoportal es posible en aproximadamente el 80% de los pacientes5. Asimismo, la anticoagulación no incrementa el riesgo de hemorragia y reduce el riesgo de infarto mesentérico5.
La incidencia de trombosis portal de origen no neoplásico (no asociada a carcinoma hepatocelular) en pacientes cirróticos no es bien conocida. Se ha estimado, según distintas series, entre el 0,6 y el 15,8%6. Esta variabilidad está relacionada con los heterogéneos grupos de pacientes analizados y las diferentes técnicas diagnósticas empleadas. La patogenia de la trombosis portal en pacientes con cirrosis hepática es poco clara. El descenso del flujo portal y las anomalías de la arquitectura hepática (como la presencia de linfangitis periportal y fibrosis) son los principales factores considerados en estos pacientes. La hiperhomocisteinemia es un factor de riesgo independiente para la producción de trombosis arterial y venosa7, y se ha demostrado la relación entre los valores de homocisteína y el riesgo de trombosis8. La cirrosis hepática es una causa adquirida de este trastorno como consecuencia del descenso de la expresión de los principales genes involucrados en su metabolismo. La mutación más frecuentemente asociada con el incremento de los valores de homocisteína es la presencia del polimorfismo C677T de la enzima metilentetrahidrofolato reductasa. Sin embargo, la presencia de hiperhomocisteinemia moderada, asociada o no a la mutación MTHFR C677T, aunque frecuente tanto en pacientes cirróticos como en pacientes con trombosis portal, no se ha asociado a un incremento del riesgo trombótico9.
Al mismo tiempo, la proporción de factores procoagulantes y anticoagulantes se encuentra modificada, por la reducción de la síntesis hepática, lo que puede considerarse un factor precipitante. Otros factores reconocidos asociados al desarrollo de trombosis portal en los pacientes cirróticos son el incremento de la presión portal y el estado terminal de la cirrosis hepática. A pesar de los factores de riesgo descritos, asociados a la presencia de cirrosis, sólo un bajo porcentaje de los pacientes cirróticos desarrolla trombosis portal, por lo que deben presentarse otros factores intercurrentes, o previos, para que en la evolución de estos enfermos se desencadene el evento trombótico10.
La incidencia de la trombosis del eje portal postesplenectomía no está claramente determinada, y varía entre el 1,6 y el 11%11,12. Dichos porcentajes no son altamente fiables debido a que en muchos casos no se diagnostica, al no ser clínicamente evidente. Se consideran factores que incrementan el riesgo de trombosis postesplenectomía la presencia prequirúrgica de esplenomegalia (al presentar el tamaño esplénico una clara relación con el diámetro de la vena esplénica), la trombocitosis y los síndromes mieloproliferativos13. La trombosis portal es una rara pero significativa complicación de la esplenectomía realizada en casos de enfermedades hematológicas. Un estudio retrospectivo reciente señala que las enfermedades más comunes que requieren esplenectomía en la infancia son la esferocitosis hereditaria y la talasemia mayor12. Sin embargo, en los síndromes mieloproliferativos es donde se detecta un mayor porcentaje de casos de trombosis portal postesplenectomía14. En un estudio prospectivo y observacional15 se puso de manifiesto que la mayoría de los casos de trombosis portal se diagnostican antes de los 15 días tras la intervención, y todos los casos sintomáticos antes del séptimo día posquirúrgico. Los pocos casos de presentación tardía (13-46 meses poscirugía) se consideran secundarios a trastornos ya existentes basalmente en los pacientes, como la presencia de un síndrome mieloproliferativo, que pueden ocasionar una trombosis portal espontánea sin tener relación con la esplenectomía. De lo anteriormente mencionado se desprende que la presencia de una esplenectomía en la infancia no justifica la existencia o el riesgo de trombosis portal en la edad adulta.
Tanto la HCC como la terapia con IFN-Peg o con IFN estándar inducen la producción de autoanticuerpos –crioglobulinas, factor reumatoide, anti-LKM, anticardiolipina y antifosolípido, entre otros–, que pueden tener un papel en la patogenia del estado de hipercoagulabilidad observado en pacientes con HCC16,17. Los anticuerpos antifosfolípido actúan de manera directa contra los fosfolípidos de la membrana celular, incrementando el riesgo de daño vascular local y, por tanto, de trombosis. Asimismo, se ha demostrado que el empleo de elevadas dosis de IFN-alfa, administradas en el tratamiento del melanoma metastático, induce la producción de anticuerpos anticardiolipina que se asocian con trombosis vasculares18.
El uso terapéutico de IFN-alfa en la leucemia mielocítica crónica se ha relacionado con la producción de microangiopatía trombótica, entidad asociada también con la infección por el virus de la hepatitis C19. De hecho, se ha documentado en modelos animales que el IFN produce un daño microvascular y una lesión de las células endoteliales, fenómeno que puede tener un papel patogénico en la isquemia digital que se observa en algunos pacientes tratados20. De lo anteriormente expuesto se desprende que muchas de las complicaciones vasculares constatadas en pacientes con HCC, tratados con IFN-Peg o IFN estándar, aunque infrecuentes, pueden ser secundarias al fármaco y no a la enfermedad hepática. Además, la diabetes mellitus y la hipertrigliceremia son considerados factores de riesgo añadidos de hipercoagulabilidad que, a su vez, pueden desencadenarse por el tratamiento con IFN-Peg21.
El tratamiento con IFN-Peg en pacientes con HCC puede provocar alteraciones en el equilibrio homeostático entre factores procoagulantes y trombolíticos, lo que contribuye a la producción de eventos trombóticos. Así, en los 2 casos presentados, la ausencia de otros factores protrombóticos, la relación temporal con el tratamiento con IFNPeg y la resolución de la trombosis sin recidiva tras el tratamiento anticoagulante apoyan la hipótesis expuesta.