OBSERVACIÓN CLÍNICA
Varón de 80 años de edad, que ingresó 2 meses antes en el servicio de hematología, con antecedente de anemia sin filiar, conocida desde hacía 2 años, y un cuadro de astenia, anorexia y pérdida de 20 kg de peso durante este período. En la exploración física, el paciente presentaba caquexia, con palidez cutánea y mucosa; la auscultación cardiopulmonar fue normal, y el resto de la exploración fue irrelevante.
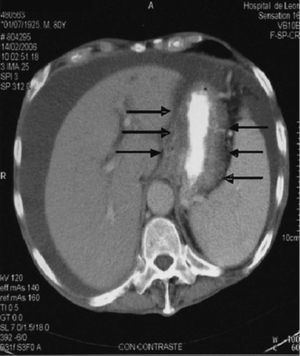
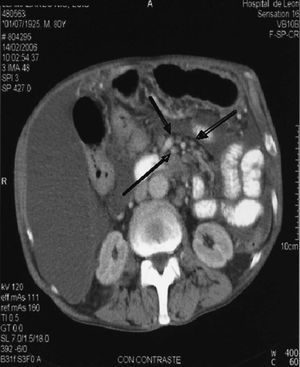
La analítica presentaba los siguientes resultados: leucocitos 3.800/µl, hemoglobina 7,3 g/dl (VCM 86 fL, HCM 30 pg) y plaquetas 84.000/µl; reticulocitos 1,8% (42.700/l). El frotis de sangre periférica reveló una anisopoiquilocitosis leve con hipogranularidad neutrofílica en cantidad moderada. La tomografía computarizada (TC) toracoabdominal realizada antes del ingreso mostraba ascitis adenopatías mediastínicas y mesentéricas, hepatosplenomegalia y engrosamiento del antro gástrico (figs. 1-3).
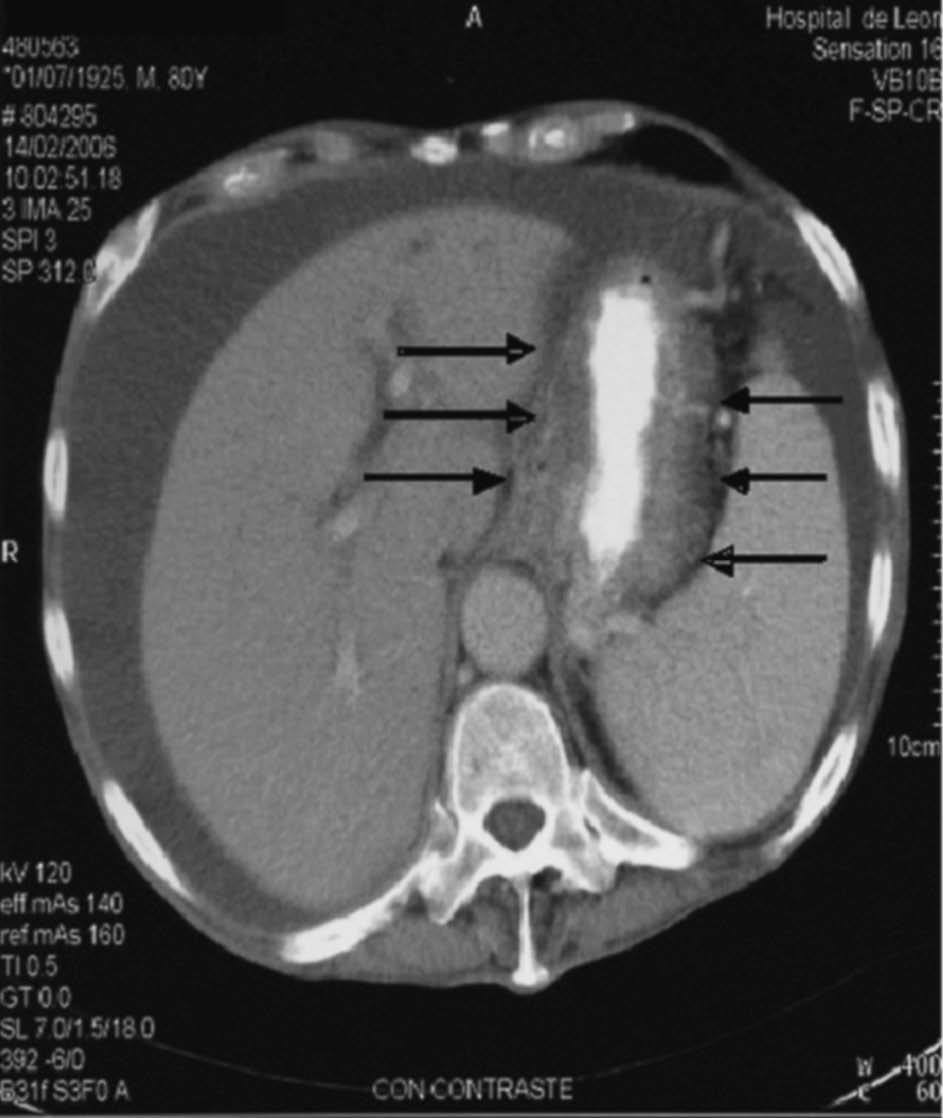
Fig. 1. Ascitis masiva. Esplenomegalia.
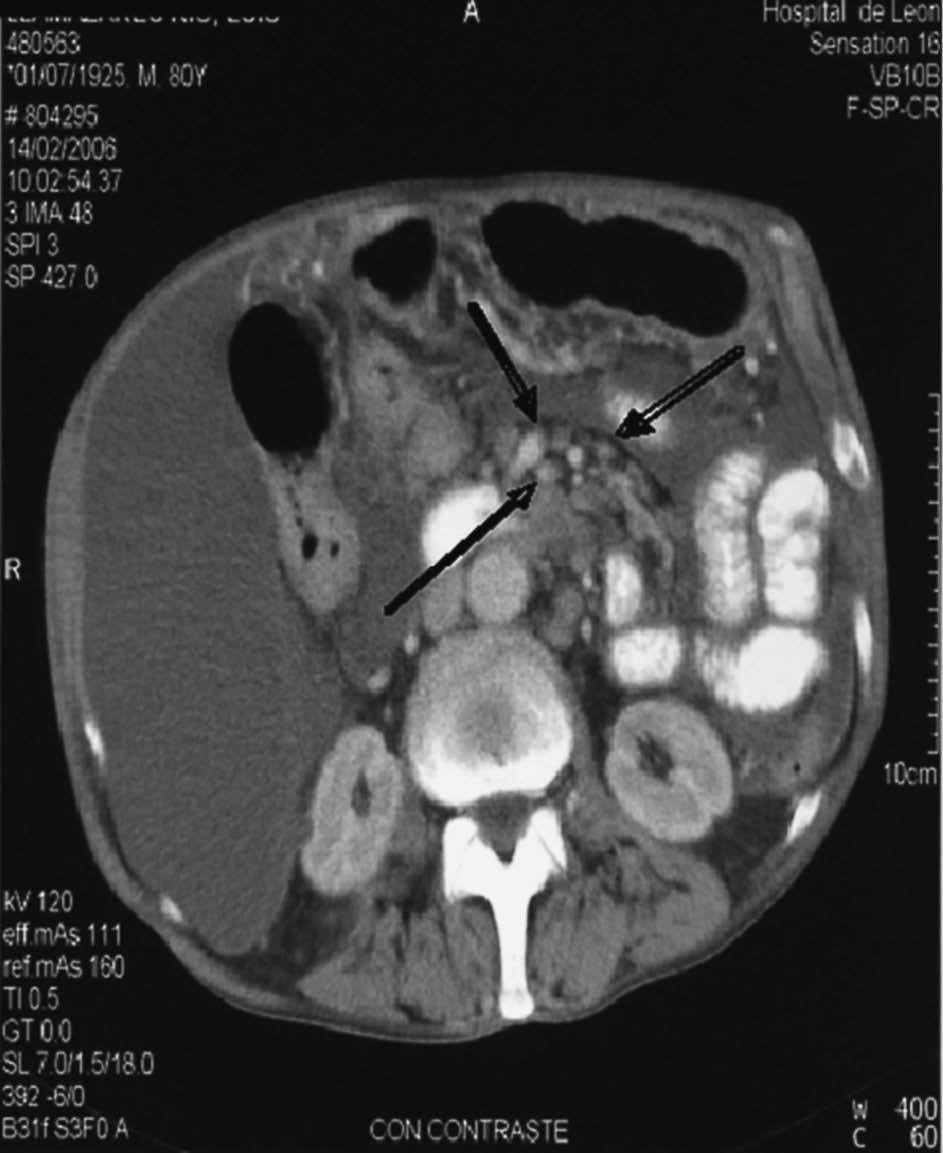
Fig. 2. Engrosamiento de la pared gástrica y del antro gástrico.
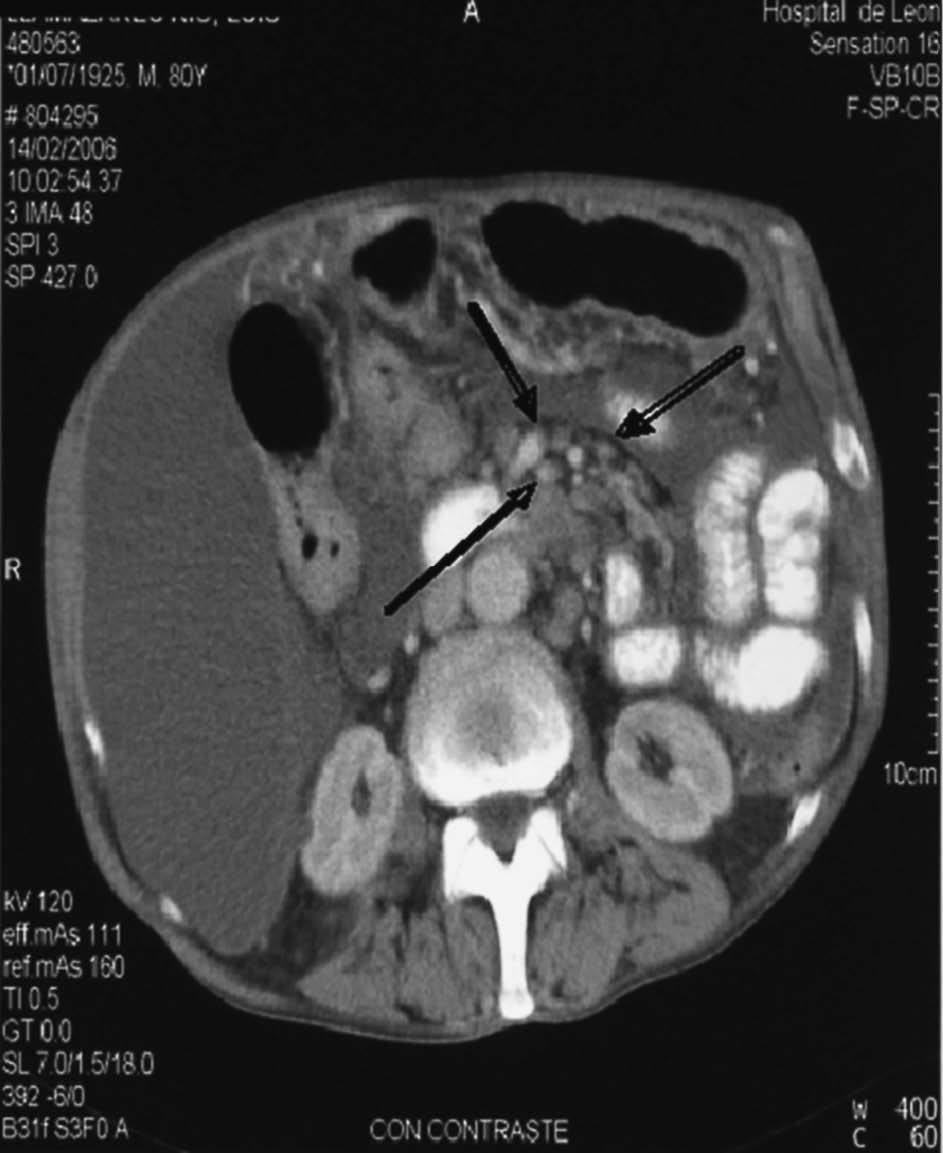
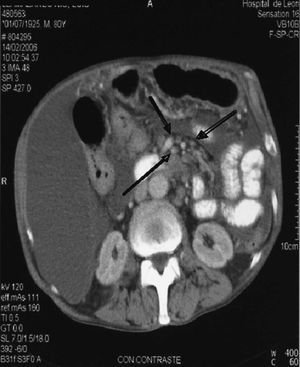
Fig. 3. Adenopatías alrededor de los vasos mesentéricos.
Se realizó una biopsia endoscópica del antro, que fue informada como gastritis crónica atrófica. Durante el ingreso, también se realizó al paciente una biopsia de médula ósea y una punción-aspiración con aguja fina (PAAF) del páncreas y las adenopatías infradiafragmáticas, que tuvieron un resultado histopatológico inespecífico, por lo que no ayudaron a aclarar el diagnóstico. Se planteó la realización de una laparotomía exploratoria con toma de biopsias, pero el paciente se negó a dicha prueba; por tanto, se decidió el alta hospitalaria con el diagnóstico de probable síndrome mielodisplásico.
Recientemente, el paciente ingresó en el servicio de medicina interna aduciendo continuar con la clínica anteriormente descrita, sumada a la aparición de un aumento progresivo del perímetro abdominal y sensación de plenitud gástrica.
En la exploración física el paciente continuaba pálido y desnutrido, y en el abdomen se apreciaba una semiología de ascitis. En la analítica, lo único destacable respecto a la realizada previamente era la aparición de una proteína C reactiva de 120 mg/l. En el perfil férrico destacaba: hierro 19 µg/100, transferrina 143 mg/100 y ferritina 883,3 ng/ml. La bioquímica del líquido ascítico reflejaba: 626 células (60% linfocitos), proteínas 3,2 g/dl y lactatodeshidrogenasa 314 U/l (normal: 230-460). La citología del líquido presentaba mínimos linfocitos con material fibrinohemático, negativo para células malignas. La baciloscopia en el líquido ascítico fue negativa. En sangre la ß-2-microglobulina 9,68 mg/l (normal: 0,8-2,20). La radiografía de tórax mostraba un seno costodiafragmático derecho pinzado, el resto era normal.
La TC toracoabdominal reveló: adenopatías paratraqueales inferiores derechas precarinales, la mayor de 2 cm de diámetro, adenopatías hiliares derechas, atelectasia de lóbulo inferior derecho, derrame pleural izquierdo, ascitis y esplenomegalia, engrosamiento de la pared y del antro gástrico con ligero descenso de las adenopatías del ligamento gastrohepático con respecto a la TC previa, páncreas normal y adenopatías alrededor de los vasos mesentéricos. No se apreciaron adenopatías en el retroperitoneo ni en las cadenas ilíacas.
Al paciente se le realizó una nueva gastroscopia, en la que se observó un antro de aspecto infiltrativo afectado hasta el bulbo duodenal, con 2 pequeñas lesiones ulceradas. Se indicó al endoscopista que tomara biopsias de estas úlceras, sobre todo muestras de la mucosa y la submucosa. El resultado histopatológico fue una úlcera crónica y una gastritis crónica granulomatosa, con probable origen tuberculoso.
El paciente inició tratamiento tuberculostático con rifampicina, isoniacida y pirazinamida; en las visitas de control, realizadas hasta 7 meses después del alta, presentaba una mejoría clínica y analítica significativa.
DISCUSIÓN
La tuberculosis (TBC) abdominal es una enfermedad poco común en los países desarrollados1. Las manifestaciones clínicas de la TBC pueden sugerir la presencia de una enfermedad tumoral, sobre todo en los grupos de población más expuestos a la infección (pacientes provenientes de países de alta endemia, bajo nivel socioeconómico, institucionalizados, etc.) y, entre los infectados, en los pacientes con un sistema inmunitario afectado (al cohólicos, usuarios de drogas por vía parenteral, diabéticos, cirróticos, pacientes oncológicos o sometidos a tratamientos con esteroides o inmunosupresores y, en los infectados por el virus de la inmunodeficiencia humana [VIH])1-8. En este sentido, debemos tener en cuenta especialmente a nuestros ancianos, muy expuestos al bacilo tuberculoso en épocas de alta endemia hace décadas en nuestro país y, por otro lado, a los inmunodeprimidos por una cuestión de edad. Como resultado de todo ello, este colectivo, expuesto a Mycobacterium tuberculosis, incluso en edades tempranas, tiene un elevado riesgo de desarrollar la enfermedad cuando con el paso de los años el sistema inmunitario va claudicando.
Algunos autores han sugerido que la aparición de esta enfermedad está en relación directa con la gravedad de la afectación tuberculosa pulmonar9,10. Otros postulan que la incidencia de TBC gastroduodenal podría estar aumentada con la terapia prolongada con antagonistas de los receptores H23,7.
Las formas de presentación más frecuentes de la TBC abdominal son: la TBC intestinal, en la que destaca la forma ileocecal (la más frecuente), la peritonitis tuberculosa y la linfadenitis mesentérica1,2.
La TBC gástrica es una de las presentaciones menos frecuentes de la TBC abdominal, con series que indican incidencias en torno al 2,3% de las autopsias de pacientes fallecidos por TBC pulmonar9,10. El mecanismo causal más común es la diseminación desde los ganglios linfáticos celíacos adyacentes. Otras vías son la hematógena durante la primoinfección tuberculosa y la deglución de bacilos durante la fase de enfermedad pulmonar activa o por ingestión de leche infectada, más propia esta última de los países con pocos recursos2,4,6,10.
La baja frecuencia de aparición de la TBC gástrica en pacientes con TBC pulmonar está justificada por la escasez de tejido linfoide en la pared del estómago, el bajo pH gástrico y el rápido vaciamiento del contenido gástrico2,6,9,10. Las lesiones se localizan sobre todo en la curvatura mayor y menor y en la región pilórica1,2,9. Pueden presentarse como lesiones ulceradas (más frecuente), hipertróficas o mixtas10. En el primer tipo, como en nuestro caso, pueden ser únicas o múltiples, de forma irregular y con márgenes mal definidos, que en ocasiones se confunden con la úlcera péptica o la enfermedad neoplásica gástrica9. El diagnóstico diferencial también se tendrá que realizar con entidades de características similares, como la sarcoidosis, la sífilis, la enfermedad de Crohn y la gastritis granulomatosa primaria2,9,10.
La clínica normalmente es inespecífica, e incluye epigastralgia, náuseas y vómitos, distensión abdominal, astenia, anorexia y pérdida de peso. En la analítica, en ocasiones pueden apreciarse leucocitosis con linfocitosis, anemia microcítica o normocítica y elevación de reactantes de fase aguda.
La anemia, en los casos de TBC gástrica, como el que presentamos, puede ser de origen mixto. En parte, estaría justificada por la afectación de los vasos de la pared gástrica; se produce un sangrado que en la mayoría de casos no suele ser agudo, pero sí mantenido en el tiempo9, que requiere a veces transfundir al paciente, como ocurrió en nuestro caso. Por otro lado, también desempeñaría un papel el proceso inflamatorio intercurrente, como se pudo observar en el perfil férrico de este paciente.
Cuando hay ascitis, el análisis bioquímico revelará, en la mayoría de los casos, una celularidad con predominio linfocitario y un cociente de albúmina entre el suero y líquido ascítico menor de 1,1, cuyo contenido es más rico en proteínas que en plasma, típico de los exudados6. En este paciente había un claro predominio de linfocitos (60%) en el recuento de células. Algunos autores sugieren que la determinación de ADA, del marcador tumoral CA 12,5 y del interferón gamma están elevados en el líquido ascítico de muchos casos de ascitis tuberculosa y TBC peritoneal; esta última determinación tiene una sensibilidad y una especificidad del 93 y el 98%, respectivamente. Por tanto, estos marcadores deberían tenerse en cuenta para establecer el diagnóstico diferencial, sobre todo en los casos de difícil diagnóstico2,6.
La prueba del Mantoux suele ser positiva en los casos de TBC abdominal, aunque debemos tener presente las condiciones especiales en que el resultado negativo nos puede llevar a un error de diagnóstico, como ocurre en los pacientes de edad avanzada, las personas sometidas a tratamientos con esteroides e inmunosupresores o los infectados por el VIH2,9. En el caso de nuestro paciente no se realizó dicha prueba, debido a que se llegó al diagnóstico por otras pruebas complementarias.
En la radiografía de tórax pueden observarse signos de enfermedad pulmonar activa simultánea en torno al 20% de los casos, según estimaciones de distintos autores1-3.
La TC es la prueba de imagen de mayor resolución y fiabilidad para detectar las lesiones típicas de la TBC abdominal. En el caso que presentamos, se observaron adenopatías mediastínicas y mesentéricas, ascitis, esplenomegalia y engrosamiento de la pared y del antro gástrico.
Las adenopatías son la manifestación más comúnmente encontrada en la TBC abdominal y están normalmente asociadas con la TBC gastrointestinal1,4, cuyas localizaciones más frecuentes son el mesenterio y la región perigástrica/periduodenal. La forma de presentación son adenopatías de baja atenuación central, en relación con la necrosis caseosa y el resalte periférico debido al tejido linfoide inflamatorio externo1,2,4.
Esta presentación, aunque típica, no es patognomónica de la TBC, ya que también se ha identificado en casos de linfoma, metástasis neoplásicas, infección piógena y enfermedad de Whipple1,4. Por tanto, el diagnóstico será difícil de establecer y requerirá por parte del clínico un alto índice de sospecha.
Las adenopatías también pueden apreciarse en la TBC duodenal, muchas veces asociada a la TBC gástrica, y manifestarse como un cuadro oclusivo del tracto de salida, por obstrucción extrínseca de la luz duodenal secundario al crecimiento de dichas adenopatías1-3,6,7,11-13.
La ascitis suele ser de alta densidad, lo que refleja el característico alto contenido en proteínas y células del líquido ascítico1,4. La esplenomegalia es un hallazgo relativamente común en la TBC abdominal.
Por último, el engrosamiento de la pared y del antro gástrico fue la clave diagnóstica del caso, ya que, a pesar de haberse realizado previamente una gastroscopia con resultado de gastritis crónica atrófica, en el último ingreso seguíamos teniendo una fuerte sospecha de TBC; por ello, repetimos dicha prueba insistiendo al endoscopista que tomara muestras de estas lesiones, de la mucosa y la submucosa, práctica poco habitual en las endoscopias sistemáticas, donde no suelen tomarse muestras de la submucosa; teniendo en cuenta que las lesiones de la TBC gástrica suelen localizarse en dicha región, esto podría influir en el bajo rendimiento de esta prueba y, por ello, muchos casos podrían quedar sin diagnosticar3. Además, con relativa frecuencia no es posible demostrar la presencia del bacilo de Koch mediante tinciones y cultivos específicos; por ello, en estos casos sólo se llegará a un diagnóstico de probabilidad9.
En este caso, el diagnóstico fue una gastritis crónica granulomatosa de probable origen tuberculoso.
El tratamiento de la TBC gástrica debe realizarse con los mismos antituberculosos y durante igual período que la TBC pulmonar. La cirugía debe reservarse sólo para los casos que presenten estenosis pilórica y/o grandes lesiones necrótico-caseosas, en las que la penetración de los fármacos se ve dificultada3,6,9,10.
Al paciente le fue instaurado tratamiento con rifampicina, isoniacida y pirazinamida, y se observó una mejoría clínica en las visitas de control realizadas hasta 7 meses después del alta, con desaparición de la astenia, ganancia de peso y elevación de los valores de hemoglobina y hematocrito.
Sin embargo, en este caso, no se realizaron pruebas endoscópicas ni de imagen de control posteriores.
En resumen, la TBC gástrica es una de las presentaciones menos frecuentes de la TBC abdominal. Se trata de una entidad difícil de diagnosticar, que requiere por parte del clínico un alto índice de sospecha1-3,10.
Debemos pensar en ella en los pacientes con algún grado de inmunodepresión y en ancianos1-8.
La clínica es poco específica (se observaban ciertos síntomas, como epigastralgia, náuseas y vómitos y pérdida de peso), indistinguible en muchas ocasiones de la úlcera péptica y la enfermedad neoplásica gástrica.
Los hallazgos analíticos son también poco orientativos, y a veces se detectan leucocitosis con linfocitosis, anemia y elevación de reactantes de fase aguda.
Las imágenes del TC suelen mostrar adenopatías, normalmente asociadas con la TBC gastrointestinal, localizadas sobre todo en el mesenterio y la región perigástrica/periduodenal1. También puede observarse un engrosamiento de las paredes y del antro gástrico, como en nuestro caso, que junto con las adenopatías en las zonas adyacentes, proporcionarán al conjunto un aspecto difícil de distinguir del linfoma, las metástasis neoplásicas, la infección piógena y la enfermedad de Whipple1,4.
A veces, el cuadro se acompaña de ascitis y hepatosplenomegalia inespecífica.
El diagnóstico se establecerá mediante endoscopia con toma de biopsia. A pesar de que el rendimiento de la prueba es bajo2, consideramos que éste es mejorable si se toman muestras de la mucosa y la submucosa, debido a la predominante localización submucosa de estas lesiones, que, por otro lado, no suele incluirse en la biopsia endoscópica habitual3.
No obstante, es relativamente frecuente no poder llegar a un diagnóstico microbiológico, y habrá que iniciar un tratamiento tuberculostático empírico basándose en un diagnóstico de probabilidad9.
Además, los hallazgos endoscópicos son similares a la enfermedad ulcerosa gástrica, la neoplasia gástrica y otras enfermedades granulomatosas9,10, lo que dificulta aún más el diagnóstico por parte del clínico.
Por último, el tratamiento debe realizarse con los mismos tuberculostáticos y durante igual período que la TBC pulmonar. La cirugía quedará reservada para las complicaciones y los casos que no puedan resolverse exclusivamente con tratamiento médico3,6,9,10.
AGRADECIMIENTOS
Nuestro agradecimiento a la Dra. Elena Reimunde Seoane, por su colaboración en el análisis de las imágenes, y a la profesora María Rosa Alonso Medina, por su ayuda inestimable en la traducción del texto.