El tumor de células granulares (TCG) es un tumor infrecuente descrito en 1926 por Abrikossoff. El 6% de estos tumores se encuentran en el tracto gastrointestinal siendo el esófago el lugar de mayor incidencia. El comportamiento suele ser benigno por lo que la mayoría de los TCG esofágicos son asintomáticos descubriéndose de forma casual en la realización de una gastroscopia. En el examen endoscópico aparece como una lesión polipoide o sésil, de aspecto submucoso, bien delimitada, recubierta de mucosa normal de color amarillento y con un aumento de su consistencia. La ecoendoscopia ha mejorado notablemente la evaluación de estas lesiones siendo actualmente la mucosectomía endoscópica el tratamiento de elección con una baja tasa de complicaciones. El estudio histológico de la pieza de resección evidencia características propias como la positividad para la proteína S-100. Presentamos 2 nuevos casos de TCG en esófago recientemente diagnosticados y se comentan los aspectos más relevantes de esta infrecuente enfermedad.
Granular cell tumors (GCT) are infrequent tumors first described by Abrikossoff in 1926. Gastrointestinal involvement occurs in about 6% of GCT, the esophagus being the most frequent location. These tumors are usually benign and asymptomatic and are usually found incidentally when an upper gastrointestinal endoscopy is carried out for another reason, showing an isolated polyp or sessile submucosal nodule, covered by intact yellowish mucosa and with firm consistency. Endoscopic ultrasonography has significantly improved the diagnosis of these lesions. Nowadays endoscopic mucosectomy is the treatment of choice of esophageal GCT with a low frequency of complications. Histologic analysis of the surgical specimen shows specific characteristics such as positivity for S-100 protein. We present two new cases of esophageal GCT that were diagnosed recently and discuss the most relevant features of this infrequent disease.
El tumor de células granulares (TCG) fue descrito por primera vez en 1926 por Abrikossoff en una serie de 5 pacientes con tumoraciones en la lengua, a las que él denominó mioblastomas1. Posteriormente describió en 1931 el primer caso de este tumor en el esófago2. Se trata de un tumor poco frecuente y ampliamente distribuido en el cuerpo humano, habiéndose descrito su aparición en la cavidad bucal (preferentemente la lengua), piel, tejido celular subcutáneo, mama, tiroides, árbol respiratorio, vía biliar, aparato genital y sistema nervioso, entre otros3–7. La afectación gastrointestinal es una de las menos frecuentes (2,7-8,1%) y puede verse afectado cualquier tramo del tubo digestivo8. La afectación esofágica es una de las más frecuentes constituyendo el 2% de los TCG digestivos3, localizándose más frecuentemente en el tercio distal9. El comportamiento suele ser benigno aunque se han descrito casos de malignización con metástasis a distancia10,11 o TCG asociados a otras neoplasias primarias como adenocarcinomas o carcinomas escamosos12–16. Hasta el momento se han descrito en la literatura médica 13 casos procedentes de centros españoles en MEDLINE (noviembre de 2010; palabras clave: esophagus, granullar cell tumor, myoblastoma, Abrikossoff)17–23, junto con otros 6 casos no indexados15,24–26. En la literatura internacional hasta 2007 existe notificación de unos 270 casos publicados de localización esofágica27.
Presentamos 2 nuevos casos de TCG en esófago recientemente diagnosticados y se comentan los aspectos más relevantes de esta poco frecuente enfermedad.
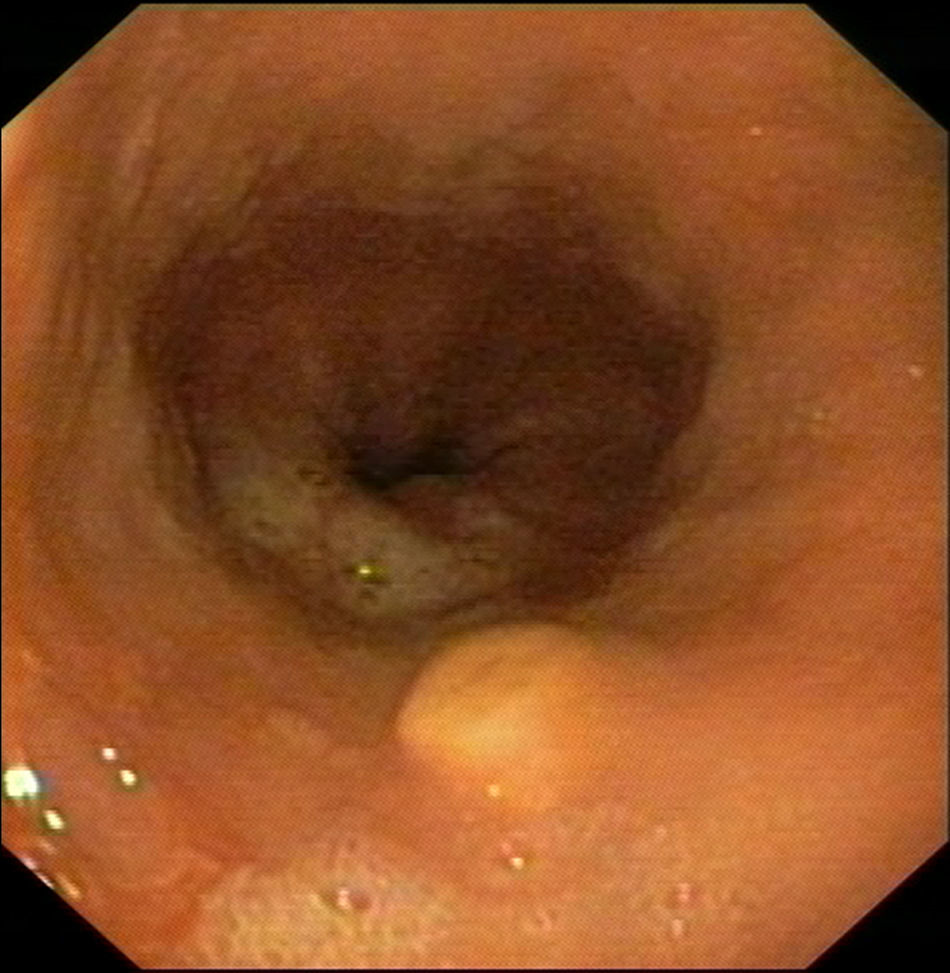
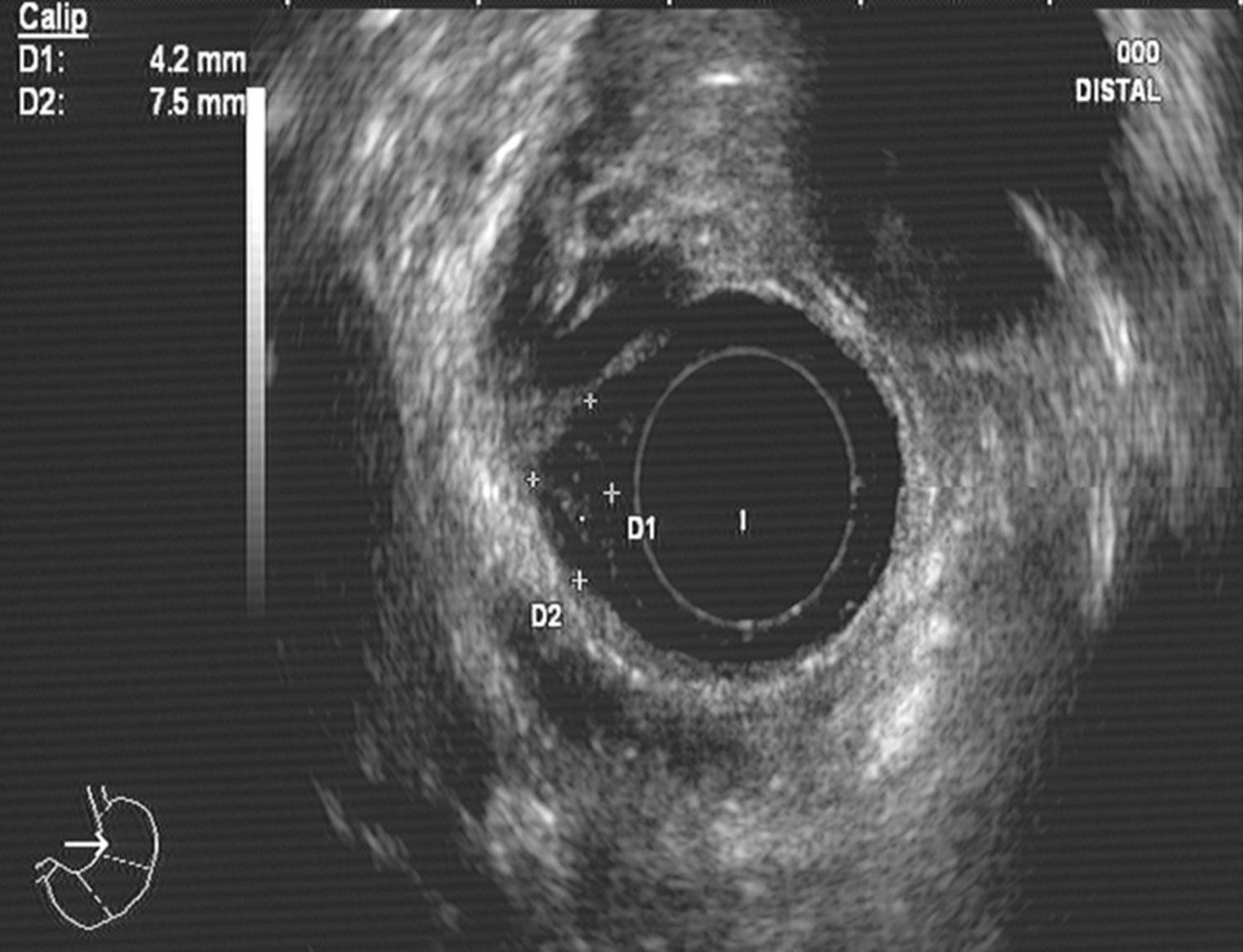
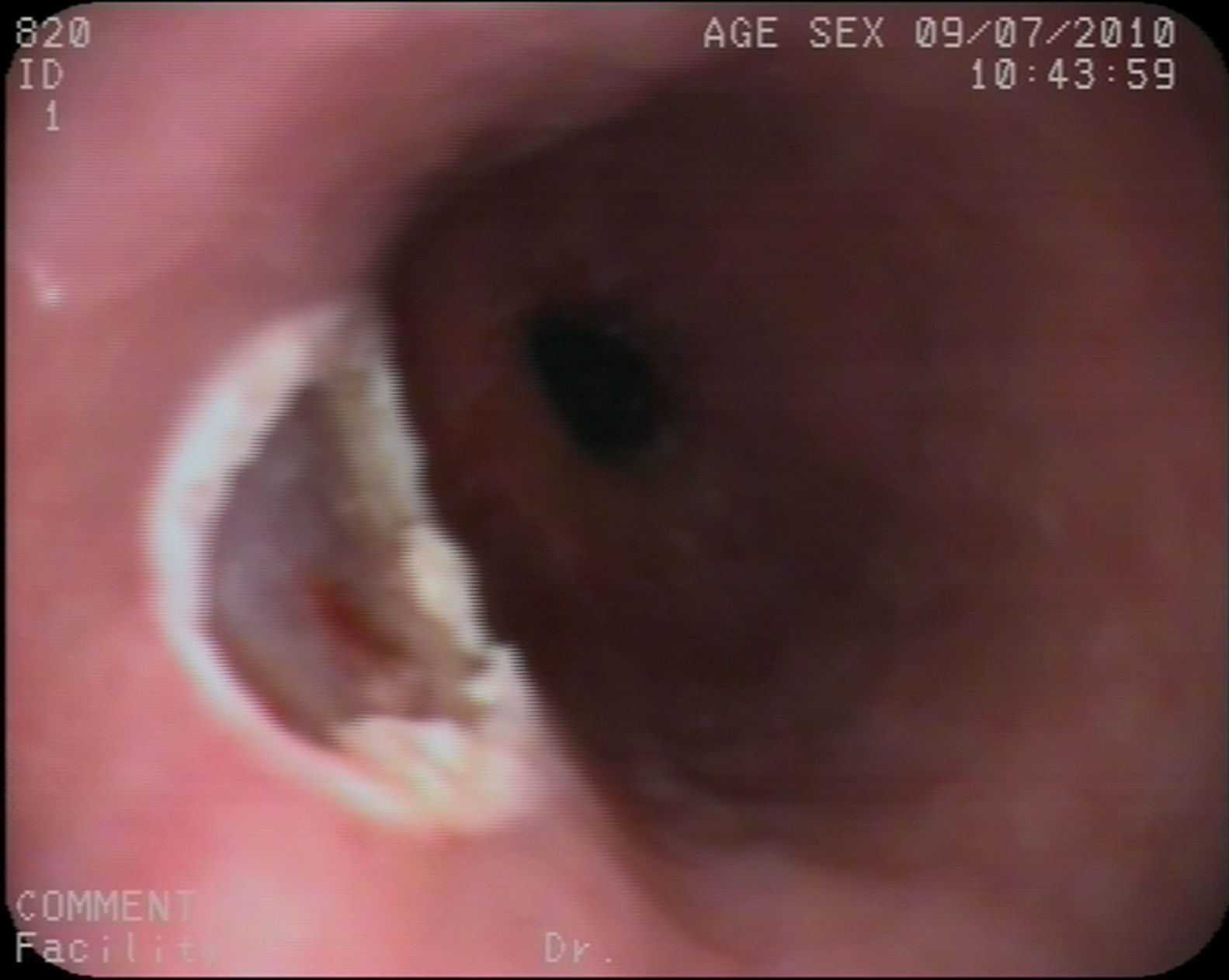
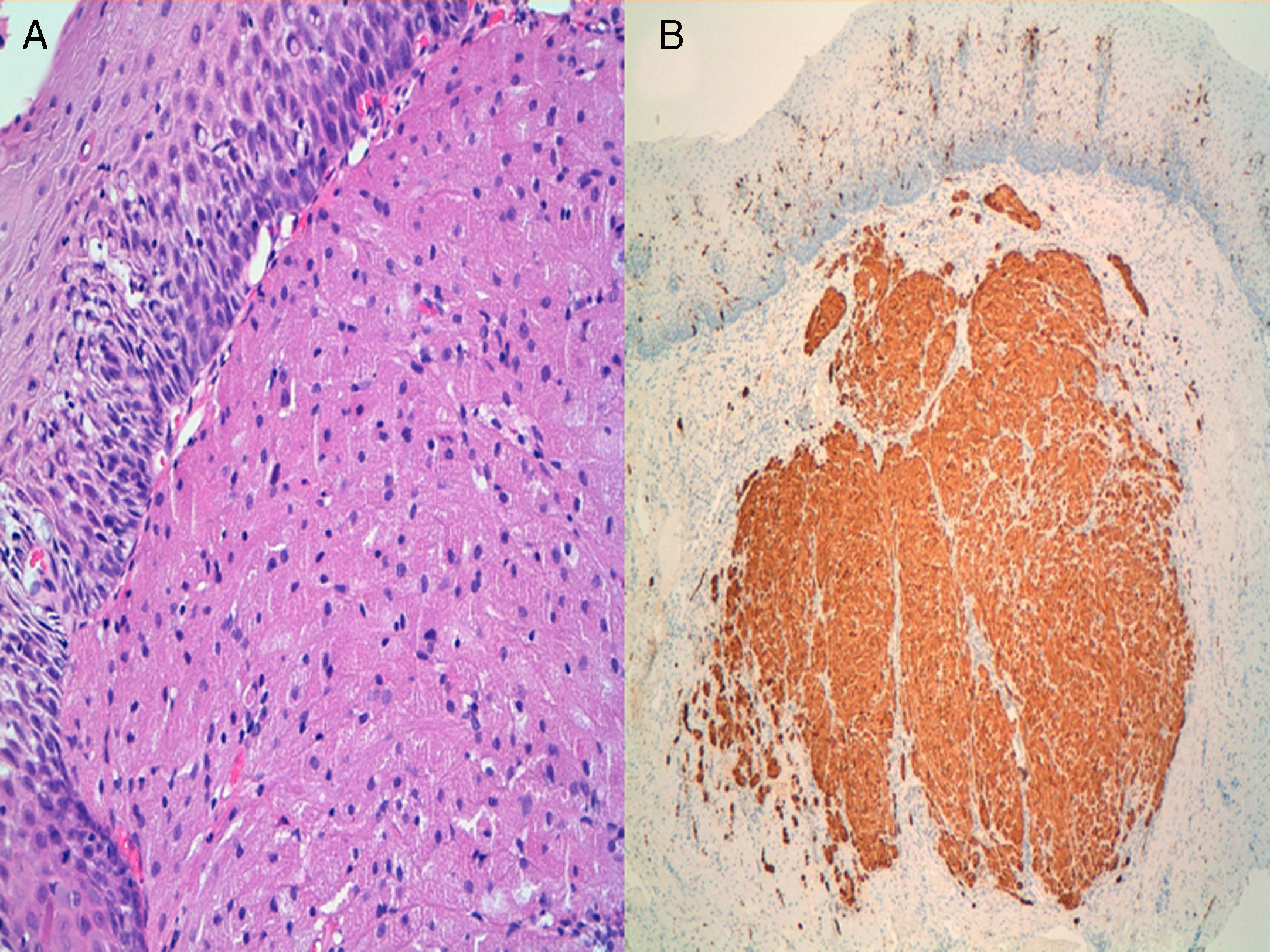
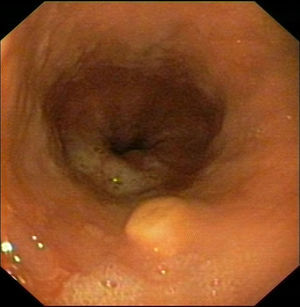
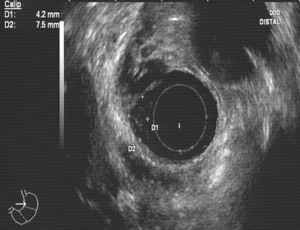
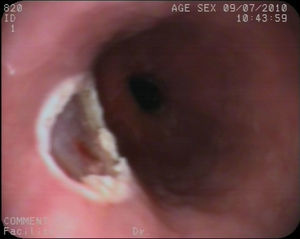
Caso clínico 1Varón de 30 años con antecedentes de prostatitis crónica en estudio por epigastralgia ocasional junto con pirosis. Se solicitó una gastroscopia en la que se observó en esófago distal una lesión nodular redondeada, amarillenta, umbilicada, móvil y dura, de unos 10mm, de la que se tomaron biopsias (fig. 1). Estas fueron informadas como una proliferación de células con núcleo pequeño y central y citoplasma amplio y granular, con positividad para la proteína S-100, compatible con tumor de células granulares. Se realizó posteriormente una ecoendoscopia con visualización de la lesión a nivel exclusivamente mucoso (T1) de unos 8mm, con ausencia de adenopatías patológicas (fig. 2). Ante estos hallazgos se realizó una mucosectomía con asa de diatermia, previa inyección submucosa de suero fisiológico sin incidencias (fig. 3). La histología fue compatible con el diagnóstico previo de tumor de células granulares (fig. 4). Al paciente se le realizan en estos momentos controles endoscópicos periódicos.
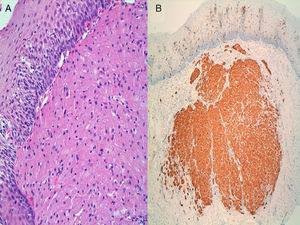
Estudio histológico de la pieza endoscópica compatible con tumor de células granulares. A) Tinción de hematoxilina-eosina. Proliferación de células con núcleo pequeño y central y citoplasma amplio y granular. B) Inmunohistoquímica con proteína S-100, comprobando captación intensa de la misma.
Paciente varón de 65 años sin antecedentes de interés salvo pirosis ocasional. Se realizó una gastroscopia en la que se visualizó a nivel supracardial una lesión polipoidea semipediculada de 8mm. Las biopsias de la lesión esofágica se describieron como una proliferación fusocelular de estirpe estromal de malignidad indeterminada, recomendando la extirpación completa para su mejor filiación histológica. Se completó el estudio con una ecoendoscopia encontrando una lesión hipoecoica de 8mm con áreas anecogénicas en su interior que dependía de la capa mucosa y con integridad de la muscular propia. Se realizó posteriormente una resección endoscópica de la lesión con asa de diatermia previa inyección submucosa de suero fisiológico, quedando una escara amplia y profunda pero con un vaso visible sin sangrado por lo que se colocaron 3 hemoclips sin complicaciones inmediatas. La histología fue compatible con un tumor de células granulares esofágico. En la gastroscopia de control en 6 semanas se visualizó una cicatriz de polipectomía siendo las biopsias compatibles con cambios inflamatorios inespecíficos sin evidencia de tumor residual. Actualmente el paciente sigue revisiones endoscópicas anuales.
DiscusiónA pesar de que el TCG es una lesión relativamente rara en el esófago, dentro de los tumores estromales ocupa el segundo lugar tras los leiomiomas. La localización más frecuente es en el esófago distal (65-75%)3 como en nuestros 2 casos, siendo habitualmente solitarios aunque pueden ser múltiples en el 10% de los pacientes y pudiendo afectar a otras áreas del tracto digestivo8,28. Respecto a la mayor incidencia según el sexo, los estudios no son concluyentes3,7,29. Los TCG suelen diagnosticarse en la edad media de la vida con un rango entre los 19 y 65 años7. En nuestro caso ambos pacientes eran varones y diagnosticados a los 30 y 65 años de edad. No se observaron datos histológicos de malignidad, si bien se ha estimado que entre un 1,5 y un 2,7% de los TCG son malignos, con aparición de metástasis linfáticas o a distancia en el 50-70% de estos casos10,11,30,31.
En un principio se creía que el TCG se originaba de las células del músculo estríado, denominándose por tanto mioblastoma de células granulares2. Posteriormente la naturaleza e histogénesis del TCG ha sido ampliamente debatida, considerándose hoy en día que su origen reside en las células de Schwann6,32, dado que se ha observado una elevada concentración de cerebrósidos y gangliósidos en estas células, así como un patrón neuronal de crecimiento33 y la presencia en inmunohistoquímica de proteínas específicas del sistema nervioso como S-10034. La expresión de nestina en los TCG indica que estos tumores podrían proceder de una célula madre pluripotencial del tracto gastrointestinal, con capacidad para diferenciarse bien a células intersticiales de Cajal o células del sistema nervioso periférico35.
La mayoría de los TCG esofágicos son asintomáticos y se descubren de forma casual en la realización de una gastroscopia solicitada por otro motivo (dispepsia, epigastralgia, reflujo gastroesofágico, etc.) o en un estudio necrópsico. No obstante, si el crecimiento tumoral es importante (tumores mayores de 1cm), pueden producir síntomas como disfagia9,36. El aspecto endoscópico es el de una lesión polipoide o sésil, submucosa, bien delimitada, normalmente menor de 1cm, recubierta de mucosa normal de color amarillento y con un aumento de su consistencia. Excepcionalmente puede verse como una lesión ulcerada o estenosante simulando un carcinoma esofágico37,38. La biopsia endoscópica puede permitir el diagnóstico aunque la localización submucosa hace que, en la mitad de los casos, solo se realice un diagnóstico definitivo con la resección de la lesión. En el primer caso que presentamos la biopsia fue suficiente para obtener el diagnóstico, pero no en el segundo caso, donde fue necesaria la pieza de resección para llegar al diagnóstico final.
En los últimos años se han realizado numerosos avances para el diagnóstico de las lesiones submucosas, siendo uno de ellos la ecoendoscopia. En el caso de los TCG se dispone de información desde comienzos de los años 9039, permitiendo la evaluación de la profundidad de la lesión, siendo la precisión diagnóstica del 97-100%. Los TCG esofágicos se observan normalmente como lesiones hipoecogénicas, homogéneas, con bordes regulares y dependientes de la capa mucosa o submucosa, la mayoría de las veces menores de 2cm. La presencia de lesiones mayores de 2cm, con irregularidad de los bordes o rotura de la capa submucosa o muscular propia indica malignidad con una gran probabilidad. Un reciente artículo evaluó la precisión diagnóstica de la ecoendoscopia con sonda de alta frecuencia, para diferenciar los TCG de los leiomiomas, encontrando una sensibilidad del 85,7% y una especificidad del 96,7% si las lesiones cumplían, al menos, 2 de 3 características diferenciadoras: coloración amarillenta de la lesión, mayor hiperecogenicidad respecto a la capa muscular adyacente y bordes poco delimitados, siendo esto característico de los TCG40. La coloración amarillenta en la endoscopia es algo bastante característico de estas lesiones y que permite ya desde el primer momento sospechar la presencia de un TCG. Por otro lado, esta técnica va a permitir también la valoración de la resecabilidad endoscópica de la lesión41 que es posible siempre que no sobrepase la muscular propia. En nuestros 2 pacientes la imagen ecoendoscópica evidenció lesiones hipoecogénicas sin diagnóstico definitivo por este método de TCG. La mucosectomía fue posible dado que las lesiones dependían exclusivamente de la capa mucosa. La ecoendoscopia también permite la toma de muestras mediante punción-aspiración con aguja fina, aunque su sensibilidad no es muy grande para lesiones esofágicas malignas de pequeño tamaño42. Por otro lado, la tomografía computarizada es útil en el estudio de extensión tumoral en caso de malignidad, si bien para la valoración de adenopatías regionales es más sensible la ecoendoscopia.
Una vez descubierta la lesión y realizado el estudio ecoendoscópico para valorar su resecabilidad, el procesamiento histológico de la pieza y la utilización de inmunohistoquímica (IHQ) va a permitir realizar el diagnóstico definitivo de TCG y descartar la presencia de datos de malignidad. Microscópicamente se observan como una tumoración con proliferación de células granulares, poligonales, con núcleo pequeño hipercromático y citoplasma amplio eosinófilo repleto de gránulos PAS + y diastasa resistente. Estos gránulos se ha comprobado que corresponden a acumulaciones de lisosomas intracitoplásmicos. Respecto a la IHQ se ha demostrado la presencia de proteínas específicas del sistema nervioso (S-100) y de la mielina del nervio óptico (PS y PO), así como vimentina, nestina, proteína enolasa neural específica y laminina22,27. La presencia de más de un 50% de células positivas para p53 o más del 10% para Ki67 se correlaciona con malignidad de estos tumores43. Una característica típica de este tumor es que puede inducir hiperplasia seudoepiteliomatosa del epitelio subyacente pudiéndose confundir con un carcinoma escamoso bien diferenciado.
Dado que son tumores poco frecuentes, no se ha llegado a un consenso sobre cuál es la mejor actitud terapéutica ante un TCG. Cuando el tumor es < 1cm y el paciente está asintomático, la mayoría de los autores recomiendan seguimiento endoscópico semestral o anual36. En cambio, cuando la lesión es > 1cm se suele aconsejar la resección endoscópica, siendo posible si la lesión cumple los siguientes criterios: tamaño < 2cm, no afectación de la capa muscular propia valorada por ecoendoscopia y ausencia de datos de malignidad41. Para este propósito se han descrito diversas técnicas como la fulguración con láser YAG44,45 o la inyección de alcohol deshidratado46, ambas técnicas prácticamente en desuso hoy en día.
Actualmente la mucosectomía endoscópica es un procedimiento eficaz, seguro, que permite realizar un análisis histológico de la totalidad de la lesión y que presenta un coste inferior a la alternativa quirúrgica con una menor tasa de morbimortalidad. Esta técnica puede realizarse bien directamente con un asa de polipectomía habitual41 o bien mediante técnica de ligadura con banda23,47. En ambas técnicas es recomendable la inyección previa, en la base de la lesión, de suero fisiológico para levantar la misma y evitar posibles complicaciones. Estas 2 técnicas fueron evaluadas en una serie de casos prospectiva en la cual se resecaron 20 lesiones submucosas esofágicas en un periodo de 4 años siendo compatibles 12 de ellas con TCG. El resto de lesiones fueron 6 leiomiomas, un GIST y un lipoma. De los TCG, 10 fueron resecados tras ligadura con banda y 2 con polipectomía tras inyección de adrenalina submucosa. En la serie global no hubo complicaciones mayores pero en el 40% de los pacientes se produjo hemorragia postresección, bien inmediata o al cabo de horas, que se controló con medidas hemostásicas y sin precisar transfusión sanguínea en ningún paciente48. En otras series más amplias la frecuencia de hemorragia fue significativamente más baja, probablemente debido a mayor experiencia49,50. En nuestros 2 casos se realizó la mucosectomía con asa de polipectomía previa inyección se suero fisiológico sin incidencias, aunque la presencia de una vaso visible en el segundo caso obligó a la colocación de clips profilácticos, sin datos de hemorragia posteriormente. Finalmente, la resección quirúrgica queda en estos momentos relegada a lesiones de gran tamaño o con datos de malignidad.
En resumen, los TCG deben considerarse dentro del diagnóstico diferencial de las lesiones submucosas esofágicas encontrando en la ecoendoscopia un procedimiento diagnóstico esencial y en la mucosectomía endoscópica, un tratamiento eficaz y seguro para la gran mayoría de estas lesiones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.