El tumor de Krukenberg supone una variedad de cáncer metastático que infiltra de manera unilateral o bilateral el ovario, cuyo origen puede ser conocido o no. Su incidencia es difícil de evaluar, pero se estima que varía entre el 3 y el 8% de los tumores de ovario. En la mayoría de los casos se reconoce el tumor primario; éste es de origen digestivo (sobre todo gástrico o colorrectal). Hay alguna referencia al tumor primario hepático (vesícula biliar y hepatocarcinoma), pero ninguna al tumor de Krukenberg cuyo tumor primario hepático sea un hepatocarcinoma fibrolamelar. Presentamos el caso de una paciente de 45 años de edad, que presentó un dolor en hemiabdomen inferior, diagnosticado de tumor de Krukenberg de origen hepático. Aunque es posible la afectación ovárica como signo inicial de tumores digestivos, el origen hepático es raro.
Krukenberg’s tumor refers to unilateral or bilateral ovarian metastatic tumors whose origin may be known or unknown. The incidence of this type of tumor is difficult to evaluate but may represent between 3% and 8% of ovarian tumors. In most cases, the primary tumor is identified and is usually digestive (basically gastric or colorectal). There are some references to primary hepatic tumors (gall bladder tumor and hepatocarcinoma) but none to fibrolamellar hepatocarcinoma as the primary tumor. We present the case of a 45-year-old woman who presented with lower hemiabdominal pain and who was diagnosed with Krukenberg’s tumor of hepatic origin. Although ovarian involvement in primary digestive tumors is possible, hepatic origin is rare.
La variante histológica fibrolamelar del hepatocarcinoma primario (HCC-FL) es una forma de presentación clínicopatológica distintiva poco frecuente1. Se ha asociado implícitamente a mejores resultados pronósticos en términos de supervivencia, aunque se han indicado resultados contradictorios sobre este último punto2. Suele presentarse en pacientes jóvenes, sin enfermedad hepática de base, lo que origina un diagnóstico tardío y a veces en estadios avanzados de la enfermedad. Todas estas características apoyan la necesidad de tratamientos quirúrgicos agresivos, con un mejor resultado en términos de supervivencia a largo plazo3.
Además, una forma de inicio, como es el tumor de Krukenberg, con metástasis bilaterales ováricas no se ha relacionado con el HCC-FL. Según la Organización Mundial de la Salud, el tumor de Krukenberg es un tumor ovárico, con producción intracelular de mucina por células en «anillo de sello», asociado a una proliferación de estroma sarcomatosa. Sin embargo, el concepto ha sido ampliado, y hoy en día hace referencia también a cualquier carcinoma metastásico del ovario unilateral o bilateral, independientemente del lugar de origen del tumor primario, conocido o desconocido.
Presentamos el caso clínico de una paciente afecta de un hepatocarcinoma fibrolamelar con un inicio en forma de tumor de Krukenberg.
OBSERVACIÓN CLÍNICASe trata de una paciente de 45 años de edad, sin antecedentes médicos ni quirúrgicos de interés, que acudió a nuestra consulta por presentar un cuadro de dolor abdominal, de 5 meses de evolución, localizado en el hemiabdomen inferior, de tipo constante, progresivo en intensidad, que evolucionó a moderado-grave en las últimas semanas. La paciente no refería ninguna sintomatología digestiva ni ginecológica asociada.
En la exploración física destacaba un buen estado general, con constantes vitales mantenidas. La auscultación cardiopulmonar fue normal y la exploración abdominal reveló una hepatomegalia no dolorosa a expensas del lóbulo hepático izquierdo, así como la palpación de masas redondeadas bien delimitadas y duras en ambas fosas ilíacas.
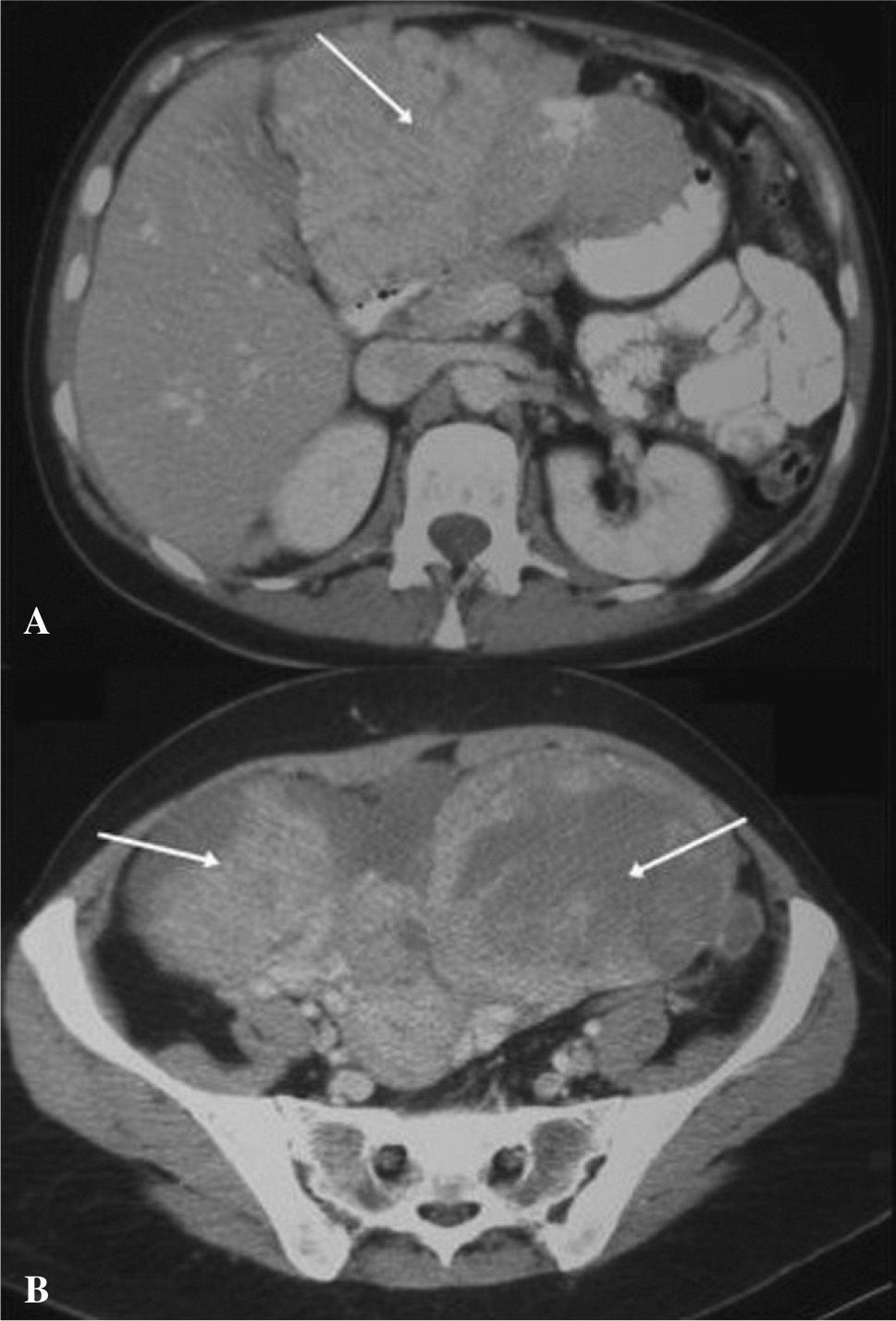
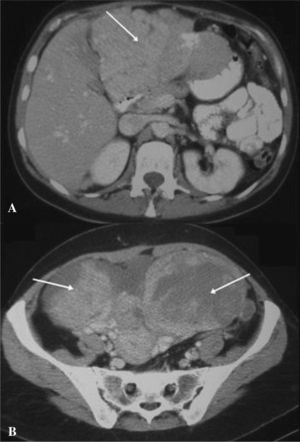
Se realizó una radiografía simple de abdomen que no mostró hallazgos significativos. Una ecografía abdominal reveló un hígado heterogéneo con una lesión ocupante de espacio en los segmentos II y III del lóbulo hepático izquierdo, así como grandes masas ováricas bilaterales, con líquido libre ascítico. El estudio se completó con una tomografía computarizada (TC) y una resonancia magnética (RM) abdominal, que mostraron la presencia de grandes masas anexiales bilaterales asociadas a líquido intraperitoneal, múltiples implantes peritoneales en el epiplón mayor, el perihepático, la gotiera paraaórtica derecha y la pelvis menor (figs. 1a y b), así como una lesión hepática de contornos mal delimitados, que afectaban a la práctica totalidad del segmento II-III del lóbulo hepático izquierdo.
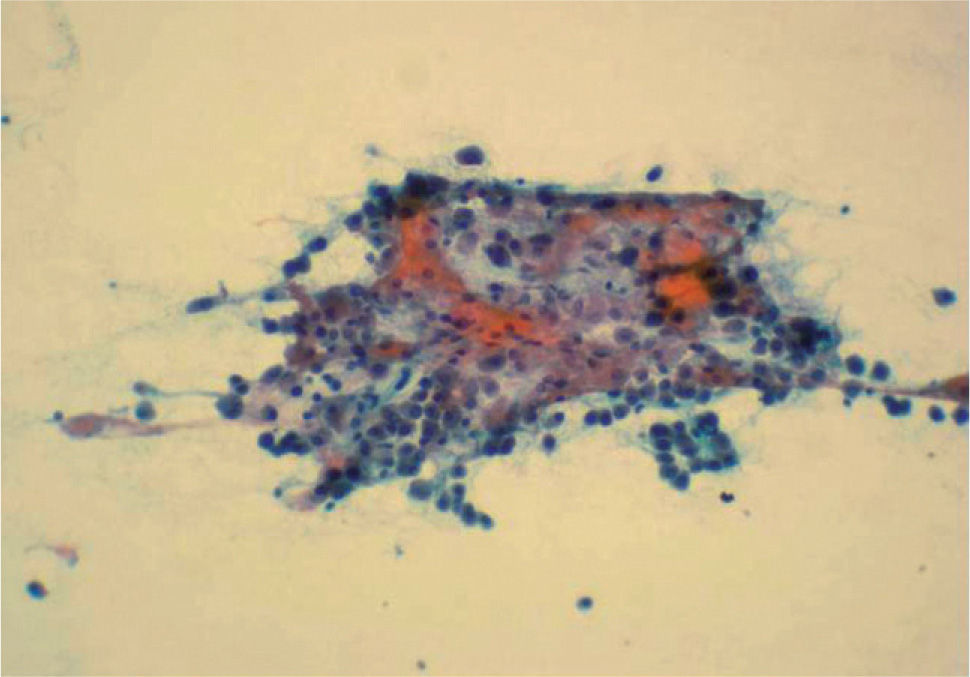
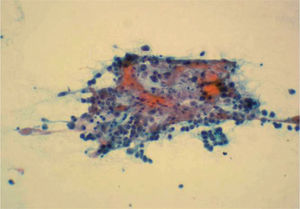
El diagnóstico inicial fue de tumor ovárico con metástasis hepáticas. Sin embargo una punción-aspiración con aguja fina (PAAF) de las lesiones ováricas mostraron una celularidad maligna con características morfológicas semejantes a los hepatocitos (fig. 2). En la analítica general, la paciente presentaba serologías virales hepáticas negativas, con CEA de 1,1 ng/ml, CA 19,9 de 5,2 U/ml, CA 125 de 165 U/ml, CA 50 de 4 U/ml, CA 72,4 de 9,2 U/ml y alfafetoproteína (AFP) de 5,1 ng/ml.
Teniendo en cuenta la citología, las imágenes, la edad de la paciente y la ausencia de enfermedad hepática de base, el diagnóstico diferencial se planteó entre tumor hepático primario con metástasis ováricas y peritoneales, o tumor ovárico primario con metástasis hepáticas y peritoneales. Dado el contexto clínico se decidió la intervención quirúrgica.
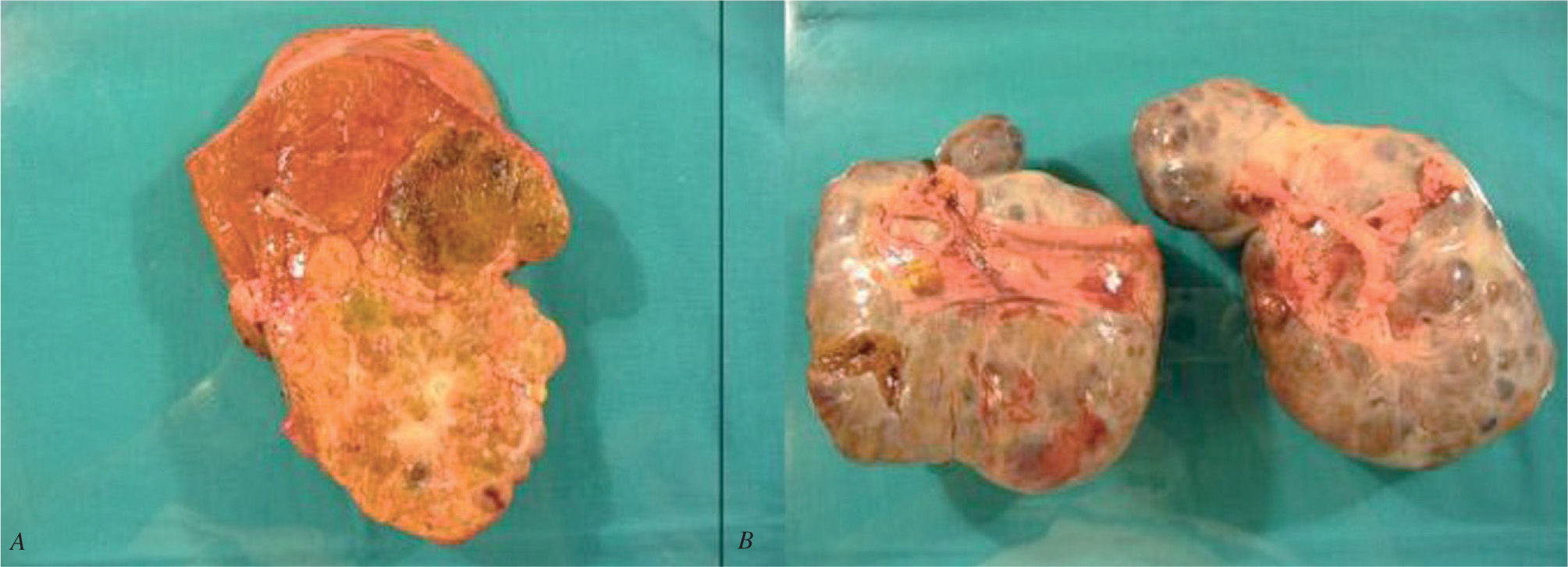
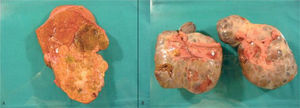
Durante la cirugía se confirmó la presencia de grandes tumoraciones bilaterales ováricas con implantes peritoneales en el espacio de Douglas, el epiplón mayor y el peritoneo diafragmático derecho. Asimismo, se halló una tumoración hepática izquierda en el segmento II-III. Se realizó una hepatectomía izquierda con doble anexectomía, omentectomía y peritonectomía (figs. 3a y b). La paciente cursó un postoperatorio satisfactorio, y fue dada de alta a los 10 días de la intervención quirúrgica.
El examen anatomopatológico halló un HCC-FL bien diferenciado (G1) de 14 × 11 cm, sin satelitosis y con un 5% de necrosis tumoral. Los nódulos peritoneales y las masas ováricas correspondieron a metástasis múltiples de HCC-FL.
La paciente fue sometida a ciclos de quimioterapia cada 2 semanas, basada en gemcitabina 1.000 mg/m2 el primer día y oxaliplatino 100 mg/m2 el segundo día. Recibió un total de 4 ciclos, con mala respuesta al tratamiento. En la TC de control a los 6 meses se constató un aumento de los implantes peritoneales, así como una recidiva retroperitoneal paraaórtica y en la bifurcación ilíaca. Tras 24 meses de seguimiento, con un estado general relativamente conservado, un índice de Karnovsky del 50% y tratamiento paliativo domiciliario, la paciente falleció por una recidiva de la enfermedad y un síndrome de la vena cava inferior.
DISCUSIÓNHepatocarcinoma fibrolamelarEl HCC-FL es una variante histológica del hepatocarcinoma, descrita por Edmonson en el año 19564. Sin embargo, la implicación clínica de este tipo de tumor no fue claramente definida hasta 1980, cuando Craig et al5 y Berman et al1 reflejaron la ausencia de enfermedad subyacente en el hígado, la negatividad de los marcadores hepáticos, así como el mejor pronóstico en los pacientes afectados por este tipo de tumor.
Desde el punto de vista epidemiológico, el HCC-FL afecta principalmente a pacientes jóvenes, en la segunda y la tercera décadas de la vida. Afecta por igual a mujeres que a varones, y supone un 1-9% del conjunto de los hepatocarcinomas6. No se ha observado ninguna relación entre la cirrosis o la hepatitis y el desarrollo de un HCC-FL; tampoco se han hallado factores de riesgo6. La incidencia es mayor en los países occidentales en contraposición a lo que ocurre en los países asiáticos6.
La presentación clínica es variable. Dado que aparece en personas jóvenes y sanas, alcanza un gran tamaño antes de provocar síntomas y éstos, si los hay, son secundarios al crecimiento. Suelen alcanzar diámetros superiores a los 10 cm en más del 70% de los casos2. Los pacientes suelen referir dolor y se palpa una masa en el hipocondrio derecho, síntomas que, por ser inespecíficos y aparecer en personas jóvenes y sanas, han podido pasar desapercibidos, pero están presentes entre los 3 y los 12 meses previos al diagnóstico. En pacientes varones puede aparecer ginecomastia, debido a la conversión de andrógenos circulantes por la enzima aromatasa producida por los hepatocitos malignos del tumor7. La ictericia, aunque sólo se ha descrito en un 5% de los casos, suele producirse por fenómenos compresivos sobre la vía biliar y no por insuficiencia hepática8. La presencia de fiebre, dolor, trombosis venosa o enfermedad metastásica, como en nuestro caso, son hallazgos infrecuentes9. Histológicamente, se caracteriza por la llamada tríada histológica, que consiste en la presencia de células con citoplasma eosinofílico, presencia de grandes núcleos con nucléolos prominentes y un estroma fibroso dispuesto en capas paralelas que rodean las células2,10.
En los parámetros de laboratorio no suele constatarse una elevación de los marcadores tumorales, como la AFP, el CEA y el CA 19.911, aunque algunos autores lo relacionan con valores elevados de CA 12512. Las transaminasas suelen estar mínimamente elevadas5.
En el diagnóstico por pruebas de imagen, la radiografía simple de abdomen no aporta hallazgos significativos, aunque a veces se puede observar un hígado aumentado de tamaño o con calcificaciones hasta en un 40% de los casos. Suelen estar situadas cerca del tumor, y con forma nodular o estrellada de pequeño tamaño6. El uso de la ecografía sistemática ha ayudado en gran medida al diagnóstico de estos tumores, visualizándose como tumores solitarios, bien delimitados y con ecogenicidad variable. La ecografía sólo permite visualizar la cicatriz central en la tercera parte de los casos y en ella no se observa bien la necrosis tumoral9. La TC muestra el HCC-FL como una masa solitaria hipodensa, bien definida y con márgenes lobulados; debido a su gran vascularización, presenta un gran realce durante la fase arterial tras la inyección de contraste6. Durante la fase portal, se observa un patrón similar a la hiperplasia nodular focal6,8,9 y en la fase de equilibrio se aprecia mejor el realce de la cicatriz central. La RM suele mostrar una lesión lobulada, homogénea e hipointensa en secuencias T1 en hasta el 86% de los casos. En las secuencias T2, la tumoración se suele visualizar de manera heterogénea e hiperintensa. Si hay cicatriz, ésta suele ser hipointensa6. La arteriografía también se ha utilizado para realizar un rastreo arterial preoperatorio, hallándose habitualmente una hipervascularización y múltiples ramas colaterales6. La gammagrafía con tecnecio muestra una zona fría, ya que el HCC-FL no tiene células de Kuppfer, que son necesarias para captar el tecnecio. En cambio, la gammagrafía con galio-67 sí capta el trazador. Radiológicamente, el diagnóstico diferencial hay que realizarlo con la hiperplasia nodular focal, el hepatocarcinoma, el colangiocarcinoma intrahepático, el hemangioma y las metástasis hipervasculares6. En el diagnóstico diferencial con la hiperplasia nodular focal es de ayuda el aspecto que adquiere la cicatriz central en la RM, ya que aparece hiperintensa en aquélla e hipoentensa en el HCC-FL. Los hematíes marcados con tecnecio sirven para establecer el diagnóstico diferencial con el hemangioma: la prueba es positiva para éste y negativa para el HCC-FL.
El estadio tumoral es el mismo que para el HCC, motivo por el cual la estadificación tumoral no es un factor predictivo de mala evolución13,14. Según la American Joint Commission on Cancer, el estadio I es el tumor único de cualquier tamaño, sin afectación ganglionar ni invasión vascular; el estadio II es un tumor único < 5 cm, sin invasión ganglionar y con invasión vascular; el estadio III es el tumor > 5 cm con invasión vascular, o cualquier tamaño tumoral con invasión ganglionar, y el estadio IV es el tumor hepático con implantes peritoneales. El HCC-FL metastatiza a ganglios con más frecuencia que el HCC14. Las metástasis a los vasos linfáticos regionales suponen el 50-70% de los casos. Sin embargo, la invasión vascular portal o arterial es poco frecuente comparado con el HCC6. Las metástasis a distancia más frecuentes se realizan por vía directa, linfática y vascular. La diseminación peritoneal es rara. Si está presente, suele estar asociada a una rotura del tumor y a la implantación mecánica, como probablemente haya sido el caso de nuestra paciente14,15. Los sitios más frecuentes de metástasis a distancia son el pulmón, el hueso y la glándula suprarrenal6.
En cuanto al pronóstico, el HCC-FL se comporta como un tumor maligno de crecimiento expansivo lento. Aunque diversos autores han afirmado que es menos agresivo que el HCC2,5,16, la mayoría de trabajos adolecen de un escaso número de pacientes, poco seguimiento y falta de rigor en el diagnóstico histológico. Además, lo comparan con el HCC sin tener en cuenta el estadio tumoral ni la presencia o no de cirrosis subyacente. Cuando el HCC-FL se compara con el HCC sobre un hígado sano y en el mismo estadio tumoral, la supervivencia es similar y, por otra parte, es superior a la del HCC en el hígado cirrótico. Por tanto, se trata de un tumor agresivo con una supervivencia global del 45% a los 5 años2. El aparente mejor pronóstico del HCC-FL está relacionado con la ausencia de cirrosis de base y el mejor estado general del paciente joven. Entre los factores de riesgo de recurrencia de la enfermedad en los casos resecables están la presencia de nódulos linfáticos metastásicos, y no el tamaño tumoral.
El mejor tratamiento del HCC-FL es la resección quirúrgica con intención curativa, incluso en presencia de enfermedad peritoneal, metástasis a distancia o recurrencia de la enfermedad17. Aunque en el 73% de los pacientes, los tumores presentaban diámetros superiores a los 10 cm, la mayoría de los pacientes (80%) se trataron quirúrgicamente con intención curativa3. Habitualmente, se requieren grandes hepatectomías con márgenes de seguridad muy ajustados14. El trasplante hepático también se ha utilizado en pacientes afectados de HCC-FL como abordaje inicial, cuando la resección parcial es imposible. Aunque ofrece menores resultados que la hepatectomía, sigue habiendo controversia al respecto18,19. Además, el trasplante hepático sólo estaría indicado en casos de enfermedad exclusivamente hepática y siempre que el tumor primario esté controlado. No hay otros tratamientos alternativos. La quimioterapia adyuvante sistémica, o intraperitoneal, es un aspecto del tratamiento controvertido si hay diseminación peritoneal. En nuestro caso, a la paciente se le aplicó quimioterapia postoperatoria con gemcitabina y oxaliplatino. La supervivencia a los 5 años es del 40-60%2,15,18, con supervivencias medias situadas entre los 30 y los 36 meses. Sin embargo, la recidiva a los 5 años suele ser la norma en el 80% de los pacientes intervenidos14.
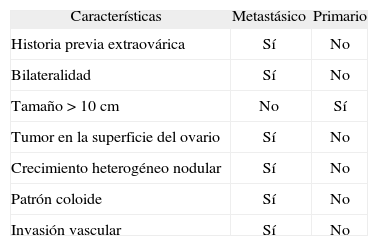
Tumor de KrukenbergEl tumor de Krukenberg es un tumor ovárico, con producción intracelular de mucina por células en «anillo de sello», asociado a una proliferación de estroma sarcomatoso20–22. Sin embargo, el concepto ha sido ampliado, y hoy en día hace referencia también a cualquier carcinoma metastásico del ovario unilateral o bilateral, independientemente del lugar de origen del tumor primario, conocido o desconocido. Epidemiológicamente, el tumor de Krukenberg es más frecuente en personas con menos de 40 años de edad. La sintomatología que producen es secundaria al tumor metastásico con más frecuencia que al primario. La distensión abdominal, el dolor en el hemiabdomen inferior y la ascitis están presentes en casi la mitad de los casos. El aspecto macroscópico y microscópico del tumor de Krukenberg puede ser muy diferente a la del tumor primario, lo que dificulta el diagnóstico diferencial entre tumor primario o secundario de ovario (tabla I). La mayor parte son bilaterales, el tamaño excede los 10 cm de diámetro y afecta a la superficie del ovario. La mayoría son de aparición sincrónica, lo que facilita el diagnóstico. Microscópicamente, pueden tener aspecto sólido y firme o edematoso y gelatinoso. Sin embargo, una tercera parte puede tener aspecto quístico. Habitualmente, son más celulares en las capas externas, y edematosos y gelatinosos en el centro, con un crecimiento nodular heterogéneo. Presentan invasión linfática y vascular, a diferencia de los tumores primarios de ovario. La morfología es muy variada, según la proporción y la disposición de sus 3 componentes, células en anillo de sello, mucina extracelular y diferentes células epiteliales. Las células en anillo de sello pueden estar dispuestas solas, en grupos, formando masas, o en disposición seudoglandular o tubular, semejando microquistes o glándulas de mediano a mayor tamaño de tipo intestinal. La mucina extracelular está asociada a una estroma colagenoso. Además, puede haber diferentes proporciones de otras células no productoras de mucina, como células escamosas, células claras y células transicionales, formando cordones, trabéculas o islotes. El origen más frecuente del tumor de Krukenberg23 es el gástrico en el 70% de los casos, formado por las células típicas en anillo de sello. Sin embargo, aunque más raros, también hay tumores de origen gástrico, pero formados por células de tipo intestinal que semejan glándulas tubulares. Aparece en una edad más tardía que el típico tumor de Krukenberg y no van acompañadas de manifestaciones endocrinas. El segundo origen más frecuente de los tumores de Krukenberg es el origen intestinal en el 15% de los casos23. La localización más frecuente es el colon y el recto, seguida del intestino delgado. También aparece en edades más tardías que el típico tumor de Krukenberg, macroscópicamente tienen el centro necrótico, y microscópicamente tienen un aspecto glandular. El diagnóstico diferencial con los carcinomas primarios de ovario endometriales, o mucinosos, se establece por ausencia de contenido achocolatado, presencia de centro necrótico, positividad para el CK 7 y negatividad para el CK 20. Otros orígenes son el pancreático-biliar, en el 5% de los casos23. Se han descrito casos de metástasis ováricas de adenocarcinoma ductal, de carcinoma de células acinares y de tumor neuroendocrino de páncreas. Los primeros tumores descritos del área hepatobiliar estaban originados en la vesícula biliar y los conductos biliares extrahepáticos. La mayoría de los casos procedía de Tailandia, área endémica de colangiocarcinoma por la alta prevalencia de infección crónica por helmintos del tipo Opistoschis viverrini. El aspecto microscópico es variado. Puede ser glandular, endometriode o mucinoso. El diagnóstico diferencial hay que establecerlo con tumores primarios ováricos, endometriodes o mucinosos. Los tumores propiamente hepáticos metastatizan muy raramente a los ovarios y son pocos los casos descritos20. La incidencia de esta forma de presentación es incierta, pero se estima que varía entre el 3 y el 8% de los tumores ováricos. Suele ocurrir en pacientes jóvenes, como en nuestro caso. Hay 7 casos de metástasis ováricas de HCC descritos en la bibliografía, pero ninguno de ellos hace referencia al HCC-FL24–28. Los que aparecen en gente joven se caracterizan por ser tumores oxifílicos, mientras que los que aparecen en edades más tardías tienen aspecto hepatoide. Microscópicamente, pueden tener disposición trabecular, glandular o insular. El diagnóstico diferencial hay que establecerlo con tumores embrionarios originados en el esbozo hepático del seno endodérmico. La presencia de bilis o canalículos biliares puede ayudar en el diagnóstico. También se han descrito metástasis ováricas de colangiocarcinoma intrahepático, la mayoría de casos en Tailandia. El diagnóstico diferencial hay que establecerlo con tumores mucinosos ováricos. También se ha descrito un caso de hepatoblastoma de aparición en edad adulta, con metástasis ováricas. El origen apendicular representa el 1-2% de los casos23. El aspecto microscópico es multilocular, con quistes con mucina en su interior y rodeados de células ricas en mucina. Se ha descrito su asociación con el seudomixoma ovárico y el seudomixoma peritoneal, por lo que es necesario hacer el diagnóstico diferencial con los tumores ováricos primarios, que también se acompañan de esudomixoma peritoneal. Otros orígenes menos frecuentes son los tumores carcinoides del íleo, el yeyuno y el páncreas, el carcinoma de mama tanto lobular como ductal, los tumores pulmonares en cualquiera de sus variantes histológicas, el melanoma, el carcinoma renal de células claras o el carcinoma transicional renal, los sarcomas endometriales y gastrointestinales, el cáncer de cérvix o el carcinoma de endometrio y los mesoteliomas.
Diagnóstico diferencial macroscópico y microscópico entre tumores quístico-mucinosos ováricos primarios o metastáticos
| Características | Metastásico | Primario |
| Historia previa extraovárica | Sí | No |
| Bilateralidad | Sí | No |
| Tamaño > 10 cm | No | Sí |
| Tumor en la superficie del ovario | Sí | No |
| Crecimiento heterogéneo nodular | Sí | No |
| Patrón coloide | Sí | No |
| Invasión vascular | Sí | No |
La paciente del caso descrito presentó una forma de inicio típica de un tumor de Krukenberg, con dolor en el hemiabdomen inferior, ocasionado por las metástasis y no por la enfermedad primaria. Teniendo en cuenta la citología, las imágenes, la edad de la paciente y la ausencia de enfermedad hepática de base, el diagnóstico diferencial se planteó entre el tumor hepático primario, con metástasis ováricas y peritoneales, el tumor ovárico primario embrionario del seno endodérmico, con metástasis hepáticas y peritoneales, o cualquier tumor ovárico primario de células oxifílicas. En el caso que nos concierne, al igual que en todos los casos de tumores de Krukenberg, el tipo de presentación como metástasis ováricas resalta la necesidad de realizar una evaluación exhaustiva para evitar laparotomías innecesarias. También es importante el diagnóstico certero, para evitar la administración de pautas de quimioterapia erróneas, dirigidas a un tumor ovárico, cuando la extirpe celular es totalmente diferente a la ovárica29. Por regla general (en el 90% de los casos), podemos decir que la afectación bilateral de ambos ovarios, o la afectación unilateral con un tamaño inferior a 10 cm, va a favor de las metástasis. Sin embargo, la afectación unilateral con un tamaño tumoral superior a 10 cm va a favor de un tumor primario. Debido a la incertidumbre que plantean estos casos, y también a la edad joven de los pacientes, está indicada la actitud agresiva, con fines diagnósticos y curativos. Por ello, la cirugía está indicada aún en presencia de una enfermedad diseminada. La morfología y la inmunohistoquímica no ayudan mucho porque en ocasiones son idénticas30. La presencia de pigmento biliar también puede aparecer en tumores embrionarios del seno endodérmico. La AFP puede ser negativa en muchos hepatocarcinomas y en la mayoría de los HCC-FL. Algunos autores indican que puede ayudar en el diagnóstico diferencial la elevación del Ca 125, como en el presente caso.
En conclusión, el HCC-FL es una variante histológica del hepatocarcinoma, de biología diferente, que lo hace especialmente frecuente en gente joven. A menudo, el diagnóstico es tardío, por lo que es frecuente el inicio en estadios avanzados. La clínica de presentación suele ser el dolor en el hipocondrio derecho, y es rara la forma de inicio como masas ováricas, lo que obliga al diagnóstico diferencial del tumor ovárico primario. Este caso se presentó como un tumor de Krukenberg, y se halló el tumor primario hepático posteriormente. El tratamiento quirúrgico agresivo es la norma, tanto en casos de HCC-FL que afecta únicamente al hígado como en casos de tumor de Krukenberg, dada su presentación en personas jóvenes con buen estado general, en las que es necesaria una amplia muestra histológica para hacer un adecuado diagnóstico del origen del tumor y su estadio. La supervivencia de estos tumores suele ser superior al hepatocarcinoma, aunque la recurrencia sigue siendo elevada, posiblemente porque se intervienen a pesar de presentar estadios más avanzados en el momento del diagnóstico. El uso de la quimioterapia no ha mostrado su eficacia para este tipo de tumores.