Entre los tumores hepáticos benignos se encuentra un amplio espectro de lesiones que se comportan de formas muy diversas y que, debido a esto, precisan una estrategia de tratamiento adaptada específicamente a cada uno de ellos. El tumor hepático benigno sólido más frecuente es el hemangioma seguido de la hiperplasia nodular focal, y el tumor quístico más frecuente es el quiste simple. La mayoría de estos tumores son asintomáticos, hallazgos casuales en pruebas de imagen realizadas por otros motivos, y generalmente no precisan tratamiento ni seguimiento. En ocasiones, el diagnóstico diferencial con tumores malignos hepáticos es difícil y esto constituye el principal motivo para la resección quirúrgica, así como la presencia de síntomas o complicaciones.
There is a wide range of benign liver tumors that behave in very different ways and require a management strategy specifically tailored to each. The most common benign solid liver tumor is hemangioma followed by focal nodular hyperplasia; the most common cystic tumor is the simple cyst. Most of these tumors are asymptomatic and are discovered as incidental findings on imaging tests performed for other reasons. Usually, no treatment or follow-up is required. The differential diagnosis with malignant liver tumors is sometimes difficult. This difficulty, together with the presence of symptoms or complications, is the main reason for surgical resection.
Los tumores hepáticos benignos son frecuentes, de naturaleza sólida o quística, únicos o múltiples, y es beneficioso conocerlos bien para poder distinguirlos de tumores malignos, establecer el riesgo de complicaciones y determinar el tipo de seguimiento más eficaz que precisan. Los más comunes de naturaleza sólida son el adenoma hepatocelular, el hemangioma cavernoso, el hemangioendotelioma infantil, la hiperplasia nodular focal, la hiperplasia nodular regenerativa y el pseudotumor inflamatorio. De naturaleza quística tenemos la poliquistosis hepática, los quistes solitarios no parasitarios, los complejos de Von Meyenburg, la enfermedad de Caroli y la peliosis hepática.
Generalmente, la historia clínica, la ecografía simple de abdomen y la analítica delimitan la sospecha clínica a algunas de estas entidades. La tomografía computarizada (TC) y la resonancia magnética (RM) muestran hallazgos característicos, por lo que solamente en algunos casos será necesaria la biopsia para llegar al diagnóstico definitivo. En esta actualización nos centraremos fundamentalmente en los 3 tipos de tumores benignos más comunes que aparecen en la edad adulta: el adenoma hepatocelular, la hiperplasia nodular focal (HNF) y el hemangioma.
1. Adenoma hepático. Es un tumor epitelial caracterizado por una proliferación benigna monoclonal de hepatocitos, más frecuente en mujeres de 20 a 45 años, generalmente únicos (70–80%). Su incidencia ha ido aumentando en las últimas décadas en relación con el uso de anticonceptivos orales, y son más frecuentes cuanto mayor es la dosis y mayor es la duración del tratamiento hormonal1. Otros factores etiológicos asociados son el uso de anabolizantes con esteroides y las enfermedades de depósito de glucógeno (con una prevalencia del 50% para el tipo i y del 25% para el tipo iii)2,3. En este último caso suelen aparecer, de forma múltiple, en varones menores de 20 años, con resolución de éstos tras tratamiento dietético y normalización de los niveles de insulina, glucosa y glucagón.
Macroscópicamente son nódulos bien circunscritos no encapsulados, aunque pueden formar pseudocápsulas por compresión del tejido hepático adyacente. El tamaño es variable y llega a los 30cm de diámetro de manera excepcional. Pueden romperse o sangrar, y esto es debido a la presencia de hipervascularización, con vasos sanguíneos grandes y prominentes tanto en la superficie como en el seno del tumor, a la ausencia de una cápsula verdadera y a la localización subcapsular4.
Desde el punto de vista clínico, suelen comportarse como un hallazgo casual en una persona previamente sana y asintomática con pruebas de función hepática y valor de AFP normales, aunque en adenomas de gran tamaño puede existir dolor abdominal epigástrico o incluso ictericia obstructiva por compresión extrínseca de los conductos biliares intrahepáticos. Aunque son tumores de naturaleza benigna, de forma poco frecuente presentan riesgo de malignización5. La rotura espontánea y la hemorragia abdominal, que producen un cuadro de abdomen agudo, son la forma de presentación en un 8–12% de los casos6.
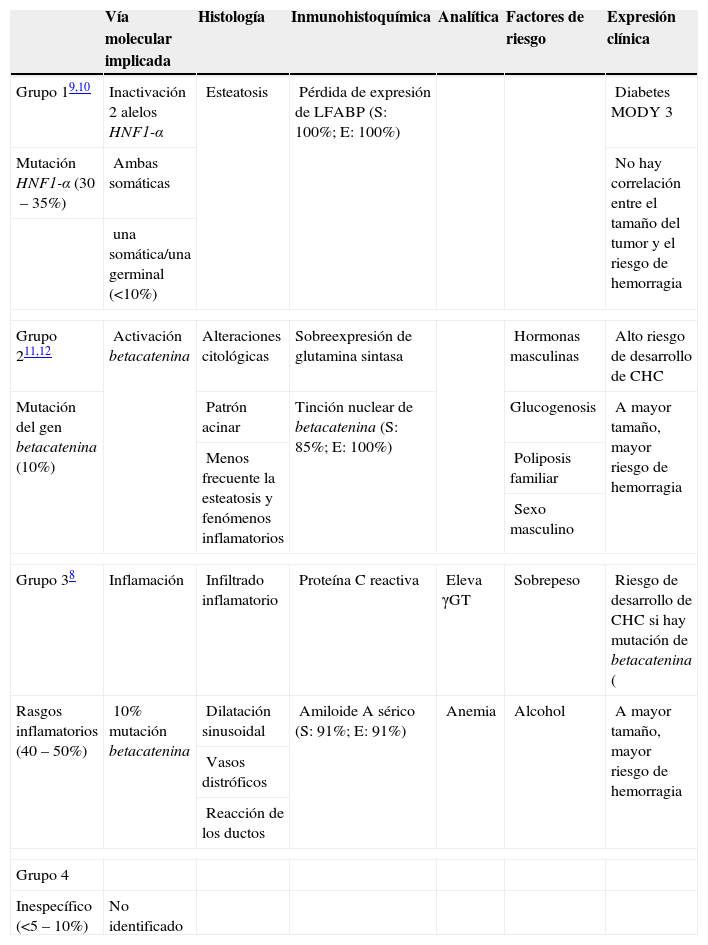
Recientemente se ha publicado una clasificación de los adenomas en función de distintos rasgos histológicos y hallazgos genéticos (tabla 1)7,8. El gen TCF-1 (factor de transcripción 1) codifica el HNF1-α (factor nuclear de los hepatocitos 1-alfa), que se ha identificado como gen supresor tumoral implicado en el desarrollo de tumores hepáticos. La pérdida de actividad del HNF1-α se asocia al desarrollo de hígado graso, hepatomegalia, displasia de los hepatocitos y proliferación celular9,10. El gen betacatenina es el oncogén más frecuentemente activado en el carcinoma hepatocelular (CHC). Se han descrito mutaciones que activan el gen betacatenina en un 20–34% de los CHC11. Dentro de la clasificación fenotipo-genotipo de los adenomas hepáticos, en el grupo 1 están los adenomas con mutaciones de HNF1-α (el 30–35% de los adenomas). Histológicamente, estos tumores se caracterizan por una marcada esteatosis y pérdida de expresión de la proteína LFABP. En el grupo 2 se concentran los adenomas con mutaciones del gen betacatenina (el 10% de los adenomas). Histológicamente presentan alteraciones citológicas y un patrón acinar; son menos frecuentes la esteatosis y los rasgos inflamatorios. La sobreexpresión de glutamina sintasa y la tinción nuclear de betacatenina son excelentes predictores de adenomas con mutación del gen betacatenina12. El grupo 3 está compuesto por los adenomas con rasgos inflamatorios (40–50%), presentan infiltrados inflamatorios, dilatación sinusoidal, vasos distróficos y reacción de los ductos. Se asocian a elevación de γGT, aparecen en pacientes con sobrepeso y con consumo excesivo de alcohol. Un 10% de los adenomas englobados en este grupo presentan, además, mutación del gen betacatenina. Finalmente, el 5–10% de los adenomas restantes, sin mutación de HNF1-α o betacatenina y sin expresión de proteínas inflamatorias, constituye el grupo 4. La importancia de esta clasificación radica en que el 46% de los adenomas con mutación de betacatenina se asocian con la presencia de CHC, mientras que no se ha descrito en ninguno del grupo de los inflamatorios y sólo muy raramente en los tumores con mutación de HNF1-α. La biopsia hepática sigue siendo la única opción para detectar la mutación de betacatenina, aunque su lectura en una biopsia es difícil8. En pacientes con adenomas que presentan mutación de betacatenina se recomienda suspender el consumo de preparados hormonales y extirpar cualquier nódulo mayor de 4–5cm para evitar el riesgo de hemorragia así como de desarrollo de CHC. En el caso de los hombres, esta recomendación se extiende a nódulos menores de 3cm8. Si el tamaño no es un argumento para la resección, se recomienda un seguimiento estricto y extirparlos rápidamente si el tamaño aumenta después de suspender los anticonceptivos orales.
Clasificación genotipo-fenotipo de los adenomas hepáticos7,8
| Vía molecular implicada | Histología | Inmunohistoquímica | Analítica | Factores de riesgo | Expresión clínica | |
| Grupo 19,10 | Inactivación 2 alelos HNF1-α | Esteatosis | Pérdida de expresión de LFABP (S: 100%; E: 100%) | Diabetes MODY 3 | ||
| Mutación HNF1-α (30–35%) | Ambas somáticas | No hay correlación entre el tamaño del tumor y el riesgo de hemorragia | ||||
| una somática/una germinal (<10%) | ||||||
| Grupo 211,12 | Activación betacatenina | Alteraciones citológicas | Sobreexpresión de glutamina sintasa | Hormonas masculinas | Alto riesgo de desarrollo de CHC | |
| Mutación del gen betacatenina (10%) | Patrón acinar | Tinción nuclear de betacatenina (S: 85%; E: 100%) | Glucogenosis | A mayor tamaño, mayor riesgo de hemorragia | ||
| Menos frecuente la esteatosis y fenómenos inflamatorios | Poliposis familiar | |||||
| Sexo masculino | ||||||
| Grupo 38 | Inflamación | Infiltrado inflamatorio | Proteína C reactiva | Eleva γGT | Sobrepeso | Riesgo de desarrollo de CHC si hay mutación de betacatenina ( |
| Rasgos inflamatorios (40–50%) | 10% mutación betacatenina | Dilatación sinusoidal | Amiloide A sérico (S: 91%; E: 91%) | Anemia | Alcohol | A mayor tamaño, mayor riesgo de hemorragia |
| Vasos distróficos | ||||||
| Reacción de los ductos | ||||||
| Grupo 4 | ||||||
| Inespecífico (<5–10%) | No identificado | |||||
CHC: carcinoma hepatocelular; Diabetes MODY 3: diabetes de inicio en la madurez de los jóvenes; α E: especificidad; γGT: Gamma glutamil transpeptidasa; HNF1-α: factor nuclear de los hepatocitos 1-alfa; S: sensibilidad.
El concepto de adenomatosis se refiere a la presencia de más de 10 adenomas. Se ha descrito en ausencia de toma de anticonceptivos orales así como en presencia de glucogenosis, con igual frecuencia en hombres que en mujeres, sintomáticos, con elevación de aminotransferasas y con un mayor riesgo de hemorragia o malignización que los adenomas solitarios13. Recientemente se ha indicado que la adenomatosis no es una entidad específica como se pensaba hasta la fecha8. Los adenomas con LFABP-negativa y los adenomas inflamatorios con proteína C reactiva y amiloide A sérico positivo representan el 80% de los adenomas, y pueden aparecer en solitario o múltiples. Son más frecuentes en número mayor de 10 en el grupo de adenomas con LFABP-negativa. Desde el punto de vista clínico, el tamaño, el genotipo y la enfermedad de base son más importantes que el número de adenomas. Es el tamaño y no el número de nódulos lo que tiene importancia a la hora de considerar posibles complicaciones8.
Respecto al diagnóstico del adenoma, la ecografía inicial presenta una masa hiperecoica, solitaria, grande, bien definida, aunque a veces es heterogénea debido a la hemorragia intratumoral. Con contraste muestra hipercaptación centrípeta completa que envuelve la cápsula así como en la porción interna durante la fase arterial. En la fase tardía, las lesiones mantienen la captación de forma persistente. La cápsula se mantiene generalmente hipercaptante. El Doppler color puede ayudarnos a diferenciarlo de la HNF por la presencia de vasos intratumorales o peritumorales en ausencia de arteria central. Un estudio reciente14 ha demostrado una buena correlación entre los 2 subtipos más frecuentes de la clasificación genotipo-fenotipo y los patrones específicos de la RM: en los adenomas con HNF1-α inactivado suele observarse un reparto difuso de la grasa, con caída de la señal en las secuencias potenciadas en T1 en fase opuesta debido a esteatosis; isoseñal o leve hiperseñal en T2, y realce moderado en la fase arterial, que no se mantiene ni en la fase venosa ni en la fase tardía. El valor predictivo positivo de esta caída de la señal en las secuencias potenciadas en T1 en fase opuesta fue del 100%, el valor predictivo negativo fue del 94,7%, la sensibilidad fue del 86,7% y la especificidad fue del 100%. En el grupo de adenomas con rasgos inflamatorios, en relación con la dilatación sinusoidal, se observa un patrón de caída de la señal focal o ausente en secuencias potenciadas en T1 en fase opuesta, marcada hiperseñal en T2, hiperseñal en la zona periférica de las lesiones (en correlación con las zonas de dilatación sinusoidal) y fuerte realce en fase arterial persistente en la fase portal y tardía. El valor predictivo positivo fue del 88,5%, el valor predictivo negativo fue del 84%, la sensibilidad fue del 85,2% y la especificidad fue del 87,5%14.
El manejo de los adenomas varía en función de los síntomas, el tamaño, el número, la localización y la seguridad en el diagnóstico: a) mujer asintomática con adenoma de pequeño tamaño tomadora de anticonceptivos orales: suspenderlos y observación, si aparecen síntomas o aumenta el tamaño, valorar la resección quirúrgica; b) mujer con deseos de embarazo15: resección, ya que el comportamiento de los adenomas durante el embarazo es impredecible y el riesgo de hemorragia aumenta durante este período, y c) pacientes sintomáticos, con adenomas mayores de 5cm o que inician con rotura y hemorragia intraabdominal: resección. Después de realizar una resección completa, pueden aparecer nuevos adenomas durante el primer año de seguimiento, más frecuentemente en el grupo de HNF1-α inactivada. En los pacientes con adenomas múltiples no tratables mediante resección hepática parcial se ha empleado con éxito el trasplante hepático6.
2. Hiperplasia nodular focal. La HNF es el tumor hepático benigno más frecuente tras los angiomas, con una prevalencia en estudios de autopsias del 0,4 al 3% y en series clínicas del 0,03%4. Predomina en mujeres en edad fértil con hígado sano. La patogénesis y las vías moleculares alteradas en estos tumores son poco conocidas, aunque se considera que es una respuesta hiperplásica de los hepatocitos a una malformación vascular congénita con alto flujo arterial por arterias anómalas localizadas en el centro de estos nódulos. La frecuente asociación de la HNF con la enfermedad de Rendu-Osler-Weber y con los hemangiomas hepáticos fortalece la hipótesis de que se trate de una anomalía vascular congénita16,17. Su asociación con el uso de anticonceptivos orales es controvertida. En el 80–95% de los casos aparecen como nódulos solitarios menores de 5cm, bien circunscritos, no encapsulados. Histológicamente, los hepatocitos presentan un aspecto benigno; están dispuestos en pequeños nódulos o cordones separados entre sí por septos fibrosos con múltiples ramas arteriales que irradian de una arteria central grande. Esta disposición anatómica es la causa del hallazgo característico en las pruebas de imagen, la disposición en forma de «rueda de carro». Se distingue del adenoma hepático porque en este último suele haber pérdida de ductos biliares y de células de Kupffer. Se han descrito 3 variantes de la HNF clásica, que en más del 95% de los casos carecen de la cicatriz fibrosa central característica: la HNF mixta hiperplásica y adenomatosa, difícil de distinguir del adenoma; la HNF con atipia citológica, semejante a la displasia de tipo de células grandes, y la HNF de tipo telangiectásico, que comparte una relación molecular con el adenoma del grupo LFABP negativo y amiloide A sérico y proteína C reactiva positivos8,18. La HNF suele ser asintomática; en más del 65% de los casos se diagnostica de forma casual y cursa con aminotransferasas normales, si bien las lesiones de mayor tamaño pueden presentarse con dolor sordo o malestar localizados en el epigastrio o el hipocondrio derecho.
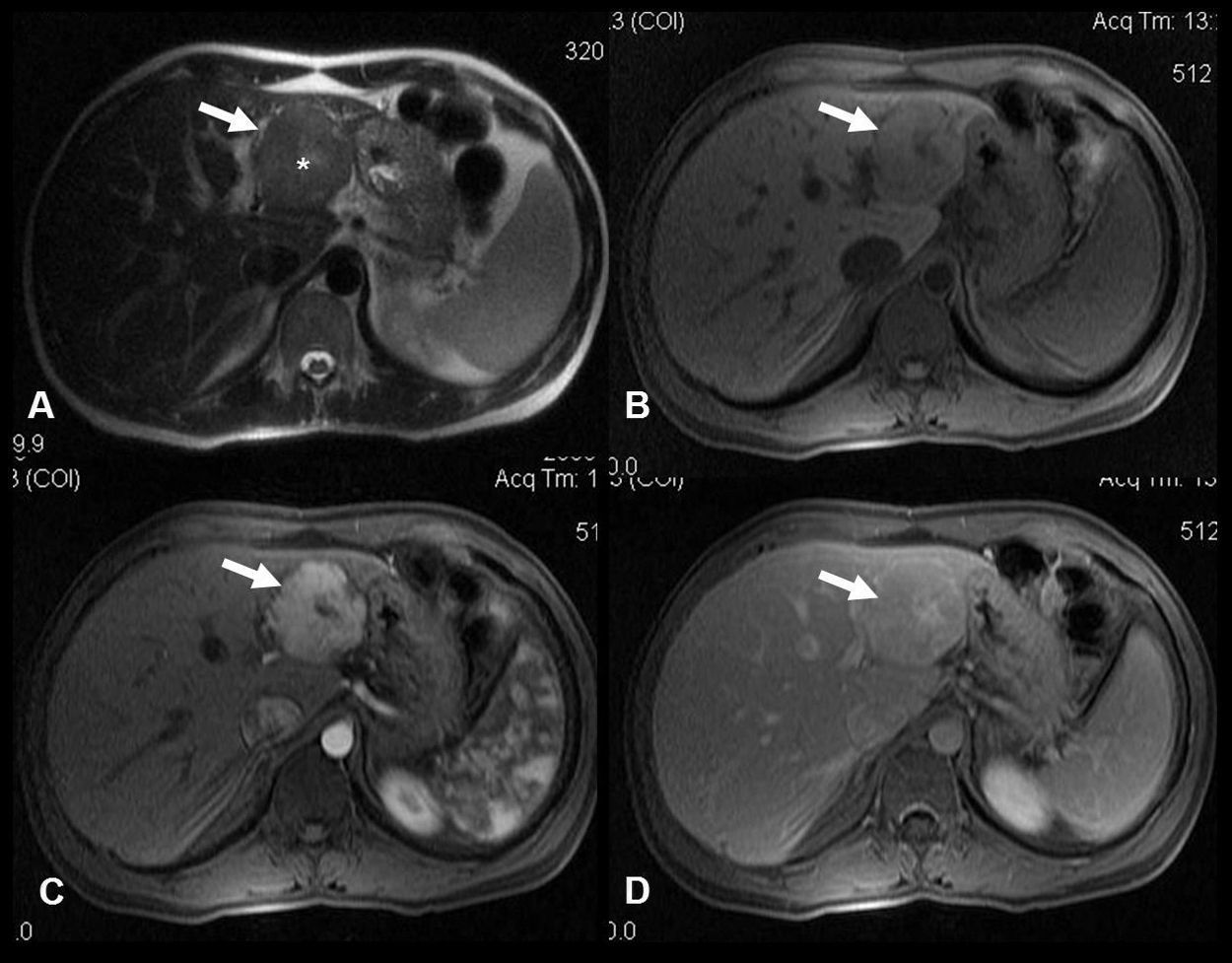
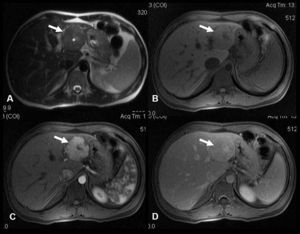
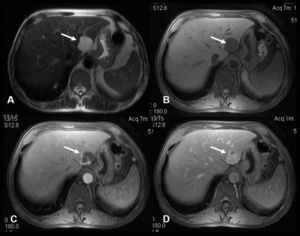
En la ecografía se identifica una lesión focal hepática sólida homogénea isoecoica, con la cicatriz central característica en el 20–45% de los casos. Si se aplica contraste ecográfico se ve una captación intensa y homogénea durante la fase arterial, que se mantiene hiperecoica o isoecoica durante las fases portal y tardía, en comparación con el parénquima hepático adyacente. El mismo comportamiento se observa en la TC multifásica. En la RM (fig. 1), la HNF aparece como una lesión isointensa en T1, isointensa o levemente hiperintensa en T2 con la cicatriz central típica que muestra una señal de alta intensidad en T2 debido a los vasos o al edema en la cicatriz. Tras la infusión de gadolinio se produce una rápida captación del contraste debido a su aporte sanguíneo arterial, y en fases tardías la lesión de HNF suele ser isointensa respecto al parénquima hepático normal. La cicatriz central, en cambio, se hace hipercaptante en fase tardía. Este hallazgo es útil para distinguir la HNF del carcinoma hepatocelular fibrolamelar, ya que la cicatriz de este último suele ser de aspecto arboriforme, excéntrica, con amplias bandas fibrosas y capta el contraste de forma precoz en la fase arterial del estudio dinámico.
A) Imagen axial en T2: masa en lóbulo hepático izquierdo (flecha) con área central hiperintensa de aspecto cicatricial (*). B, C y D) Imágenes axiales T1 con supresión grasa, sin contraste (B) y tras administración de contraste paramagnético intravascular en fase arterial (C) y de equilibrio (D). Realce intenso de la masa en fase arterial con realce tardío de la cicatriz. Diagnóstico: hiperplasia nodular focal.
Para su distinción del adenoma se ha utilizado clásicamente la gammagrafía. Con el radiofármaco DISIDA, en las imágenes iniciales la masa es homogénea respecto de la totalidad del hígado, pero después, en el 80% de los casos, se hace más evidente por un retraso en la eliminación del trazador, ya que no hay conexión de los canalículos biliares del tumor con las vías excretoras19. En la gammagrafía con Tc99 y azufre coloidal, las lesiones correspondientes a HNF se realzan en la mayoría de los casos por la presencia de las células de Kupffer en su arquitectura. Esto puede ayudar en el diagnóstico diferencial con los adenomas, que habitualmente no captan Tc99 porque carecen de ellas20,21. Desafortunadamente, algunos adenomas y otros tumores como el hepatocarcinoma también pueden mostrar captación en algunas ocasiones22.
La RM con contrastes organoespecíficos (MultiHance®, Primovist®) permite valorar el grado de captación del contraste del hepatocito y de las lesiones focales, y ayuda a diferenciar el adenoma de la HNF, que a veces se comportan de forma similar en el estudio dinámico convencional. Así, debido a que los adenomas carecen de ductos biliares y de tractos portales, estos aparecen hipointensos en la fase hepatobiliar del estudio, mientras que la HNF generalmente aparece isointensa o hiperintensa31.
La HNF clásica no precisa seguimiento una vez diagnosticada, puesto que es benigna e indolente. Las lesiones atípicas, como la HNF de tipo telangiectásico, han de seguirse con la misma actitud que si fueran adenomas18.
3. Hemangioma hepático. El hemangioma o angioma hepático es el tumor hepático benigno más frecuente; en más del 40% de los casos puede aparecer de forma múltiple y, aunque el tamaño oscila entre los pocos milímetros hasta más de 20cm, lo más frecuente es que sean menores de 5cm de diámetro. Suelen diagnosticarse más en mujeres entre los 30 y los 50 años. La etiología no es bien conocida, algunos indican que se trata de una malformación congénita y se ha descrito la posibilidad de una influencia hormonal tras observarse crecimiento tumoral durante el embarazo o durante el tratamiento con estrógenos y progesterona23, aunque en la mayoría de los casos esta influencia hormonal no es perceptible y suelen permanecer estables en el tiempo. Generalmente, son lesiones bien delimitadas, rodeadas por una delgada cápsula, de consistencia esponjosa, con hemorragia, cicatrices o raramente calcificaciones. Microscópicamente, se observan espacios vasculares quísticos dilatados recubiertos por una monocapa de células endoteliales. Estos espacios contienen trombos, fibrina o agregados de hematíes separados unos de otros por tejido fibroso. Los hemangiomas grandes pueden presentar una cicatriz colagenosa o nódulos fibrosos.
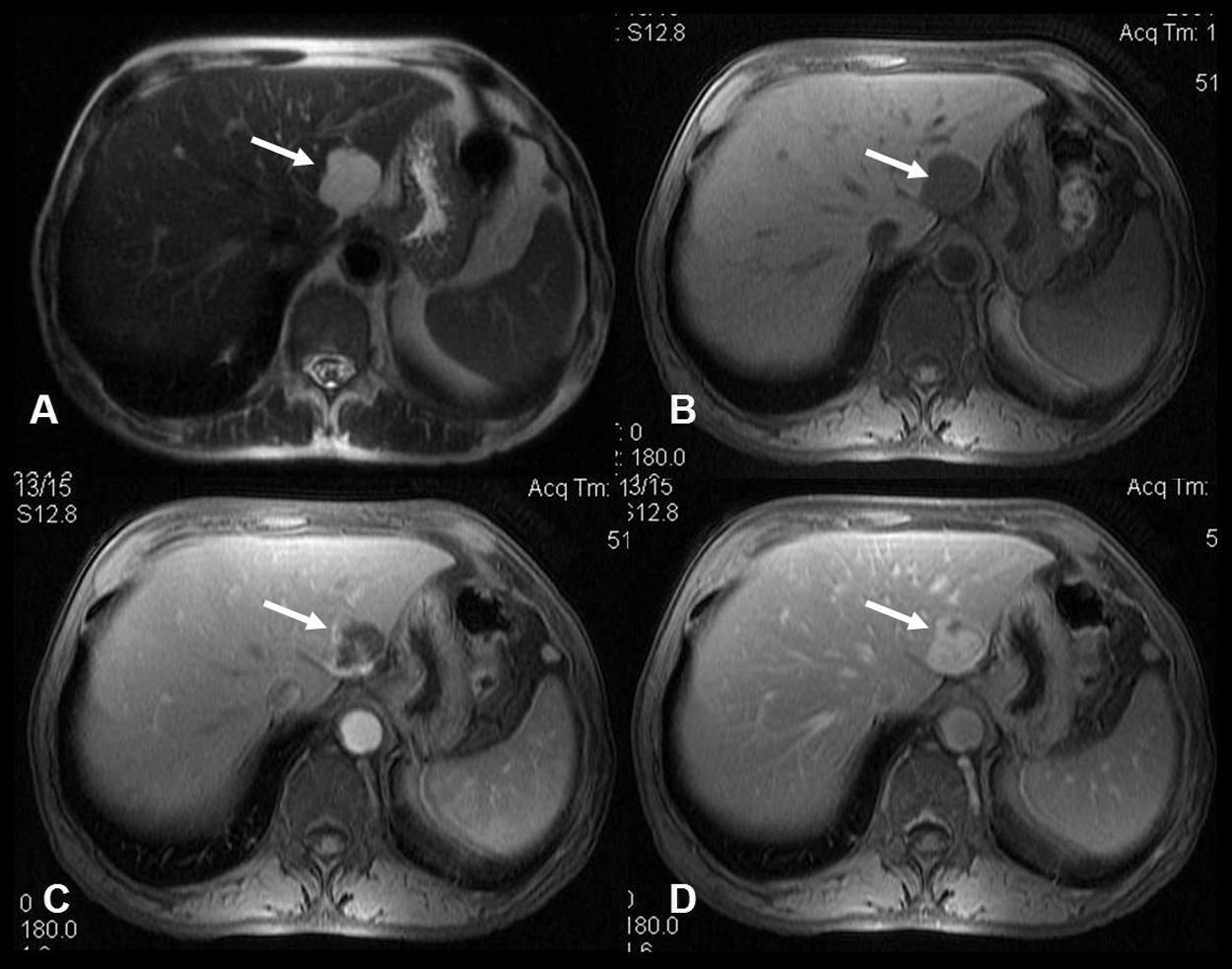
Suelen diagnosticarse de forma casual durante estudios de imagen realizados por otras causas, en laparotomías o autopsias. En niños a veces se asocian a hemangiomas cutáneos. Las lesiones mayores de 4cm tienen más probabilidades de causar síntomas: dolor abdominal, malestar en el cuadrante superior derecho, sensación de plenitud gástrica, náuseas, anorexia o saciedad precoz; estos 3 últimos por compresión de órganos adyacentes por hemangiomas de gran tamaño. Ocasionalmente, puede producirse dolor abdominal agudo secundario a inflamación de la cápsula de Glisson por trombosis o hemorragia intralesional. La rotura espontánea es excepcional. El síndrome de Kasabach-Merritt es una coagulopatía de consumo, trombocitopenia e hipofibrinogenemia, en asociación con hemangiomas gigantes, la mayoría en niños asociada a hemangiomas cutáneos24. Ocasionalmente, se puede palpar la masa a la altura del hipocondrio derecho. Las pruebas de función hepática habitualmente son normales, excepto en caso de trombosis, hemorragia o compresión de la vía biliar. El diagnóstico se realiza habitualmente por técnicas de imagen, la más específica es la RM. En la ecografía abdominal (sensibilidad del 60–70%, especificidad del 60–80%) se detecta un nódulo homogéneo hiperecoico bien delimitado. En ocasiones se aprecia hipoecoico sobre hígados con infiltración grasa y a veces la ecogenicidad varía si presenta fibrosis, trombosis, hemorragia o calcificaciones. Al administrar contraste, presenta típicamente captación periférica globular en la fase arterial con llenado centrípeto en la fase portal. En la fase tardía suele aparecer como una lesión isocaptante o hipercaptante en comparación con el parénquima hepático subyacente. Dado que algunas lesiones hepáticas malignas presentan patrones acústicos similares25, son necesarias otras pruebas de imagen para llegar a un diagnóstico definitivo. La TC (sensibilidad del 75–85%, especificidad del 75–100%) muestra una lesión hipodensa bien delimitada y las calcificaciones se aprecian hasta en un 10% de los casos. El comportamiento frente al contraste es similar. La RM (fig. 2) es altamente precisa (sensibilidad del 90%; especificidad del 91–99%), identifica una masa lisa, homogénea, bien delimitada, hipointensa en T1, hiperintensa en T2, y con el gadolinio se observa en la fase arterial una captación globular o nodular periférica discontinua con captación progresiva centrípeta en la fase tardía. Los hemangiomas pequeños pueden presentar una captación rápida uniforme a veces indistinguible de metástasis hipervasculares o del carcinoma hepatocelular. El papel de la biopsia hepática percutánea es controvertido debido al riesgo de complicaciones hemorrágicas, sobre todo en lesiones grandes con localización subcapsular.
A) Imagen axial T2: masa en lóbulo hepático izquierdo (flecha) hiperintensa, homogénea y bien delimitada. B, C y D) Imágenes axiales T1 con supresión grasa, sin contraste (B) y tras administración de contraste paramagnético intravascular en fase arterial (C) y de equilibrio (D). Realce progresivo y centrípeto de la lesión. Diagnóstico: hemangioma hepático.
Una vez realizado el diagnóstico de certeza, el seguimiento no es necesario en pacientes de bajo riesgo de malignidad (ausencia de enfermedad hepática crónica o evidencia de enfermedad maligna extrahepática). Solamente se debe realizar resección quirúrgica en aquellos casos seleccionados con lesiones mayores de 5cm de diámetro de localización subcapsular con dolor o síntomas secundarios a la compresión extrínseca de estructuras adyacentes tras descartar otras causas que justifiquen el dolor abdominal26. En algunos casos excepcionales, muy sintomáticos, con hemangiomas gigantes irresecables y hemangiomas asociados con síndrome de Kasabach-Merritt se ha planteado el trasplante27,28. El hemoperitoneo secundario a la rotura de un hemangioma puede tratarse mediante embolización de la arteria hepática, ya que controla la hemorragia aguda y los síntomas28. En algunos casos se ha empleado la radioterapia para reducir el tamaño del tumor y la sintomatología29 o el interferón α−2a en niños con riesgo vital con hemangiomas de localización extrahepática30.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.