El cáncer de páncreas (CP) continúa siendo una entidad de pésimo pronóstico. Estudios epidemiológicos sugieren que las estatinas en los fumadores podrían constituir un factor protector mientras que la positividad del HbsAg del virus de la hepatitis B podría ser un factor de riesgo. La ultrasonografía endoscópica (USE) continúa siendo el pilar fundamental diagnóstico y surgen avances asociados a ella, como el empleo de la elastografía cuantitativa, los contrastes intravenosos y, más recientemente, la endomicroscopia láser confocal. Surgen nuevos marcadores en orina y en jugo pancreático para la diferenciación del CP con la pancreatitis crónica. Se refuerza claramente el papel del patólogo “en la sala” para aumentar el rendimiento diagnóstico de las punciones guiadas por ecoendoscopia y aparecen estudios multicéntricos comparativos entre agujas de citología y de histología o procore. En relación con los tumores quísticos, los trabajos se centran en validar las nuevas guías de 2012 y en determinar los factores predictivos de malignidad de las lesiones quísticas, fundamentalmente del tumor mucinoso papilar intraductal. Desde el punto de vista terapéutico, la ablación con radiofrecuencia guiada por ecoendoscopia emerge como una técnica factible y segura en tumores solidos y quísticos en determinadas circunstancias.
Pancreatic cancer (PC) continues to have a very poor prognosis. New epidemiological trials suggest that statins could play a protective role in smokers, while HbsAg-positive hepatitis B virus could be a risk factor. Endoscopic ultrasound (EUS) is the main diagnostic tool for PC, and new technologies associated with this technique have emerged, such as quantitative elastography, intravenous contrasts or, more recently, LASER confocal endomicroscopy. New markers in urine or pancreatic juice have appeared to distinguish between PC and chronic pancreatitis. The role of the “on site” cytopathologist to increase the diagnostic yield of EUS-guided pancreatic sampling is completely supported by new prospective trials and some multicenter studies have been reported that compare the standard cytologic needles with the new procore-histology needles. Regarding cystic pancreatic tumors, most studies have aimed to validate the 2012 Sendai international guidelines and to ascertain predictive factors of malignancy in cystic lesions, mainly intraductal papillary mucinous neoplasm (IPMN). The role of intracystic CEA levels in determining malignancy is challenged. From a therapeutic point of view, EUS-guided radiofrequency ablation of cystic and solid lesions has emerged as a feasible and safe procedure in specific circumstances.
El cáncer de páncreas (CP) representa la quinta causa de muerte por cáncer en el ámbito mundial. En España se diagnostican unos 4.000 casos al año. Con una supervivencia estimada para todos los estadios inferior al 5% a 5 años1 y una esperanza de vida media de entre 6–10 meses, constituye la neoplasia más letal que puede padecer un ser humano. De hecho, como se desprende de estudios de supervivencia realizados en la última década2, su incidencia es prácticamente igual a su mortalidad. Esto se debe, fundamentalmente, a la diseminación precoz de esta neoplasia, puesta de manifiesto en varios estudios3, que conlleva a que en la mayor parte de los casos el tumor se manifieste clínicamente en estadios avanzados que impiden su resecabilidad y limitan en gran medida las posibilidades terapéuticas. Hasta tal punto esto es así que tan solo un 15–20% de los sujetos diagnosticados de CP son subsidiarios de una pancreatectomía con intención curativa, recibiendo el resto de los pacientes tratamiento oncológico, fundamentalmente paliativo; por ello es básico remarcar la importancia de todo lo que conlleve una optimización del pronóstico de esta enfermedad.
Durante el último congreso de la Digestive Disease Week (DDW) que tuvo lugar en Orlando (Florida, Estados Unidos) se presentaron los últimos avances para el mejor conocimiento y manejo de los tumores pancreáticos. En esta revisión nos centraremos inicialmente en el CP (es decir, en el adenocarcinoma pancreático, por lo que los tumores neuroendocrinos quedan excluidos) para posteriormente hacer referencia al campo de los tumores quísticos de páncreas, fundamentalmente la neoplasia papilar mucinosa intraductal (TPMI) y focalizándonos en trabajos basados en investigación clínica. Haremos una división en 4 puntos principales: prevención y factores de riesgo, avances diagnósticos, innovaciones terapéuticas y, finalmente, los tumores quísticos pancreáticos.
Cáncer de páncreasPrevención y factores de riesgoEn las últimas décadas se han estudiado multitud de factores de riesgo asociados al desarrollo del CP; de ellos, el tabaco ha sido el más ampliamente evaluado, considerándose como responsable de una cuarta parte de los casos4; otros como la dieta hipercalórica, la poca actividad física diaria, la infección por Helicobacter pylori o el consumo de alcohol presentan una asociación más que discreta5,6. En los últimos años, también se ha especulado sobre el papel de determinados fármacos, como las estatinas, como posibles factores de riesgo7.
Haciendo referencia a esto último se ha presentado un estudio caso-control en 2 centros de Reino Unido8, en el que mediante análisis de regresión logística se calculan las odds ratio (OR) para el desarrollo de CP en consumidores habituales de estatinas, realizándose un análisis posterior en función de la edad, el consumo de tabaco y la presencia de diabetes mellitus tipo 2 (DM2). Sobre 252 CP y 505 controles se identificó a un 23% de CP que era consumidor habitual de estatinas, frente a un 22% de los controles. En la población general, el riesgo de CP en consumidores de estatinas es de: OR: 0,79 (intervalo de confianza [IC] del 95, 0,52–1,20; p=0,28). En pacientes con DM2, el riesgo de CP con uso regular de estatinas fue de: OR: 0,88 (IC del 95%, 0,33–2,66; p=0,8), sin diferencias por edad. Sin embargo, en varones fumadores, el uso regular de estatinas reduce el riesgo de desarrollo de CP (OR: 0,11; IC del 95%, 0,01–0,99; p=0,05), por lo que los autores consideran a este grupo concreto como de especial interés para estrategias de quimioprevención.
En los últimos años ha adquirido gran relevancia el papel de la DM como marcador precoz de desarrollo de CP9. En este sentido se presenta un estudio retrospectivo japonés10 que trata de establecer un cribado efectivo en este grupo de pacientes. De 287 pacientes con CP agrupan 68 que ya presentaban DM durante un período de 5 años. Estos 68 pacientes quedan divididos en 2 grupos: grupo I, en el que el CP se detecta por un empeoramiento de su DM, y grupo II, en el que el CP se diagnostica con independencia de su diabetes. Finalmente, con 34 pacientes por cada grupo, no detectan diferencias en ellos en cuanto a síntomas, marcadores tumorales o tamaño del tumor, pero sí en la media de HbA1c, que fue significativamente mayor en el grupo I (el 10 frente al 8,6%; p=0,006), así como la tasa de resecabilidad (el 41,1 frente al 18%; p=0,02); los autores concluyen que una elevación del 10% en los valores de la HbA1c es una importante señal para el desarrollo de CP que debería conducir a la realización de procedimientos diagnósticos de forma inmediata.
Finalmente se presenta un metaanálisis sobre la relación entre la positividad del antígeno de superficie del virus de la hepatitis B (HbsAg) y el riesgo de CP11, hecho previamente evaluado en alguna revisión sistemática12. Este metaanálisis, que incluye 2 estudios caso-controles y 2 de cohortes, con un total de 2.101 pacientes con CP, ofrece un riesgo estimado por una OR de 1,45 (IC del 95%, 1,22–1,73) para individuos HbsAg +, considerando sin influencia si el estudio es caso-control o de cohortes. Los autores concluyen que hay que considerar a esta población como de riesgo y que no es posible aportar más datos sobre el riesgo de CP ante la positividad de otros marcadores serológicos, así como que faltaría definir el riesgo ante el estado de portador o de infectado.
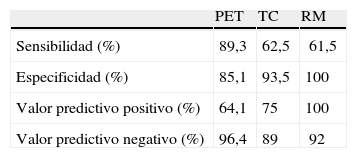
Avances diagnósticosUtilidad de la tomografía de emisión de positrones en el diagnóstico preoperatorio del cáncer de páncreasLos métodos fundamentales para el diagnóstico y estadificación del CP son la ultrasonografía endoscópica (USE), la tomografía computarizada (TC) abdominal multicorte y la resonancia magnética (RM)13. Otros medios como la tomografía de emisión de positrones (PET) se encuentran mucho menos desarrollados. En esta edición de la DDW se presenta como póster distinguido un estudio retrospectivo que evalúa el papel de la PET en la estadificación preoperatoria del CP14. Estudian 123 pacientes en un período de 5 años que tienen realizados PET, TC y RM. La PET y la TC/RM concuerdan en 108 casos (88%), sin embargo se identificó metástasis en 7 (5,6%) pacientes considerados resecables por TC/RM. Entre aquellos a los que se ofreció una resección inmediata, 5 (14%), tenían metástasis ocultas identificadas por laparoscopia, incluyendo 3 previamente identificadas por PET no concordante y 2 falsos negativos de la PET. Falsos positivos de la PET condujeron a la realización de procedimientos innecesarios, retrasando la cirugía en 3 casos (8,3%). En la cohorte de pacientes a priori libres de metástasis, en términos de detección de metástasis, la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) aparecen reflejados en la tabla 1. Los autores concluyen que la PET presenta una utilidad limitada como parte del manejo inicial de pacientes que han realizado una TC o RM para la estadificación preoperatoria del CP.
Sensibilidad, especificidad y valores predictivos de la tomografía de emisión de positrones (PET), la tomografía computarizada (TC) y la resonancia magnética (RM) en la estadificación preoperatoria del cáncer de páncreas.
| PET | TC | RM | |
| Sensibilidad (%) | 89,3 | 62,5 | 61,5 |
| Especificidad (%) | 85,1 | 93,5 | 100 |
| Valor predictivo positivo (%) | 64,1 | 75 | 100 |
| Valor predictivo negativo (%) | 96,4 | 89 | 92 |
El grupo de Lankisch15 realiza una búsqueda en orina de marcadores péptidos que diferencien una pancreatitis crónica (PC) de un CP. A través de electroforesis capilar y por espectrofotometría de masas establecen un modelo de 55 péptidos, entre los que destacan la fetuína y la alfa 1 antitripsina que permiten diferenciar CP de PC con un AUC de 0,94. De hecho, utilizando el panel propuesto se identifican correctamente 37 de 39 CP y 28 de 30 PC.
Por otro lado, Raimondo et al16 analizan en jugo pancreático diversos marcadores moleculares que ayuden en este diagnóstico diferencial. A través de la recolección del jugo mediante ecoendoscopia, previamente tras estimulación con secretina intravenosa (i.v.), son capaces de identificar, a través del ADN del jugo, marcadores de metilación del ADN como el CD1D metilado, que se muestra más sensible para la detección de CP y sustancialmente con menor tasa de falsos positivos para PC que la mutación KRAS.
Procedimientos asociados a la ecoendoscopia y la punción guiada por ecografía endoscópicaUso de contrastes intravenosos en modo armónico. En la última década se ha puesto de relevancia el importante papel del uso de contrastes i.v. en modo armónico asociados a la ecoendoscopia (CE-EUS)17, sobre todo en el diagnóstico diferencial de lesiones sólidas pancreáticas. Dos trabajos se han presentado en esta edición de la DDW en referencia a ellos.
En el primero se valora la utilidad de CE-EUS en el diagnóstico diferencial de metástasis pancreáticas18. En una muestra, extraída de una base de datos con inclusión prospectiva, de 10 pacientes, si bien la mayoría de las lesiones presentan un patrón hipovascular e inhomogéneo (6/10), en 3 de ellos se presenta como hipervascular (2 metástasis de un carcinoma renal y un linfoma), presentando además las metástasis de cáncer de colon un lavado rápido del contraste a diferencia del resto. Los autores concluyen que sería posible predecir el origen de la metástasis al presentarse este patrón.
El segundo hace referencia al posible papel del CE-EUS en servir de guía para aumentar la rentabilidad diagnóstica de la citología por USE-PAAF (punción aspiración con aguja fina)19. De forma prospectiva, a 30 pacientes les realizan 2 pases con aguja de 22G de una lesión sólida pancreática, el segundo pase se efectúa con posterioridad a la administración de contraste i.v. evitando zonas más vascularizadas y necróticas que disminuirían el rendimiento citológico. Las 2 muestras son evaluadas por un patólogo “ciego” que no se encuentra en la sala durante el procedimiento. Los resultados, bastante sorprendentes, son que se obtienen bloques celulares mayores y que la eficacia diagnóstica se incrementa un 10% en la punción realizada tras la administración del contraste.
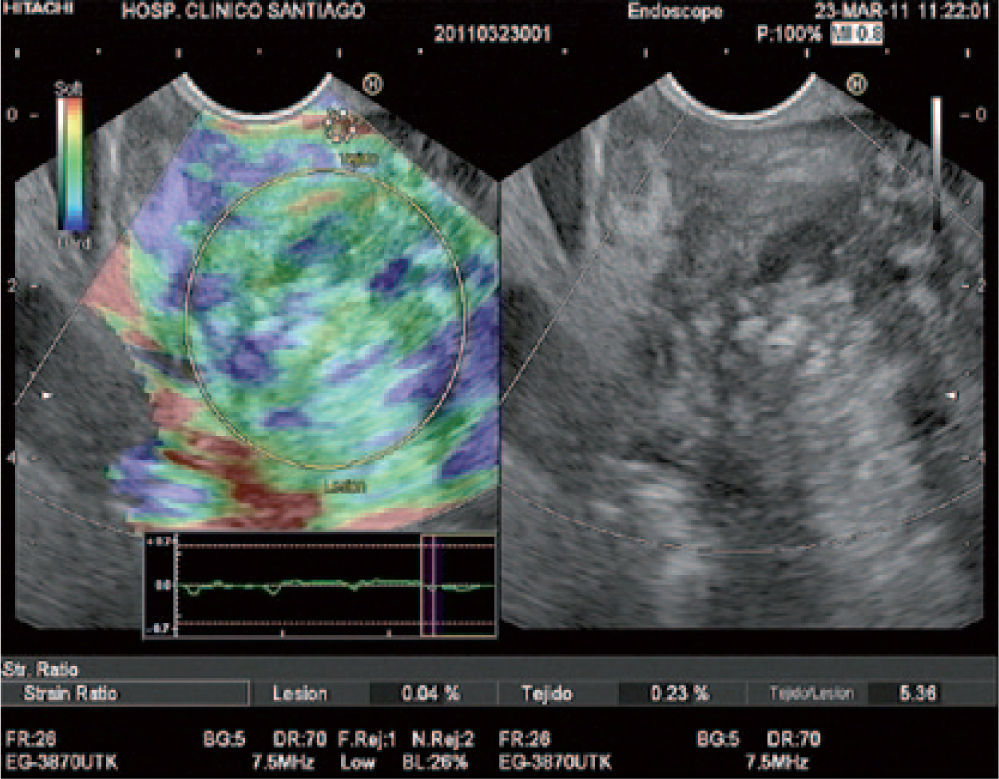
Elastografía cuantitativa guiada por ecoendoscopia (Q-EUS-E). Nuestro grupo20 presentó su experiencia acumulada mediante este método, que permite cuantificar la elasticidad tisular en el diagnóstico diferencial de lesiones sólidas pancreáticas. A través de un protocolo bien establecido de cálculo de un coeficiente de elasticidad o strain ratio (SR) y a partir de un punto de corte de 9,5 de un total de 199 pacientes con lesiones sólidas pancreáticas se obtiene, respectivamente, una sensibilidad, especificidad, VPP, VPN y eficacia global del 100, 91, 97, 100 y 98% en la detección de malignidad, confirmando resultados previamente publicados21 (fig. 1).
Endomicroscopia láser confocal. La endomicroscopia láser confocal a través de la aguja (nCLE) es una técnica de imagen que permite una observación microscópica de órganos sólidos, en tiempo real, a través de la USE-PAAF y que ha cobrado gran relevancia en los últimos años. Se mencionan 2 trabajos.
En primer lugar, el estudio22 CONTACT, estudio multicéntrico y prospectivo francés que trata de definir un atlas de imágenes y criterios de interpretación de estas y en el que se evalúan mediante nCLE a través de una aguja de 19G 18 masas sólidas pancreáticas. Los autores especulan sobre la importancia de 2 signos en la determinación de malignidad, como la presencia de agregados de células oscuras de aspecto seudogranular (indicativo de malignidad) o la presencia de bandas/elementos hiperdensos como marcadores de fibrosis. Por otra parte, el aspecto del páncreas normal se visualizaría como granos de café correspondiendo a los acinos pancreáticos. De igual forma, otro estudio multicéntrico23 se centra, sobre todo, en la seguridad y factibilidad del procedimiento al aplicarlo en 20 pacientes (en los que no se registraron complicaciones) sin entrar claramente a interpretar las imágenes presentes.
Análisis con ayuda digital. Habría que destacar un notable trabajo presentado como comunicación oral que hace referencia a la utilidad de métodos de análisis de las imágenes de la ecoendoscopia con ayuda digital. En este interesante trabajo, Xu et al24, tras diseñar un complejo programa de ordenador que analiza las imágenes contenidas en un área determinada manualmente de una lesión sólida pancreática visualizada por USE, son capaces de diferenciar entre un CP y una PC con una eficacia, sensibilidad, especificidad, VPP y VPN, respectivos, del 94,2, 96,2, 93,4, 92,2 y 96,7% sobre un total de 262 CP y 126 PC. En el futuro habrá que considerar este método seriamente.
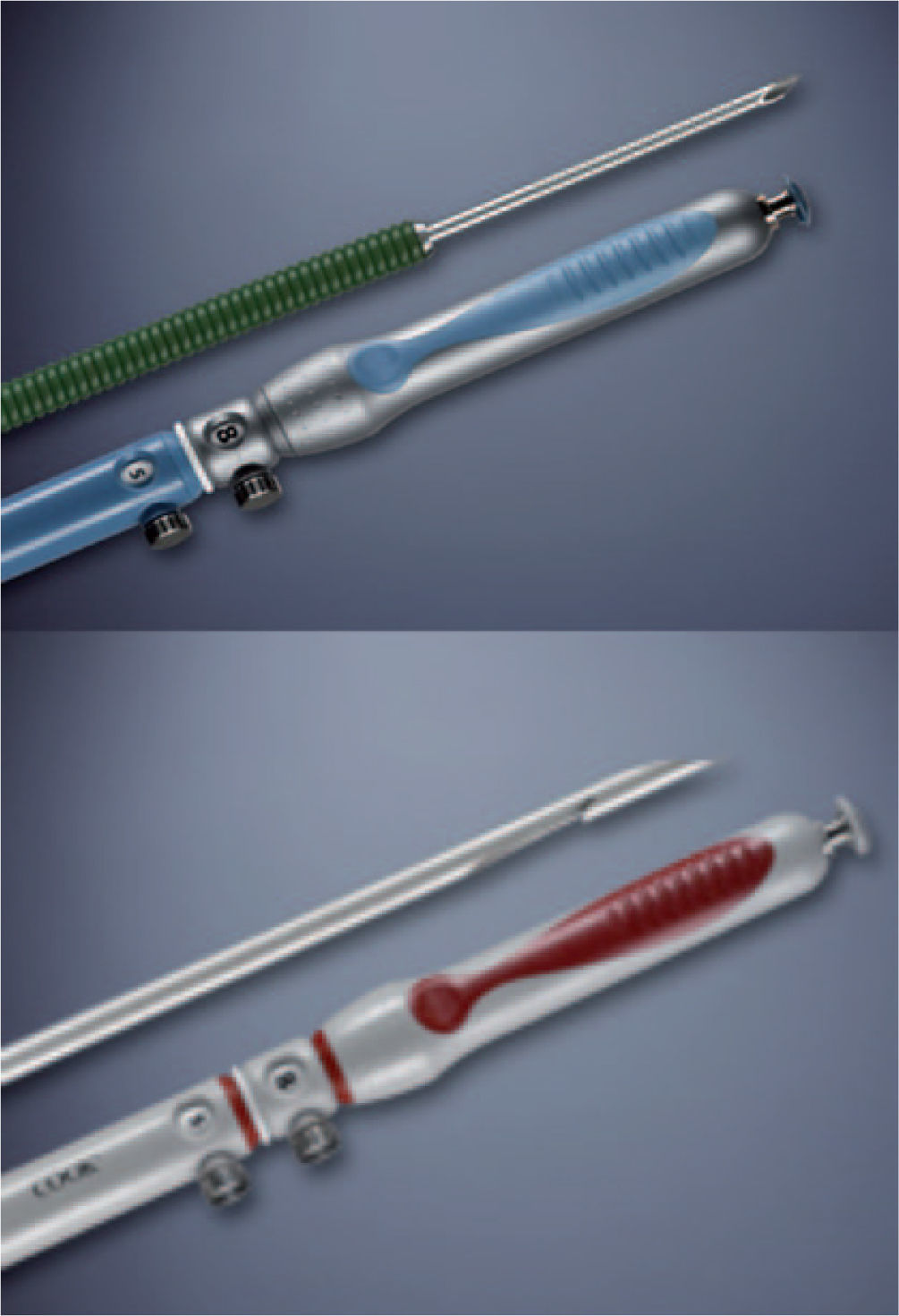
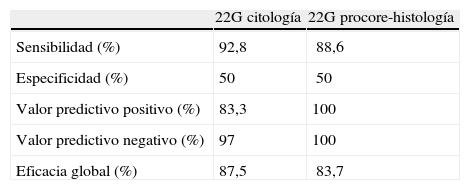
Estudios que evalúan el papel de la ultrasonografía endoscópica-punción aspiración con aguja fina. Tras el desarrollo de nuevas agujas de punción para obtención de material histológico (procore), varios estudios han tratado de compararlas frente a las convencionales (aptas para la obtención de material citológico) (fig. 2) en el diagnóstico diferencial de lesiones sólidas pancreáticas. Por sus sorprendentes resultados merece la pena comentar el estudio multicéntrico y prospectivo francés25, en el que se evalúa la eficacia diagnóstica en 80 pacientes mediante el uso cruzado de una aguja de 22G procore (1 pase) frente a una 22G Echotip® (de citología, 2 pases) en el diagnóstico de lesiones sólidas de páncreas. Se trata de un estudio aleatorizado, en el que primero se utiliza una aguja y después la del otro tipo sobre la misma lesión, empleando el patrón oro que se usa habitualmente en estos estudios (cirugía, citohistología positiva o seguimiento con un mínimo de 6 meses) y en el que los patólogos son independientes y ciegos para el resultado de aleatorización, y cuyos sorprendentes resultados aparecen reflejados en la tabla 2. Al parecer no hay ninguna mejora significativa en emplear las agujas procore de 22G frente a las de citología convencional, si bien es cierto que en este último grupo se realizaron 2 pases, frente a 1 en las agujas procore, y que la mayor parte de las lesiones eran malignas, en donde se sabe que la citología aumenta mucho su rendimiento.
Sensibilidad, especificidad, valores predictivos y eficacia global de las agujas de citología de 22G frente a las de histología-procore 22G en la eficacia diagnóstica de lesiones sólidas pancreáticas.
| 22G citología | 22G procore-histología | |
| Sensibilidad (%) | 92,8 | 88,6 |
| Especificidad (%) | 50 | 50 |
| Valor predictivo positivo (%) | 83,3 | 100 |
| Valor predictivo negativo (%) | 97 | 100 |
| Eficacia global (%) | 87,5 | 83,7 |
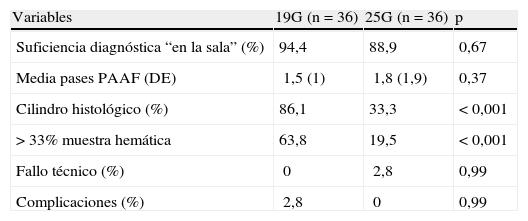
Por otra parte, en otro estudio se comparan de forma multicéntrica, prospectiva y aleatorizada26 las agujas de 19G frente a las de menor calibre, las de 25G. Con la presencia, en todos los casos, de patólogo en la sala y en 72 pacientes, los resultados aparecen reflejados en la tabla 3. Destacar que es factible realizar la punción de todo tipo de lesiones (incluidas las ubicadas en la cabeza, con la nueva aguja de 19G flexible) y que los resultados parecen favorecer a esta frente a las de 25G.
Comparativa de resultados entre las agujas de 19G y 25G en la punción de lesiones sólidas pancreáticas.
| Variables | 19G (n=36) | 25G (n=36) | p |
| Suficiencia diagnóstica “en la sala” (%) | 94,4 | 88,9 | 0,67 |
| Media pases PAAF (DE) | 1,5 (1) | 1,8 (1,9) | 0,37 |
| Cilindro histológico (%) | 86,1 | 33,3 | < 0,001 |
| > 33% muestra hemática | 63,8 | 19,5 | < 0,001 |
| Fallo técnico (%) | 0 | 2,8 | 0,99 |
| Complicaciones (%) | 2,8 | 0 | 0,99 |
DE: desviación estándar; PAAF: punción aspiración con aguja fina.
Por último, destacar por su importancia el trabajo de Wani et al27, en el que se compara de forma prospectiva y aleatorizada el rendimiento diagnóstico en la detección de malignidad con la presencia del citopatólogo “en la sala”. Empleando un estricto protocolo (7 pases cuando no se dispone de patólogo) y tras realizar cálculo del tamaño muestral, se muestran los resultados de un análisis “in interim” en 131 pacientes. La presencia de patólogo “en la sala” proporciona mayor cantidad de pacientes sin significación estadística con diagnóstico de malignidad (el 80,3 frente al 67,7%; p=0,09), mayor proporción significativa de pacientes con diagnóstico concluyente o sospechoso de malignidad (el 88 frente al 70,8%; p=0,01), así como mayor porcentaje de muestras adecuadas y una reducción significativa en el número de pases. El mensaje parece claro: si se dispone de patólogo “en la sala” lo ideal es utilizarlo; de lo que no se habla es de lo “entrenado” que tiene que estar el patólogo en patología pancreática y en la interpretación de las muestras.
Avances terapéuticos en el cáncer de páncreasPocos son los trabajos que hacen referencia a nuevos tratamientos para el CP. Tan solo destacaremos 2. El primero es un ensayo en fase I en humanos de la inyección intrapancreática a través de ecoendoscopia de una vacuna de poxvirus (PANVAC) asociada a tratamiento subcutáneo con la misma vacuna en 13 pacientes con CP localmente avanzado28. Este trabajo evidencia el posible y prometedor efecto beneficioso en términos de supervivencia, así como la factibilidad del procedimiento (realizado con agujas de 22G y 25G) y la ausencia de complicaciones en este grupo de pacientes, resultados que deberán ser corroborados en un ensayo fase II.
El segundo trabajo destaca por lo novedoso del mismo. Wang et al29 utilizan la ablación por radiofrecuencia guiada por ecoendoscopia (EUS-RFA) en 3 pacientes con adenocarcinoma de páncreas irresecable a través de una aguja de 22G. Si bien es anecdótico el número de pacientes, es de destacar la ausencia de complicaciones, la factibilidad del procedimiento, la buena tolerancia de los pacientes y el hecho de objetivarse una reducción en el tamaño del tumor y en los valores del Ca 19.9 durante el seguimiento.
Tumores quísticos de páncreasLa mayor parte de los trabajos presentados en la última edición de la DDW hacen referencia al tumor mucinoso papilar intraductal (TPMI). Básicamente se centran en validar la reciente guía internacional de manejo de estas neoplasias, que tuvo lugar tras la reunión de Fukuoka en 201230, así como en buscar predictores de desarrollo de malignidad en esta neoplasia. La mayor parte de estos trabajos se centran en la ecoendoscopia como procedimiento idóneo para su evaluación.
Haciendo referencia a la validación de las nuevas guías clínicas de 2012, nos centraremos en 2 trabajos. En el primero de ellos, a través de un estudio multicéntrico y retrospectivo de 5 años31 en el que se incluyen 544 pacientes con lesiones quísticas pancreáticas (un 2,4% de ellos resultaron finalmente malignas: displasia de alto grado, carcinoma y enfermedad metástásica), emplean la USE como procedimiento de referencia y se evalúa la eficacia de las nuevas guías en función de la presencia/ausencia de los siguientes criterios endosonográficos: a) presencia de nódulos murales; b) componente sólido; c) dilatación del Wirsung > 5 mm, y d) citología sospechosa y positiva para malignidad. Finalmente, del global de los pacientes, 77 (14,2%) presentaban algún criterio endosonográfico predictor de malignidad, pero ¡atención!: un 46,2% de los cánceres no mostraba ninguno de estos criterios. La presencia de algún criterio USE confería finalmente una sensibilidad, especificidad, VPP y VPN, respectivamente, del 53,8, 86,8, 9,1 y 98,7% para la detección de malignidad; mientras que en el análisis multivariante tan solo una citología sospechosa se asociaba de forma independiente con el riesgo de malignidad (OR: 42,5; IC del 95%, 7,5–241,5). La conclusión evidente de los autores del trabajo es que los criterios endosonográficos descritos carecen de sensibilidad suficiente para considerar la resección de lesiones quísticas mucinosas.
El segundo estudio al que haremos mención muestra resultados contradictorios con el primero. Se trata de un estudio retrospectivo32 sobre un período de 5 años, en el que se incluyeron 165 pacientes a los que se les realizó USE y en el que se evalúa el riesgo de desarrollar CP así como la supervivencia a 5 años de acuerdo a las nuevas guías. Los pacientes se separaron en 2 grupos: los considerados de alto riesgo por la presencia de ictericia, tener un Wirsung > 5 mm, tamaño del quiste > 30 mm y presencia de nódulos murales, frente a los de bajo riesgo, que no poseen ninguna de estas características. Se objetivó que el riesgo de desarrollar CP en los de alto riesgo es del 9%, frente al 1% en los de bajo riesgo (p=0,02) y que hay una tendencia a la menor supervivencia en los pacientes de alto riesgo a 3 y 5 años frente a los de bajo riesgo (el 85 frente al 93% y el 63 frente al 87%; p=0,08). Se concluye, por tanto, que los pacientes que no presentan “worrisome features” ni “high-risk stigmata”, según las guías de 2012, presentan un bajo riesgo para el desarrollo de CP.
En cuanto a la búsqueda de predictores de malignidad en lesiones quísticas pancreáticas destaca el trabajo de Gaddam et al33, en el que se establece un modelo de predicción de malignidad estudiando en un período de 5 años un total de 1.033 pacientes a los que se les hizo USE y USE-PAAF. Tras identificar determinados criterios predictivos de malignidad basándose en las características ecoendoscópicas, en la historia clínica del paciente así como en el líquido extraído tras la punción, que se asocian con un mayor riesgo de malignidad, como la presencia de masa sólida (OR: 7,9), mucina en la citología (OR: 99,3) y otros que se relacionan de forma negativa, como la historia previa de pancreatitis aguda (OR: 0,31), establecen una ecuación compleja que permite predecir, a partir de un determinado punto de corte, la presencia de malignidad con una sensibilidad del 90% y una especificidad del 73,3%. A pesar de la complejidad de este modelo predictivo, sus resultados lo hacen bastante atractivo y fuente de posteriores estudios multicéntricos.
De igual forma se presenta un estudio retrospectivo con 162 pacientes diagnosticados de TPMI de rama lateral en los que se trata de determinar predictores de malignidad34. Tras realizar un análisis de regresión logística se evidencia en el análisis multivariante que la presencia de un nódulo mural > 5mm y un valor de antígeno carcinoembrionario (CEA) en jugo pancreático obtenido mediante colangiopancreatografía retrógrada endoscópica (CPRE) > 30ng/ml constituyen factores independientes predictores de malignidad. De hecho, y de ahí lo importante del trabajo, es que cuando ambos factores están presentes el VPP es del 100% y el VPN del 96,6%.
A modo de resumen se presenta una revisión sistemática que precisamente evalúa el rendimiento diagnóstico de los procedimientos endoscópicos a la hora de distinguir benignidad de malignidad en los TPMI35. Este metaanálisis incluye 668 pacientes de 17 estudios observacionales y concluye que si bien estos procedimientos endoscópicos (que incluyen la USE-PAAF y la CPRE) presentan buena especificidad a la hora de detectar malignidad, carecen de una adecuada sensibilidad, por lo que los autores advierten de la necesidad de encontrar nuevas técnicas o marcadores que ayuden en este sentido.
Finalmente, en la parte diagnóstica comentaremos 2 trabajos que específicamente hacen referencia a la utilidad del CEA intraquístico como predictor de lesiones mucinosas. En el primero de ellos36, tras estudiar por USE-PAAF de forma retrospectiva a 86 pacientes, y siempre utilizando la histología de la pieza quirúrgica como patrón oro, tras el cálculo correspondiente de las curvas ROC, se establece que el punto de corte óptimo del valor del CEA en la detección de lesiones quísticas mucinosas frente a las no mucinosas se situaría en 30,7ng/ml. Utilizando este punto de corte se obtendrían las siguientes cifras, respectivas, de sensibilidad, especificidad, VPP, VPN y eficacia global: 88,3, 77,8, 97,1, 43,8 y 87,2%. Simplemente recordar que el punto de corte que hasta ahora se consideraba para este sentido era el de 192ng/ml, por lo que este nuevo punto de corte ha de ser tenido en consideración para posteriores trabajos. De igual forma se presenta, en forma de póster, un metaanálisis37 en el que se incluyen 8 estudios y 504 pacientes y en el que se concluye que la eficacia del CEA intraquístico en la diferenciación de quistes benignos de malignos es baja, y que la decisión de realizar un acto quirúrgico de un quiste pancreático incluyendo los TPMI no debe basarse solamente en la presencia de un CEA intraquístico elevado.
Desde el punto de vista terapéutico, tan solo destacaremos el trabajo de Pai et al38, en el que de forma prospectiva realizan ablación por radiofrecuencia guiada por ecoendoscopia (EUS-RFA) de 6 neoplasias quísticas (5 mucinosas y 1 adenoma microquístico) a través de agujas de 19G y 22G. Los autores concluyen no solo que el procedimiento es factible y seguro (no se registraron complicaciones), sino que además en 2 pacientes, tras realizarse en 3-6 meses una prueba de imagen de control, se evidenciaba una resolución completa, mientras que en los 4 restantes se observaba una reducción del 50% del diámetro de la neoplasia.
ConclusionesEn la actualidad, el CP continúa siendo una entidad de difícil manejo, con una incidencia que se mantiene prácticamente estable y con elevada morbimortalidad. Se buscan nuevos grupos de riesgo en los que realizar cribado y eventuales factores protectores o que nos ayuden a identificar de forma precoz la enfermedad. En este punto, las estatinas parecen actuar como factor protector, pero solo en sujetos fumadores, un agravamiento de la DM debe hacernos sospechar un CP y la positividad para HbsAg del virus de la hepatitis B parece constituir un grupo de riesgo. En el campo diagnóstico, la USE se asienta como el pilar fundamental para la detección del CP incorporándose métodos asociados a esta que ayudan en el diagnóstico diferencial con otras entidades, como la PC; en este campo destacaremos la elastografía cuantitativa, el uso de contrastes i.v. en modo armónico y, más recientemente, la endomicroscopia láser confocal a través de la aguja. Precisamente hablando de estas surgen estudios comparativos entre las agujas tradicionales de citología y las nuevas procore de histología con resultados contradictorios, confirmándose la importancia vital de la presencia de un patólogo “en la sala” para aumentar el rendimiento diagnóstico de las punciones guiadas por USE en el diagnóstico de CP. Con referencia a los tumores quísticos, la mayoría de los trabajos se centran en validar las recientes guías de consenso internacional de Fukuoka en 2012 (con resultados también contradictorios) y en la predicción de malignidad de los TPMI, fundamentalmente basándose en criterios ecoendoscópicos. El valor del CEA intraquístico vuelve a ponerse en entredicho y desde el punto de vista terapéutico aparecen trabajos que avalan la seguridad de la ablación por radiofrecuencia por USE, tanto en lesiones sólidas como quísticas.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.