Ustekinumab es un anticuerpo monoclonal dirigido frente a la subunidad p40, que forma parte de las interleucinas IL-12 y IL-23. En los ensayos clínicos fase3, ustekinumab ha demostrado su eficacia frente a placebo, en términos de respuesta clínica y remisión de la inducción. Cuando se ha empleado como terapia de mantenimiento por vía subcutánea, ustekinumab ha confirmado su beneficio terapéutico (sobre placebo) tanto en la respuesta clínica como en la remisión, en pacientes que habían respondido clínicamente a la terapia de inducción. Adicionalmente, ustekinumab ha demostrado una mejoría de los parámetros de curación mucosa. El perfil de seguridad del fármaco ha sido bueno, con tasas de infecciones infrecuentes (sin reactivación de tuberculosis) y ausencia de descripción de tumores. El desarrollo de inmunogenicidad frente al fármaco parece ser infrecuente. En resumen, ustekinumab representa una prometedora opción de tratamiento en pacientes con enfermedad de Crohn, como alternativa a los fármacos anti-TNFα.
Ustekinumab is a monoclonal antibody directed against the p40 subunit, which is part of interleukins IL-12 and IL-23. The efficacy of ustekinumab versus placebo in terms of clinical response and remission of induction has been shown in phase3 clinical trials. When used as subcutaneous maintenance therapy, the therapeutic benefit of ustekinumab over placebo has been confirmed in both clinical response and remission in patients who have responded clinically to induction therapy. In addition, ustekinumab has demonstrated an improvement in mucosal healing parameters. The safety profile of the drug has been good, with low infection rates (without reactivation of tuberculosis) and absence of tumour reporting. The development of drug immunogenicity appears to be rare. In summary, ustekinumab is a promising treatment option in patients with Crohn's disease, as an alternative to anti-TNFα drugs.
La enfermedad de Crohn es una enfermedad inflamatoria crónica mediada por la inmunidad del tracto gastrointestinal, caracterizada por períodos de actividad y de remisión1. En los últimos años se han realizado grandes avances en el tratamiento farmacológico de esta enfermedad. Sin embargo, existe todavía un importante número de pacientes para los cuales los tratamientos actuales siguen siendo insuficientes.
Los aminosalicilatos son escasamente eficaces (sobre todo en la enfermedad de Crohn de localización ileal). Por otro lado, los corticosteroides son eficaces para inducir la remisión, pero no logran mantenerla. Debido a ello, con frecuencia —habitualmente por corticodependencia— es preciso recurrir a los fármacos inmunosupresores (fundamentalmente tiopurínicos, como la azatioprina o la mercaptopurina, y metotrexato), los cuales se asocian con una relativamente elevada incidencia de efectos adversos2-6. Además, estos inmunosupresores tienen un inicio de acción lento (varios meses), lo que los hace inadecuados para inducir la remisión.
Con cierta frecuencia se requiere escalar el tratamiento y emplear alguno de los fármacos bloqueantes del factor de necrosis tumoral alfa (TNFα), que en nuestro medio se limitan a infliximab o adalimumab en el caso de la enfermedad de Crohn7-10. Sin embargo, aproximadamente un tercio de los pacientes no responden inicialmente al tratamiento anti-TNFα (fracaso primario), y una proporción relevante experimenta pérdida de eficacia (fracaso secundario) o intolerancia al mismo8,11-16. Por otra parte, los efectos secundarios asociados al empleo de estos últimos fármacos, aunque infrecuentes, pueden ser graves17,18. Finalmente, los pacientes no respondedores —tanto primarios como secundarios— a los fármacos anti-TNFα muestran una peor respuesta al retratamiento con estos fármacos que aquellos que son naïve19.
Recientemente, se ha aprobado el tratamiento con vedolizumab para pacientes con enfermedad de Crohn adultos con respuesta inadecuada, pérdida de respuesta, contraindicación o intolerancia al tratamiento convencional o a fármacos anti-TNFα20. Aunque este fármaco representa una alternativa terapéutica prometedora, dispone de una eficacia moderada en los pacientes con enfermedad de Crohn21-23.
Consecuentemente, es patente la necesidad clínica de disponer de agentes biológicos adicionales dirigidos a otras vías inflamatorias o dianas terapéuticas24-27. Ustekinumab es un anticuerpo monoclonal dirigido a la subunidad p40 compartida por las citocinas proinflamatorias interleucina (IL) IL-12 e IL-23.
La IL-12 y la IL-23 desempeñan una función clave en la cascada inflamatoria en la enfermedad de Crohn28,29. En la patogénesis de esta enfermedad, la activación de los receptores tipo toll y los dominios de oligomerización para la unión a nucleótidos (NOD) por parte de antígenos bacterianos dan lugar a la secreción de IL-12 e IL-23 por las células presentadoras de antígeno28-30. La IL-12, un heterodímero compuesto por una subunidad p35 y p40, es la principal responsable de la activación de la maduración de los linfocitosT indiferenciados a linfocitos Th130. Los pacientes con enfermedad de Crohn muestran una respuesta de tipo Th1 similar, en muchos aspectos, a la observada en la infección aguda28,29. Esta respuesta Th1 se asocia a la expresión de citocinas proinflamatorias, incluidos interferón gamma (IFNγ) y TNFα28,29,31. La producción de IFNγ mediada por IL-12 da lugar a la amplificación de la cascada inflamatoria y la posterior producción de citocinas, incluidas IL-7, IL-15, IL-18 e IL-21, que estimulan aún más la respuesta de los linfocitos Th131.
Por otro lado, la IL-23 es una proteína heterodimérica que tiene una subunidad común con la IL-12 (p40) acoplada con p1928,29. Actúa sobre los linfocitos Th17 estimulando la producción de una serie de citocinas efectoras. Estas provocan la respuesta inflamatoria mediante la inducción de la infiltración de neutrófilos y la inducción de la expresión de otras citocinas proinflamatorias, como TNFα, IL-1β e IL-628,29. De este modo, la acumulación de los efectos mediados por las citocinas producidas a través de los linfocitos Th17 contribuye a la inflamación crónica característica de la enfermedad de Crohn29. Ustekinumab impide, precisamente, la interacción de estas citocinas con el receptor IL-12Rβ1 de la superficie de los linfocitosT32-34, interrumpiendo así la activación de estas líneas celulares que participan en la mencionada inflamación descrita en la enfermedad de Crohn29,35,36.
El presente artículo pretende revisar el papel de ustekinumab en la enfermedad de Crohn, prestando especial atención a sus propiedades farmacocinéticas y farmacodinámicas, su posología, sus indicaciones, su eficacia, su seguridad y, finalmente, cuál podría ser el lugar que ocupe el fármaco en el tratamiento de esta enfermedad. Para ello se ha empleado una estrategia de búsqueda bibliográfica en MedLine y en los congresos internacionales más relevantes [European Crohn's and Colitis Organisation (ECCO), United European Gastroenterology (UEG) y Digestive Disease Week (DDW)], incluyendo los términos «Crohn's disease» y «ustekinumab».
Propiedades farmacocinéticasLa mediana del volumen de distribución durante la fase terminal (Vz) tras una única administración intravenosa de ustekinumab a pacientes con psoriasis fue de 57 a 83ml/kg. La mediana del aclaramiento (CL) sistémico después de una sola administración intravenosa a estos pacientes osciló entre 1,99 y 2,34ml/día/kg37.
La mediana de la semivida (t1/2) de ustekinumab fue aproximadamente de 3semanas en los pacientes con psoriasis, artritis psoriásica o enfermedad de Crohn, con un intervalo de 15 a 32días en todos los ensayos de psoriasis y artritis psoriásica37.
En un análisis farmacocinético poblacional, el aclaramiento aparente (CL/F) y el volumen de distribución aparente (V/F) fueron de 0,465 y 15,7l/día, respectivamente, en los pacientes con psoriasis. El sexo no influyó en el CL/F del fármaco. El análisis farmacocinético poblacional mostró una tendencia hacia un aumento del aclaramiento de ustekinumab en los pacientes con anticuerpos positivos frente a ustekinumab37.
El peso parece afectar a los parámetros farmacocinéticos. Así, los pacientes con psoriasis o artritis psoriásica con un peso>100kg presentaron una mediana de concentraciones plasmáticas de ustekinumab más baja tras la administración de la misma dosis que aquellos con un peso ≤100kg34.
Actualmente no se dispone de datos farmacocinéticos sobre el uso de ustekinumab en pacientes con insuficiencia renal o hepática.
Propiedades farmacodinámicasUstekinumab es un anticuerpo monoclonal totalmente humano perteneciente al grupo farmacoterapéutico de los inmunosupresores, inhibidores de la IL (código ATC: L04AC05).
Como se ha mencionado previamente, ustekinumab se une específicamente a la subunidad proteica p40 que comparten la IL-12 y la IL-23, inhibiendo la unión de estas al receptor IL-12Rβ1, que se expresa en la superficie de los linfocitosT. Sin embargo, ustekinumab no puede unirse a aquellas citocinas que ya estén adheridas a la superficie celular por su interacción con estos receptores IL-12Rβ1. Gracias a esto, es poco probable que ustekinumab active la cascada del complemento que provoca la destrucción celular (citotoxicidad mediada por el complemento).
Debido a la unión de ustekinumab a la subunidad p40 que comparten la IL-12 y la IL-23, ustekinumab ejerce su efecto clínico en psoriasis38,39, artritis psoriásica39 y enfermedad de Crohn28,31, a través de la interrupción de las vías de las citocinas Th1 y Th17, que son centrales en la patogenia de las mencionadas enfermedades.
Dosis y frecuencia de administración en la enfermedad de CrohnSegún la información de la ficha técnica, en la enfermedad de Crohn, la primera dosis de ustekinumab se debe administrar por vía intravenosa37. Esta dosis es única, y está basada en el peso del paciente (aproximadamente 6mg/kg). Se recomienda que los pacientes que pesen ≤55kg reciban 260mg, los pacientes que pesen>55 y ≤85kg reciban 390mg, y los pacientes con un peso>85kg reciban 520mg37. Ustekinumab intravenoso se presenta en viales de 130mg, de manera que según el rango de peso en que se encuentre el paciente recibirá 2, 3 o 4 viales.
La primera dosis subcutánea de ustekinumab, de 90mg, debe administrarse 8semanas después de la dosis intravenosa inicial. Tras esto, según criterio médico, puede establecerse una pauta de dosis cada 8 o cada 12semanas. Se recomienda, por tanto, una evaluación del paciente a las 8semanas de la primera dosis subcutánea. En este punto, se debe considerar la suspensión del tratamiento en pacientes que no muestren ningún beneficio terapéutico. Así mismo, se puede valorar la administración de la segunda dosis en el momento de la evaluación en caso de presentar una eficacia parcial (respuesta clínica) o, en caso de haber logrado una respuesta completa (remisión clínica), posponer la administración hasta la semana12.
Durante todo el tratamiento, queda abierta la posibilidad, a criterio médico, de que los pacientes que no respondan de manera suficiente (o pierdan eficacia) a la pauta de 90mg cada 12semanas puedan beneficiarse de un aumento en la frecuencia de administración a cada 8semanas40.
En los pacientes de edad avanzada no es necesario ajustar la dosis, pues los análisis de farmacocinética no han revelado ningún efecto del incremento de la edad. En la población pediátrica con enfermedad de Crohn no se dispone de datos, no habiéndose establecido ni la eficacia ni la seguridad de ustekinumab en niños de 0-17años.
Indicación terapéutica en la enfermedad de CrohnSegún la ficha técnica, ustekinumab está indicado para el tratamiento de la enfermedad de Crohn activa, de moderada a grave, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o a anti-TNFα, o presenten contraindicaciones médicas a esos tratamientos37.
Eficacia clínica en la enfermedad de CrohnLa eficacia y seguridad de ustekinumab en pacientes con enfermedad de Crohn se ha evaluado en 2 ensayos clínicos fase2, y en 3 ensayos fase3. Adicionalmente, se están llevando a cabo 2 ensayos clínicos para evaluar la eficacia en pacientes pediátricos (12-17años)41 y para investigar el beneficio de diferentes estrategias terapéuticas, con la hipótesis de que una estrategia de tratamiento de mantenimiento con ustekinumab junto con una evaluación endoscópica temprana se asociaría a una mayor eficacia (en términos de curación mucosa)42.
En el ensayo fase2b CERTIFI se estudió la eficacia de ustekinumab en pacientes con enfermedad de Crohn con fracaso al tratamiento con anti-TNFα. Se administró ustekinumab por vía intravenosa a dosis de 1, 3 y 6mg/kg peso. La respuesta clínica en la semana6 fue significativamente mayor que la del placebo en todos los grupos terapéuticos43.
Posteriormente se realizaron 2 ensayos clínicos fase3 de inducción de ustekinumab en enfermedad de Crohn (UNITI-1 y UNITI-2) y un ensayo de mantenimiento (IM-UNITI), todos ellos aleatorizados, doble ciego y controlados con placebo, como se resume a continuación44.
Eficacia como tratamiento de inducción (UNITI-1 y UNITI-2)En ambos estudios se incluyeron pacientes con una enfermedad de Crohn de moderada a grave, esto es, con una puntuación en el Crohn's Disease Activity Index (CDAI) de 220 a 450puntos. Debían haber experimentado fracaso o ser intolerantes al tratamiento anti-TNFα (UNITI-1) o al tratamiento convencional (UNITI-2), incluidos inmunosupresores (azatioprina, mercaptopurina, metotrexato) o corticosteroides. En el estudio UNITI-2, podían incluirse pacientes con antecedentes de tratamiento con anti-TNFα, pero solo si no habían fracasado ni habían desarrollado intolerancia a dicho tratamiento. En ambos ensayos se estudió la inducción, analizando la eficacia de una dosis fija de 130mg o una dosis variable ajustada por peso (6mg/kg).
El objetivo primario del estudio (respuesta clínica en la semana6) se alcanzó con ambas dosis estudiadas en los ensayos UNITI-1 y UNITI-2. Los principales resultados de eficacia de ambos estudios para la dosis finalmente aprobada en ficha técnica (6mg/kg) se muestran en la tabla 1.
Resultados de eficacia de ustekinumab en la enfermedad de Crohn en los estudios UNITI-1 y UNITI-2
| Eficacia | UNITI-1 | UNITI-2 |
|---|---|---|
| Respuesta clínica semana 3 (CDAI>70) | 101/249 (40,6%)* | 106/209 (50,7%)* |
| Respuesta clínica semana 6 (CDAI>100) | 84/249 (33,7%)* | 116/249 (55,5%)* |
| Respuesta clínica semana 8 (CDAI>100) | 94/249 (37,8%)* | 121/249 (57,9%)* |
CDAI: Crohn's Disease Activity Index.
Los primeros datos de eficacia derivados de estos estudios se analizaron a la semana3 de la inducción, donde se observó ya una diferencia significativa entre ustekinumab y placebo, lo que sugiere que el efecto del tratamiento sería más rápido de lo descrito con otros fármacos biológicos22. Además, esta diferencia aumentó de manera progresiva en las sucesivas semanas del estudio. Así, en la semana6 (objetivo primario del estudio) el 34% de los pacientes en el UNITI-1 y el 55% en el UNITI-2 cumplieron criterios de respuesta clínica (CDAI<100), siendo estas cifras del 38 y 58%, respectivamente, en la semana8. De manera similar a lo descrito con otros tratamientos biológicos, la eficacia fue superior en los pacientes naïve a los fármacos anti-TNFα (UNITI-2) que en aquellos en los que habían fracasado previamente estos fármacos (UNITI-1)45.
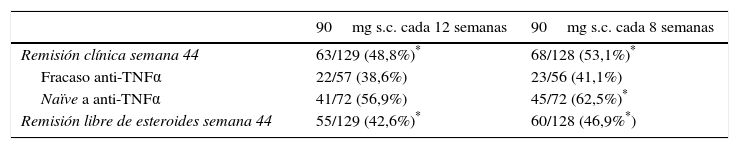
Eficacia como tratamiento de mantenimiento (IM-UNITI).En el estudio IM-UNITI se demostró que el tratamiento de mantenimiento con ustekinumab (administrado por vía subcutánea) era eficaz en los pacientes que habían respondido a la terapia de inducción intravenosa de los estudios UNITI-1 o UNITI-244. Aunque el tratamiento con 90mg de ustekinumab cada 8semanas alcanzó resultados de eficacia numéricamente superiores a los de la administración cada 12semanas, las diferencias no alcanzaron la significación estadística44. Con ambas pautas de administración, la tasa de remisión clínica (CDAI<150) a la semana44 (objetivo primario) fue significativamente superior frente a placebo. En la tabla 2 se muestran los resultados de eficacia del ensayo IM-UNITI con las 2 pautas posológicas mencionadas.
Resultados de eficacia de ustekinumab en la enfermedad de Crohn en el estudio IM-UNITI
| 90mg s.c. cada 12 semanas | 90mg s.c. cada 8 semanas | |
|---|---|---|
| Remisión clínica semana 44 | 63/129 (48,8%)* | 68/128 (53,1%)* |
| Fracaso anti-TNFα | 22/57 (38,6%) | 23/56 (41,1%) |
| Naïve a anti-TNFα | 41/72 (56,9%) | 45/72 (62,5%)* |
| Remisión libre de esteroides semana 44 | 55/129 (42,6%)* | 60/128 (46,9%*) |
La pauta de administración de ustekinumab en la fase de mantenimiento se inicia con una dosis subcutánea en la semana8, tras lo cual, según criterio clínico, puede administrarse tanto cada 8 como cada 12semanas40, tal y como se ha mencionado anteriormente. La posibilidad del ajuste de dosis surge de un subanálisis del IM-UNITI, en el que los pacientes con falta de respuesta a la pauta de cada 12semanas consiguen tasas de remisión clínica del 41% a las 16 semanas de modificar su pauta a cada 8semanas46.
En coincidencia con lo descrito en los estudios de inducción, la eficacia fue mayor en los pacientes naïve a biológicos que en aquellos con fracaso a anti-TNFα (tabla 2). Así, los pacientes procedentes del ensayo UNITI-2 (naïve a biológicos) alcanzaron tasas de eficacia superiores a los del UNITI-1 (fracaso a anti-TNFα). Esta diferencia coincide con lo descrito con otros fármacos biológicos, como es el caso de vedolizumab21.
En base a todos estos resultados, el informe elaborado por el comité de productos médicos de uso humano de la EMA consideró que «ustekinumab proporciona un beneficio clínico significativo comparado con las terapias existentes»47.
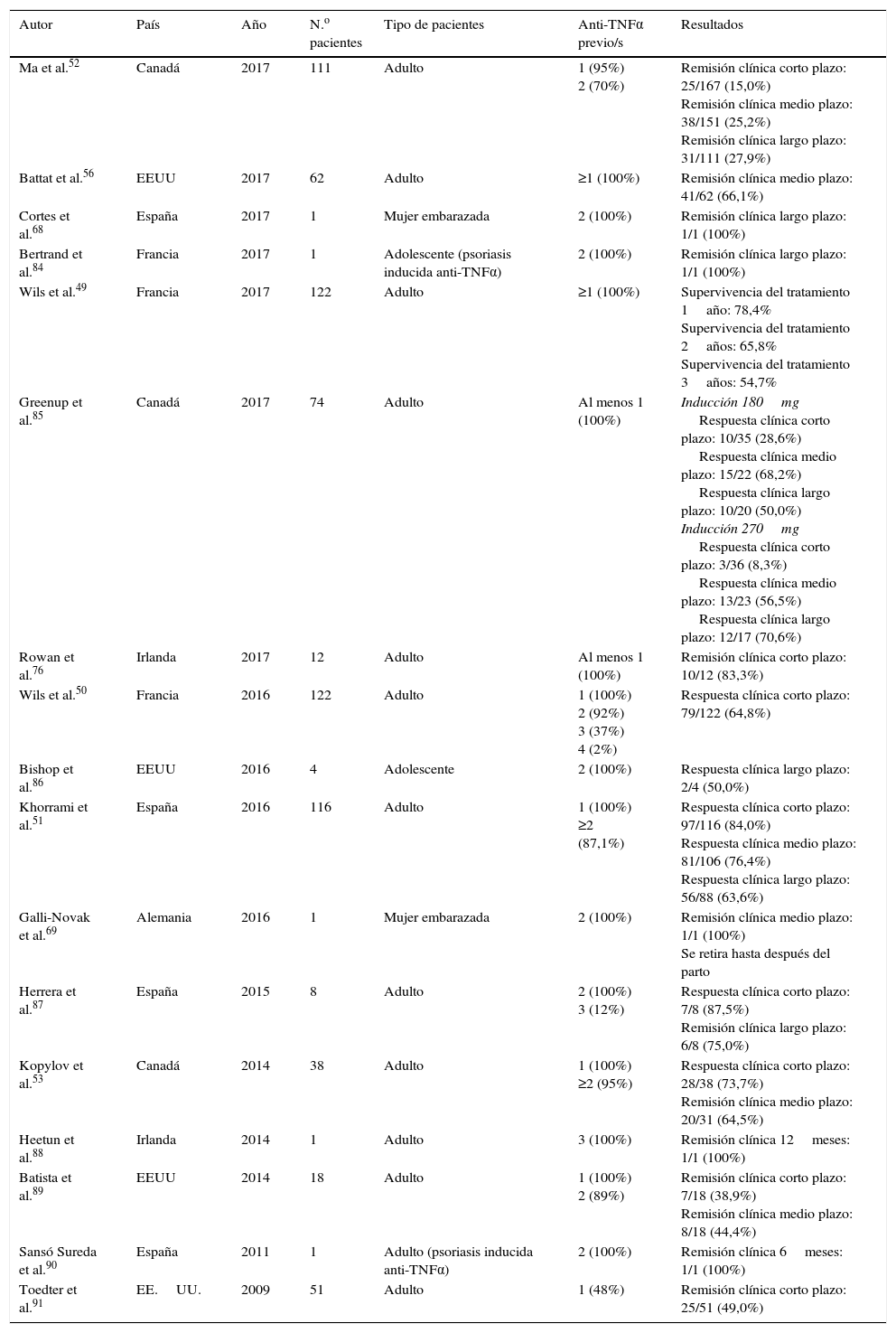
Resultados en la práctica clínicaLas series de pacientes tratados con ustekinumab incluidos en estudios de práctica clínica que se han publicado hasta la fecha, así como sus principales resultados de eficacia, se resumen en la tabla 3. Es preciso destacar que todos los pacientes incluidos en estas series habían fracasado previamente a, al menos, un anti-TNF, y la mayoría lo había hecho a 2. Además, la mayor parte de los estudios utilizaron dosis exclusivamente subcutáneas y la frecuencia de administración del fármaco fue muy variable (generalmente a criterio clínico), lo que dificulta considerablemente la evaluación global y la interpretación de dichos resultados.
Estudios clínicos que evalúan ustekinumab en la enfermedad de Crohn en la práctica clínica
| Autor | País | Año | N.o pacientes | Tipo de pacientes | Anti-TNFα previo/s | Resultados |
|---|---|---|---|---|---|---|
| Ma et al.52 | Canadá | 2017 | 111 | Adulto | 1 (95%) 2 (70%) | Remisión clínica corto plazo: 25/167 (15,0%) Remisión clínica medio plazo: 38/151 (25,2%) Remisión clínica largo plazo: 31/111 (27,9%) |
| Battat et al.56 | EEUU | 2017 | 62 | Adulto | ≥1 (100%) | Remisión clínica medio plazo: 41/62 (66,1%) |
| Cortes et al.68 | España | 2017 | 1 | Mujer embarazada | 2 (100%) | Remisión clínica largo plazo: 1/1 (100%) |
| Bertrand et al.84 | Francia | 2017 | 1 | Adolescente (psoriasis inducida anti-TNFα) | 2 (100%) | Remisión clínica largo plazo: 1/1 (100%) |
| Wils et al.49 | Francia | 2017 | 122 | Adulto | ≥1 (100%) | Supervivencia del tratamiento 1año: 78,4% Supervivencia del tratamiento 2años: 65,8% Supervivencia del tratamiento 3años: 54,7% |
| Greenup et al.85 | Canadá | 2017 | 74 | Adulto | Al menos 1 (100%) | Inducción 180mg Respuesta clínica corto plazo: 10/35 (28,6%) Respuesta clínica medio plazo: 15/22 (68,2%) Respuesta clínica largo plazo: 10/20 (50,0%) Inducción 270mg Respuesta clínica corto plazo: 3/36 (8,3%) Respuesta clínica medio plazo: 13/23 (56,5%) Respuesta clínica largo plazo: 12/17 (70,6%) |
| Rowan et al.76 | Irlanda | 2017 | 12 | Adulto | Al menos 1 (100%) | Remisión clínica corto plazo: 10/12 (83,3%) |
| Wils et al.50 | Francia | 2016 | 122 | Adulto | 1 (100%) 2 (92%) 3 (37%) 4 (2%) | Respuesta clínica corto plazo: 79/122 (64,8%) |
| Bishop et al.86 | EEUU | 2016 | 4 | Adolescente | 2 (100%) | Respuesta clínica largo plazo: 2/4 (50,0%) |
| Khorrami et al.51 | España | 2016 | 116 | Adulto | 1 (100%) ≥2 (87,1%) | Respuesta clínica corto plazo: 97/116 (84,0%) Respuesta clínica medio plazo: 81/106 (76,4%) Respuesta clínica largo plazo: 56/88 (63,6%) |
| Galli-Novak et al.69 | Alemania | 2016 | 1 | Mujer embarazada | 2 (100%) | Remisión clínica medio plazo: 1/1 (100%) Se retira hasta después del parto |
| Herrera et al.87 | España | 2015 | 8 | Adulto | 2 (100%) 3 (12%) | Respuesta clínica corto plazo: 7/8 (87,5%) Remisión clínica largo plazo: 6/8 (75,0%) |
| Kopylov et al.53 | Canadá | 2014 | 38 | Adulto | 1 (100%) ≥2 (95%) | Respuesta clínica corto plazo: 28/38 (73,7%) Remisión clínica medio plazo: 20/31 (64,5%) |
| Heetun et al.88 | Irlanda | 2014 | 1 | Adulto | 3 (100%) | Remisión clínica 12meses: 1/1 (100%) |
| Batista et al.89 | EEUU | 2014 | 18 | Adulto | 1 (100%) 2 (89%) | Remisión clínica corto plazo: 7/18 (38,9%) Remisión clínica medio plazo: 8/18 (44,4%) |
| Sansó Sureda et al.90 | España | 2011 | 1 | Adulto (psoriasis inducida anti-TNFα) | 2 (100%) | Remisión clínica 6meses: 1/1 (100%) |
| Toedter et al.91 | EE.UU. | 2009 | 51 | Adulto | 1 (48%) | Remisión clínica corto plazo: 25/51 (49,0%) |
Corto plazo: 2-3meses; medio plazo: ∼6meses; largo plazo: ∼12meses.
Recientemente se han publicado los resultados del seguimiento a largo plazo (semana96) del estudio IM-UNITI, incluyéndose los pacientes que continuaron tanto a dosis cada 12semanas como a dosis cada 8semanas: el 79 y el 87% de los pacientes, respectivamente, continuaban en remisión clínica al final del seguimiento48. En esta misma línea, se han publicado recientemente los resultados del mayor seguimiento hasta la fecha del tratamiento con ustekinumab en pacientes con enfermedad de Crohn, con una supervivencia del fármaco del 78% al año, del 66% a los 2años y del 55% a los 3años49. Estos resultados a largo plazo podrían ser superiores a los descritos previamente con los fármacos anti-TNFα15, si bien la ausencia de estudios comparativos directos impide extraer conclusiones firmes.
Enfermedad fistulizante perianalLa evidencia sobre la eficacia de ustekinumab en el tratamiento de las fístulas perianales es aún muy limitada, pero prometedora. La serie francesa de Wils et al. (GETAID) incluyó 9pacientes con afectación perianal, de los cuales 8 (89%) presentaron un beneficio clínico a los 3meses del tratamiento con ustekinumab50. Otras series han mostrado resultados similares, como la española (61% pacientes con mejoría de la afectación perianal)51, y 2 series canadienses más que evidencian una eficacia en fístulas perianales que oscila entre el 49%52 y el 69%53.
Cotratamiento con inmunosupresoresEl beneficio de la combinación de los fármacos inmunosupresores con los biológicos con la intención de mejorar su eficacia es un aspecto controvertido sobre el que no hay una evidencia definitiva54,55. Un tercio de los pacientes del estudio IM-UNITI recibían inmunosupresores concomitantes al inicio del ensayo, lo cual no pareció influir en la eficacia del tratamiento43. A nivel endoscópico también se ha comprobado que el uso de inmunosupresores no modifica las tasas de respuesta y remisión56. En resumen, a pesar de que no existen datos que muestren un aumento de la eficacia de ustekinumab con el tratamiento inmunosupresor concomitante, actualmente no puede establecerse una recomendación concluyente, precisándose más datos que aclaren este punto.
Utilidad de los biomarcadores como predictores de la respuesta al tratamientoEn los ensayos fase3 se evaluó el papel que los niveles de proteínaC reactiva (PCR) y de calprotectina fecal podrían desempeñar como factores predictores de la respuesta al tratamiento con ustekinumab57,58. Así, en los estudios UNITI-1 y UNITI-2, las reducciones de las concentraciones plasmáticas de PCR en las semanas 3, 6 y 8, en comparación con la basal, fueron significativamente mayores con ustekinumab que con placebo44. Resultados similares se encontraron para la concentración de calprotectina fecal que, ya en la semana6, fue inferior de forma estadísticamente significativa44. En general, las reducciones alcanzadas en los niveles de PCR y calprotectina fecal durante la fase de inducción se mantuvieron hasta la semana44 con ambas dosis de ustekinumab en el estudio IM-UNITI44. Finalmente, estudios adicionales han identificado otros biomarcadores sanguíneos como potenciales predictores de la respuesta al tratamiento, incluyendo la reducción del receptor sérico de la IL-2, la mieloperoxidasa, la creatincinasaMB y la IL-8, así como un aumento de la proteína amiloideA sérica, IFNγ, IL-17A, y TNFα59,60.
Eficacia sobre la cicatrización mucosaDurante la última década se ha planteado la cicatrización mucosa como un factor predictivo de la evolución de la enfermedad y por tanto como uno de los principales objetivos terapéuticos61. En el seno de los ensayos clínicos UNITI e IM-UNITI se realizó un subestudio endoscópico para analizar la eficacia de ustekinumab sobre la cicatrización mucosa. Los pacientes fueron sometidos a una colonoscopia basal y en las semanas 8 y 44. Se observó una reducción desde el valor basal en la puntuación del Simple Endoscopic Score for Crohn's Disease (SES-CD) significativamente mayor en los pacientes tratados con ustekinumab frente a los que recibieron placebo. Este beneficio terapéutico de ustekinumab se confirmó en ambos estudios de inducción (UNITI-1 y UNITI-2) y para ambas dosis de mantenimiento (cada 8 y cada 12semanas)62. Finalmente, estos hallazgos han sido confirmados en algunos estudios no aleatorizados, como el de Battat et al. (que describió una respuesta endoscópica en el 59% de los pacientes)56 o el de Ma et al. (que constató la respuesta endoscópica en la mitad de los casos)52.
Perfil de seguridadA pesar de la reciente aprobación de ustekinumab en la enfermedad de Crohn, existe un amplio conocimiento sobre este fármaco en el campo de la dermatología y la reumatología. Esto permite que los datos de seguridad de ustekinumab se basen en un considerable número de pacientes tratados en la práctica clínica real.
En este sentido, el registro PSOLAR, un registro longitudinal de más de 12.000pacientes con psoriasis tratados con diferentes biológicos63,64, sugirió que el tratamiento con infliximab y adalimumab se asociaba a un mayor riesgo de presentar infecciones graves, en comparación con el placebo; mientras que los pacientes que recibían ustekinumab no mostraron una mayor incidencia de complicaciones infecciosas65. No obstante, hay que tener en cuenta que los resultados de seguridad en los pacientes con psoriasis no son necesariamente extrapolables a los que tienen enfermedad de Crohn, puesto que lo habitual en la primera es el empleo en monoterapia y a dosis generalmente inferiores.
Por otro lado, resulta destacable la ausencia, hasta el momento, de reactivaciones de tuberculosis latente en los pacientes tratados con ustekinumab. En este contexto, un reciente metaanálisis comparó las tasas de reactivación tuberculosa entre ustekinumab y diversos tratamientos anti-TNFα en los ensayos clínicos fases 2 y 3 realizados en pacientes con artritis reumatoide, espondilitis anquilosante, psoriasis, artritis psoriásica, enfermedad de Crohn y colitis ulcerosa, observándose una frecuencia de complicaciones significativamente inferior en los pacientes que recibían ustekinumab66.
Del mismo modo, el registro PSOLAR sugiere que ustekinumab es seguro durante el embarazo, no observándose un incremento de abortos, partos prematuros ni anomalías congénitas67. En este sentido, se han publicado datos adicionales de embarazos a término sin complicaciones específicamente en pacientes con enfermedad de Crohn tratadas con ustekinumab68,69. A pesar de esto, de momento, y hasta que no dispongamos de más evidencia, se aconseja no utilizar ustekinumab durante el embarazo, salvo que los beneficios superen a los riesgos. De igual modo, se desconoce si el fármaco se excreta en la leche materna, por lo que de momento se aconseja evitar la lactancia materna en las pacientes tratadas con ustekinumab.
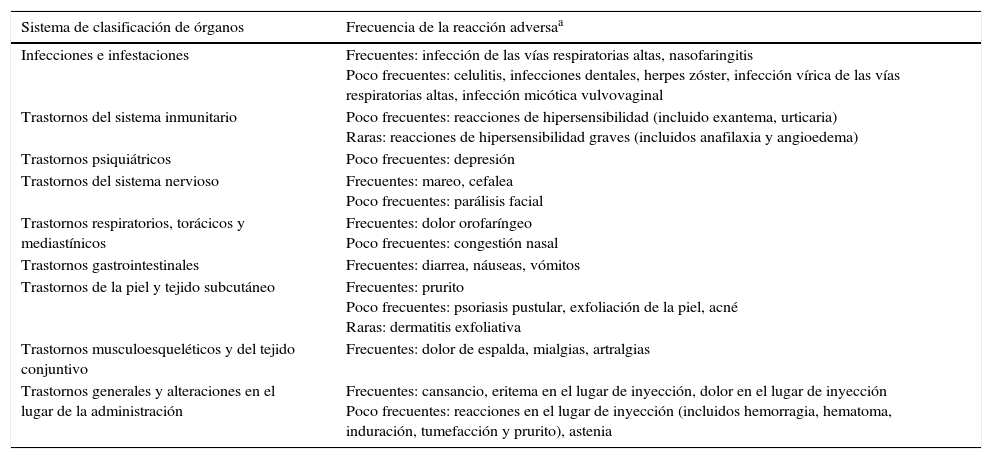
En la tabla 4 se resumen las reacciones adversas notificadas durante los ensayos clínicos realizados con ustekinumab en pacientes con psoriasis, artritis psoriásica y enfermedad de Crohn, así como las reacciones adversas notificadas tras la comercialización del fármaco37. En concreto, en los ensayos clínicos llevados a cabo en pacientes con enfermedad de Crohn, la aparición de eventos adversos fue similar a la descrita con placebo44. No hubo muertes, ni tumores, ni casos de leucoencefalopatía multifocal progresiva tras un año de exposición a ustekinumab44. Estos resultados se han corroborado en un reciente metaanálisis de seguridad que incluyó 7 ensayos clínicos de ustekinumab en psoriasis, enfermedad de Crohn, sarcoidosis y esclerosis múltiple70. Adicionalmente, otras series de pacientes corroboran estos favorables datos de seguridad50,52,71. Finalmente, aunque de forma excepcional, se han publicado reacciones paradójicas tras el tratamiento con ustekinumab, de forma similar a lo descrito con los fármacos anti-TNFα72.
Reacciones adversas, debidas al tratamiento con ustekinumab notificadas en ensayos clínicos y en estudios de práctica clínica
| Sistema de clasificación de órganos | Frecuencia de la reacción adversaa |
|---|---|
| Infecciones e infestaciones | Frecuentes: infección de las vías respiratorias altas, nasofaringitis Poco frecuentes: celulitis, infecciones dentales, herpes zóster, infección vírica de las vías respiratorias altas, infección micótica vulvovaginal |
| Trastornos del sistema inmunitario | Poco frecuentes: reacciones de hipersensibilidad (incluido exantema, urticaria) Raras: reacciones de hipersensibilidad graves (incluidos anafilaxia y angioedema) |
| Trastornos psiquiátricos | Poco frecuentes: depresión |
| Trastornos del sistema nervioso | Frecuentes: mareo, cefalea Poco frecuentes: parálisis facial |
| Trastornos respiratorios, torácicos y mediastínicos | Frecuentes: dolor orofaríngeo Poco frecuentes: congestión nasal |
| Trastornos gastrointestinales | Frecuentes: diarrea, náuseas, vómitos |
| Trastornos de la piel y tejido subcutáneo | Frecuentes: prurito Poco frecuentes: psoriasis pustular, exfoliación de la piel, acné Raras: dermatitis exfoliativa |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Frecuentes: dolor de espalda, mialgias, artralgias |
| Trastornos generales y alteraciones en el lugar de la administración | Frecuentes: cansancio, eritema en el lugar de inyección, dolor en el lugar de inyección Poco frecuentes: reacciones en el lugar de inyección (incluidos hemorragia, hematoma, induración, tumefacción y prurito), astenia |
Ustekinumab ha mostrado mejorar la calidad de vida en diversos subestudios realizados en el seno de los diversos ensayos clínicos. En el ensayo CERTIFI, se evaluó la calidad de vida relacionada con la salud utilizando el Health-Related Quality of Life (HRQoL)73, así como el deterioro del sueño mediante el cuestionario de evaluación del sueño de Jenkins (JSEQ)74, observando una mejoría significativa en los pacientes tratados con ustekinumab respecto a los que recibieron placebo. Más recientemente, la calidad de vida relacionada con la salud se ha evaluado en los ensayos clínicos fase3 mediante el cuestionario genérico de calidad de vida SF-36 y el específico en enfermedad inflamatoria intestinal (IBDQ)75. En la semana8, tanto en el estudio UNITI-1 como UNITI-2, los pacientes tratados con ustekinumab mostraron una mejoría estadísticamente significativa en la puntuación total del IBDQ y del componente físico y mental del SF-36, en comparación con el placebo75. En general, la mencionada mejoría se mantuvo en los pacientes tratados con ustekinumab, en el estudio IM-UNITI, hasta la semana4475.
Niveles séricos de ustekinumabSe ha estudiado la relación entre los niveles séricos de ustekinumab y los parámetros de eficacia clínica. Así, en los ensayos clínicos fase3 se evaluó la proporción de pacientes que se encontraban en remisión clínica en función de los niveles séricos del fármaco. Tanto en el ensayo UNITI-2 como en el IM-UNITI, se evidenció una tendencia a un mayor porcentaje de pacientes en remisión en los grupos con mayor concentración de ustekinumab sérico, aunque las diferencias no alcanzaron la significación estadística44. Esta correlación sí se ha podido confirmar en otras series, en las que unos niveles séricos más elevados de ustekinumab se han asociado a una mayor respuesta clínica y endoscópica, así como a unas cifras PCR más bajas56,76. A modo de ejemplo, se ha descrito que unos niveles séricos superiores a 4,5μg/ml en la fase de mantenimiento se asocian a una mayor respuesta endoscópica56.
Otro parámetro de interés es la proporción de anticuerpos antifármaco generados tras el tratamiento con ustekinumab. En los ensayos clínicos en enfermedad de Crohn, menos del 3% de los pacientes generaron estas inmunoglobulinas44, cuyos niveles, además, no se correlacionaron con una disminución de la respuesta al tratamiento77. Estos datos, asociados al prometedor perfil de seguridad, permiten augurar tasas de supervivencia del fármaco relativamente elevadas en la enfermedad de Crohn, tal y como ya se ha confirmado que ocurre en otras enfermedades, como la psoriasis, en la que dicha supervivencia es superior para ustekinumab que para infliximab o adalimumab78.
Contraindicaciones e interaccionesEl tratamiento con ustekinumab está contraindicado en las siguientes situaciones: a) hipersensibilidad al principio activo o a alguno de los excipientes, y b) infecciones graves activas, como tuberculosis40. Como se ha comentado anteriormente, en pacientes con artritis psoriásica y enfermedad de Crohn, la farmacocinética de ustekinumab no se ha visto afectada por el uso concomitante de azatioprina, mercaptopurina, metotrexato, corticosteroides orales o antiinflamatorios no esteroideos, ni por la exposición previa a agentes anti-TNFα44,79. Se han realizado estudios in vitro que sugieren que no es necesario ajustar la dosis en pacientes que reciben de forma concomitante fármacos que se metabolizan vía CYP45080. Además, no se ha observado que el uso concomitante de inmunosupresores o corticosteroides afectara a la eficacia ni a la seguridad de ustekinumab en pacientes con enfermedad de Crohn44.
Posicionamiento de ustekinumab en el tratamiento actual de la enfermedad de CrohnEs bien conocido que aproximadamente un tercio de los pacientes no responde a un primer anti-TNFα y que un porcentaje difícil de cuantificar presentará una respuesta parcial que puede resultar insuficiente; en estos casos, la eficacia de un segundo anti-TNFα es todavía menor19. Por otro lado, la pérdida secundaria de respuesta a los fármacos anti-TNFα suele manejarse mediante la optimización (intensificación) del tratamiento, estrategia que incrementa notablemente los costes14. El cambio a otro anti-TNFα tras la pérdida de eficacia constituye también una maniobra muy extendida en la actualidad, pero su eficacia es discreta a corto plazo y pobre a medio plazo19. Actualmente, la única alternativa terapéutica aprobada es el tratamiento con vedolizumab, cuya rapidez en la inducción de la remisión de la enfermedad de Crohn parece ser modesta y podría ser menor que la de los fármacos anti-TNFα, si bien su eficacia a más largo plazo parece similar a la de infliximab y adalimumab.
La aprobación de ustekinumab representa una alternativa terapéutica necesaria y esperada. Es, actualmente, el único tratamiento para la enfermedad de Crohn dirigido frente a las vías inflamatorias de la IL-12/23, lo que supone una opción de tratamiento con un mecanismo de acción novedoso para los pacientes que han fracasado o son intolerantes al tratamiento previo con corticosteroides, inmunomoduladores o antagonistas del TNFα.
Hasta la fecha, no se han realizado ensayos clínicos comparativos directos entre ustekinumab y otros agentes aprobados para el tratamiento de la enfermedad de Crohn (es decir, infliximab, adalimumab o vedolizumab); estos estudios serían de gran utilidad para clarificar la posición de ustekinumab en el algoritmo terapéutico de la enfermedad de Crohn. Sí existe, no obstante, un estudio de comparaciones indirectas que realiza una revisión sistemática de todos los ensayos de inducción y mantenimiento de ustekinumab, infliximab, adalimumab y vedolizumab. Este estudio sugiere que la probabilidad de alcanzar la remisión a un año con ustekinumab es mayor en comparación con vedolizumab o adalimumab81. No obstante, este método de comparación indirecta tiene limitaciones y las conclusiones deben interpretarse con cautela.
La vía (subcutánea) y el régimen de administración (cada 8-12semanas) de ustekinumab pueden considerase una ventaja en muchos pacientes, en comparación con las terapias administradas por vía intravenosa, como infliximab y vedolizumab, que además requieren un régimen de inducción con dosis más frecuentes82,83. Ustekinumab tiene un perfil de seguridad muy favorable, sin haberse descrito, por el momento, la aparición de tumores ni la reactivación de tuberculosis. Además, el desarrollo de inmunogenicidad frente al fármaco parece ser infrecuente, y es posible que sea menor al descrito con infliximab y adalimumab, aunque esto deberá ser confirmado en futuros estudios.
Actualmente, los fármacos anti-TNFα cuentan con una extensa experiencia y, por tanto, al menos de momento, es probable que continúen siendo de primera elección, reservando ustekinumab para casos de fracaso, intolerancia o contraindicación a los anti-TNFα. Sin embargo, las agencias reguladoras internacionales —como la EMA y la FDA— consideran que ustekinumab representa también una opción de primera línea de tratamiento biológico en los pacientes con enfermedad de Crohn.
En conclusión, ustekinumab constituye una alternativa prometedora para el tratamiento de la enfermedad de Crohn activa, de moderada a grave, en pacientes que han fracasado o son intolerantes al tratamiento con terapias convencionales o anti-TNFα. Su posición en el arsenal terapéutico en relación con los demás fármacos, en especial con los anti-TNFα, no está aún establecida. Ello dependerá de la experiencia que durante los próximos años se vaya acumulando en cuanto a su eficacia (incluyendo un mayor número de pacientes y un seguimiento más prolongado), en cuanto a su seguridad (si se confirma el favorable perfil descrito hasta el momento) y, evidentemente, del coste del tratamiento.
Conflicto de interesesJavier P. Gisbert: asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Roche, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
María Chaparro: asesoramiento científico, soporte para investigación y/o actividades formativas: MSD, Abbvie, Hospira, Pfizer, Takeda, Janssen, Ferring, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma.