Las enfermedades crónicas del hígado producen una acumulación progresiva de fibra colágena en el parénquima hepático. La biopsia hepática ha sido durante años el método de referencia para cuantificar la fibrosis hepática. Actualmente se dispone de alternativas no invasivas para cuantificar la fibrosis. La elastografía de transición (ET) o Fibroscan® cuantifica la rigidez del hígado, que es proporcional al grado de fibrosis hepática. Se dispone de estudios que han evaluado la fiabilidad y las limitaciones de la ET en sujetos sanos, en pacientes con hepatitis aguda, en diferentes enfermedades crónicas del hígado y en receptores de trasplante hepático. La ET es fiable para el diagnóstico de cirrosis hepática (Estadio 4 de Fibrosis o F4) y de fibrosis significativa (Estadio de fibrosis 2 o superior, Fe2), pero sus valores pueden variar según las características del paciente y la etiología de la enfermedad. La ET permite evitar la biopsia hepática en el 90% de los pacientes con cirrosis y hasta en el 70% de los pacientes con fibrosis significativa cuando se combina con otros métodos no invasivos.
Las enfermedades crónicas del hígado producen, independientemente de su etiología, una acumulación progresiva de fibra colágena en el parénquima hepático. La aparición de nódulos de regeneración altera la arquitectura hepática y produce un aumento de la presión portal. El aumento significativo de la presión portal es causante de la aparición de várices esofágicas y de ascitis, lo que empeora el pronóstico de la enfermedad. La cuantificación de la fibrosis hepática se ha realizado, durante años, mediante el análisis histológico de una pequeña muestra del tejido hepático (obtenida por vía percutánea o transyugular). Sin embargo, la fiabilidad de la biopsia para graduar la fibrosis es limitada. La muestra de tejido hepático representa sólo una de cada 50.000 partes del hígado, la distribución de la fibra puede ser heterogénea, se requiere un correcto procesado de la muestra y de un observador experimentado para su idónea interpretación1,2. Hay varias clasificaciones histológicas de la fibrosis hepática. La escala METAVIR y la clasificación de Scheuer3,4 gradúan la fibrosis en 5 estadios: F0 (ausencia de fibrosis), F1 (fibrosis portal), F2 (fibrosis periportal), F3 (puentes de fibrosis entre espacios porta) y F4 (cirrosis). Sin embargo, esta clasificación cualitativa del grado de fibrosis limita la detección y cuantificación de los cambios observados en biopsias de seguimiento. Por otra parte, la biopsia no está exenta de riesgos (en especial en pacientes con alteraciones de la coagulación), requiere el ingreso del paciente y de un personal experimentado para su realización, procesamiento e interpretación.
Las limitaciones de la biopsia y la evaluación periódica del paciente han impulsado la búsqueda de alternativas no invasivas para evaluar el grado de fibrosis hepática5,6. En los últimos años se han identificado multitud de marcadores serológicos implicados directa o indirectamente en el proceso de fibrosis hepática7,8,9,10. Se han desarrollado programas específicos para aumentar la fiabilidad de detección de la fibrosis hepática con el uso de las técnicas radiológicas ya existentes11,12,13. Sin embargo, el avance más importante se ha obtenido con la aparición de la elastografía de transición (ET) o Fibroscan® (FS)14.
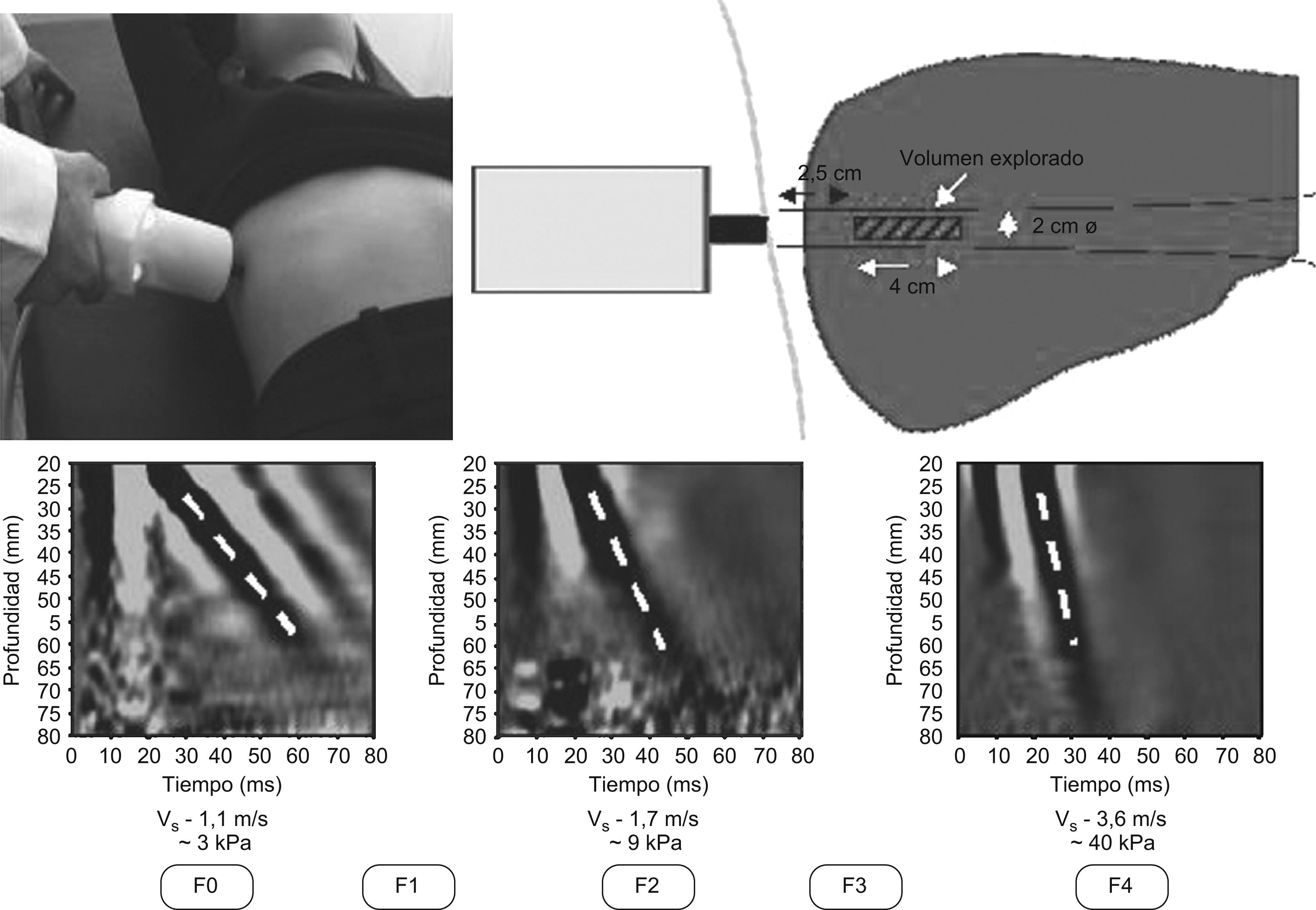
Interpretación de los resultados obtenidos con el Fibroscan®La ET o «elastografía por pulso unidimensional» se basa en la medición de la rigidez o elasticidad de un tejido y utiliza un pulso mecánico de vibración y una onda de ultrasonidos. Primero se emite el pulso mecánico que produce una onda elástica que se transmite a través del tejido. Segundo, la onda de ultrasonidos, que sigue la onda mecánica, mide la velocidad de propagación de la onda elástica en el interior del tejido. La velocidad de propagación de la onda elástica es proporcional a la rigidez del tejido (cuanto más duro sea el tejido más rápido se propagará la onda). El resultado se expresa en unidades de kilopascal (kPa)15.
El método comercializado que utiliza la ET para medir la rigidez del hígado se denomina Fibroscan® (FS) (Echosens, París, Francia). El FS está formado por una sonda emisora y receptora y un ordenador que procesa la información y genera una imagen de la onda elástica y el valor de la rigidez hepática en kPa. La sonda contiene un mecanismo vibrador que produce la onda mecánica y un transductor que produce la onda de ultrasonidos. La exploración se inicia con el paciente en ayunas, en decúbito supino y con el brazo derecho detrás de la cabeza. La sonda se aplica sobre la silueta hepática, entre las costillas, en la línea media axilar derecha y perpendicular al plano de la piel (figura 1). El explorador debe mantener la posición de la sonda (con el mínimo movimiento posible) y pulsar el botón para obtener 10 determinaciones válidas. La onda mecánica produce una vibración de amplitud media y de frecuencia baja (50Hz) que se propaga hasta 65mm de la superficie cutánea y el volumen de parénquima hepático evaluado es 100 veces superior al de la biopsia. En la pantalla del ordenador se genera una imagen de la onda elástica en 2 dimensiones y su morfología puede facilitar la obtención de registros válidos. Se deben realizar 10 determinaciones válidas (el ordenador determinará si la medición es válida o debe repetirse). Además de la imagen, la pantalla mostrará 3 valores que deben tenerse en cuenta: la razón o relación entre el número de mediciones válidas y el número total de mediciones, el rango intercuartílico (RIC) o variación del total de mediciones válidas con respecto a su valor mediano y el valor final de rigidez o mediana de las 10 determinaciones válidas (expresado en kPa). La exploración con el FS es rápida (5min), sencilla y su rango de detección es amplio, entre 2,5 y 75kPa. El personal no médico (preferiblemente una enfermera) puede realizar la exploración tras completar un corto aprendizaje (de 50 a 100 exploraciones), pero la interpretación de los resultados la debe realizar un médico con conocimientos amplios sobre las características y limitaciones de la técnica16.
Figura 1. Determinación de la rigidez hepática con el Fibroscan® (FS) (adaptado de Castera et al 14 ). El FS® está constituido por una sonda emisora y receptora de la onda mecánica y de ultrasonidos, así como por un ordenador. La sonda contiene un mecanismo vibrador y un transductor de ultrasonidos. La onda mecánica se propaga dentro del hígado y evalúa un volumen de parénquima 100 veces superior al de la biopsia. El valor obtenido es proporcional al grado de fibrosis hepática.
Ventajas y limitaciones del Fibroscan® en la práctica clínicaEl FS permite conocer la rigidez hepática mediante una exploración no invasiva, rápida, fácil, fiable y que ofrece un valor cuantitativo proporcional al grado de fibrosis hepática (figura 1). Estas características han permitido su rápida y amplia utilización en diferentes enfermedades crónicas del hígado que requieren una evaluación de la fibrosis hepática. Fraquelli et al17 demostraron una excelente correlación tanto entre observadores como intraobservadores. Dos exploradores evaluaron 200 pacientes con un total de 800 determinaciones de rigidez hepática (400 ET cada uno). El coeficiente de correlación intraclase (CCI) global fue excelente. Sin embargo, la correlación entre observadores fue significativamente inferior en pacientes con escasa fibrosis (CCI para F0 y F1: 0,60; CCI para F2 a F4: 0,99), esteatosis (CCI para esteatosis superior o igual al 25%: 0,90; CCI para esteatosis inferior al 25%: 0,98) o con un índice de masa corporal (IMC) elevado (CCI para IMC superior o igual a 25: 0,94; CCI para IMC inferior a 25: 0,98).
Por otra parte, la validez de los resultados puede verse influida por 2 parámetros: la razón y el RIC. La razón o tasa de éxito debe ser superior al 60% para demostrar que personal experimentado ha realizado la exploración15. El RIC debe ser inferior al 30% del valor final de rigidez para conseguir una buena reproducibilidad de la técnica18. Debe tenerse en cuenta, además, las limitaciones de esta técnica. La penetración del pulso mecánico-ultrasónico puede estar disminuida o ausente en pacientes con espacios intercostales estrechos y en pacientes obesos o con ascitis15. En estos pacientes se pueden obtener registros anómalos o ausencia de registros a pesar de realizar múltiples mediciones. La tasa de fracasos en los que no se obtienen resultados oscila en torno al 4,5% de las exploraciones realizadas, y el principal factor causante es un elevado IMC19.
Fibroscan® en sujetos sanos y en pacientes con mínima fibrosis hepática (F0 y F1)La rigidez o elasticidad hepática, medida con el FS®, en sujetos sanos es de aproximadamente 5,5±1,6kPa. Recientemente Roulot et al20 han examinado 429 sujetos sin enfermedad hepática conocida y con aminotransferasas normales. Los valores de rigidez hepática fueron más elevados en varones (5,8±1,5kPa) que en mujeres (5,2±1,6kPa) (p=0,0002) y en sujetos con un IMC superior a 30 (6,3±1,9kPa) que con un IMC inferior a 30 (5,4±1,5kPa) (p=0,0003). Tras realizar un ajuste por IMC y sexo, la rigidez hepática continuó siendo mayor en sujetos con síndrome metabólico (6,5±1,6kPa) que en sujetos sin él (5,3±1,5kPa) (p<0,0001). La biopsia hepática demostró la presencia de fibrosis portal y signos de esteatohepatitis no alcohólica en 4 pacientes con síndrome metabólico y ET superior a 8kPa. Sin embargo, en un segundo estudio realizado en 80 sujetos sanos (potenciales donantes de lóbulo hepático derecho) a los que se les realizó una ET y una biopsia, el punto de corte óptimo para excluir la presencia de fibrosis fue llamativamente bajo (4,0kPa) y el área bajo la curva (ABC) para identificar mínima fibrosis (F1 frente a F0) fue de 0,70. Además, no se observó correlación entre la rigidez hepática y el grado de esteatosis, por lo que los autores concluyeron que el FS no es útil para detectar esteatosis en sujetos sanos21.
Por otra parte, la ET puede verse influida (especialmente en pacientes sin o con escasa fibrosis) por cualquier proceso que modifique la consistencia del hígado. Pueden observarse valores elevados del FS, sin que haya fibrosis hepática, en pacientes con congestión venosa por fallo cardíaco22, en pacientes con hipertensión biliar secundaria a colestasis extrahepática23 y en pacientes con hepatitis aguda24,25 o crónica26 con elevada inflamación o necrosis lobulillar. Además, en estos casos, se puede observar un descenso progresivo del valor obtenido con el FS paralelamente al descenso de la rigidez del hígado. Es decir, puede observarse un descenso significativo de la ET en aquellos pacientes con hepatitis aguda o con colestasis extrahepática cuando se resuelve la hepatitis24,25 o se realiza el drenaje de la vía biliar23.
Por tanto, antes de dar por válido un resultado obtenido con el FS debe tenerse en cuenta la posición del paciente, la localización de la sonda, la técnica de medición, los valores de referencia (razón y RIC), los casos en que puede no obtenerse el registro y las situaciones en las que podemos obtenerse valores anómalos de rigidez hepática.
Utilidad del Fibroscan® en pacientes con fibrosis significativa (F¿2)En la actualidad se dispone de estudios amplios que han evaluado la precisión del FS para identificar pacientes con fibrosis significativa (F ¿ 2) y cirrosis (F4) en diferentes enfermedades crónicas del hígado (tabla 1). Sin embargo, como ocurre con otros métodos no invasivos, la mayoría de estos estudios se han realizado en pacientes con hepatitis crónica C. Los primeros estudios en pacientes con hepatitis C demostraron una excelente relación entre el estadio de fibrosis y la rigidez hepática. Ziol et al27 observaron 251 pacientes, 163 pacientes (65%) con F superior o igual a 2, una rigidez (mediana) de 5,5; 6,6; 10,3, y 30,8kPa en pacientes con estadios de fibrosis F0¿1, F2, F3 y F4, respectivamente. El ABC para identificar a los pacientes con fibrosis significativa fue de 0,79. Un valor de rigidez hepática superior o igual a 8,7kPa identificó 101 pacientes (62%), de los cuales sólo 9 tenían F1 y ninguno F0 en la biopsia. La fiabilidad diagnóstica del FS para identificar pacientes con F superior o igual a 2 puede aumentar si se lo combina con otros métodos no invasivos. Castera et al28 evaluaron en 183 pacientes con hepatitis crónica C, 136 pacientes (74%) con F superior o igual a 2, el poder diagnóstico del FS solo y en combinación con el Fibrotest® (FT) o el test APRI. La combinación del FS y el FT mostró la mayor fiabilidad (ABC: 0,88) para identificar pacientes con F superior o igual a 2. El 95% de los pacientes con un valor de rigidez hepática superior o igual a 7,1kPa mostraron fibrosis significativa (F ¿ 2) en la biopsia (valor predictivo positivo [VPP]: 95%). Se observó concordancia entre el FS® y el FT del 70 al 80% de los casos y con la biopsia en el 84% de los pacientes con fibrosis significativa, en el 95% de los pacientes con fibrosis avanzada y en el 94% de los pacientes con cirrosis.
Tabla 1. Fiabilidad del Fibroscan® para diagnosticar fibrosis significativa (F¿2) y cirrosis hepática (F4)
| Etiología | n | Prevalencia de F ¿ 2 | Punto de corte F ¿ 2 (kPa) | Punto de corte F4 (kPa) | VPP | VPN | ABC | Autores |
| VHC | 251 | 65% | 8,8 | 88 | 56 | 0,79 | Ziol et al 27 | |
| 14,6 | 78 | 97 | 0,97 | |||||
| VHC | 183 | 74% | 7,1 | 95 | 48 | 0,83 | Castera et al 28 | |
| 12,5 | 77 | 95 | 0,95 | |||||
| VHC + VIH | 72 | 61% | 4,5 | 65 | 61 | 0,72 | De Lédinghen et al 29 | |
| 11,8 | 100 | 82 | 0,97 | |||||
| VHB | 170 | 58% | 7,0 | 84 | 65 | 0,81 | Marcellin et al 31 | |
| 10,3 | 48 | 97 | 0,92 | |||||
| NAFLD | 67 | 49% | 6,6 | 93 | 59 | 0,87 | Yoneda et al 34 | |
| 17,0 | 64 | 96 | 0,99 | |||||
| Alcohol | 147 | 91% | 11,6 (F ¿ 3) | 96 | 70 | 0,94 | Nahon et al 37 | |
| 22,7 | 85 | 82 | 0,87 | |||||
| CBP/CEP | 95 | 60% | 7,3 | 91 | 79 | 0,92 | Corpechot et al 30 | |
| 17,3 | 78 | 99 | 0,96 | |||||
| ECH | 711 | 78% (n = 498) | 7,2 | 90 | 52 | 0,80 | Foucher et al 35 | |
| ECH | 775 | 15,5% (F4) | 14,6 | 74 | 96 | 0,95 | Ganne-Carrie et al 36 | |
| TH-VHC | 124 | 43% | 8,5 | 79 | 92 | 0,90 | Carrión et al 43 | |
| 12,5 | 50 | 100 | 0,98 | |||||
| VHC-rLHD | 56 | 37,5% | 9,9 | 86 | 94 | 0,92 | Harada et al 38 | |
| 26,5 | 83 | 100 | 0,99 |
ABC: área bajo la curva; CBP: cirrosis biliar primaria; CEP: colangitis esclerosante primaria; ECH: enfermedades crónicas del hígado; NAFLD: non-alcoholic fatty liver disease ¿enfermedad grasa del hígado no alcohólica¿; rLHD: receptor de lóbulo hepático derecho; TH: trasplante hepático; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los estudios de ET en el resto de las enfermedades crónicas del hígado son todavía limitados (tabla 1). El FS ha demostrado ser superior a otros métodos no invasivos (APRI y FIB-4) para identificar fibrosis significativa en pacientes con coinfección por virus de la hepatitis C (VHC) y por virus de la inmunodeficiencia humana (VIH), pero inferior al observado en pacientes sin coinfección (ABC: 0,72) 29. Corpechot et al30 han evaluado la rigidez del hígado en 101 pacientes con enfermedades colestásicas crónicas (73 pacientes con cirrosis biliar primaria y 28 pacientes con colangitis esclerosante primaria). Los autores identificaron con gran precisión a pacientes con fibrosis significativa (ABC: 0,92), F superior o igual a 3 (ABC: 0,95) y cirrosis (ABC: 0,97). El valor de rigidez hepática óptimo (7,3kPa) para identificar pacientes con F superior o igual a 2 (VPP: 91%) fue similar al descrito en pacientes con infección crónica por VHC. En pacientes con hepatitis crónica B, el FS también ha demostrado una elevada fiabilidad para identificar a pacientes con fibrosis significativa. Marcellin et al31 mostraron un rendimiento elevado del FS para identificar F superior o igual a 2 (ABC: 0,81) y un valor de rigidez hepática muy similar al descrito en pacientes con hepatitis crónica C (7,2kPa). Sin embargo, la actividad necroinflamatoria, la concentración de aminotransferasas y el tratamiento antivírico pueden modificar (independientemente del estadio de fibrosis) los valores de ET en pacientes con hepatitis B32. Respecto a la NAFLD (non-alcoholic fatty liver disease ¿enfermedad grasa del hígado no alcohólica¿), su diagnóstico, en la actualidad, es esencialmente histológico. Esta entidad se caracteriza por incluir un amplio espectro de afecciones hepáticas que van desde una esteatosis simple (con o sin componente inflamatorio y escasa fibrosis) a una NASH (non-alcoholic steatohepatitis ¿esteatohepatitis no alcohólica¿) que se asocia a fibrosis y cirrosis33. Sin embargo, su elevada prevalencia y la necesidad de seguir estrechamente a estos pacientes (especialmente los casos con NASH) han promovido la búsqueda de alternativas a la biopsia para identificar los casos más graves. La edad y la resistencia a la insulina se han mostrado predictivos de fibrosis avanzada; sin embargo, esta relación no se ha observado tan claramente en los estudios de seguimiento. Recientemente, Yoneda et al34 han demostrado el elevado valor diagnóstico de la ET para identificar fibrosis significativa y cirrosis en pacientes con NAFLD. Sin embargo, son necesarios más estudios y con un mayor número de pacientes para identificar los valores de referencia de ET en las diferentes presentaciones de la enfermedad grasa del hígado no asociada a alcohol.
Utilidad del Fibroscan® en pacientes con fibrosis avanzada (F¿3) o cirrosis (F4)El FS muestra una elevada fiabilidad para identificar precozmente a pacientes con fibrosis avanzada (F¿3) o cirrosis (F4). Sin embargo, los valores óptimos para diagnosticar cirrosis pueden variar según la etiología de la enfermedad hepática (tabla 1). Los estudios clásicos de Ziol et al27 y Castera et al28 demostraron un elevado poder diagnóstico para identificar cirrosis hepática en pacientes con hepatitis crónica C (ABC: 0,97 y 0,95 respectivamente). Además, el valor óptimo de rigidez hepática fue muy similar en ambos estudios, 14,5kPa (valor predictivo negativo [VPN]: 97%) y 12,5kPa (VPN: 95%), respectivamente. Estudios multicéntricos y con un número elevado de pacientes con diferentes enfermedades crónicas del hígado han demostrado la elevada fiabilidad del FS para identificar cirrosis hepática35,36, incluso en pacientes con esteatosis. En un estudio que incluyó 775 pacientes con diferentes enfermedades crónicas del hígado, el ABC para identificar cirrosis fue de 0,95 y el valor diagnóstico de rigidez fue de 14,6kPa. Al analizar a los 80 pacientes (10%) que mostraron discrepancia con la biopsia se observó que los pacientes sin cirrosis y con ET superior a 14,6kPa (n=45) presentaban puentes de fibrosis (F3) en 27 pacientes (60%) y presentaban fibrosis periportal (F2) en 10 pacientes (22%). Por el contrario, los pacientes con cirrosis y ET inferior o igual a 14,6kPa (n=35) presentaban macronódulos en 10 casos (29%) y ausencia de actividad en 25 casos (71%)36. Sin embargo, el valor de rigidez óptimo para diagnosticar cirrosis hepática en pacientes con: enfermedades colestásicas30, NAFLD34, ingesta enólica crónica37 o receptores de lóbulo hepático derecho de donante vivo38 es claramente superior al descrito en pacientes con hepatitis crónica C.
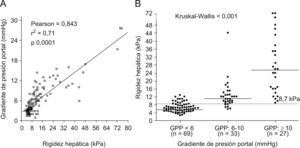
Utilidad del Fibroscan® en pacientes con hipertensión portalEl método por excelencia para medir la presión portal es la determinación del gradiente de presión portal (GPP). El GPP es una técnica altamente reproducible, fiable y representativa de la presión portal. Varios estudios han hallado una excelente correlación entre el grado de fibrosis y el valor del GPP39 sin embargo, al igual que ocurre con la biopsia, se trata de un método invasivo que requiere de material y de personal especializado. La presencia de várices esofágicas y la aparición de ascitis son signos de hipertensión portal clínicamente significativa (GPP¿10mmHg)40. Hay un interés creciente para identificar, de forma precoz y no invasiva, a aquellos pacientes con elevado riesgo de desarrollo de descompensación clínica y várices esofágicas debido a su peor pronóstico. La ecografía Doppler puede identificar signos de hipertensión portal como la esplenomegalia, la circulación colateral, el aumento de la vena porta y la disminución de la velocidad del flujo portal o la aparición de ascitis, pero estos signos no permiten cuantificar la presión portal. Recientemente, se ha descrito la excelente correlación que hay entre la rigidez hepática y el GPP. Hasta la fecha al menos en 3 estudios, 2 en pacientes con cirrosis41,42 y otro estudio en pacientes con trasplante hepático (TH)43, se ha demostrado una excelente correlación entre el FS y el GPP. Vizzutti et al42 demostraron una correlación muy elevada entre la rigidez hepática y el GPP (r=0,81; p<0,001) en 61 pacientes con fibrosis avanzada (F3 o F4). El 97% de los pacientes con hipertensión portal clínicamente significativa (GPP¿10mmHg) presentaba un valor de ET superior a 13,6kPa. La correlación entre la ET y el GPP fue excelente en pacientes con GPP inferior a 10mmHg (r=0,81; p<0,001), fue peor en pacientes con valores superiores (GPP>10mmHg) (r=59; p<0,001), fue pobre para identificar la presencia de várices esofágicas y no se observó correlación entre la ET y el tamaño de las várices. Recientemente, un estudio en 298 pacientes con cirrosis hepática ha demostrado que los pacientes con várices esofágicas presentan valores de rigidez hepática superiores y que un valor superior o igual a 21,5kPa tiene una sensibilidad y especificidad para identificar la presencia de várices esofágicas del 76 y del 78%, respectivamente44. Sin embargo, el mejor factor predictivo de riesgo de hemorragia es el tamaño de las várices (determinado por vía endoscópica)40 debido a la diferencia individual existente entre la presión portal y la resistencia de las venas colaterales.
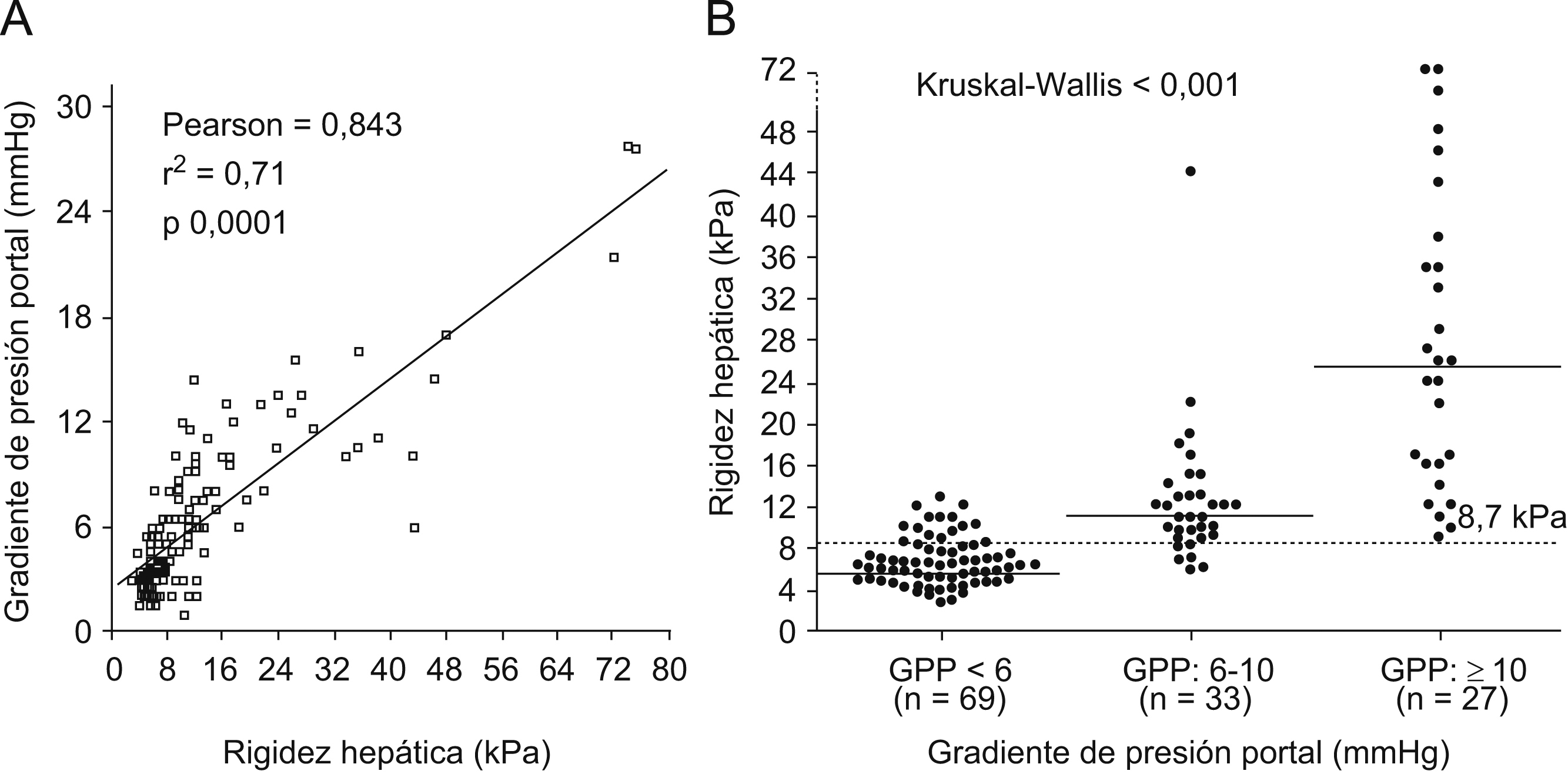
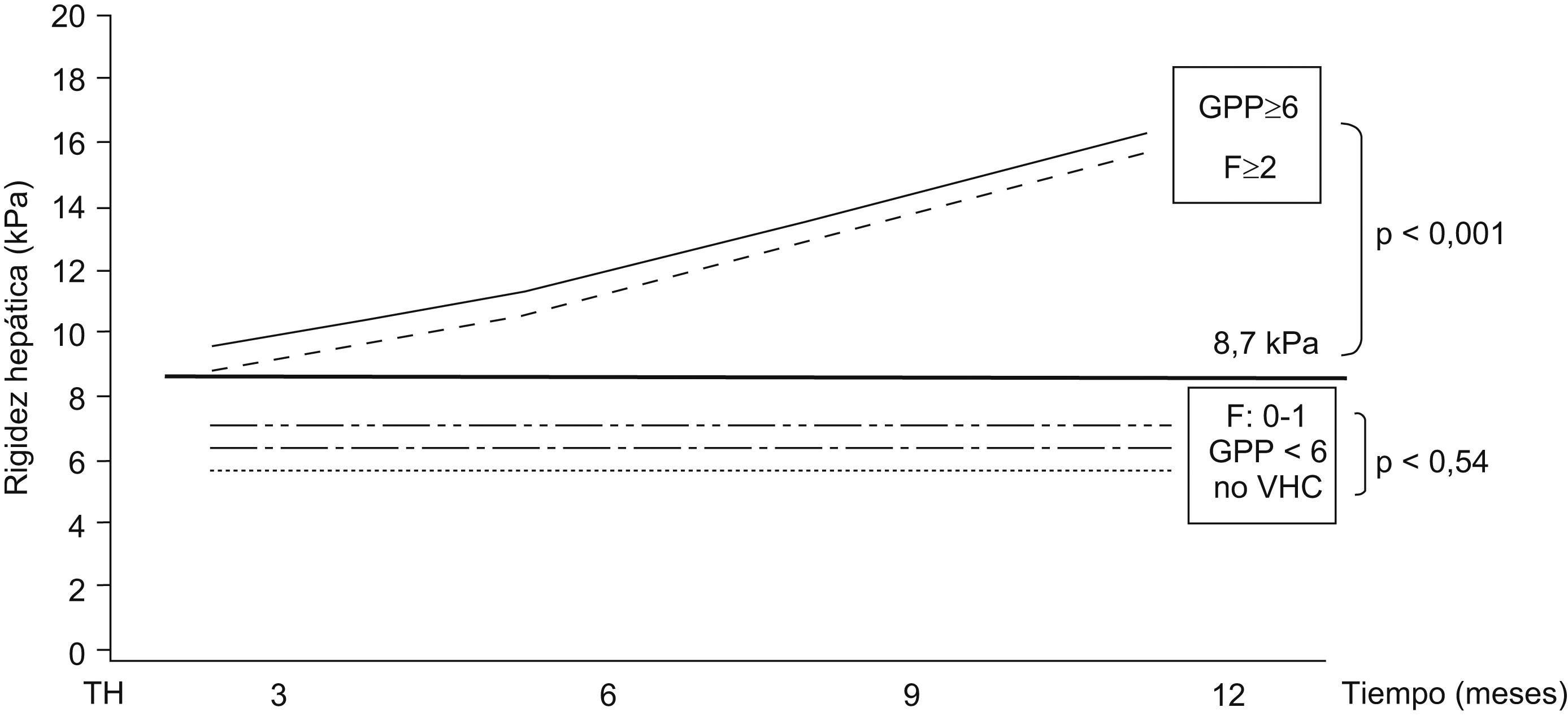
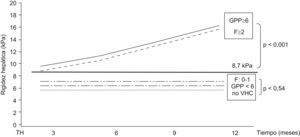
Utilidad del Fibroscan® en pacientes con trasplante hepáticoEn torno al 40 o 50% de los pacientes en la lista de espera para TH están infectados por el VHC. La reinfección del injerto se produce siempre45 y provoca una recurrencia acelerada de la enfermedad en una proporción importante de pacientes46. La rápida progresión de la enfermedad obliga a una continua evaluación histológica de estos pacientes47. La determinación del GPP ha demostrado ser, incluso, más sensible que la biopsia para identificar a pacientes con enfermedad grave y riesgo de descompensación clínica48. Sin embargo, tanto la biopsia hepática como la determinación del GPP son técnicas invasivas. Hasta la fecha, sólo se dispone de datos preliminares sobre la utilidad de los marcadores serológicos «directos» de fibrosis en pacientes con TH49. Recientemente, se ha evaluado la fiabilidad del FS en 135 pacientes con recidiva C tras el TH43. Se realizaron un total de 169 biopsias hepáticas y 129 estudios hemodinámicos (GPP) pareados con la determinación de rigidez hepática. Este estudio demostró una buena asociación entre el estadio de fibrosis y la rigidez hepática y una excelente correlación entre el GPP y la rigidez hepática (figura 2). El ABC para el diagnóstico de fibrosis significativa (F¿2) y de hipertensión portal (GPP¿6mmHg) fue de 0,90 y de 0,93, respectivamente. El FS parece, por tanto, ser una excelente herramienta para el seguimiento de pacientes con recidiva C tras el TH y recientemente también se ha descrito su utilidad en receptores de lóbulo hepático derecho de donante vivo38. Recientemente, el grupo de Barcelona ha presentado los primeros resultados prospectivos de la ET en pacientes con TH-VHC50. El estudio analizó la diferente progresión de la rigidez hepática en pacientes con presencia o ausencia de fibrosis significativa o hipertensión portal al año del TH. Para esto se realizaron 4 determinaciones de ET (a los 3, 6, 9 y 12 meses tras el TH) en 52 pacientes con recidiva C. A todos los pacientes se les realizó una biopsia hepática al año y se determinó el GPP en 49. Se observó un aumento progresivo de la ET en pacientes con F superior o igual a 2 (0,66kPa por mes) o GPP superior o igual a 6mmHg (0,67kPa por mes) superior a los pacientes con F0 y F1 (0,03kPa por mes) o GPP inferior a 6mmHg (0,01kPa por mes) (p<0,001 en ambos casos) (figura 3).
Figura 2. Correlación entre la Elastografía de transición (ET) y el gradiente de presión portal (GPP). Figura 2 A) Correlación lineal positiva entre la ET y el GPP, según el coeficiente de correlación de Pearson (r=0,84). Figura 2 B) Un valor de ET superior o igual a 8,7kPa identificó a todos los pacientes con recidiva C tras el TH y GPP superior o igual a 10mmHg. Cada punto representa un valor de ET según el GPP. La línea transversal es el valor (mediana) de ET en cada categoría de GPP. La línea punteada representa el valor de rigidez hepática óptimo (8,7kPa) para identificar pacientes con hipertensión portal (GPP¿6mmHg).
Figura 3. Progresión de la rigidez hepática en pacientes con presencia o ausencia de fibrosis significativa o hipertensión portal al año del trasplante hepático. La figura muestra un aumento progresivo y rápido de la rigidez hepática (kPa por mes) en pacientes con fibrosis significativa (F¿2) o hipertensión portal (GPP¿6mmHg) en comparación con los pacientes con mínima fibrosis (F0¿1), presión portal normal (GPP>6) o sin infección por virus de la hepatitis C.
ConclusionesLas características propias del Fibroscan® como técnica no invasiva, fácil, rápida, reproducible y fiable, lo convierten en la alternativa a la biopsia más importante para identificar fibrosis significativa o cirrosis. El personal no médico puede realizar la exploración tras un corto aprendizaje. Sin embargo, la interpretación de los resultados debe ser realizada por personal con conocimientos sobre las propiedades y limitaciones de la técnica. La fiabilidad diagnóstica del FS es elevada, pero los valores de referencia pueden variar según las características del paciente, la etiología de la enfermedad y la presencia de factores que modifiquen la consistencia del hígado. Por todo esto, es recomendable la realización de mediciones repetidas y el seguimiento de los pacientes. Además, la combinación con otros métodos no invasivos puede mejorar sus resultados, aunque se requieren más estudios que evalúen estas posibilidades.
Preguntas para el test5:
Respuesta: la colocación errónea de la sonda, una técnica inadecuada, una mala posición del paciente y características como unos espacios intercostales estrechos, obesidad o ascitis. Por otra parte, cualquier factor que modifique la consistencia del hígado, independientemente de la cantidad de fibrosis, puede producir un incremento anómalo de los resultados.
Respuesta: sí, el RIC muestra la dispersión de los valores válidos con respecto al valor final. Cuanto mayor es la dispersión del conjunto de valores, menos representativa (del conjunto) es su mediana.
Actualmente se recomienda reevaluar a los pacientes en los que se obtiene un RIC superior al 30% del valor final.
Respuesta: en pacientes con cirrosis hepática y también en pacientes con recidiva C tras el TH, el FS ha demostrado poseer una buena correlación con el gradiente de presión portal, pero es escasa con la presencia de várices esofágicas y está ausente con el tamaño de las várices.
Respuesta: hay varios estudios en pacientes con recidiva C tras el TH que han demostrado una buena correlación entre la rigidez hepática y el estadio de fibrosis. Además, recientemente el FS ha demostrado ser útil para identificar precozmente a pacientes con hipertensión portal en los que estaría indicado iniciar tratamiento antivírico dado su peor pronóstico.
Respuesta: las características del FS lo convierten en la alternativa más importante a la biopsia hepática para identificar pacientes con fibrosis significativa o cirrosis. Pero, probablemente, la combinación de varios métodos no invasivos sea superior a la utilización de cada uno de éstos por separado. Sin embargo, todavía son necesarios más estudios que evalúen esta posibilidad.
¿Que factores pueden influir negativamente en la obtención del valor del FS?
¿Es importante el RIC a la hora de considerar válido el resultado expresado por el FS?
¿La elastografía hepática puede identificar la presencia y el tamaño de las várices esofágicas?
¿El FS puede ser útil en pacientes con TH?
¿Cuál es el método no invasivo más fiable para identificar pacientes con fibrosis hepática?