Publicaciones recientes han reactivado la discusión sobre el valor pronóstico de la elevación pretratamiento del antígeno carcinoembrionario (CEA) en el cáncer colorrectal. Debido a los resultados discordantes comunicados, pretendemos analizar en nuestro medio esta posible capacidad predictiva, globalmente y en los diferentes estadios tumorales.
Pacientes y métodosEstudiamos retrospectivamente 303 cánceres colorrectales resecados consecutivamente con intención curativa, analizando la mortalidad debida al tumor. Determinamos la frecuencia de casos con CEA pretratamiento patológico (>5mg/l). Comparamos mediante análisis univariante y multivariante las curvas de supervivencia entre los casos con CEA normal y patológico, tanto en el global de la serie como en los diferentes estadios pTNM.
ResultadosLa frecuencia de pacientes con CEA>5mg/l fue del 31%. La mediana de seguimiento clínico alcanzó los 83 meses. En el análisis multivariante de la serie global, la supervivencia fue desfavorable para los casos con CEA elevado: hazard ratio (HR)=1,89; intervalo de confianza al 95% (IC 95%)=(1,15-3,10); p=0,012. Al efectuar el análisis de supervivencia en los diversos estadios, únicamente se mantiene el valor predictivo en el estadio II (n=104): HR=3,02; IC 95%=(1,22-7,45); p=0,017.
ConclusionesAntes del inicio del tratamiento, un 31% de nuestros cánceres colorrectales resecados con intención curativa presentaron unos valores patológicos de CEA. Considerando la serie globalmente, la elevación del CEA pretratamiento presenta, de modo independiente, un valor pronóstico desfavorable sobre la supervivencia, pero al analizar su valor predictivo según los diferentes estadios, solo mantiene su significación en el estadio pTNM II.
Recent reports have reopened discussion of the prognostic value of elevated pre-treatment carcinoembryonic antigen (CEA) levels in colorectal cancer. Due to the discrepancies in the published results, we aimed to analyze the possible predictive value of CEA, both overall and in different tumoral stages in our environment.
Patients and methodsWe retrospectively studied 303 consecutive patients with colorectal cancer resected with curative intent by analysing tumor-related mortality. The frequency of patients with increased CEA levels (> 5mg/l) was registered. Univariate and multivariate analyses of survival curves were performed, comparing patients with increased CEA levels and those with CEA levels within normal limits, both in the overall series and in the different pTNM tumoral stages.
ResultsFrequency of patients with CEA>5mg/l was 31%. The median clinical follow-up was 83 months. A poor survival rate was registered in the multivariate analysis of the whole series in patients with high CEA levels: hazard ratio (HR)=1.81; 95% confidence interval (95% CI)=(1.15-3.10); P=.012. This predictive value was only maintained in stage II in the survival analysis of the distinct tumoral stages (n=104): HR=3.02; 95% CI=(1.22-7.45); P=.017.
ConclusionsBefore treatment, 31% of our patients with colorectal cancer resected with curative intent had pathological CEA values. In the overall series, a high pretreatment CEA level showed an independent prognostic value for poor survival. When pTNM tumoral stages were analyzed separately, CEA level had predictive value only in pTNM II tumors.
El antígeno carcinoembrionario (CEA) es una glicoproteína intracelular, perteneciente al grupo de las inmunoglobulinas, presente en bajas concentraciones en el intestino embrionario y fetal y que se puede encontrar en proporciones mínimas en la sangre del adulto sano1. Ya en 1965, Gold et al. comunicaron la sobreexpresión de CEA en el 90% de muestras tisulares de cánceres colorrectales (CCR)2. Pueden alcanzarse valores séricos elevados de CEA en otros procesos malignos como el cáncer de pulmón y mama o benignos como la enfermedad inflamatoria intestinal, hepatopatías difusas o pancreatitis3,4.
Desde hace décadas, el CEA es el marcador tumoral más aceptado y empleado en el carcinoma colorrectal5. Tras las primeras publicaciones de cifras elevadas del CEA en el CCR6, un trabajo canadiense comunicó su incremento en 35 de 36 carcinomas colorrectales, sin encontrar falsos positivos7. Estos resultados, que indicarían un elevado valor diagnóstico, no se han confirmado, por lo que actualmente se desaconseja el empleo del CEA tanto para el cribado como para el diagnóstico precoz del CCR5, al presentar una mala relación coste/eficacia8. Por ello, el mayor interés del estudio del CEA se ha centrado en la determinación de su posible utilidad pronóstica en dicha neoplasia.
En España, el CCR ocupa el primer puesto en cuanto al volumen de nuevos cánceres diagnosticados9. Además de su alta incidencia, el CCR presenta una elevada mortalidad: es el segundo tumor que más fallecimientos ocasiona en Europa10, con 12.000 fallecimientos anuales en nuestro país9. Esta mortalidad presenta una notable variabilidad individual, por lo que cobra una gran importancia el poder establecer una orientación pronóstica lo más próxima posible al momento del diagnóstico del tumor. Dentro de los muchos parámetros predictivos propuestos, se sigue considerando como «patrón oro» la estadificación tumoral posquirúrgica o clasificación pTNM11. Sin embargo, se han constatado importantes variaciones en la mortalidad dentro de los pacientes encuadrados en un mismo estadio tumoral12,13, lo que limita su utilidad y hace necesaria la búsqueda de otras variables pronósticas, independientes de dicha clasificación pTNM14.
El valor predictivo del CEA se ha analizado en diferentes circunstancias. Por una parte, se han valorado las cifras de CEA registradas en el momento del diagnóstico del tumor, tanto para valorar el pronóstico global14,15 como para predecir la respuesta al tratamiento neoadyuvante16–18. Por otra, se ha estudiado el posible valor desfavorable de una falta de descenso del CEA tras la cirugía o la administración de tratamiento adyuvante5. Finalmente, se ha postulado la conveniencia de controlar periódicamente las cifras del CEA durante el seguimiento postoperatorio, ya que su elevación permitiría sospechar más precozmente la aparición de metástasis o recidivas del tumor, aumentando las posibilidades de que un nuevo tratamiento pueda llegar a ser curativo3,5,19.
Pese a los numerosos trabajos efectuados, todavía sigue en discusión si la elevación pretratamiento del CEA tiene valor predictivo independiente sobre el pronóstico del CCR1,15,20, habiéndose publicado recientemente estudios con resultados negativos21,22. En estos últimos años ha cobrado interés la posibilidad de que la utilidad pronóstica pretratamiento del CEA sea distinta en los diferentes estadios TNM de la neoplasia, lo que podría ayudar a explicar la discordancia de los resultados obtenidos14. Las publicaciones que analizan esta posibilidad están realizadas mayoritariamente en pacientes asiáticos, habiéndose postulado una hipotética influencia de los factores étnicos sobre la evolución del CCR23, lo que podría ocasionar algún tipo de sesgo en los resultados. Con respecto a España, disponemos de muy pocos estudios, que además presentan resultados negativos sobre su valor pronóstico independiente15,24,25, por lo que se precisarían más trabajos realizados en nuestra área geográfica. Por este motivo hemos querido llevar a cabo el presente análisis, centrando nuestro objetivo en estudiar el valor predictivo del CEA, registrado en el momento del diagnóstico del tumor, sobre la supervivencia de los pacientes operados de CCR, de modo global y según el estadio pTNM de la neoplasia.
Pacientes y métodosEstudio retrospectivo y observacional de una serie de 303 cánceres colorrectales, diagnosticados y resecados consecutivamente en nuestro hospital, con una población asistida de 230.000 habitantes en el momento del análisis, a lo largo del periodo enero 2004-enero 2007. El trabajo contó con la autorización del Comité Ético del hospital para la revisión de las historias clínicas de los pacientes. Cada caso fue valorado por el Comité de Tumores Digestivos del centro, que indicó una terapia individualizada: tratamiento neoadyuvante inicial o cirugía directa, según los protocolos del hospital. La resección se efectuó por un mismo equipo quirúrgico especializado, con intención curativa y de modo programado. Se excluyeron los casos de cirugía paliativa o realizada de modo urgente por complicaciones agudas como obstrucción completa, perforación, hemorragia o abscesificación tumoral. No se incluyeron los casos fallecidos durante el postoperatorio inmediato (30 días). Se efectuaron revisiones de control cada 3 meses durante el primer año, cada 6 meses hasta los 5 años y anuales a partir de esa fecha. El tiempo de seguimiento clínico se consideró desde el inicio del tratamiento hasta el fallecimiento del paciente o a la fecha de finalización del estudio, con una duración mínima superior a los 5 años. El endpoint primario fue el análisis de la supervivencia, centrado en la mortalidad debida al tumor mediante un análisis uni- y multivariante, incluyendo al CEA como posible factor.
Valoramos la determinación del CEA más próxima al inicio del tratamiento, neoadyuvante o quirúrgico, dentro de un plazo siempre inferior a los 14 días. Determinamos la frecuencia de casos con CEA pretratamiento elevado, considerando como patológicos los valores de CEA superiores a 5mg/l14.
Analizamos las siguientes características de nuestra serie: sexo y edad del paciente, localización anatómica de la neoplasia, grado histológico de diferenciación y estadio tumoral según la clasificación pTNM de la American Joint Comittee on Cancer11. Estudiamos las posibles diferencias en cuanto a frecuencia de todas estas variables entre los casos con CEA ≤ 5mg/l y CEA>5mg/l, mediante los tests de chi-cuadrado y Fisher para las variables categóricas y el de Student para las continuas. Los valores de CEA se definieron como medias con desviación estándar y los tiempos de seguimiento como medianas con rango intercuartílico.
Con el fin de valorar la posible relación entre la elevación del CEA y el estadio tumoral, comparamos las diferencias en cuanto a frecuencia de casos con CEA patológico entre los diferentes estadios pTNM. Igualmente, comparamos los valores medios de CEA registrados en los diversos estadios tumorales.
Para estudiar el valor pronóstico del CEA pretratamiento, en primer lugar se efectuó un análisis estadístico univariante, comparando la supervivencia mediante curvas de Kaplan-Meier y test de log rank en la serie global y en cada uno de los estadios del tumor. Posteriormente, y para valorar su posible significado predictictivo independiente, se realizó un estudio multivariante, tanto en el conjunto de la casuística como en los tumores en estadio II. Se empleó el modelo de Cox, stepwise, incluyendo las covariables de ajuste: sexo, edad>65 años, localización rectal o colónica del tumor, grado de diferenciación y estadio tumoral pTNM, calculando el hazard ratio (HR) así como los intervalos de confianza al 95% (IC 95%). En las neoplasias en estadio II, se añadió como variante de estudio la clasificación de la lesión en las categorías T3 o T4.
Los cálculos estadísticos se efectuaron con los programas SPSS 19 y R 2.9.2, considerando significativos los valores de p<0,05.
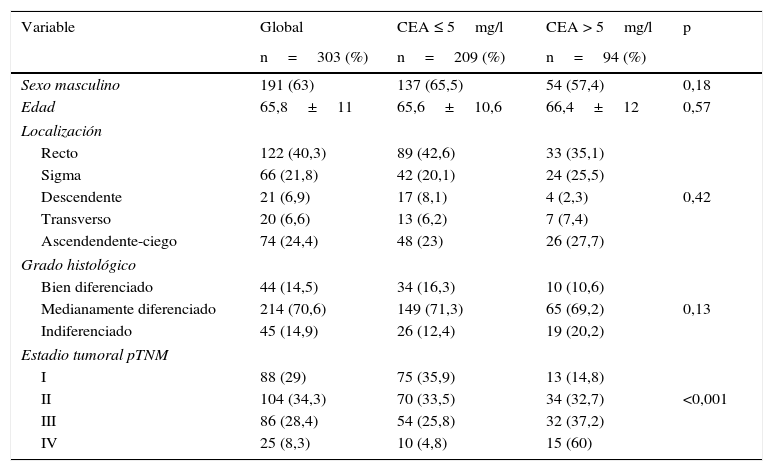
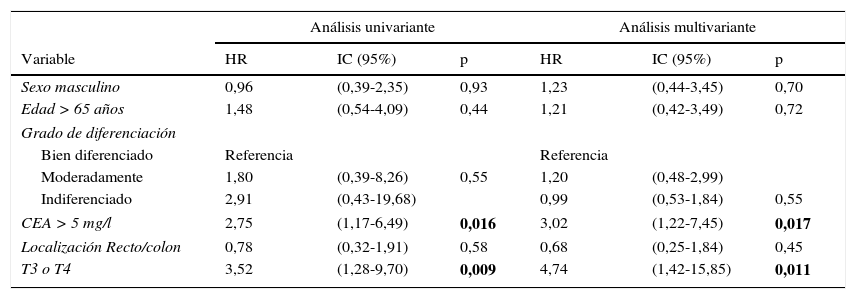
ResultadosEn la tabla 1 se resumen las características de nuestra serie global. Igualmente, se representan las diferencias encontradas al comparar el grupo de pacientes con CEA elevado con respecto al grupo con CEA normal. Como se puede comprobar, la única diferencia significativa encontrada (p<0,0001) es la mayor frecuencia de tumores en estadio más avanzado, que se registra en el grupo con CEA>5mg/l. El resto de los parámetros analizados, tanto del paciente como de la neoplasia, no mostraron diferencias destacables entre ambos grupos de valores del CEA.
Características de la serie global y diferencias en sus frecuencias, según que el antígeno carcinoembrionario (CEA) sea normal (≤5mg/l) o patológico (>5mg/l)
| Variable | Global | CEA ≤ 5mg/l | CEA > 5mg/l | p |
|---|---|---|---|---|
| n=303 (%) | n=209 (%) | n=94 (%) | ||
| Sexo masculino | 191 (63) | 137 (65,5) | 54 (57,4) | 0,18 |
| Edad | 65,8±11 | 65,6±10,6 | 66,4±12 | 0,57 |
| Localización | ||||
| Recto | 122 (40,3) | 89 (42,6) | 33 (35,1) | |
| Sigma | 66 (21,8) | 42 (20,1) | 24 (25,5) | |
| Descendente | 21 (6,9) | 17 (8,1) | 4 (2,3) | 0,42 |
| Transverso | 20 (6,6) | 13 (6,2) | 7 (7,4) | |
| Ascendendente-ciego | 74 (24,4) | 48 (23) | 26 (27,7) | |
| Grado histológico | ||||
| Bien diferenciado | 44 (14,5) | 34 (16,3) | 10 (10,6) | |
| Medianamente diferenciado | 214 (70,6) | 149 (71,3) | 65 (69,2) | 0,13 |
| Indiferenciado | 45 (14,9) | 26 (12,4) | 19 (20,2) | |
| Estadio tumoral pTNM | ||||
| I | 88 (29) | 75 (35,9) | 13 (14,8) | |
| II | 104 (34,3) | 70 (33,5) | 34 (32,7) | <0,001 |
| III | 86 (28,4) | 54 (25,8) | 32 (37,2) | |
| IV | 25 (8,3) | 10 (4,8) | 15 (60) | |
CEA: antígeno carcinoembrionario; HR: hazard ratio; IC 95%: intervalo de confianza al 95%.
Se registraron cifras patológicas (>5mg/l) del CEA en 94/303 pacientes (31%). Al comparar la frecuencia de casos con CEA patológico entre los diferentes estadios pTNM, observamos como dicha frecuencia aumenta progresivamente según se eleva el estadio tumoral: estadio I: 13/88=14,8%; estadio II: 34/104=32,7%; estadio III: 32/86=37,2%; estadio IV: 15/25=60%. Estas diferencias alcanzan significación estadística: p<0,001.
En nuestra serie global, el valor medio del CEA fue de 11,2±22,5mg/l. Analizando el valor medio registrado en cada uno de los estadios pTNM, también observamos un progresivo incremento en cada estadio tumoral: estadio I: 4,6±9,4; estadio II: 9,2±17,8; estadio III: 12,6±20,5 y estadio IV: 37,8±63,2 (p<0,001).
La mediana de seguimiento fue de 83 meses (rango intercuartílico: 64-93), con una mortalidad debida al tumor a los 5 años del 21,4% y del 24,1% a la conclusión del estudio.
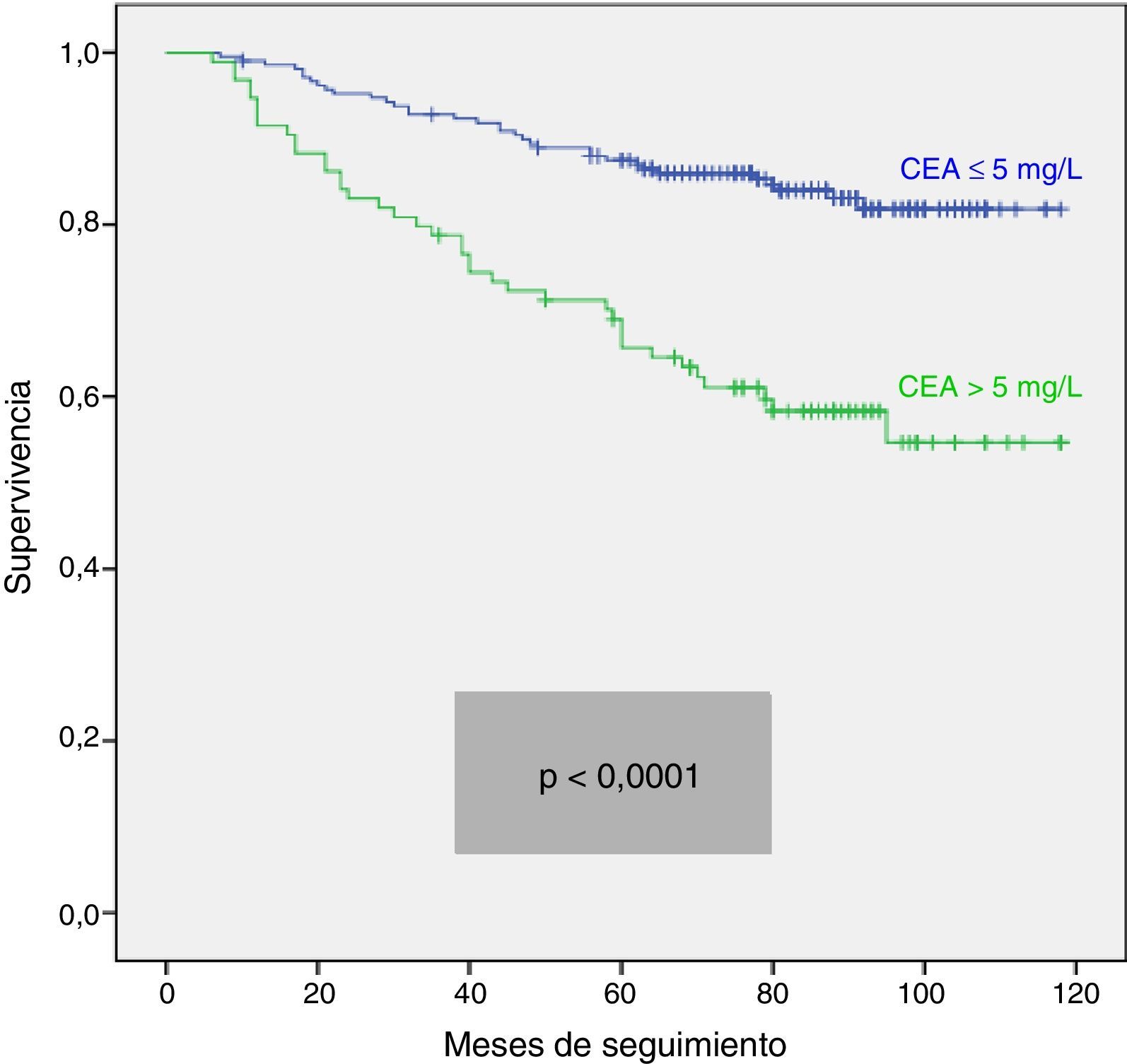
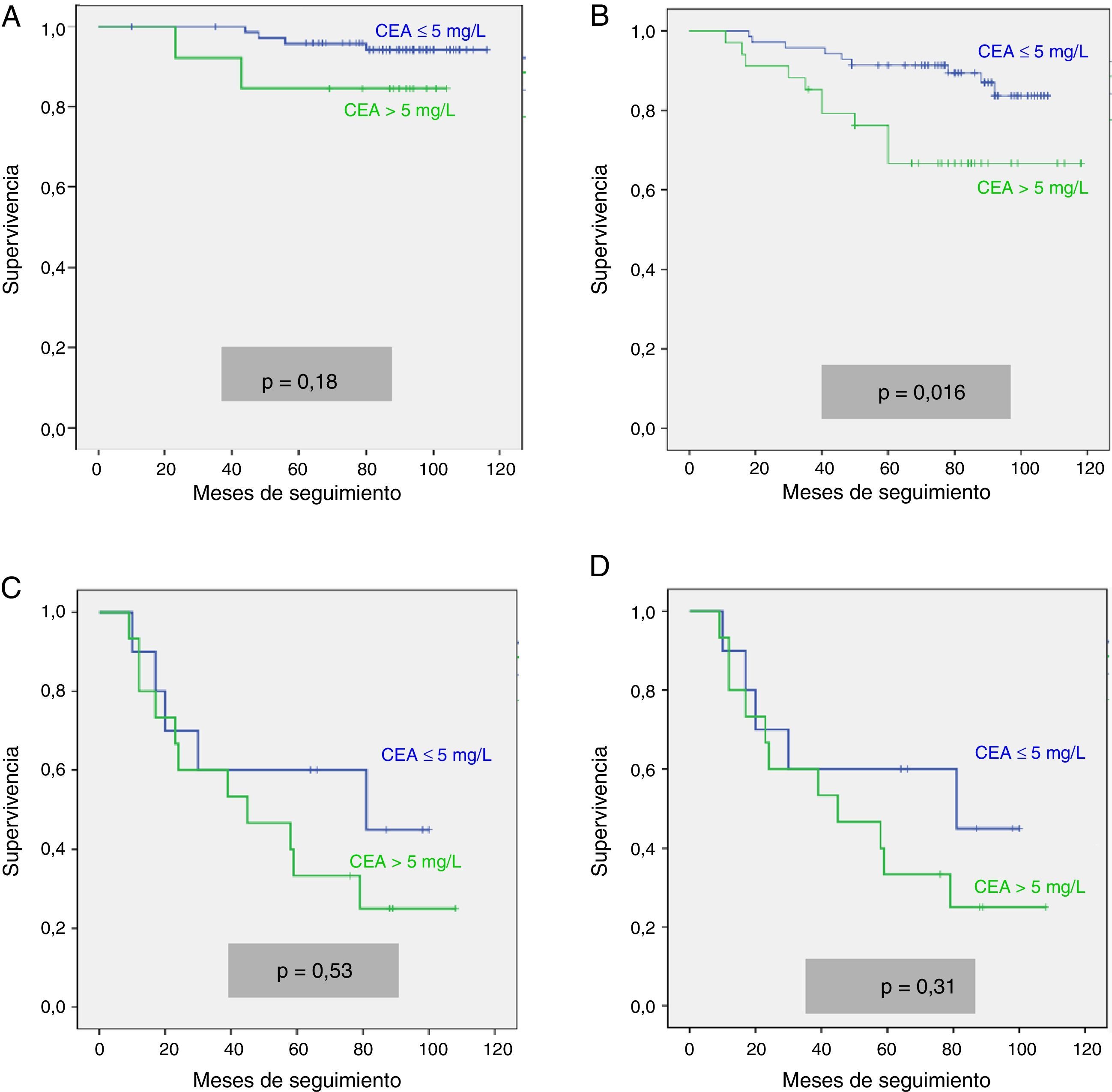
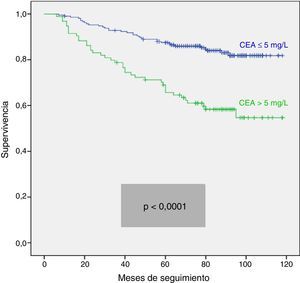
Analizamos las curvas de supervivencia de Kaplan Meier entre los casos con y sin CEA patológico, correspondientes a la serie global y a los distintos estadios pTNM. En el conjunto de nuestra casuística, los casos con CEA pretratamiento ≤ 5mg/l mostraron una supervivencia significativamente mayor: (HR=3,01; IC 95%=[1,90-4,77]; p<0,0001). Al estratificar a nuestros pacientes según su estadio tumoral, el CEA pierde significación estadística en los estadios I: (HR=3,03; IC 95%=[0,56-16,57]; p=0,18); estadio III: (HR=1,26; IC 95%=[0,61-2,5]; p=0,53) y estadio IV: (HR=1,71; IC 95%=[0,59-4,94]; p=0,31), manteniendo su valor predictivo en el estadio II: (HR=2,75; IC 95%=[1,17-6,49]; p=0,016). En la figura 1 se representan gráficamente las curvas de supervivencia de los pacientes con CEA normal y patológico en la totalidad de nuestra serie. La figura 2 muestra las curvas de supervivencia, según el CEA, de los pacientes en los diferentes estadios pTNM.
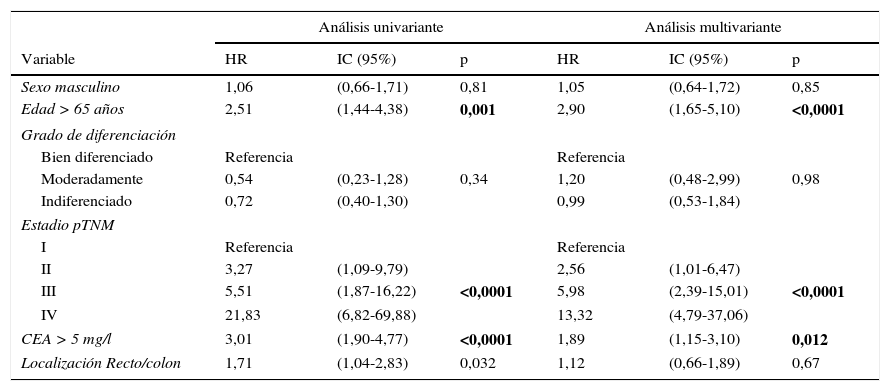
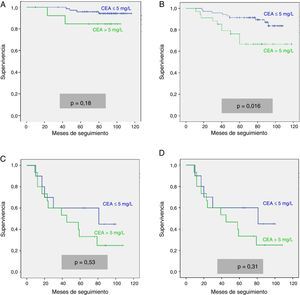
Ante las diferencias significativas registradas para la serie global y el subgrupo en estadio II, efectuamos un análisis multivariante de la supervivencia según el valor del CEA. Las variables de ajuste empleadas, así como los resultados obtenidos en la serie global, se resumen en la tabla 2. Observamos que tan solo la edad del paciente mayor de 65 años, la estadificación tumoral pTNM y la presencia de un CEA patológico mantuvieron un valor predictivo independiente sobre la supervivencia. La tabla 3 corresponde a los datos de los análisis en los casos en estadio II (n=104; T3=92; T4=12). En este subgrupo, únicamente la elevación de CEA y la categoría T4 presentaron significación estadística desfavorable para la supervivencia, tanto en el análisis univariante como en el multivariante.
Análisis estadístico univariante y multivariante de las curvas de supervivencia en el global de la serie
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| Variable | HR | IC (95%) | p | HR | IC (95%) | p |
| Sexo masculino | 1,06 | (0,66-1,71) | 0,81 | 1,05 | (0,64-1,72) | 0,85 |
| Edad > 65 años | 2,51 | (1,44-4,38) | 0,001 | 2,90 | (1,65-5,10) | <0,0001 |
| Grado de diferenciación | ||||||
| Bien diferenciado | Referencia | Referencia | ||||
| Moderadamente | 0,54 | (0,23-1,28) | 0,34 | 1,20 | (0,48-2,99) | 0,98 |
| Indiferenciado | 0,72 | (0,40-1,30) | 0,99 | (0,53-1,84) | ||
| Estadio pTNM | ||||||
| I | Referencia | Referencia | ||||
| II | 3,27 | (1,09-9,79) | 2,56 | (1,01-6,47) | ||
| III | 5,51 | (1,87-16,22) | <0,0001 | 5,98 | (2,39-15,01) | <0,0001 |
| IV | 21,83 | (6,82-69,88) | 13,32 | (4,79-37,06) | ||
| CEA > 5 mg/l | 3,01 | (1,90-4,77) | <0,0001 | 1,89 | (1,15-3,10) | 0,012 |
| Localización Recto/colon | 1,71 | (1,04-2,83) | 0,032 | 1,12 | (0,66-1,89) | 0,67 |
CEA: antígeno carcinoembrionario; HR: hazard ratio; IC 95%: intervalo de confianza al 95%.
Análisis estadístico univariante y multivariante de las curvas de supervivencia en los tumores en estadio pTNM II
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| Variable | HR | IC (95%) | p | HR | IC (95%) | p |
| Sexo masculino | 0,96 | (0,39-2,35) | 0,93 | 1,23 | (0,44-3,45) | 0,70 |
| Edad > 65 años | 1,48 | (0,54-4,09) | 0,44 | 1,21 | (0,42-3,49) | 0,72 |
| Grado de diferenciación | ||||||
| Bien diferenciado | Referencia | Referencia | ||||
| Moderadamente | 1,80 | (0,39-8,26) | 0,55 | 1,20 | (0,48-2,99) | |
| Indiferenciado | 2,91 | (0,43-19,68) | 0,99 | (0,53-1,84) | 0,55 | |
| CEA > 5 mg/l | 2,75 | (1,17-6,49) | 0,016 | 3,02 | (1,22-7,45) | 0,017 |
| Localización Recto/colon | 0,78 | (0,32-1,91) | 0,58 | 0,68 | (0,25-1,84) | 0,45 |
| T3 o T4 | 3,52 | (1,28-9,70) | 0,009 | 4,74 | (1,42-15,85) | 0,011 |
En el CCR, el CEA producido por las células tumorales sigue la circulación portal y puede ser metabolizado por el hígado en un mecanismo de «primer paso». Por este motivo y a pesar de su mayor producción, sus valores séricos pueden mantenerse normales al efectuarse su determinación en sangre periférica26, donde tan solo aparece elevada en un porcentaje limitado de pacientes. En nuestra serie, la frecuencia de casos con CEA patológico (31%) ha sido similar a la de otras publicaciones, que oscilan entre el 30 y el 40%16,26,27.
Diversos estudios han analizado qué factores pudieran influir en la aparición de valores patológicos de CEA. Se ha postulado que su elevación se vería facilitada por determinadas variables como el grado de diferenciación del tumor28 o su localización24. Al comparar las características de nuestra casuística, tanto de los pacientes como de los tumores, únicamente hemos encontrado un significativo aumento de frecuencia de CEA elevado en los estadios tumorales más avanzados. Confirmando este dato, hemos registrado como el valor medio del CEA y la frecuencia de casos con CEA patológico aumentan progresiva y significativamente según avanza el estadio pTNM de la neoplasia. Estos resultados son coincidentes con los referidos en otros estudios5,14,15 y se explican por la relación entre una mayor masa de células tumorales en los estadios avanzados y una más elevada producción del CEA3.
En el CCR el CEA modula la adhesión intercelular y actúa como promotor de la agregación celular, facilitando la invasión tumoral y la metastatización5. Por ello, se ha estudiado el posible valor pronóstico desfavorable de la presencia de cifras altas de CEA pretratamiento en este tumor. Diversos trabajos mostraron una relación significativa entre la presencia de valores patológicos iniciales de CEA y una peor evolución1,14,29,30. Llegó a proponerse por parte del College of American Pathologists en su conferencia de consenso del año 1999 al CEA pretratamiento como un marcador pronóstico de categoría I en el CCR31, equiparándolo a la clasificación TNM, la invasión linfática o vascular o la presencia de cáncer residual tras la cirugía32. Esta afirmación ha sido puesta en duda, argumentándose en contra del valor predictivo que, en el momento del diagnóstico, el valor del CEA pueda depender más del tamaño del tumor que de la presencia de unas posibles metástasis ocultas, verdaderas responsables del mal pronóstico22, ya que se acepta que el tamaño del tumor por sí solo no tiene valor predictivo33.
En estos últimos años la utilidad pronóstica del CEA pretratamiento en el CCR, considerado de modo global, sigue siendo objeto de debate, habiéndose publicado estudios que no muestran un valor predictivo independiente21,22. Las discrepancias en los resultados obtenidos pueden deberse a diversos factores como el tamaño de la muestra, la duración del seguimiento y el considerar conjuntamente o no tumores rectales y colónicos1. Otro aspecto a considerar es el punto de corte del CEA utilizado, ya que se han empleado valores que oscilan entre 2,434 y 10mg/l29. Al igual que la mayoría de las publicaciones1,14,21,35,36, en nuestro estudio hemos definido como patológicos los valores de CEA superiores a 5mg/l.
Aunque la mayor parte de los estudios se refieren al valor del CEA «prequirúrgico», en nuestro trabajo, como otros autores16,17, hemos preferido hablar de CEA «pretratamiento», ya que la serie también incluye a pacientes que recibieron tratamiento neoadyuvante antes de ser operados. Considerando la totalidad de la casuística, los resultados que hemos obtenido apoyan el valor predictivo sobre la supervivencia de la elevación pretratamiento del CEA en los pacientes con CCR resecado con intención curativa, con un riesgo de fallecimiento debido al tumor 3 veces superior. Este valor pronóstico es independiente de la edad, la localización rectal o colónica y el estadio de la neoplasia.
Como ya hemos mencionado, cabe la posibilidad de que el valor predictivo del CEA pretratamiento sea válido para el CCR considerado en su totalidad, pero pueda perderse dependiendo del estadio tumoral del paciente14. Este hecho también contribuiría a explicar los diferentes resultados obtenidos en las series globales, ya que estas pueden presentar diferentes porcentajes de estadios pTNM. En la literatura revisada, el CEA pretratamiento no tiene valor pronóstico en los estadios pTNM I y IV1,14,29, por lo que la discusión se centra en los estadios II y III. En el estadio pTNM II los datos publicados son contradictorios: la mayoría de los estudios otorga un valor pronóstico independiente a la elevación del CEA pretratamiento1,14,37–39, frente a otros que presentan resultados negativos15,40,41. También en el estadio pTNM III los resultados son discordantes, habiéndose comunicado resultados predictivos significativos del CEA en el análisis multivariante15,28, que no se ha confirmado en otros trabajos más recientes1,14. Esta falta de concordancia podría deberse a que los puntos de corte para el CEA fueron más altos en los estudios que mostraron resultados positivos que en aquellos en los que no se alcanzó un valor pronóstico independiente. En nuestro estudio, al analizar separadamente el CEA pretratamiento en cada uno de los estadios pTNM, observamos como únicamente mantiene su valor pronóstico en el estadio II. En dicho estadio II, el CCR es una enfermedad bastante heterogénea, tanto biológica como clínicamente, que incluye tumores que respetan la capa serosa (T3) junto a otros que la invaden (T4). Debido a todo ello, se registran importantes diferencias en cuanto al riesgo de recidivas tras la resección quirúrgica, que pueden oscilar entre el 10 y el 50%12, con variaciones en el índice de supervivencia a los 5 años de hasta un 30%11. Por este motivo, y especialmente en los casos de cáncer colónico, es muy importante disponer de factores pronósticos que nos permitan seleccionar los grupos de casos que se beneficiarían más de un tratamiento adyuvante, cuyas indicaciones en este estadio siguen en discusión36,42,43. Según nuestros resultados, la elevación pretratamiento del CEA en el estadio II, independientemente de que el tumor sea T3 o T4, podría ayudar a seleccionar un subgrupo de pacientes con peor pronóstico.
Nuestro estudio presenta la limitación de ser retrospectivo. Salvo pocas excepciones38,39, la gran mayoría de análisis sobre el valor pronóstico del CEA comparten esta característica, lo que reduce el valor de sus conclusiones. Además de este inconveniente, el trabajo que presentamos es unicéntrico. Este hecho por una parte mejora su homogeneidad y evita el posible sesgo que pueda suponer la actuación de diversos equipos quirúrgicos, pero por otra disminuye la amplitud de la casuística y no permite disponer de una validación externa. Por ello, nuestros resultados deberían ser confirmados por otros trabajos prospectivos y multicéntricos, realizados preferiblemente en nuestra área geográfica. Si estos futuros estudios confirmasen en el global de la serie los actuales resultados, la elevación pretratamiento del CEA (>5mg/l) sería un parámetro de fácil obtención y bajo coste que nos ayudaría a orientar, desde el momento del diagnóstico y antes de efectuar la estadificación del tumor, una menor probabilidad de supervivencia tras la resección de la neoplasia. Adicionalmente, en los tumores en estadio pTNM II, e independientemente de que se tratara de lesiones T3 o T4, facilitaría la delimitación de un subgrupo de pacientes con un teórico peor pronóstico, que podría tenerse en cuenta a la hora de indicar un tratamiento más agresivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.