La pandemia producida por SARS-CoV-2 ha supuesto uno de los mayores desafíos del sistema sanitario español. El impacto del virus sobre el hígado no es bien conocido, pero en pacientes con enfermedades hepáticas crónicas, especialmente en estadios avanzados, puede comprometer de forma crítica la supervivencia y desencadenar descompensaciones. El tratamiento en esta subpoblación es complejo por la potencial hepatotoxicidad de algunos fármacos empleados. Más allá, la pandemia también ha impactado negativamente sobre aquellos con enfermedades hepáticas que no han adquirido la enfermedad, ya que la redistribución de los recursos humanos y materiales hacia la atención de pacientes con COVID-19 ha provocado una merma en su tratamiento, diagnóstico y seguimiento que, a buen seguro, tendrá consecuencias negativas en el futuro. La reorganización eficiente de las unidades de Hepatología es una necesidad de primer orden para aminorar el impacto de la pandemia sobre una población tan vulnerable como los pacientes con hepatopatía.
The SARS-CoV-2 pandemic has proven to be a serious challenge for the Spanish healthcare system. The impact of the virus on the liver is not well known, but in patients with chronic liver disease, mostly in advanced stages, it can critically compromise survival and trigger decompensation. Treatment in this subpopulation is complex due to the potential hepatotoxicity of some of the medicinal products used. Moreover, the pandemic has also negatively impacted patients with liver disease who have not contracted COVID-19, since the reallocation of human and material resources to the care of patients with the virus has resulted in a decrease in the treatment, diagnosis and follow-up of patients with liver disease, which will surely have negative consequences in the near future. Efficient reorganization of hepatology units is a priority to minimise the impact of the pandemic on a population as vulnerable as liver disease patients.
La infección por el coronavirus-2 del síndrome respiratorio agudo grave (SARS-CoV-2), agente causal de la enfermedad denominada COVID-19, constituye uno de los mayores desafíos para la infraestructura de los sistemas sanitarios y la salud pública de los últimos tiempos1,2. Esta pandemia ha ocasionado, al primero de junio de 2020, más de 300.000 fallecimientos a escala mundial3. En España, el impacto de la COVID-19 está siendo especialmente grave, ya que es el tercer país europeo con mayor número de casos confirmados, y el quinto mundial por detrás de Estados Unidos, Brasil, Rusia y Reino Unido3. En la mayoría de las ocasiones el curso de la enfermedad es benigno, sin embargo, en otras el desenlace puede ser fatal, alcanzando una tasa de letalidad en nuestro medio del 11,1%4. La causa de muerte suele ser el fallo respiratorio agudo secundario a un daño alveolar difuso; sin embargo, el hígado puede resultar protagonista en dos vertientes: 1) por verse afectado por la propia infección, su tratamiento (o ambas cosas) y 2) por las implicaciones que pueda tener la existencia de una enfermedad hepática crónica subyacente en el pronóstico.
¿Cómo es el daño hepático en los pacientes con COVID-19?Hoy conocemos que SARS-CoV-2 utiliza el receptor de la de la enzima convertidora de la angiotensina 2 (ECA-2) como puerta de entrada para la infección5. Este está presente en la superficie celular de prácticamente todos los órganos humanos, lo que convierte a la COVID-19 en una enfermedad sistémica que, si bien se manifiesta fundamentalmente con síntomas a nivel del tracto respiratorio, puede del mismo modo afectar a otros órganos vitales como hígado, corazón, páncreas, riñones e intestino.
La afectación hepática asociada a la COVID-19, entendida como cualquier alteración clínica o analítica relacionada con la función hepática, puede aparecer en individuos previamente sanos o con patología hepática preexistente. Los primeros estudios procedentes de China proporcionaron datos dispares sobre su prevalencia, con proporciones que abarcaban desde el 14 hasta más del 50%6-8. En el estudio que incluyó un mayor número de pacientes la principal alteración detectada fue la elevación de las aminotransferasas, presente hasta en el 20%, seguida de ligeros incrementos de la bilirrubina en el 10% de los casos9. Por el contrario, la elevación de otros parámetros de colestasis, como gamma-glutamil-transferasa (GGT) y fosfatasa alcalina (FA), fue relativamente infrecuente. Otras observaciones más recientes sí describen elevaciones de GGT hasta en el 50%, pero con FA normal10. Por su parte la hipoalbuminemia suele ser un hallazgo analítico relativamente frecuente en pacientes con COVID-19 grave; sin embargo, no se acompaña de otros datos sugerentes de insuficiencia hepática, como la hiperamonemia, hiperbilirrubinemia, hipoglucemia o prolongación de los tiempos de la coagulación9.
Hasta la fecha no se ha descrito ningún caso de insuficiencia hepática aguda grave secundaria a la infección por SARS-CoV-2 y la alteración de las transaminasas suele ser transitoria8,9. Los estudios que han analizado la relación de la afectación hepática con el pronóstico arrojan resultados contradictorios. Mientras que dos cohortes de pacientes asiáticos identificaron una relación entre la gravedad de la COVID-19, la necesidad de ingreso en unidades de cuidados intensivos (UCI), el sexo masculino y la existencia de concentraciones elevadas de transaminasas6,9; otras no detectan un mayor riesgo de muerte en este subgrupo11,12. Aunque el hecho de que aproximadamente un tercio de los pacientes presenten afectación hepática ya al ingreso podría indicar un efecto citopático directo del virus sobre el hígado; lo cierto es que es más probable que al daño hepático contribuyan más otros mecanismos fisiopatológicos también presentes en situaciones hemodinámicas o respiratorias críticas, o de sepsis grave. Esto, probablemente dificulte la interpretación del papel que juega la disfunción hepática en el pronóstico de los pacientes con COVID-19.
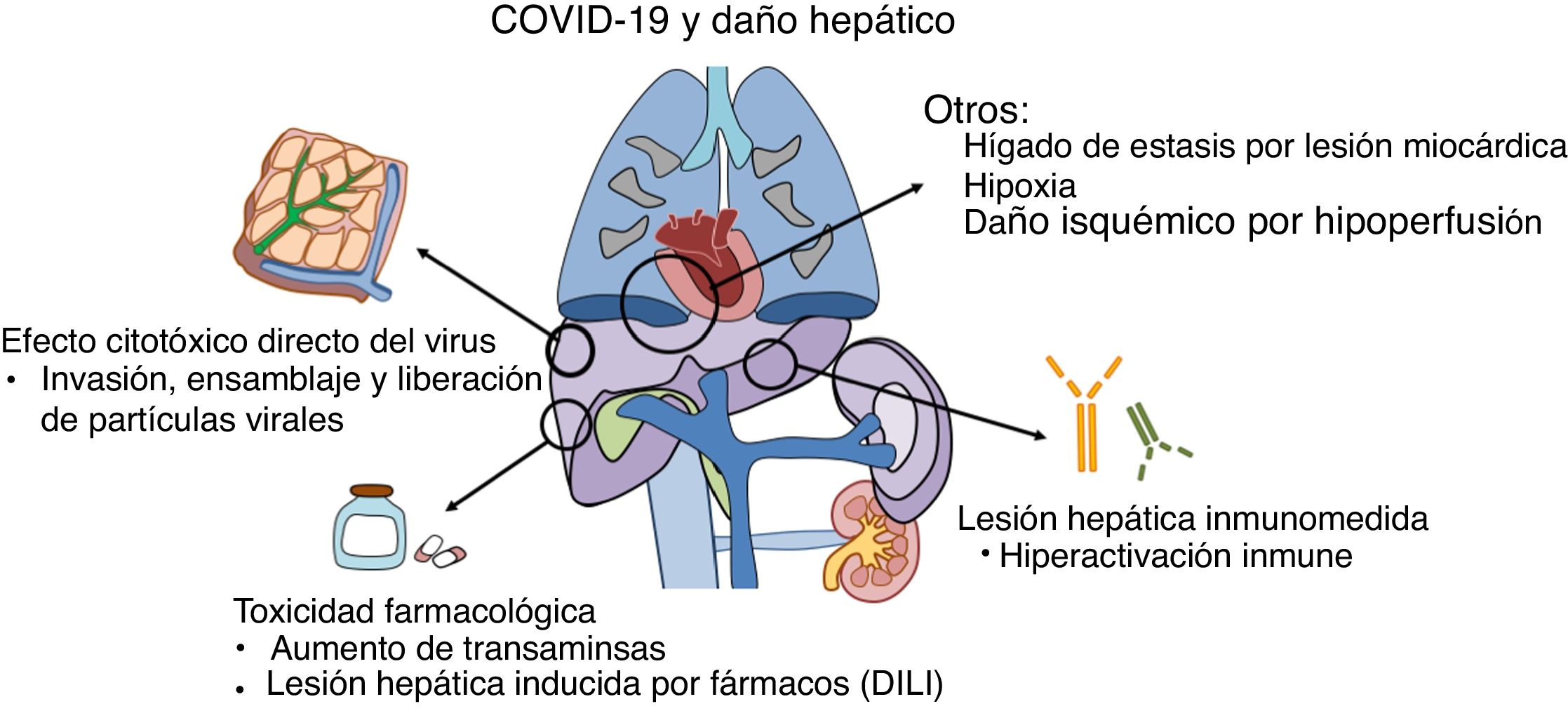
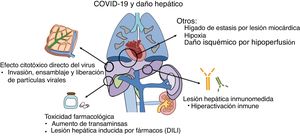
¿Por qué se produce el daño hepático en la COVID-19?El daño hepático en los pacientes con COVID-19 puede deberse a varios mecanismos, entre los que destacan la propia acción del virus o del sistema inmunológico sobre las células del hígado y la toxicidad de los fármacos utilizados en su tratamiento (fig. 1).
Fisiopatología de la lesión hepática: diversos mecanismos en relación con la infección por SARS-CoV2 pueden inducir alteraciones hepáticas, tanto directamente por el efecto citopático del virus, como por el efecto indirecto de la hiperactivación inmunológica o la toxicidad farmacológica.
Publicaciones recientes sugieren que el virus puede unirse a receptores de la ECA-2 situados en las células hepáticas, especialmente en los conlangiocitos donde su expresión es más abundante13.Tras su unión al receptor y entrada en la célula, se ponen en marcha mecanismos de replicación dirigidos a generar nuevo ARN viral y sintetizar proteínas estructurales necesarias para el ensamblaje y liberación de nuevas partículas virales14. En contraposición, la expresión de receptores de la ECA-2 en los hepatocitos es escasa, lo que podría explicar la ausencia de datos analíticos e histológicos típicos de las hepatitis virales15.
En algunos casos graves ha ocurrido una hiperactivación inmunitaria proinflamatoria, cuyas consecuencias podrían ser más letales que el propio efecto citopático del virus16. Sobre esta hipótesis de daño inmunomediado se sustenta el potencial beneficio de determinadas terapias farmacológicas actualmente en fase de investigación17,18. Sin embargo, las consecuencias a nivel hepático de esta disfunción inmunitaria en el contexto de la COVID-19 son todavía desconocidas.
En segundo lugar, la toxicidad inducida por los fármacos empleados en el tratamiento de la COVID-19 también puede contribuir al daño hepático19. Esto es especialmente relevante, por una parte, en los pacientes con enfermedades hepáticas crónicas preexistentes en los cuales el riesgo de toxicidad es mayor y, por otra, en los pacientes trasplantados hepáticos, por las potenciales interacciones con los fármacos inmunosupresores utilizados de forma habitual. Entre las distintas opciones farmacológicas empleadas hasta la fecha, el remdesivir, un análogo de nucleótido, ha mostrado resultados prometedores al disminuir el tiempo de recuperación y estancia hospitalaria20. Inicialmente se describió un aumento de transaminasas durante el tratamiento con remdesivir en hasta el 23% de los pacientes, siendo solo necesario, en dos de ellos, suspender el tratamiento por este motivo20. Sin embargo, los resultados preliminares de dos ensayos clínicos encuentran este efecto adverso en tan solo el 4,1- 5.0% de los pacientes, sin diferencias frente al grupo placebo21,22. Otros fármacos utilizados en el tratamiento de la COVID-19, como los inhibidores de la proteasa (lopinavir) y tocilizumab, también podrían suponer un potencial riesgo de hepatotoxicidad23,24.
¿Cuál es el impacto de la COVID-19 en los pacientes con enfermedad hepática crónica?Varios estudios han analizado la prevalencia de enfermedad hepática crónica subyacente en largas series de pacientes hospitalizados por COVID-19, con cifras que oscilan entre el 0,6 y 1,4%9,25,26. En un reciente metaanálisis se ha documentado que en aproximadamente el 60% de los pacientes con enfermedad hepática crónica, el curso de la infección fue grave, con una tasa de letalidad del 18%27. El principal inconveniente de los estudios incluidos es que en ellos no se ha llevado a cabo un análisis estratificado en función de la causa o del estadio de la enfermedad hepática.
La enfermedad hepática más relacionada con la COVID-19 es la de origen metabólico (de sus siglas en inglés, MAFLD: metabolic associated fatty liver disease)28. Un primer estudio asiático, que incluyó a 202 pacientes, mostró que la presencia de datos indirectos de MAFLD, junto con la edad, el sexo masculino y la existencia de otras comorbilidades, son un factor de mal pronóstico. No obstante, las enfermedades cardiovasculares coexistentes podrían actuar como factores de confusión, por lo que la interpretación de los resultados es compleja. En un intento por controlar dichos factores, otro grupo chino informó que la existencia de MAFLD y de obesidad se relaciona con una peor evolución únicamente en el grupo de población < 60 años, independientemente del sexo, el tabaquismo y otras enfermedades metabólicas (hipertensión arterial, dislipidemia y diabetes mellitus)29,30. Estos hallazgos permiten especular sobre una posible relación entre la inflamación sistémica basal, más presente en individuos jóvenes y obesos con MAFLD en comparación con los más ancianos, y una mayor respuesta inflamatoria sistémica asociada a la infección por SARS-CoV-2. Esta relación podría explicar en parte un peor curso evolutivo de la enfermedad en pacientes con este perfil. Sin embargo, el diagnóstico de MAFLD en ambos estudios se obtuvo mediante métodos no invasivos, lo que podría constituir un factor de confusión importante dado que los parámetros utilizados podrían estar alterados por la propia inflamación sistémica y la presencia de otros agentes etiológicos no considerados, como el consumo de alcohol. Por tanto, la posible sobrestimación del efecto de la MAFLD por la coexistencia de otros factores de mal pronóstico (hipertensión arterial, obesidad, enfermedad cardiovascular, enfermedad pulmonar obstructiva crónica), hace que debamos interpretar estos resultados con cautela. No obstante, independientemente de la relación causa-efecto, estos hallazgos deben alertar sobre la importancia de llevar a cabo una vigilancia estrecha y optimización de las medidas preventivas frente a la infección en aquellos pacientes con diagnóstico previo de esteatohepatitis de origen metabólico.
Por su parte, la enfermedad hepática de origen autoinmunitario, especialmente cuando es tratada con fármacos inmunomoduladores o inmunosupresores podría, al menos desde un punto de vista teórico, suponer un mayor riesgo de complicaciones asociadas a la COVID-19. Con esta premisa se desarrolló en el norte de Italia, uno de los epicentros de la pandemia en Europa, un estudio basado en 148 entrevistas clínicas telefónicas. Este trabajo ha permitido conocer que la incidencia de infección por SARS-CoV-2 en los pacientes con hepatitis autoinmunitaria no es superior a la de la población general, y que, en caso de producirse, el riesgo de desarrollar complicaciones graves es bajo31. Estos datos permiten especular sobre el papel modulador sobre el sistema inmunológico que estos fármacos pudieran tener en situaciones de hiperestimulación del mismo inducidas por la infección. Estos datos, unidos a las posibles consecuencias fatales derivadas de la suspensión brusca del tratamiento, permiten concluir que es aconsejable mantener la terapia inmunosupresora en todos los casos, incluso en áreas de alto riesgo de trasmisión comunitaria. Por último, el impacto del SARS-CoV-2 en los pacientes con enfermedades biliares primarias, como la colangitis biliar primaria o la colangitis esclerosante primaria, no ha sido evaluado hasta la fecha. Sin embargo, teniendo en cuenta la especial afinidad del virus por los colangiocitos y la presencia en este grupo de una lesión biliar preestablecida, el riesgo de alteración de los parámetros de colestasis en estos pacientes podría ser mayor.
La infección crónica por virus hepatotropos, especialmente por el virus de la hepatitis B (VHB), no parece implicar un peor pronóstico en pacientes con infección por SARS-CoV-29. Sin embargo, esta ha cobrado especial relevancia en el manejo de la COVID-19 porque la utilización de fármacos con efecto inmunosupresor potente (glucocorticoides en dosis altas o tocilizumab, entre otros) podría aumentar el riesgo de reactivaciones virales graves. Por ello, es aconsejable que en todo paciente con diagnóstico de COVID-19 se evalúe adecuadamente el estado serológico frente a los virus de la hepatitis B y C y se evalúe, con base en ello, la necesidad de tratamiento antiviral preventivo en el caso de precisar fármacos inmunosupresores de alta potencia.
Respecto a los pacientes con enfermedad hepática avanzada, la información disponible también es escasa. El primer estudio multicéntrico basado en dos registros internacionales ha permitido conocer el impacto del SARS-CoV-2 en una cohorte de 152 pacientes. En esta serie, 103 de los casos incluidos presentaban cirrosis y la etiología más frecuente de la enfermedad hepática fue la esteatohepatitis de origen metabólico32. La mortalidad durante el ingreso alcanzó el 40%, siendo en cerca del 80% de origen respiratorio. Como era esperable, esta fue más alta en los pacientes con un mayor grado de insuficiencia hepática (24, 43 y 63% en Child-Pugh A, B y C, respectivamente). Además, se pudo comprobar cómo en el 40% de ellos, la infección por SAR-CoV-2 supuso un desencadenante de una descompensación hepática (encefalopatía, empeoramiento de la ascitis y/ o hemorragia varicosa), siendo esta, y no los síntomas respiratorios, la clínica dominante hasta en el 24%. Otro estudio con menor número de pacientes ha mostrado que la infección por SARS-CoV-2 desencadena un fallo agudo sobre crónico hasta en el 28% de los casos, siendo la mortalidad comparativamente más alta que en pacientes con cirrosis ingresados por infección bacteriana, especialmente en aquellos con MELD ≥ 15 y/ o fallo respiratorio33. Los datos actualizados procedentes de la combinación de los registros SECURE-Cirrhosis y COVID-HEP que incluyen ya a 352 pacientes con cirrosis, confirman una mortalidad elevada que alcanza el 34%34.
Hasta la fecha no se dispone de datos relativos al impacto de la COVID-19 en los pacientes con carcinoma hepatocelular. Sin embargo, en ellos es altamente probable que el efecto sea negativo, pues en la mayoría se dan dos condiciones clínicas asociadas a un peor pronóstico: la enfermedad oncológica per se y la hepatopatía avanzada35. Por otro lado, las limitaciones logísticas a nivel asistencial provocadas por la pandemia, han tenido un impacto negativo tanto en el proceso diagnóstico como en el tratamiento del cáncer hepático en algunos casos. Este hecho, probablemente también tendrá un impacto indirecto desfavorable en el pronóstico de estos pacientes.
Finalmente, los candidatos a trasplante hepático merecen una consideración aparte por tratarse de una población especialmente vulnerable y con una ventana de oportunidad terapéutica más estrecha. La elevada morbimortalidad de los procedimientos quirúrgicos en pacientes con COVID-1936, unida a la escasez de camas en UCI, la disminución drástica del número de donantes y el riesgo de trasmisión nosocomial de la infección por SARS-CoV-2, han provocado un descenso sin precedentes del número de trasplantes en España. De hecho, hemos podido comprobar cómo se ha pasado de un número de 20-30 trasplantes hepáticos semanales, en los primeros dos meses del año 2020, a menos de un tercio de ellos en marzo y abril, incrementando tan solo hasta aproximadamente la mitad de la actividad previa en el mes de mayo37. La realidad es que, en los últimos meses, en la mayoría de las unidades de trasplante, únicamente se ha llevado a cabo el procedimiento en casos seleccionados de extrema gravedad (fallo hepático fulminante) y/o alta probabilidad de salida de la lista de espera. Aunque por el momento nos encontramos a la espera de datos definitivos, es previsible que la pandemia tenga un impacto significativo en la supervivencia de los candidatos en lista de espera, no solo por la pérdida de oportunidad en algunos casos, sino porque la demora de la cirugía conlleve su realización posterior en un escenario clínico posiblemente más complejo. No obstante, cabe destacar que España cuenta con uno de los sistemas de trasplante más vanguardistas y eficientes del mundo, lo que ha permitido que, aun en situaciones de extrema dificultad, haya sido posible llevar a cabo los procedimientos con las máximas garantías de seguridad.
¿Qué debemos tener en cuenta al tratar la COVID-19 en pacientes con enfermedad hepática crónica?A día de hoy, se desconoce cuál es el tratamiento farmacológico óptimo para la infección por COVID-19 y en qué situaciones clínicas concretas se debe aplicar. Por ello, numerosos ensayos clínicos se encuentran activos en la actualidad con el fin de obtener evidencias científicas más sólidas a este respecto. La incertidumbre acerca del manejo terapéutico de la infección por SARS-CoV-2 también afecta a los pacientes con enfermedades hepáticas crónicas, en los que el riesgo de toxicidad hepática y las interacciones farmacológicas cobran mayor relevancia.
Entre los fármacos utilizados para el control sintomático cabe destacar la potencial toxicidad del paracetamol, capaz de inducir lesión hepatocelular por sobredosis, especialmente en los pacientes con hepatopatía de origen enólico38. Con respecto a los antivirales, remdesivir se asocia a una elevación reversible de las transaminasas en el 5-30% de los pacientes. Por ello se desaconseja su uso cuando la AST o la ALT se encuentran aumentadas más de cinco veces por encima del límite alto de la normalidad39. La cloroquina y la hidroxicloroquina, con o sin azitromicina, también han sido propuestas como agentes antivirales frente a la COVID-19, al conseguir bloquear la entrada del virus en las células diana en estudios preclínicos40. Aunque no se han reportado efectos hepatotóxicos significativos con estos fármacos, su uso no se recomienda fuera del contexto de los ensayos clínicos por los potenciales efectos adversos (principalmente cardiológicos) y las dudas en cuanto a su eficacia41. Por último, agentes inmunomoduladores como tocilizumab (antagonista del receptor de IL-6), sarilumab o siltuximab (ambos, anticuerpos monoclonales anti-IL-6), están siendo investigados por su potencial para contrarrestar la hiperactivación inmunitaria asociada con los casos más graves. Con estos fármacos también se han detectado elevaciones reversibles de transaminasas42, por lo que su uso se desaconseja si los valores de AST y/o ALT superan cinco veces o más el límite alto de la normalidad43.
Las implicaciones del tratamiento inmunosupresor asociado con el trasplante de órgano sólido sobre la evolución de la COVID-19 solo se conocen parcialmente. A día de hoy disponemos de la información recogida en series de pequeño tamaño que muestran datos no concluyentes sobre el pronóstico de la enfermedad en este subgrupo, describiéndose tasas de mortalidad variables que oscilan entre el 4,8 y el 19%34,44,45. En cuanto al manejo farmacológico, se ha reportado el uso de hidroxicloroquina, azitromicina, remdesivir, tocilizumab y bolos de esteroides en estos pacientes, sin poder obtener hasta la fecha conclusiones definitivas en cuanto a cuál es el mejor tratamiento en estos casos. En general, se aboga por una diminución de la dosis de inmunosupresores (o su suspensión en casos excepcionales), ya que la presencia de infecciones nosocomiales graves concomitantes se asocia a un peor pronóstico46. La administración de lopinavir/ritonavir (Kaletra®) se desaconseja por el elevado riesgo de interacciones y los potenciales efectos secundarios. Esta premisa se fundamenta en el hecho de que ritonavir es un potente inhibidor del citocromo CYP3A4, involucrado tanto en el metabolismo de los inhibidores de calcineurina como en el de sirólimus y everólimus. En caso de precisar la administración conjunta de ambos fármacos, se recomienda disminuir la dosis de tacrólimus a 1/20-1/50 con respecto a la pauta habitual46.
¿Qué impacto ha tenido y tendrá en el futuro la pandemia en los pacientes con enfermedad hepática crónica?El advenimiento de la pandemia por SARS-CoV-2 ha tenido un grave impacto en el sistema de cuidados hospitalarios y extrahospitalarios en España, lo que a buen seguro modificará los protocolos de intervención y práctica clínica adoptados hasta la fecha. Si bien el impacto de la epidemia no ha sido el mismo en todo el territorio nacional, existe un denominador común: la necesidad de una reorganización inmediata de todas las unidades de Hepatología. En la mayoría de los centros estas han visto mermados sus recursos humanos y materiales debido a la redistribución de los mismos hacia zonas de atención prioritarias de pacientes con COVID-19. La primera consecuencia de ello ha sido la reducción de la actividad asistencial dirigida al tratamiento, diagnóstico y seguimiento de las enfermedades hepáticas crónicas.
Hasta hoy los pacientes y médicos hemos vivido el pico máximo de la pandemia en España, que llevó a la implementación de medidas extraordinarias de obligado cumplimiento como el distanciamiento físico, el confinamiento domiciliario o el uso de mascarillas en los lugares públicos, entre otras47. A la vista de los últimos datos epidemiológicos disponibles, estas medidas han permitido reducir de forma significativa la transmisión del virus. Sin embargo, lejos de recobrar la normalidad, aún debemos conocer el impacto que esta «primera ola» ha supuesto sobre un grupo especialmente vulnerable: los pacientes con enfermedades hepáticas crónicas. Aunque la situación epidemiológica actual es más favorable, la repercusión de la pandemia en la atención médica de este colectivo sigue siendo grave y puede que estemos ante una «segunda ola» donde las consecuencias derivadas de la demora asistencial, y los cambios obligados en los modelos de atención clínica, puedan tener mayor impacto negativo en la evolución los pacientes que la propia infección. Incluso hay autores que sugieren la posibilidad de una futura «tercera ola» en la que la suspensión de actividades preventivas, como el cribado del carcinoma hepatocelular, haga que los pacientes acudan con problemas que hubieran sido inicialmente prevenibles o más fácilmente tratables48.
Es bien sabido que la responsabilidad del médico trasciende del puro acto de la atención al paciente, siendo también garante de la distribución juiciosa de los recursos, incluso en situaciones de escasez de los mismos o de extraordinaria presión asistencial. Fruto de ello, las diferentes sociedades científicas, entre ellas, la Asociación Española para el Estudio del Hígado (AEEH), las asociaciones americanas (AASLD) y europea (EASL), han elaborado documentos de posicionamiento que permiten diseñar las líneas generales que las diferentes unidades de Hepatología deben seguir en la actualidad y durante los próximos meses (tabla 1)46,49,50.
Resumen de las recomendaciones basadas en los documentos de consenso de AEEH, EASL y AASLD46,49,50
| Escenario clínico | |
|---|---|
| Paciente ambulatorio estable | |
| Paciente ambulatorio | Limitar visitas presenciales de seguimiento y facilitar visitas telemáticas46,49,50Limitar las primeras visitas a pacientes con ictericia, AST o ALT > 500 y/o descompensación hepática39Mantenimiento de los tratamientos antivirales activos (VHB y VHC)46,49,50Diferir el inicio de tratamiento frente al VHC46,49,50, salvo en pacientes descompensados (AEEH)42Mantener el tratamiento inmunosupresor, sin reducir la dosis, en pacientes con hepatitis autoinmunitaria46,49,50En pacientes con diagnóstico de novo de hepatitis autoinmunitaria grave no demorar el inicio de corticoides, pero diferir el inicio de azatioprina42 |
| Cribado, diagnóstico y tratamiento del carcinoma hepatocelular | Diferir el cribado dos meses39 o hasta cuando las unidades de ecografía permitan realizar el procedimiento con seguridad42,43Priorizar la indicación de pruebas de imagen a pacientes de alto riesgo (elevación de AFP, cirrosis avanzada en lista de espera, hepatitis crónica B de alto riesgo)39Mantenimiento de comités multidisciplinarios, preferiblemente virtuales46,49,50Iniciar y mantener los tratamientos oncológicos indicados según las guías46,49,50. En los casos que no sea posible, las desviaciones de las guías de práctica clínica deben ser abordadas en comités multidisciplinarios y pueden guiarse por las recomendaciones publicadas por la International Liver Cancer Association (https://ilca-online.org/management-of-hcc-during-covid-19-ilca-guidance/) |
| Cribado de varices esofágicas y profilaxis primaria y secundaria | Aplicación universal de los criterios de Baveno VI para indicar el cribado43Indicar betabloqueantes no cardioselectivos en profilaxis primaria y secundariaMantenimiento del programa de ligadura endoscópica con bandas en pacientes de alto riesgo en profilaxis secundaria42En pacientes con COVID-19 solo se realizarán endoscopias urgentes ante sospecha de hemorragia digestiva43 |
| Paciente con descompensación y candidatos a trasplante | |
| Cirrosis descompensada | Fomentar la telemedicina46,49,50Limitar el número de visitas y revisar los pacientes que deben ser vistos presencialmente39,43Limitar el tiempo de ingreso, especialmente en las valoraciones previas al trasplante43Asegurar que los pacientes disponen de tratamiento y facilitar la prescripción del mismo a largo plazo39Cribado de SARS-CoV-2 en todos los pacientes ingresados por una descompensación aguda42,43Valorar cautelosamente el tratamiento con corticoides en hepatitis aguda alcohólica39Mantenimiento continuo de las evaluaciones de trasplante, ajustando la indicación a la situación epidemiológica en cada momento42Crear circuitos «libres de COVID-19» para llevar a cabo las evaluaciones previas al trasplante39 |
| Trasplante hepático | |
| Momento del trasplante | Reforzar la entrevista clínica telefónica sobre síntomas de COVID-19 del potencial receptor46,49,50Cribado de SARS-CoV-2 universal mediante PCR de exudado nasofaríngeo y prueba de imagen en potenciales donantes y receptores46,49,50Los casos positivos para infección activa (sintomática o asintomática) por SARS-CoV-2 deben ser descartados tanto como donantes como receptores42,*Considerar aceptar órganos con bajo tiempo de isquemia para evitar estancias postoperatorias prolongadas39Considerar suspender temporalmente los programas de donante vivo, excepto para receptores pediátricos39 |
| Postrasplante inmediato | Seguir los protocolos de inmunosupresión habitualmente utilizados46,49,50Maximizar el aislamiento y las medidas de prevención de trasmisión nosocomial de infecciones, evitando las visitas externas46,49,50 |
| Seguimiento del paciente trasplantado | Mantener el tratamiento inmunosupresor46,49,50Favorecer las consultas no presenciales46,49,50 |
| Recomendaciones generales | |
| Medidas para evitar contagio | Mantener distancia física y uso de mascarilla46,49,50Evitar desplazarse a zonas de mayor riesgo de contagio39Instruir a los pacientes para evitar acudir a reuniones, incluso a grupos de soporte (ej. terapias de alcohol)39Colaboración estrecha con médicos de Atención Primaria43 |
| Paciente con enfermedad hepática y COVID-19 | |
| Ingreso temprano de los pacientes con cirrosis y COVID-1946,49,50Evaluar reducir la dosis o, en casos puntuales, suspender el tratamiento inmunosupresor en pacientes con trasplante hepático o enfermedad autoinmunitaria46,49,50Ajustar la indicación de fármacos antivirales al grado de insuficiencia hepática46,49,50 | |
| Investigación y desarrollo | |
| Limitar a la actividad esencial, minimizando las visitas presenciales39No iniciar nuevos ensayos clínicos, salvo ausencia de otra alternativa terapéutica39,42No reclutar nuevos pacientes en ensayos clínicos no esenciales39Trabajo remoto del personal de investigación39 | |
AASLD: American Association for the Study of Liver Diseases; ALT: alanina aminotransferasa; AEEH: Asociación Española para el Estudio del Hígado; AFP: alfa feto proteína; AST: aspartato aminotransferasa; EASL: European Association for the Study of the Liver; TACE: transarterial chemoembolization; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
Se debería contemplar la posibilidad de falso positivo o negativo de la prueba diagnóstica de COVID-19, para lo que se tendrá en cuenta la situación epidemiológica en el momento de la donación y la existencia de síntomas, semiología radiológica sugerente (o ambas cosas).39
En general, se debe priorizar la atención de los pacientes con enfermedad hepática más avanzada, como aquellos con cirrosis descompensada, candidatos a trasplante hepático o con diagnóstico de carcinoma hepatocelular. Se hace hincapié en la incorporación de herramientas de atención telemática, bien mediante llamadas telefónicas, videollamadas o a través de e-mail. El objetivo de las mismas es evitar el contacto de los pacientes con el medio sanitario, sobre todo en situaciones que a priori no aporten valor añadido, como las consultas realizadas para informar de la normalidad de una prueba diagnóstica. Dentro de los objetivos de las consultas telemáticas está el reforzar la adherencia terapéutica en pacientes con enfermedades crónicas, como las hepatitis virales o de origen autoinmunológico. Para ello, también es fundamental la coordinación con los Servicios de Atención Primaria y Farmacia Hospitalaria, de manera que se pueda facilitar el acceso al tratamiento de forma ágil, evitando desplazamientos innecesarios. La atención presencial debe reservarse para pacientes con enfermedad grave o descompensada y siempre maximizando las medidas de protección individual y acortando los tiempos de espera.
En los pacientes con carcinoma hepatocelular es posible que la pandemia haya retrasado el inicio de algunos tratamientos como cirugías, terapias ablativas locales o quimioterapia. La existencia de comités multidisciplinarios para el manejo del hepatocarcinoma ha demostrado ser una herramienta eficaz51. Por ello, se deben promover estas reuniones mediante videoconferencia o con el distanciamiento físico adecuado, ya que permiten priorizar el inicio de dichos tratamientos independientemente de la situación epidemiológica y de la disponibilidad local de recursos en cada momento.
Los potenciales candidatos a trasplante hepático también han visto reducidas sus probabilidades de inclusión en lista en los últimos meses52. Por ello, la restauración de los comités multidisciplinarios para la valoración de candidatos se considera una medida prioritaria. Se recomienda que, en el momento del trasplante, tanto el donante como el receptor sean cuidadosamente evaluados, descartándose una infección activa por SARS-CoV-2 mediante pruebas virológicas (serología y PCR), exploración física y pruebas de imagen.
Muchas de las pruebas complementarias utilizadas en el diagnóstico y seguimiento de la enfermedad hepática crónica como ecografía, biopsia hepática, elastografía, endoscopia y hemodinámica hepática, se han visto diferidas o anuladas. En este sentido, las diferentes sociedades científicas abogan por una restauración paulatina de las mismas, que deberán priorizarse en los pacientes de mayor riesgo. Se aconseja realizar las ecografías de cribado de carcinoma hepatocelular tan pronto como sea posible, difiriendo otras que rara vez son urgentes como la elastografía o la hemodinámica hepática53. La realización de biopsias hepáticas, bien por vía percutánea o transyugular, debe reservarse inicialmente para casos graves en los que el resultado de la biopsia implique un cambio en la estrategia terapéutica. Por su parte la medición del gradiente hepático de presión venosa se debería reservar en un primer momento para los pacientes candidatos a cirugía de resección de hepatocarcinoma. La endoscopia digestiva alta es un procedimiento generador de aerosoles y, por consiguiente, de riesgo para la transmisión de SARS-CoV-254. Por ello, es importante ceñirse a los criterios propuestos en la conferencia de Baveno VI que permiten, a través de métodos no invasivos, estratificar el riesgo de desarrollo de varices esofágicas55.
Finalmente, cabe destacar que la pandemia por COVID-19 ha llegado en un momento muy importante de la historia de la Hepatología, cuando se empezaban a desarrollar planes de macroeliminación (en la población general) y microeliminación (en poblaciones de riesgo) del virus de la hepatitis C (VHC). Es evidente que la pandemia puede repercutir de forma negativa en la consecución de objetivos tan importantes y ambiciosos como la erradicación de la infección antes del año 2024. No obstante, el contacto con el medio sanitario de muchos pacientes hasta ahora sanos, a raíz de la infección por SARS-CoV-2, puede también facilitar diagnósticos oportunistas de infección crónica por VHC. Por ello, el restablecimiento de la actividad ambulatoria en Hepatología deberá seguir manteniendo como objetivo el acceso simplificado y universal a los tratamientos antivirales.
Necesidades futuras y conclusionesLa pandemia causada por el SARS-CoV-2 representa uno de los mayores retos de las últimas décadas para los profesionales y sistemas sanitarios a escala mundial. La infección por COVID-19 compromete no sólo la supervivencia de los pacientes afectados por dicha enfermedad sino que, además, tiene una gran repercusión en la atención médica de otras afecciones, entre ellas las enfermedades hepáticas crónicas. A este respecto, es importante generar más y mejores evidencias en cuanto a la seguridad y eficacia de los tratamientos, tanto en la población general como en subgrupos específicos y, al mismo tiempo, adaptar los protocolos de atención habituales a la situación actual, en donde la disponibilidad de pruebas complementarias y las opciones de tratamiento se han visto comprometidas.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Francisco Gea, por su inestimable colaboración para la revisión crítica del artículo y al Servicio de Gastroenterología y Hepatología del Hospital Ramón y Cajal por no perder la vocación por la constante actualización científica, incluso en situaciones excepcionales.