Más de 30 años después de su descubrimiento, la infección por Helicobacter pylori (H. pylori) sigue siendo la causa más frecuente de enfermedades gástricas y duodenales. H. pylori es la causa principal de la gastritis crónica, la úlcera péptica, el linfoma MALT gástrico y el adenocarcinoma gástrico. Recientemente se han publicado varios consensos sobre el manejo de la infección por H. pylori. Las líneas generales del consenso español, del de Toronto y el Maastricht V del 2016 son similares, pero las recomendaciones concretas pueden variar notablemente. Además, las recomendaciones de alguno de estos consensos resultan francamente complejas. El presente documento de posicionamiento de la Societat Catalana de Digestologia es una actualización de las recomendaciones basadas en la evidencia sobre el manejo y tratamiento de la infección por H. pylori. Este documento pretende revisar esta información para hacer unas recomendaciones para la práctica clínica habitual sencillas, concretas y que sean de fácil aplicación en nuestro medio.
More than 30 years after its discovery, Helicobacter pylori (H. pylori) infection remains the most common cause of gastric and duodenal diseases. H. pylori is the leading cause of chronic gastritis, peptic ulcer, gastric MALT lymphoma and gastric adenocarcinoma. Several consensuses have recently been published on the management of H. pylori infection. The general guidelines of the Spanish consensus, the Toronto Consensus and the Maastricht V Consensus of 2016 are similar but concrete recommendations can vary significantly. In addition, the recommendations of some of these consensuses are decidedly complex. This position paper from the Catalan Society of Digestology is an update of evidence-based recommendations on the management and treatment of H. pylori infection. The aim of this document is to review this information in order to make recommendations for routine clinical practice that are simple, specific and easily applied to our setting.
El presente documento de posicionamiento es una actualización de las recomendaciones basadas en la evidencia sobre el manejo y tratamiento de la infección por Helicobacter pylori (H. pylori).
Desde la Societat Catalana de Digestologia se invitó a los autores listados a participar en la redacción y posterior revisión del documento sobre el manejo de la infección por H. pylori. Dos digestólogos (JSD y XC) actuaron de coordinadores. Se redactaron preguntas clave/recomendaciones que se revisaron y aprobaron por los participantes. El equipo coordinador formó 4 subgrupos de trabajo (indicaciones para investigar y tratar H. pylori, métodos diagnósticos, tratamiento de la infección por H. pylori y manejo del paciente con hemorragia digestiva y tratamiento con antiinflamatorios no esteroides [AINE] y/o ácido acetil salicílico [AAS] y/o anticoagulantes). Se dividieron las preguntas clave/recomendaciones entre estos subgrupos de trabajo para su redacción. Finalmente el manuscrito fue revisado y aceptado por todos los autores y publicado en la página web de la Societat Catalana de Digestologia como Documento de Posicionamiento (http://www.scdigestologia.org/?p=page/html/docs_posicionament).
IntroducciónMás de 30 años después de su descubrimiento, la infección por H. pylori sigue siendo la causa más frecuente de enfermedades gástricas y duodenales. H. pylori es la causa principal de la gastritis crónica, la úlcera péptica, el linfoma MALT gástrico y el adenocarcinoma gástrico1–3.
Actualmente no existe un único tratamiento óptimo para tratar la infección. Durante décadas, la triple terapia que combina inhibidores de la bomba de protones (IBP), amoxicilina y claritromicina durante 7 o 10 días ha sido el tratamiento de elección4,5. No obstante, en los últimos años este tratamiento ha obtenido unas tasas de erradicación subóptimas6,7 debido a un aumento de las resistencias bacterianas, especialmente la claritromicina. Por este motivo, las recomendaciones de tratamiento se han modificado.
En la actualidad se consideran de elección las nuevas pautas cuádruples con o sin bismuto, con una duración de 10 a 14 días y asociadas al uso de dosis altas de IBP. Estas nuevas pautas han conseguido mejorar la eficacia del tratamiento, con tasas de erradicación iguales o superiores al 90%.
Recientemente se han publicado varios consensos sobre el manejo de la infección por H. pylori8–12. Las líneas generales del consenso español, del de Toronto y el Maastricht V del 2016 son similares, pero las recomendaciones concretas pueden variar notablemente. Además, las recomendaciones de alguno de estos consensos resultan francamente complejas. En este contexto, este documento de posicionamiento pretende revisar esta información para hacer unas recomendaciones para la práctica clínica habitual sencillas, concretas y fáciles de aplicar a nuestro medio.
Indicaciones para investigar y tratar H. pyloriLas indicaciones para investigar y tratar la infección por H. pylori (tabla 1) están establecidas desde hace años y las revisiones recientes de consenso no han introducido grandes cambios al respecto8,10. Solo comentaremos los aspectos más controvertidos o aquellos en los que se han observado cambios con base en la nueva evidencia.
Indicaciones del tratamiento de la infección por Helicobacter pylori
| Úlcera péptica |
| Dispepsia no investigada<55 años sin signos/síntomas de alarmaa (estrategia «test and treat») |
| Manejo diagnóstico y terapéutico de la dispepsia funcionalb |
| Antes de iniciar tratamiento en pacientes que requerirán AINEb |
| En pacientes que inician tratamiento con AINE y antecedentes de enfermedad ulcerosa además del tratamiento con IBP de mantenimientob |
| Linfoma MALT gástrico de bajo grado |
| Resección quirúrgica o endoscópica de un cáncer gástrico |
| Familiares de primer grado de pacientes con cáncer gástrico |
| Gastritis crónica atrófica o metaplasia intestinal |
| Anemia ferropénica de causa no aclarada |
| Púrpura trombocitopénica idiopática |
| Déficit de vitamina B12 no explicable por otras causas |
| Uso prolongado de inhibidores de la bomba de protones en pacientes jóvenes |
| Se recomienda ofrecer a todo paciente diagnosticado de infección por H. pylori un tratamiento erradicador |
De acuerdo con los nuevos criterios de Roma IV13, no se podrá considerar que una dispepsia es funcional hasta que no se hayan descartado razonablemente las causas orgánicas de esta. Esto incluye, en nuestro medio, haber determinado y erradicado, si se detecta, la infección por H. pylori y, probablemente, descartar celiaquía. Por tanto, con un paciente con sospecha de dispepsia funcional, se debe investigar y tratar la infección por H. pylori si la tiene antes de establecer el diagnóstico definitivo de ser considerado una causa funcional.
La indicación más frecuente de erradicación en la práctica clínica será la dispepsia no investigada siguiendo la estrategia «test and treat». Esta estrategia consiste en determinar la infección por H. pylori mediante un test no invasivo (se recomienda el test del aliento o el test en heces; ver más adelante) y tratarla si se detecta. Se debe aplicar solo en la población joven y sin síntomas/signos de alarma. No está bien establecida la edad de corte para considerar «población joven». Los criterios para determinar esta edad dependerán del riesgo de cáncer gástrico y este varía entre diferentes áreas poblacionales. Se ha recomendado aplicar «test and treat» por debajo de edades tan dispares como 35 y 55 años y el consenso europeo no especifica ninguna edad. En nuestra área, con una prevalencia baja de cáncer gástrico, seguimos recomendando aplicar «test and treat» por debajo de la edad de 55 años. Se recomienda, sin embargo, no utilizar la edad como único criterio. En pacientes con riesgo alto de neoplasia gástrica a criterio de su médico (población inmigrante, fumadores, dispepsia de reciente aparición, falta de respuesta al tratamiento antisecretor, etc.) o con presencia de signos o síntomas de alarma, la endoscopia permitirá descartar una neoplasia y realizar un estudio histológico para determinar la infección por H. pylori.
Estos signos o síntomas de alarma serían la pérdida de peso significativa no intencionada, la presencia de vómitos intensos y recurrentes, la disfagia u odinofagia, los signos de sangrado digestivo (anemia, hematemesis o melena), la detección de una masa abdominal palpable y la presencia de ictericia o linfadenopatías.
Las 3 situaciones que han generado más estudios en los últimos años son la erradicación en los pacientes con enfermedad por reflujo gastroesofágico (ERGE), la erradicación en pacientes con gastritis atrófica o metaplasia intestinal y los pacientes con tratamiento continuado con AINE o AAS.
Enfermedad por reflujo gastroesofágico e infección por H. pyloriLos estudios que evalúan la relación entre H. pylori y ERGE son heterogéneos en su diseño y población, con resultados que pueden parecer contradictorios14,15. Se ha demostrado que existe una asociación negativa entre la infección por H. pylori y los síntomas de reflujo gastroesofágico o la esofagitis y también con la presencia de esófago de Barrett y/o adenocarcinoma esofágico. Esta relación, sin embargo, parece observarse únicamente en pacientes diagnosticados de gastritis atrófica16, y la prevalencia de gastritis atrófica en la población europea es muy baja, del 1,8%. Un gran número de estudios prospectivos y metaanálisis han demostrado que la erradicación de H. pylori no incrementa la incidencia de síntomas de reflujo ni de esofagitis, ni tampoco agrava los síntomas preexistentes8,16. Otro factor a tener en cuenta es que, en los enfermos con ERGE e infección por H. pylori, el tratamiento continuado con IBP podría incrementar el riesgo de progresión a atrofia y metaplasia intestinal. Este efecto no parece observarse en pacientes no infectados por H. pylori17.
En conclusión, en nuestro medio, la presencia de ERGE no debería disuadir de tratar la infección por H. pylori. En pacientes jóvenes que previsiblemente deberán recibir tratamiento con IBP a largo plazo es razonable tratar la infección por H. pylori para disminuir el riesgo de progresión a gastritis atrófica o metaplasia intestinal.
Gastritis atrófica y metaplasia intestinalLa gastritis atrófica y especialmente la metaplasia intestinal son lesiones precursoras de cáncer gástrico. Sin embargo, en ausencia de otros factores de riesgo (como, por ejemplo, historia familiar de cáncer gástrico), el de progresión a neoplasia es muy bajo. Hay evidencia de que la erradicación de la infección por H. pylori puede revertir la gastritis atrófica. Hasta ahora se consideraba que la metaplasia intestinal era irreversible, pero es posible que también pueda revertir, si bien a largo plazo y solamente en un subgrupo de pacientes18. En todo caso, la curación de la infección por H. pylori retrasa y disminuye parcialmente el riesgo de progresión a neoplasia gástrica incluso en pacientes a los que se ha resecado una primera neoplasia gástrica.
Una vez erradicada la infección por H. pylori, el riesgo de progresión a neoplasia es muy bajo. Se recomienda, por tanto, tratar la infección por H. pylori en pacientes con gastritis atrófica o metaplasia intestinal. No hay evidencia para recomendar endoscopias periódicas de cribado una vez eliminada la infección de manera sistemática. Sin embargo, no puede descartarse su utilidad en pacientes seleccionados y de muy alto riesgo (metaplasia intestinal extensa en pacientes con antecedentes familiares de neoplasia gástrica, por ejemplo.)
Pacientes con hemorragia digestiva y/o que reciben AINE/AAS y/o anticoagulantesPacientes con hemorragia digestiva por úlcera pépticaSe debe evaluar la presencia de infección por H. pylori en todos los pacientes con hemorragia digestiva alta por úlcera péptica y prescribir tratamiento erradicador en los infectados. La erradicación de H. pylori reduce prácticamente a cero el riesgo de recidiva de la enfermedad ulcerosa y de sus complicaciones. Por lo tanto, una vez confirmada la erradicación y en ausencia de toma de AINE/AAS, se recomienda no mantener tratamiento con IBP19,20. Se aconseja, sin embargo, administrar IBP hasta confirmar la erradicación en los pacientes con úlcera péptica que hayan presentado hemorragia digestiva.
Pacientes con consumo de AINE/AASEl consumo de AINE, AAS y la infección por H. pylori son factores de riesgo independientes de enfermedad ulcerosa y de sus complicaciones. Los anticoagulantes y otros antiagregantes aumentan el riesgo de hemorragia en los pacientes con enfermedad ulcerosa21,22. Los pacientes con antecedentes de úlcera péptica o sus complicaciones tienen un riesgo muy elevado de hemorragia digestiva alta si se tratan con AINE, AAS o los inhibidores de la ciclooxigenasa 2 y se consideran, por tanto, pacientes de alto riesgo gastrointestinal. Otros factores que aumentan también el riesgo de hemorragia digestiva son la edad, el tratamiento con corticoides o la comorbilidad asociada.
Desde un punto de vista práctico hay que evaluar: a) si la erradicación de H. pylori reducirá este riesgo, y b) si el tratamiento con IBP modificará la necesidad de llevar a cabo la erradicación.
- a)
AINE
Pacientes sin antecedente de úlcera péptica o complicaciones (bajo riesgo): la erradicación de H. pylori reduce significativamente el riesgo de úlcera péptica y de hemorragia por úlcera en pacientes que iniciarán el consumo de AINE23,24. La reducción del riesgo se observa solo en pacientes que no han consumido previamente AINE pero no en los que ya reciben tratamiento con estos, en los que no estaría indicado investigar ni tratar la infección25,26. En los 2 grupos estaría indicado un IBP de mantenimiento si el paciente presenta factores de riesgo de complicación gastrointestinal.
Pacientes con antecedente de úlcera péptica o complicaciones (alto riesgo): la erradicación es claramente superior al tratamiento con IBP (12,1 vs. 34%), pero no elimina del todo el riesgo de hemorragia27. Por lo tanto, se recomienda evaluar el diagnóstico de infección por H. pylori y tratamiento en pacientes que inician AINE con antecedentes de enfermedad ulcerosa, además del tratamiento con IBP de mantenimiento. En pacientes que ya están en tratamiento crónico con AINE se recomienda IBP de mantenimiento, pero no es necesario realizar test para H. pylori ni tratamiento. En pacientes con antecedente de hemorragia por úlcera asociada a AINE se recomienda suspender este. Si no se puede, habrá que administrar un inhibidor de la ciclooxigenasa 2 junto con un IBP, independientemente de si se ha erradicado o no H. pylori.
- b)
AAS
La erradicación de H. pylori reduce la hemorragia por úlcera péptica en los pacientes consumidores de AAS28,29. Sin embargo, un metaanálisis reciente señaló que la evidencia no era suficiente para concluir que H. pylori es un factor de riesgo significativo de hemorragia por úlcera péptica en estos pacientes30. Además, un estudio epidemiológico no encontró ni efecto aditivo ni potenciador entre AAS e infección por H. pylori en pacientes con enfermedad ulcerosa31. Con la evidencia actual, no parece necesario aplicar tratamiento erradicador de manera sistemática en pacientes consumidores de AAS.
La erradicación de H. pylori reduce el riesgo de recidiva hemorrágica en los usuarios de AAS con historia previa de hemorragia por enfermedad ulcerosa. En cualquier caso, la evidencia es escasa y se basa en estudios con una muestra pequeña, con un seguimiento corto y en población asiática. Por ello, independientemente de que se realice tratamiento erradicador, se recomienda el uso de IBP de mantenimiento en pacientes tratados con AAS y antecedentes de hemorragia por úlcera previa.
Por tanto, no se recomienda ni prueba diagnóstica ni tratamiento en consumidores de AAS. Se debe indicar IBP en función de la presencia de factores de riesgo gastrointestinal. En el caso de pacientes con antecedente previo de enfermedad ulcerosa se recomienda IBP de mantenimiento.
No hay evidencia de que de la erradicación de H. pylori en consumidores de inhibidores de la ciclooxigenasa 2, otros antiagregantes o anticoagulantes (heparinas, antivitamina K o anticoagulantes de acción directa) reduzca el riesgo de hemorragia. En estos pacientes no se recomienda tratamiento erradicador sistemático22.
Métodos diagnósticosSe recomienda el diagnóstico de la infección por H. pylori antes y después del tratamiento erradicador. Las pruebas no invasivas son más accesibles, mejor toleradas y tienen un coste menor. Ante la presencia de signos o síntomas de alarma, sin embargo, se deben indicar una endoscopia y una biopsia gástrica que permitan realizar el diagnóstico. La elección de la prueba diagnóstica dependerá, por tanto, de su accesibilidad y de las circunstancias clínicas de cada paciente. El rendimiento diagnóstico de las diferentes pruebas se ve afectado por medicamentos como IBP, bismuto y antibióticos.
Pruebas diagnósticas no invasivasEl test del aliento con urea marcada con C13 con administración previa de ácido cítrico es la prueba no invasiva más sensible y específica8,11,32. En nuestro medio, se considera de elección para el diagnóstico de la infección por H. pylori antes y después del tratamiento.
La detección de antígeno en heces es una prueba no invasiva alternativa que se puede utilizar si no se dispone del test del aliento33–37. La detección de antígeno en heces se debe hacer con un método monoclonal y este debería ser validado previamente en la población donde se aplicará. Pese a que globalmente se considera que tiene una sensibilidad y una especificidad comparables a la prueba del aliento, la validación local del test que se utiliza de manera generalizada en la sanidad pública de Cataluña mostró una sensibilidad del 90% y una especificidad del 92%, inferiores incluso a las del test del aliento sin uso de ácido cítrico (sensibilidad 91%, especificidad 99%)38. Esta sensibilidad y especificidad son aceptables para el diagnóstico de la infección previa al tratamiento. Así, con una prevalencia de la infección del 60% en los pacientes con dispepsia, los valores predictivos positivos y negativos son razonablemente buenos. Sin embargo, el test en heces tendrá prestaciones subóptimas en el control postratamiento, donde la prevalencia de la infección será menor del 10% y el valor predictivo de un resultado positivo oscilará alrededor del 50%.
La fiabilidad diagnóstica de la serología es inferior a la de los otros test, varía en función del método utilizado y necesita validación en la población en que se debe utilizar. Su utilidad se ve limitada porque no permite distinguir entre infección actual o exposición previa. Por lo tanto, no se recomienda su uso en la práctica clínica habitual.
Pruebas diagnósticas invasivasSe recomienda la realización de biopsia de antro y cuerpo (2 muestras en cada localización) en el caso de que el paciente requiera una endoscopia. Esta técnica permite detectar la infección con la máxima sensibilidad y especificidad y evaluar la presencia de gastritis atrófica y metaplasia intestinal.
La prueba rápida de la ureasa es una alternativa válida. Su sensibilidad y especificidad son del 90% y del 95 al 100%, respectivamente, por lo que puede considerarse una alternativa aceptable a la histología. Se aconseja tomar al menos 2 muestras (una del antro y otra del cuerpo). Incrementar el número de muestras disminuye la probabilidad de un resultado falso negativo y acelera la obtención del resultado32. Las principales causas de resultados falsos negativos son la presencia de sangre en el estómago, la toma de IBP, antibióticos o sales de bismuto, la gastritis atrófica y la metaplasia intestinal.
Control postratamiento de la infección por H. pyloriSe recomienda confirmar la erradicación después del tratamiento con una prueba del aliento con urea marcada con C13 con la administración previa de ácido cítrico. Esta prueba tiene una alta sensibilidad y especificidad para la confirmación de la erradicación de H. pylori.
La eficacia de la prueba de detección de antígeno en heces postratamiento es subóptima11,33,37. Los tratamientos actuales son muy efectivos (más del 90%; ver más adelante) y la especificidad de la prueba de detección de antígeno que se utiliza en nuestro medio es del 90%. En este contexto, habrá que evaluar y validar otros nuevos test en heces para integrar en la práctica clínica con una especificidad que permita realizar controles postratamiento. Una prueba en heces positiva después del tratamiento tendrá un valor predictivo positivo muy bajo, de alrededor del 50%. Por lo tanto, uno de cada 2 pacientes con una determinación en heces positiva después del tratamiento será un falso positivo. Por ello se recomienda la prueba del aliento con urea marcada con C13 como de elección postratamiento. Si se realiza una determinación de antígenos en heces, ante un resultado positivo después del tratamiento erradicador se recomienda, siempre que sea posible, confirmar la persistencia de la infección mediante una prueba del aliento antes de indicar el tratamiento de segunda línea.
La serología no es una prueba válida para comprobar la erradicación, dado que puede permanecer positiva durante años después de esta.
Uso de IBP, antibióticos o sales de bismuto antes de las técnicas diagnósticasHay que suspender los IBP al menos 2 semanas antes de realizar una prueba diagnóstica de la infección por H. pylori. Los antibióticos y las sales de bismuto también se suspenderán al menos 4 semanas antes de la realización de la prueba.
Los IBP reducen la densidad de la infección por su efecto sobre el pH gástrico. Pueden reducir la sensibilidad de las pruebas diagnósticas y provocar resultados falsos negativos. Esta situación se revierte totalmente 2 semanas después de suspender el tratamiento8,11,32. Los anti-H2 tienen una actividad mínima y el antiácido no tiene actividad frente a H. pylori, por lo que no hay que suspenderlos antes de las pruebas diagnósticas. Se pueden administrar como tratamiento sintomático durante el período en que se suspenden los IBP.
En caso de toma de antibióticos o bismuto, estos deben suspenderse al menos 4 semanas antes de la realización de pruebas diagnósticas. Estos períodos de 4 semanas se consideran también suficientes para volver a detectar la infección si el tratamiento erradicador no ha sido efectivo. Los test realizados entre 8 y 12 semanas después del tratamiento podrían disminuir el número de falsos negativos, aumentando la fiabilidad del control posterradicación. Serían necesarios más estudios para clarificar este punto.
Tratamiento de la infección por H. pyloriTratamiento de primera líneaActualmente, no se recomienda el tratamiento triple clásico con un IBP, claritromicina y amoxicilina, dada la variabilidad de su eficacia, que, en la mayoría de los casos, no llega al 80%. Los 2 tratamientos que se recomiendan como de elección son la terapia cuádruple concomitante durante 14 días o la terapia cuádruple clásica con bismuto durante 10 días (Pylera®).
Ambos tratamientos han demostrado eficacias iguales o superiores al 90% en estudios bien diseñados. La ventaja de la terapia cuádruple clásica con bismuto es que requiere solo 2 fármacos, el IBP y Pylera® (un fármaco que incluye metronidazol, tetraciclina y bismuto en un solo comprimido), y es, por tanto, más fácil de prescribir y explicar (tabla 2). Sus inconvenientes son: a) que la evidencia de su eficacia en nuestro medio es más limitada que la de la cuádruple; b) el precio es moderadamente más caro que el de la cuádruple concomitante, y c) el hecho de que Pylera® ha de administrarse 4 veces al día. Respecto de este último inconveniente, es probable que administrado 3 veces al día con las comidas sea igualmente efectivo, aunque la evidencia actual al respecto es muy limitada39. La terapia cuádruple concomitante, por su parte, se administra 2 veces al día y sus inconvenientes son: a) la duración más larga; b) el hecho de que se tenga que prescribir cada uno de sus componentes por separado hace que sea más difícil de explicar, y c) el elevado número de comprimidos de fármacos diferentes puede dificultar la adherencia terapéutica.
Posología y duración de las terapias recomendadas
| Terapia cuádruple clásica (Pylera®) | |
| IBP a dosis altas/12h | |
| Pylera® 3 cápsulas/6h | 10 días |
| Terapia cuádruple «concomitante» | |
| IBP a dosis altas/12h | |
| Amoxicilina 1g/12h | |
| Claritromicina 500mg/12h | 14 días |
| Metronidazol 500mg/12h | |
| Terapia cuádruple con levofloxacino | |
| IBP a dosis altas/12h | |
| Levofloxacino 500mg/24h | |
| Amoxicilina 1g/12h | 14 días |
| Subcitrato de bismuto (Gastrodenol®) 120mg, 2 comp/12h | |
| Terapia cuádruple con rifabutina | |
| IBP a dosis altas/12h | |
| Rifabutina 150mg/12h | |
| Amoxicilina 1g/12h | 14 días |
| Subcitrato de bismuto (Gastrodenol®) 120mg, 2 comp/12h | |
Los efectos adversos son moderados y parecen similares con ambos tratamientos.
En la situación actual, parece razonable recomendar las 2 al mismo nivel como tratamiento de primera línea.
Se recomienda utilizar un IBP a dosis altas cada 12h, ya que cuanto más intensa es la inhibición ácida, más efectivo es el tratamiento de la infección por H. pylori40. Esomeprazol 40mg cada 12h ofrece la inhibición ácida más potente con un número mínimo de comprimidos. Sin embargo, el coste relativamente elevado (25€ por tratamiento frente a los 4€ del omeprazol 40mg cada 12h) hace que no quede claro que esta pauta sea coste-efectiva –especialmente en tratamientos de primera línea– y que, por tanto, no pueda recomendarse de manera generalizada.
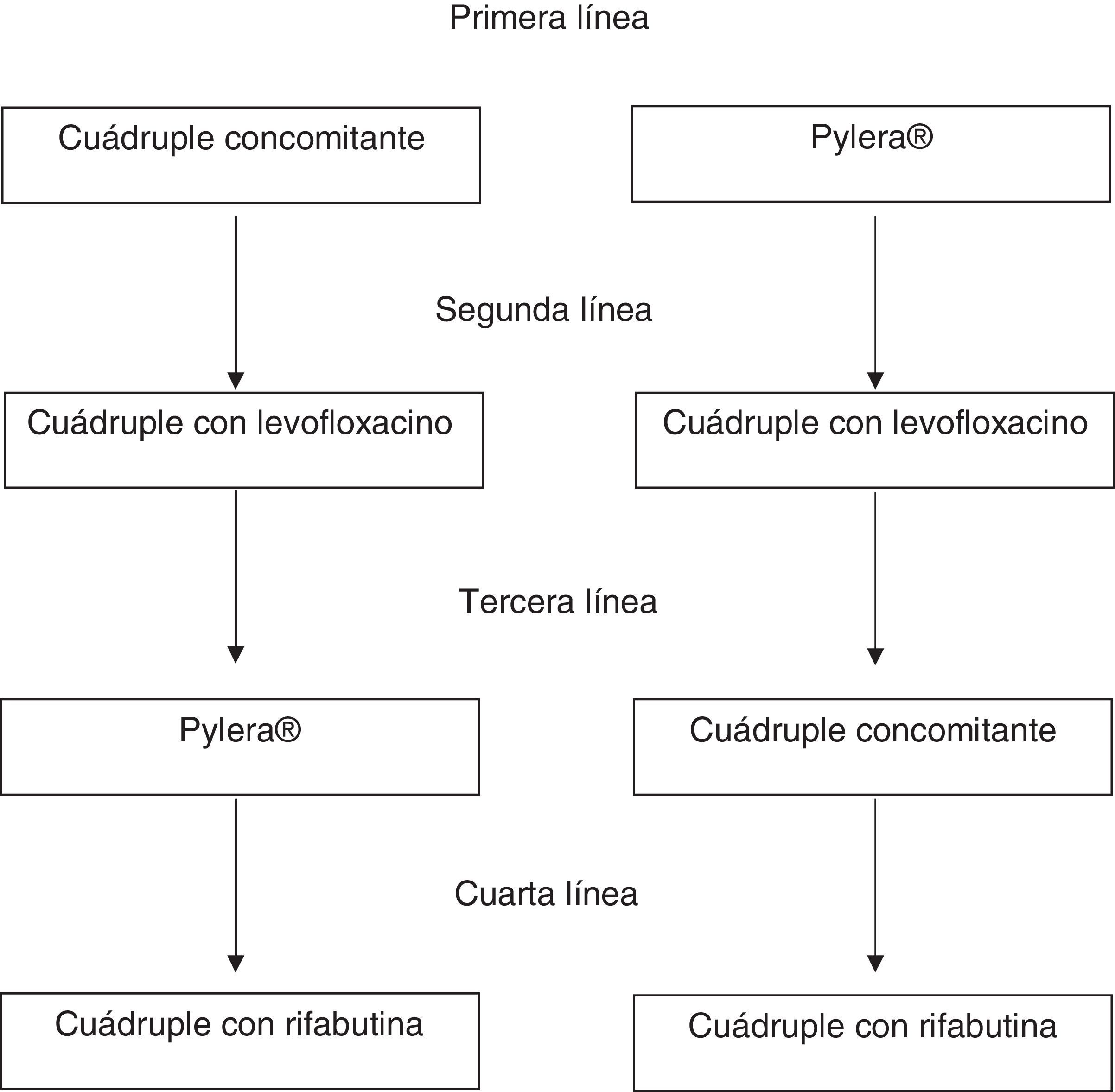
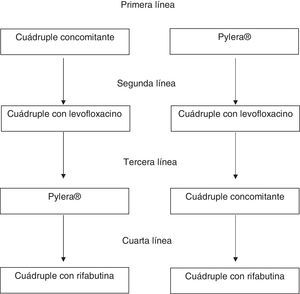
Tratamiento de segunda líneaSe recomienda una pauta cuádruple con IBP a dosis altas, levofloxacino, amoxicilina y bismuto como tratamiento de rescate cuando falla el tratamiento inicial (pauta concomitante o Pylera®) (tabla 2; fig. 1). La terapia triple con un IBP, amoxicilina y levofloxacino obtiene tasas de curación insuficientes, con un 74% de media. Por ello, aunque el número de estudios es limitado, es razonable recomendar una pauta cuádruple con IBP a dosis altas, levofloxacino, amoxicilina y bismuto como tratamiento de rescate cuando falla el tratamiento inicial, sea una pauta concomitante o Pylera® (tabla 2). Un estudio observacional bien diseñado demostró tasas de curación superiores al 90%41. Aunque se trata de un estudio único, los resultados son congruentes con la clara evidencia que muestra que añadiendo bismuto a los tratamientos triples con levofloxacino se mejora su tasa de curación en aproximadamente un 10%42. Una alternativa igualmente eficaz tras el fracaso de la terapia concomitante sería la terapia cuádruple clásica con Pylera® y un IBP a dosis altas.
Tratamiento de rescate tras 2 fracasos de tratamientoDada la alta eficacia de los tratamientos previos, el de rescate debería ser administrado solamente de manera excepcional. Se debe replantear la indicación del tratamiento erradicador y evaluar a fondo la adherencia al tratamiento. Si finalmente se acuerda con el paciente indicar un tercer tratamiento, hay una serie de normas a tener en cuenta:
- a)
No se pueden utilizar ni levofloxacino ni claritromicina si se han usado en tratamientos previos, ya que las cepas que hayan sobrevivido habrán adquirido resistencia a estos antibióticos y el tratamiento de rescate no sería eficaz. En cambio, se puede utilizar metronidazol, dado que se ha observado que un porcentaje alto de pacientes con resistencia in vitro curan la infección siempre que se administren tratamientos de más de 10 días y dosis altas de estos antibióticos.
- b)
En caso de que la terapia inicial fuera la cuádruple concomitante y la segunda la cuádruple con levofloxacino y bismuto, se recomienda utilizar Pylera® de rescate.
- c)
En el caso de que se haya utilizado terapia concomitante de primera línea y Pylera® de segunda se recomienda utilizar una cuádruple con levofloxacino y bismuto. Finalmente, tras el fracaso de Pylera® y una segunda pauta con levofloxacino se puede utilizar cuádruple concomitante o una combinación de IBP a dosis altas, amoxicilina, metronidazol y bismuto.
Después de 3 fracasos de tratamiento se recomienda persistir en el de la infección solo en pacientes con indicación muy clara –úlcera, especialmente con hemorragia o linfoma MALT, por ejemplo– o en pacientes que realmente estén altamente motivados para hacer un cuarto tratamiento tras una información adecuada. Muchos de los pacientes con 3 fracasos (y más con las terapias altamente efectivas que se recomiendan actualmente) presentarán problemas de adherencia al tratamiento. Por tanto, se debe evaluar muy cuidadosamente tanto la adherencia a tratamientos previos como la adherencia esperada a un nuevo tratamiento. La pauta recomendada si se decide hacer tratamiento incluye IBP a dosis altas, amoxicilina, rifabutina y bismuto (tabla 2).
En caso de que el clínico tenga dudas o no se encuentre cómodo con el tratamiento de rescate, debe plantearse enviar a estos pacientes a evaluar a un centro especializado.
Otros aspectos del tratamiento- a)
En la actualidad el cultivo no tiene un papel rutinario en el manejo de la infección en la práctica clínica.
- b)
No se ha evaluado la utilidad de los probióticos como coadyuvantes de las terapias cuádruples y la adición de un quinto fármaco al tratamiento complica la posología y probablemente la adherencia y aumenta el coste. Por tanto, no se recomienda su utilización rutinaria en la práctica clínica.
- c)
En los alérgicos a la penicilina, Pylera® es el tratamiento de elección. En caso de fracaso, se puede utilizar el resto de las pautas recomendadas (excepto, evidentemente, la terapia concomitante) sustituyendo la amoxicilina por metronidazol.
- d)
Se debe advertir al paciente de los posibles efectos secundarios del tratamiento. También se debe advertir específicamente que cuando se toma el bismuto las heces pueden ser de un color oscuro.
Los autores declaran no tener ningún conflicto de intereses.