La asociación entre enfermedad inflamatoria intestinal y colangitis esclerosante primaria debe ser considerada una entidad distinta. Su asociación involucra alteraciones genéticas, epidemiológicas (mayor frecuencia en varones y sin una clara distribución geográfica) y un cuadro clínico en el que destaca con mayor frecuencia un compromiso inflamatorio subclínico, el predominio de colon derecho (demostrado por endoscopia e histología), la presencia de ileítis por reflujo y la ausencia de compromiso rectal. A su vez, existe un mayor riesgo de cáncer de colon y colangiocarcinoma. El objetivo de esta revisión es mostrar como la enfermedad inflamatoria intestinal influye en su evolución, en los requerimientos de trasplante y en la recurrencia. A su vez, señalar la evidencia actual sobre el uso de la terapia biológica en este grupo de pacientes.
The association between inflammatory bowel disease (IBD) and primary sclerosing cholangitis should be considered a distinct clinical entity. This association involves genetic abnormalities, epidemiological factors (more common in men, with no a geographical pattern) and, commonly, subclinical inflammation, predominance of the right colon (endoscopic and histological), backwash ileitis and rectal sparing. Furthermore, there is an increased risk of colorectal cancer and cholangiocarcinoma. The aim of this review is to show how IBD influences the progression of this entity, transplantation requirements and recurrence. We also discuss the current evidence on the use of biological therapy in this group of patients.
La colangitis esclerosante primaria (CEP) se define como una enfermedad hepática crónica colestásica caracterizada por lesiones en el conducto biliar intra y/o extrahepático1. Presenta síntomas progresivos que incluyen fatiga, dolor en hipocondrio derecho y prurito. Puede presentar colestasis (elevación de fosfatasas alcalinas y gammaglutamiltransferasa) que, si persiste en el tiempo, puede llevar a déficit de vitaminas liposolubles, disfunción autonómica y trastornos del sueño. En la histología podemos observar que esta alteración puede generar estenosis fibroesclerótica y destrucción de los conductos biliares2. La progresión conlleva riesgos de cirrosis hepática y desarrollo de colangiocarcinoma (CCA) y/o cáncer colorrectal (CCR)3.
Existe una importante asociación con la enfermedad inflamatoria intestinal (EII), y será esta entidad en la que nos enfocaremos. La CEP en la EII se considera una manifestación extraintestinal4 que incluso puede anteceder al desarrollo de los síntomas gastrointestinales5.
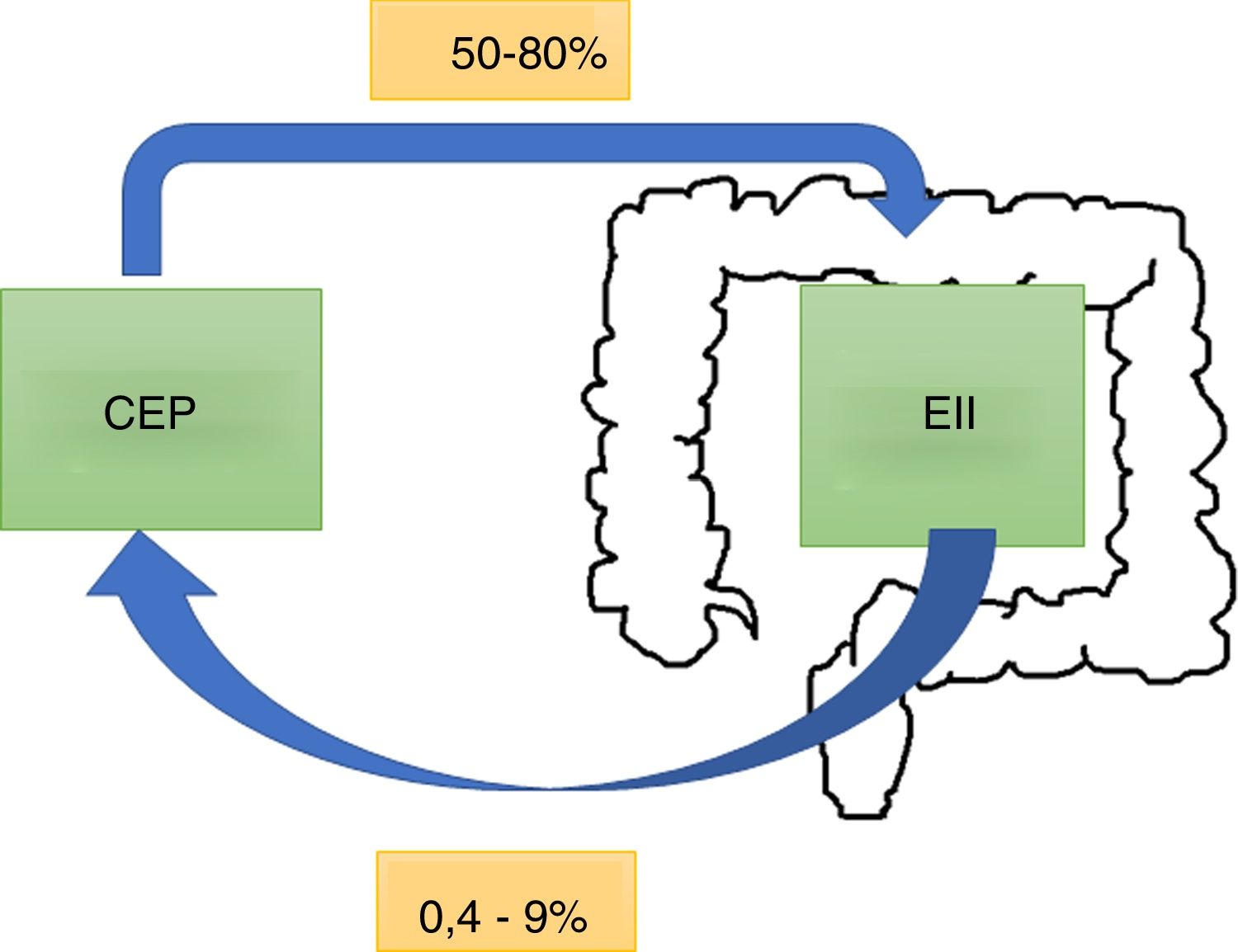
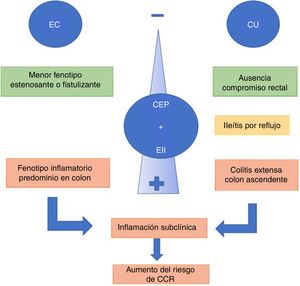
EpidemiologíaLa CEP tiene una incidencia y prevalencia de 0-1,3 por 100.000 por año y 0-16 por 100.000 en Norteamérica y en países del norte de Europa, respectivamente6. Tiende a ser más frecuente en hombres. A nivel mundial, el 50-80% de los pacientes con CEP tienen en forma concomitante una EII7, siendo más común la colitis ulcerosa (CU) que la enfermedad de Crohn (EC) o la EII noclasificable8. Este porcentaje puede variar según los criterios del estudio: si se realiza el diagnóstico en base a síntomas o por resultados de colonoscopias y biopsias9. Por otro lado, del total de pacientes con EII, el 0,8-8% de los pacientes con CU y el 0,4-9% de los que presentaban EC desarrollarán una CEP. En una cohorte chilena de 716 pacientes10 solo el 1,4% presentaron CEP, siendo el 2% para CU, el 1% en EC, y no hubo reporte de casos con EII noclasificable (fig. 1).
En un estudio retrospectivo11 que incluyó 8.231 pacientes con EII se encontraron 222 pacientes con CEP y EII (2,7%). El 40% tenían compromiso de los conductos biliares intrahepáticos y el 58%, compromiso intra y extrahepático. El 8% de los pacientes tenían un compromiso de ducto pequeño (definido por los hallazgos de la biopsia) y menos del 2% tenían un compromiso extrahepático aislado. La CEP se clasifica según como se afecten los conductos biliares (tabla 1).
Clasificación de la colangitis esclerosante primaria (CEP)
| Subtipos | Hallazgos colangiográficos | Hallazgos histológicos |
|---|---|---|
| CEP clásica | Estenosis multifocal intra y extrahepática | Cambios típicos: colangitis no supurativa, fibrosis periductal, reacción ductular y ductupenia |
| CEP intrahepática | Estenosis multifocal intrahepática, dilatación ductal segmentada | Cambios típicos |
| CEP extrahepática | Solo estenosis extrahepática y dilatación ductular proximal | No específico en estadios precoces de la enfermedad |
| CEP de ducto pequeño | Normal | Cambios típicos |
Miard et al.12 incluyeron 390 pacientes con EII sometidos a cirugía intraabdominal relacionada con la enfermedad. Doscientos cincuenta y cinco se sometieron a biopsia hepática, encontrándose 43 casos de CEP. De ellos, el 75,9% (29) tenían alteraciones en el perfil hepático al momento de la cirugía. En el grupo donde no se realizó biopsia (135 pacientes), la CEP se demostró por imágenes en 4 pacientes. Es decir, los que se sometieron a biopsia: la prevalencia de CEP fue del 16,7% vs. el 2,9% del grupo que no se sometió a este procedimiento (p<0,001), porcentaje que es mayor a lo descrito en la literatura.
Probablemente la prevalencia de CEP puede aumentar al usar técnicas con mayor sensibilidad diagnóstica. Es así como Lunder et al.13 encontraron 3 veces más CEP realizando colangiorresonancia a todos los pacientes con EII en control, siendo del 7,5% vs el 2,2% detectado previamente en base al cuadro clínico o la alteración de las pruebas hepáticas. Belle et al.14 mostraron que 1 de cada 10 pacientes con alteraciones de las pruebas hepáticas tendrían CEP. Es decir, el diagnóstico de CEP en EII aumentaría al buscarlo en forma más dirigida7.
PatogeniaSe han identificado más de 22 loci relacionados, la mayoría de ellos ligados a la respuesta inmune, especialmente en el sistema HLA. Los genes HLA B8, DR3 (HLADRB1*0301) y DRw52a15 proporcionarían un riesgo mayor de CEP, mientras otros estarían asociados a un peor pronóstico (DR2 y DR3) o serían protectores (HLA-DR4)16. En relación con la sobreposición genética entre CEP y EII, esta es menor a lo esperado: solo un 5% de los 200 loci identificados en EII se asocian a CEP17. Por otro lado, se ha visto que la asociación genética puede ser distinta según el tipo de EII (siendo en CU y EC r=0,29 y r=0,04, respectivamente), lo que difiere de la correlación entre ambas EII (r=0,56), planteando que la asociación CEP y EII sería una enfermedad distinta18.
Recientemente, un estudio que incluyó 3.402 pacientes con CEP logró identificar una variante genética rs853974 que se asociaría a sobrevida libre de trasplante19. Este gen se expresó tanto en colangiocitos murinos como en células hepáticas estrelladas humanas, actuando en vías que provocarían fibrosis. A pesar de estos hallazgos, los factores genéticos conocidos solo explicarían cerca del 10% de la enfermedad, por lo que existirían factores ambientales de riesgo que explicarían esta fracción desconocida18.
La potencial patogenia inmunomediada se basa en la presencia de varios autoanticuerpos: pANCA en el 30-80%, hipergammaglobulinemia en el 30%, IgM elevada en el 40-50%19. Sin embargo, este factor ha sido cuestionado, dado que existe mayor prevalencia de CEP en varones (al contrario de la mayoría de las enfermedades inmunomediadas), así como por la poca efectividad que tienen los fármacos inmunosupresores y por la falta de un autoanticuerpo específico16.
Dada la asociación que existe con la EII, se han propuesto diferentes hipótesis respecto a la interacción entre hígado e intestino:
- 1.
Aumento de permeabilidad intestinal20. Los componentes centrales de la barrera intestinal son los enterocitos que se encuentran ligados estrechamente por desmosomas y moléculas de adhesión. Esta barrera restringe el movimiento de microorganismos y sustancias desde la luz intestinal y actúa como una línea de defensa. Cuando se compromete por inflamación crónica, habría un aumento de la translocación bacteriana o de los productos bacterianos que irían directamente al sistema portal21, contribuyendo a la respuesta inflamatoria exagerada del colangiocito, generando finalmente que esta inflamación se traduzca en fibrosis o anillos concéntricos conocido como «piel o capas de cebolla»22.
- 2.
Interacción microbioma - ácidos biliares (AB). El hígado se comunica con el intestino mediante una conexión bidireccional y se liberan AB y mediadores bioactivos desde el conducto biliar a la circulación sistémica20. Los AB son moléculas sintetizadas a partir del colesterol en los hepatocitos centrales, son liberados al tracto biliar como glicina o taurina y llegan al duodeno, donde permiten la emulsificación y la absorción de las grasas provenientes de la dieta. Alrededor del 95% son reabsorbidos activamente en el íleon terminal y transportados nuevamente al hígado. El 5% no conjugado es transformado por la microbiota colónica, pasando en forma pasiva a la circulación portal. A su vez, a nivel intestinal se producen metabolitos que irán a la circulación portal; de esta forma el intestino puede influir en la función hepática.
- 3.
Los AB y la microbiota interactúan estrechamente: los primeros ejercen un control directo de la microbiota. La unión a FXR (receptor X farsenoide o NR1H4) lleva a la producción de péptidos antimicrobianos que de forma directa inhiben el sobrecrecimiento bacteriano. Se han detectado AB alterados secundarios a colestasis que generan una disrupción de la actividad enzimática, lo que lleva a una alteración de la microbiota/disbiosis23.
- 4.
Existen genes que generarían una mayor susceptibilidad al daño inducido por el ácido biliar1, destacando los genes que codifican para el receptor de sales biliares a nivel apical TGR5 (también conocido como GPBAR1) y los genes que codifican la enzima fucosiltransferasa2 (FUT2), que genera la estabilización del glicocálix (que protege a los colangiocitos expuestos a estas sales con una concentración 10.000 veces mayor que en otras células). Alteraciones en esos genes podrían relacionarse con una mayor predisposición al daño inducido por AB.
- 5.
Quimiocinas y moléculas de adhesión comunes al intestino e hígado. Linfocitos activados a nivel de la mucosa intestinal inflamada podrían entrar a la circulación enterohepática, que mediante quimiocinas y moléculas de adhesión propias del intestino facilitarían su permanencia a ese nivel. Estas actuarían como células de memoria perpetuando la inflamación18. Hay estudios que sugieren que la vía de la IL-2 se activaría en el desarrollo de la CEP17 mediante el receptor de esta interleucina, promoviendo la cascada inflamatoria mediada de célulasT, la que se evidencia en hígado y colon.
A la fecha, existen varios estudios que han intentado demostrar la contribución de la microbiota en CEP24. Se han encontrado receptores de microorganismos en el colangiocito y la posibilidad de bacteriobilia, bacteremia en el sistema portal, respuesta promisoria con el uso de antibióticos25, incluso respuesta favorable a vancomicina oral en un número pequeño de pacientes refractarios a terapia biológica que tenían CEP y EII26.
El rol de la microbiota en el CEP, ha sido avalado por estudios experimentales en murinos libres de microorganismos Mdr2(-/-) que, aplicando un modelo de toxicidad ácida en la vía biliar, demostraron que habría una mayor agresividad de la enfermedad biliar27. A su vez, se ha evidenciado que la microbiota en pacientes con CEP presenta una menor diversidad28,29. Habría un aumento de algunos subtipos, como Veillonella genus, 4,8 veces más frecuente en la CEP vs. individuos sanos y 7,8 veces en comparación con la CU. Es decir, la condición del microbioma de estos pacientes tiene que ver con la enfermedad hepática más que con la enfermedad inflamatoria30. Bajer et al.31 han demostrado recientemente que la CEP y la CU se asociaban a disbiosis y se caracterizaban por una reducción de la diversidad bacteriana, con cambio en su composición. Es así como Rothia, Enterococcus, Streptococcus y Veillonella aumentaban en todos los pacientes con CEP independientemente de si tenían o no EII, con disminución de Adlercreutzia equolifaciens y Prevotella copri. La disminución de Phascolarctobacterium se asoció a inflamación colónica independiente del subtipo de EII.
Los cambios en la microbiota parecen ser diferentes según los subtipos de EII. Sin embargo, hay que ser precavidos en la interpretación de estos datos, puesto que los estudios incluyen números limitados de pacientes y se dispone de datos de diagnósticos previamente conocidos, por lo que no sabemos si son cambios primarios o no.
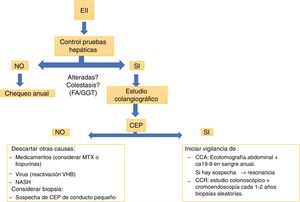
Escenarios clínicosLa mayoría de los pacientes con CEP se encuentran asintomáticos al diagnóstico y tienen posteriormente un curso progresivo32. En caso de síntomas, la astenia y el prurito son los más frecuentes. Durante el curso de la enfermedad el 10-15% de los pacientes pueden desarrollar un cuadro de colangitis33. Dentro del laboratorio destaca la elevación persistente de las fosfatasas alcalinas y de la gammaglutamiltranspeptidasa.
La colangiorresonancia es casi tan sensible como la colangiografía retrógrada endoscópica (ERCP) y conlleva menor riesgo, por lo que sería la primera prueba indicada si se sospecha una CEP. La ERCP puede ser necesaria para valorar estenosis en la búsqueda de un posible CCA, permitiendo la toma de muestras de citología. Nuevas técnicas, como el Spyglass34,35, pueden ser útiles en pacientes seleccionados. La biopsia hepática no siempre es requerida para el diagnóstico de CEP; una excepción es la sospecha de CEP en el contexto de EII con alteraciones de las pruebas hepáticas con estudio colangiográfico normal. Estos pacientes pueden tener una variante de CEP de conducto pequeño36.
Siempre que se diagnostique esta patología debe hacerse una colonoscopia que debe acompañarse de biopsias de íleon y de los diversos segmentos de colon, aunque la mucosa sea macroscópicamente normal.
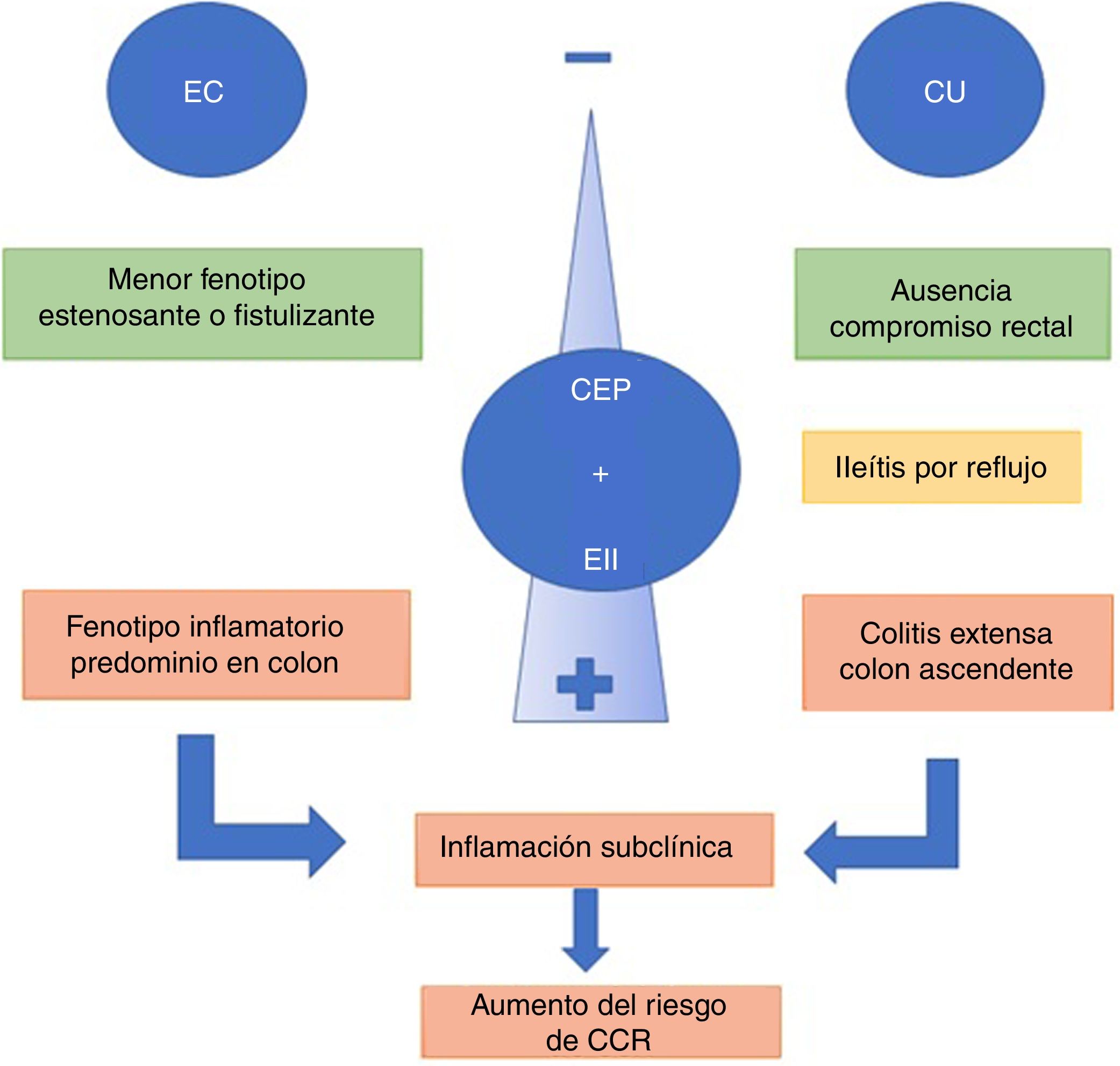
La presencia de CEP y EII se asocia con un fenotipo de EII distinto37. Los pacientes con CU y CEP tienden a presentar cuadros de colitis extensa, backwash ileítis o ileítis por reflujo y preservación de mucosa rectal (sin inflamación) en comparación con pacientes con EII sin CEP9. Recientemente, una revisión comparó CU y CEP vs CU extensa sin CEP, mostrando que pacientes con CEP y CU clínicamente asintomáticos presentaban mayor actividad histológica en el colon derecho y menor en el recto38.
La ileítis por reflujo es la inflamación de íleon por una disfunción de la válvula ileocecal, situación que se ve con mayor frecuencia en CU extensa. De Vries et al.37 reportaron ileítis por reflujo en el 16,7% de los pacientes con CEP y CU vs. el 2,5% en los que solo presentaban EII (fig. 2).
Cuando la CEP se asocia a EC, el curso de la EII tiende a ser más benigno. El fenotipo predominante es el tipo inflamatorio de colon, que puede o no tener compromiso de íleon terminal. Los fenotipos estenosante o fistulizante son menos frecuentes6. Sin embargo, esta asociación no debe considerarse inofensiva. En un centro terciario, O’Toole et al.39 evidenciaron que pacientes con EII menores de 65años, presentaron una mayor mortalidad comparado con la población general, y se consideró la CEP como un factor independiente de mortalidad tras el análisis multivariado. La mortalidad asociada a CEP fue en 9/58 pacientes (16%), siendo significativa tanto en EC y como en CU (p=0,003 y p=0,03, respectivamente).
Colangitis esclerosante primaria y cáncerLa CEP aumenta el riesgo de desarrollar neoplasias. El posibilidad de CCA tras 10años desde el diagnóstico de CEP es del 9%40. Un estudio retrospectivo de la Clínica Mayo41, que incluyó 399 pacientes con CEP y EII, mostró que tras 10años del diagnóstico existe un 33% más de riesgo de desarrollar CCA. Este riesgo no se modifica si el paciente requiere de una colectomía. La mayor estimación de riesgo de cáncer hepatobiliar en CEP proviene de un estudio multicéntrico internacional37 con un total de 7.121 pacientes en 37 países, donde la prevalencia fue del 10%, siendo el CCA el más prevalente, con 594 casos. Este riesgo es mayor si se asocia a EII42. La recomendación de la ECCO43 es realizar chequeo anual con ecografía abdominal y determinación de CA19-9 en sangre y, si hay sospecha, realizar un estudio más dirigido, con resonancia o tomografía.
Los pacientes con EII tienen un incremento significativo de desarrollar CCR, dado principalmente por el efecto pro-neoplásico secundario a la inflamación crónica intestinal44. A su vez, el riesgo relativo de desarrollar CCR está incrementado en pacientes con EII y CEP en comparación con la EII sola (OR4,79; IC95%: 3,58-6,41). Este riesgo permanece incluso si el paciente se somete a un trasplante hepático45. Miard et al12, mediante un análisis multivariado, demostraron que la CEP incrementa el riesgo de CCR con un OR2,51 (1,01-5,8), al igual que la colitis extensa, con OR2,71. En un estudio comparativo46 de 273 pacientes con CEP (223CU y 50EC) se pudo establecer que los pacientes con CU tenían un riesgo un 56% mayor de desarrollar CCR en comparación con la EC.
En una revisión sistemática45 se estableció que el riesgo de desarrollar CCR era de 3,24 (IC95%: 2,14-4,90) en pacientes con CEP y EII vs. EII sin CEP. Además de la actividad inflamatoria, la absorción de AB reducida por la colestasis llevaría a un aumento de estos a nivel del colon proximal, provocando inestabilidad genómica por radicales libres, lo que dañaría en forma directa el ADN. Aún no se ha establecido cuál sería el intervalo entre el diagnóstico de EII y el desarrollo de displasia y CCR37. Sin embargo, la presencia de displasia47 de bajo grado en pacientes con CEP y EII se asocia en el plazo de un año a un 30% de probabilidad de desarrollar displasia de alto grado o CCR propiamente tal. Estos pacientes deberían ser vigilados de una manera más estrecha, valorando incluso la opción de colectomía, ya que en la pieza anatómica se ha descrito la presencia de lesiones más avanzadas o multifocales48.
En todo paciente con diagnóstico de CEP, dada su alta asociación a CCR y EII, se debe realizar estudio colonoscópico, probablemente con cromoendoscopia49, en forma precoz. Si esta es normal, se debe repetir el procedimiento endoscópico según factores de riesgo para CCR50, y en 5años en caso de no presentar EII en ese estudio37. Si estas dos enfermedades están presentes, se debe realizar estudio colonoscópico anual idealmente con cromoendoscopia y biopsias aleatorias.
Impacto de la terapia biológica y de las moléculas pequeñas en la colangitis esclerosante primariaLa terapia biológica ha significado un gran avance en el tratamiento de las EII. La FDA y la EMA han aprobado, para el tratamiento de la EC y CU moderada-grave, infliximab (IFX) y adalimumab (ADA), ambos anticuerpos monoclonales anti-TNFalfa, y vedolizumab (VDZ), anticuerpo monoclonal IgG1 anti-integrina. Otras terapias, en cambio, se han aprobado para tipos específicos de EII; así, en la EC se ha autorizado el uso de certolizumab y ustekinumab, y en el caso de CU, golimumab51. Recientemente tofacitinib52, una molécula pequeña oral que inhibe las Jak quinasas, ha mostrado ser efectivo en la inducción y el mantenimiento de la remisión en CU.
Niveles séricos elevados de factor de necrosis tumoral alfa han sido descritos en pacientes con EII y CEP. Sin embargo, los estudios han fracasado en demostrar un efecto de IFX53,54 o ADA en la inflamación de los conductos biliares, mientras ADA solo disminuiría los niveles de fosfatasas alcalinas55. Esta disminución se relacionaría con una producción no hepática (ósea), ya que algunos estudios han mostrado que el factor de necrosis tumoral puede aumentar los niveles de fosfatasas alcalinas en condrocitos humanos56.
Como hemos mencionado anteriormente, la patogénesis de la CEP no está aún completamente aclarada, y una de las hipótesis planteadas es el rol de la migración de linfocitos activados de la mucosa intestinal hacia el hígado, provocando la fibrosis y la inflamación focal en los conductos biliares57. Vedolizumab, mediante la inhibición de la integrina α4β7, podría tener un rol en la evolución la CEP en pacientes con EII. Sin embargo, los estudios han demostrado que este fármaco no tiene mayor incidencia en la evolución de la fibrosis y la estenosis a nivel de los conductos biliares53,58.
Aunque no existe contraindicación para el uso de golimumab, ustekinumab y tofacitinib en pacientes con EII y CEP, faltan estudios que confirmen su efectividad en la evolución de la CEP.
Uno de los aspectos que preocupa es el posible aumento de infecciones que conllevaría la asociación de inmunosupresión postrasplante con la terapia biológica. Recientemente, una revisión sistematica59 que incluyó pacientes en terapia biológica que se sometieron a trasplante vs. no trasplantados demostró que no hubo diferencia significativa entre los dos grupos (p=0,886). A la fecha no hay ensayos clínicos aleatorizados que evalúen la inmunosupresión propia del trasplante asociada al tratamiento biológico.
Colectomía en la colangitis esclerosante primaria y enfermedad inflamatoria intestinalLas indicaciones de colectomía son variadas, siendo la actividad grave no controlada por terapia farmacológica o la presencia de una neoplasia las causas más frecuentes. En una revisión retrospectiva de 100 pacientes con CEP y EII sometidos a proctocolectomía con IPAA no se encontró ningún factor de riesgo de mortalidad, incluyendo el tipo de inmunosupresión utilizado53. Si bien la morbilidad a 30días fue cercana al 50%, menos del 20% requirieron reintervención, siendo el único factor de riesgo el antecedente de cirugía previa (p=0,03). Por otra parte, una revisión sistemática43 evidenció que la colectomía pre o peritrasplante tendría un rol protector de CEP. Otros han demostrado que pacientes con reservorio tendrían una mayor probabilidad de pérdida del injerto en comparación con quienes tuvieron una ileostomía terminal (2,8 vs. 0,4 por 100 pacientes año, p=0,005)60. Las principales causas de pérdida del injerto serían la trombosis de la arteria hepática y el desarrollo de estenosis biliares. Sin embargo, se requieren estudios de mayor calidad para poder recomendar una colectomía en forma rutinaria a pacientes con EII y CEP que necesiten trasplante hepático.
¿Mejora la colectomía la evolución de la colangitis esclerosante primaria?En un estudio retrospectivo que incluyó 2.594 pacientes con CEP y EII se evidenció que pacientes con EII sometidos a colectomía previo al diagnóstico de CEP tuvieron una disminución del riesgo en un 29% de fallecer o requerir trasplante hepático por CEP53. En el análisis multivariado la incidencia de trasplante hepático en pacientes sin colectomía tras 10años de seguimiento fue del 33% vs. el 25% en los que tienen colectomía previa (p=0,01).
Reservorio en colangitis esclerosante primaria y enfermedad inflamatoria intestinalEste sería un grupo con un fenotipo diferente al compararlo con pacientes con EII sin CEP. Estos pacientes presentarían un mayor riesgo de reservoritis crónica y de inflamación a nivel del asa de íleon aferente y del cuerpo del reservorio61. Dado el mayor riesgo de neoplasia a nivel del reservorio, estos pacientes requieren ingresar en un programa de vigilancia endoscópica. En este grupo de pacientes la reservorioscopia debería ser realizada cada 1 a 3 años62.
Colangitis esclerosante primaria y enfermedad inflamatoria intestinal: ¿cuándo se requerirá un trasplante hepático?Un estudio que incluyó 96 pacientes con CEP-CU63 mostró que los que requerían trasplante con mayor frecuencia tenían una EII silente, con menor número de crisis y necesidad de inmunosupresores. En contraste, los que no necesitaron trasplante presentaron una mayor necesidad de cirugía intestinal y mayor incidencia de CCR. Estos datos sugieren que la severidad de la CEP podría tener un efecto protector en la actividad de la CU.
En pacientes con EII y CEP la indicación de trasplante hepático se basa en la presencia de insuficiencia hepática, episodios de colangitis recurrente, prurito intratable o CCA (en casos muy seleccionados)64,65.
Colangitis esclerosante primaria y enfermedad inflamatoria intestinal postrasplante hepáticoHay evidencias contradictorias respecto a la actividad de la EII postrasplante. Algunos estudios señalan que al menos en el 30% de estos pacientes la actividad inflamatoria intestinal empeoraría, con un aumento en la actividad endoscópica e histológica66,67. Otros, por otra parte, han demostrado que la EII podría incluso regresar. Fattahi et al.68 evidenciaron que en 152 pacientes con CEP y EII que se sometieron a trasplante hepático hubo 24 (15,8%) en que la actividad inflamatoria no cambió, en 119 (78,3%) disminuyó y en 9 (5,9%) se incrementó. Al realizar el análisis multivariado encontraron que el uso de ciclosporina (OR0,14; IC95%: 0,015-0,79) y el peso del paciente pretrasplante (OR0,81; IC95%: 0,71-0,93) tendrían un efecto protector.
A su vez, la EII de novo (la que se desarrolla postrasplante) es 10 veces más frecuente en pacientes trasplantados por CEP vs. la población general, teniendo un riesgo del 10-11% a los 5años y del 14-30% a los 10años. La EII de novo no solo se asocia a trasplantados post-CEP, sino que también se han descrito casos postrasplantes renales, cardiacos o de células hematopoyéticas69. Las teorías que podrían explicar este riesgo son la pérdida del efecto protector de las sales biliares o secundario a la inmunosupresión, en especial por uso de tacrolimus70.
Sin embargo, la búsqueda de un diagnóstico diferencial al cuadro diarreico es fundamental71, considerando infecciones, fármacos (micofenolato) y sobrecrecimiento bacteriano. Dentro del estudio se debe realizar PCR para enteropatógenos (que incluye bacterias, virus y parásitos), incluyendo Clostridium difficile, parámetros inflamatorios como hemograma y PCR, asociado a un estudio colonoscópico con biopsias.
¿Qué pasa con la terapia inmunosupresora?Inicialmente la inmunosupresión de preferencia era azatioprina72 asociada con otro inmunosupresor. Sin embargo, en la actualidad los inmunosupresores más utilizados son tacrolimus (que ejerce una fuerte supresión de las célulasT productoras de IL-2 impidiendo la respuesta regulatoria por esa vía45) y ciclosporinaA73. En relación a este último fármaco, se ha sugerido que la ciclosporinaA tendría dos veces más riesgo de recurrencia, aunque esto no fue concluyente en el análisis multivariado74.
Rechazo postrasplanteEl manejo de la EII en los pacientes con trasplante hepático representa un desafío terapéutico debido a los brotes intercurrentes o por eventuales comorbilidades asociadas (especialmente infecciones) y efectos contradictorios entre terapia inmunomoduladora dirigida al rechazo y otras dirigidas a la prevención de la actividad de la EII64.
Los pacientes con CEP y EII tienen un mayor riesgo de presentar rechazo celular agudo tras el trasplante23. Se ha establecido que la inmunosupresión llevaría a una disminución de la inmunovigilancia y el riesgo sería mayor si al momento del trasplante la EII se encuentra activa, existe un corto intervalo desde los síntomas de EII hasta el trasplante, la presencia de CMV en el órgano donante, infección aguda por CMV o tabaquismo activo75. Sin embargo, se debe considerar que los resultados provienen de reporte de casos y estudios de caso-control, siendo necesarios estudios de mayor calidad para poder establecer este riesgo.
Recurrencia de colangitis esclerosante primaria postrasplanteSe ha establecido que tras 10años del trasplante la CEP puede recurrir en el 30-50% de los pacientes76, siendo mayor en los que presentan una EII asociada67. Este riesgo sería mayor en pacientes que presentan una actividad inflamatoria intestinal, poniendo en evidencia la necesidad de lograr objetivos de curación endoscópica. Recientemente, Lindstrom et al.77 establecieron que la realización de una colectomía pre o peri-trasplante disminuiría en aproximadamente un 20% el riesgo de recurrencia de CEP.
ConclusiónLa CEP se asocia a EII en un 50-80%. Estas dos entidades comparten cierta susceptibilidad genética, algunos autoanticuerpos y vías bidireccionales mediante el eje intestino-hígado, que perpetuaría la inflamación.
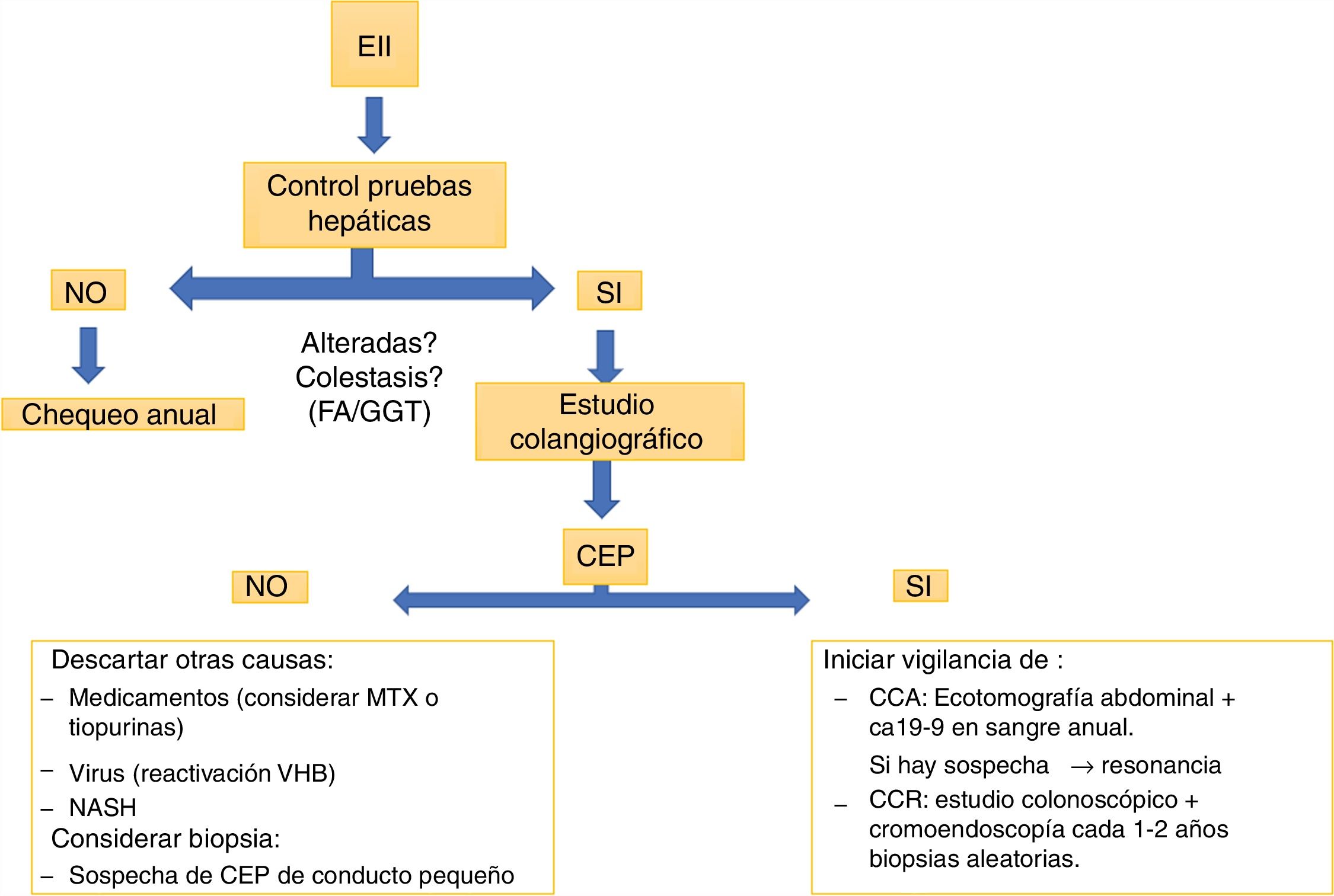
La búsqueda de EII en pacientes con CEP debe hacerse de manera rutinaria. Cuando estamos frente a pacientes con EII la pesquisa de CEP debería hacerse al menos cuando existen alteraciones en las pruebas de función hepática (fig. 3) Las implicaciones clínicas se relacionan con el hallazgo endoscópico/fenotipo con una extensión de la enfermedad de predominio de colon derecho, ileítis por reflujo y una preservación del recto, con una presentación clínica menos sintomática. Sin embargo, la histología evidenciaría una mayor actividad a la reportada por la clínica, condicionando un mayor riesgo de CCR.
Resulta fundamental poder evaluar si con la supresión de la inflamación colónica a través de la optimización de la terapia de la EII se podrá cambiar el curso natural de la CEP, teniendo en consideración que la CEP puede recurrir incluso postrasplante, haciendo que esta enfermedad no tenga un tratamiento curativo. A su vez, si este mismo control de la inflamación permitirá disminuir los casos de CCR asociados. Sin duda, se requieren más estudios para generar una recomendación.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.