Definir criterios clínicos de cribado de espondiloartritis (SpA) en pacientes con enfermedad inflamatoria intestinal (EII) y viceversa, que sirvan de referencia en la derivación entre Reumatología y Aparato Digestivo.
Material y métodosRevisión sistemática de la literatura y Delphi a dos rondas. Formaron parte del comité científico 2 reumatólogos y 2 digestólogos; del panel de expertos, 7 reumatólogos y 7 digestólogos. El comité científico definió los componentes potenciales de los criterios, teniendo en cuenta aspectos de sensibilidad, especificidad, facilidad de uso y estandarización. A continuación, se realizó el Delphi. Aquellos ítems para los que hubo acuerdo en primera o segunda ronda formaron parte de la versión final de los criterios.
ResultadosCribado positivo de SpA si se cumple al menos uno de los siguientes: dolor lumbar crónico con inicio antes de los 45 años; dolor lumbar inflamatorio o dolor alternante en nalgas; HLA-B27 positivo; sacroilitis en pruebas de imagen; artritis; entesitis del talón; dactilitis. Cribado positivo de EII si uno de los criterios mayores o al menos dos de los menores. Mayores: rectorragia; diarrea crónica de características orgánicas; enfermedad perianal. Menores: dolor abdominal crónico; anemia ferropénica o ferropenia; manifestaciones extraintestinales; fiebre o febrícula, sin focalidad aparente y de más de una semana de duración; pérdida de peso no explicable; antecedentes familiares de EII.
ConclusionesSe han definido criterios de cribado de EII en pacientes con SpA y viceversa. Estos han de ser de utilidad en la detección precoz de dichas patologías.
To define clinical screening criteria for spondyloarthritis (SpA) in patients with inflammatory bowel disease (IBD) and vice versa, which can be used as a reference for referring them to the rheumatology or gastroenterology service.
MethodSystematic literature review and a two-round Delphi method. The scientific committee and the expert panel were comprised of 2 rheumatologists and 2 gastroenterologists, and 7 rheumatologists and 7 gastroenterologists, respectively. The scientific committee defined the initial version of the criteria, taking into account sensitivity, specificity, standardization and ease of application. Afterwards, members of the expert panel assessed each item in a two-round Delphi survey. Items that met agreement in the first or second round were included in the final version of the criteria.
ResultsPositive screening for SpA if at least one of the following is present: onset of chronic low back pain before 45 years of age; inflammatory low back pain or alternating buttock pain; HLA-B27 positivity; sacroiliitis on imaging; arthritis; heel enthesitis; dactylitis. Positive screening for IBD in the presence of one of the major criteria or at least two minor criteria. Major: rectal bleeding; chronic diarrhea with organic characteristics; perianal disease. Minor: chronic abdominal pain; iron deficiency anemia or iron deficiency; extraintestinal manifestations; fever or low grade fever, of unknown origin and duration >1week; unexplained weight loss; family history of IBD.
ConclusionScreening criteria for IBD in patients with SpA, and vice versa, have been developed. These criteria will be useful for early detection of both diseases.
Los síntomas músculo-esqueléticos son las manifestaciones extraintestinales más frecuentes asociadas a enfermedad inflamatoria intestinal (EII). Los pacientes con EII con frecuencia desarrollan espondiloartritis (SpA). De acuerdo con un metaanálisis publicado en 2016, la prevalencia de artritis periférica está en torno al 13%; de sacroilitis, en torno al 10%, y de espondilitis anquilosante, al 3%1.
En una cohorte de 269 pacientes con EII evaluados por dolor articular, el 50,5% fue diagnosticado de SpA; se observó un retraso diagnóstico medio de 5,2 años2.
En otro estudio en 122 pacientes con EII la prevalencia de SpA fue del 28,7%, de los que el 45,7% no estaba diagnosticado previamente, a pesar de los antecedentes de dolor lumbar inflamatorio y/o artritis periférica3.
Por otro lado, según los datos de un metaanálisis publicado en 2015, la prevalencia de EII en espondilitis anquilosante es del 6,8%4. Asimismo, aunque en menor número, los estudios apuntan a una asociación entre la artritis psoriásica y la aparición de EII5–7.
Aunque de menor magnitud que en la SpA, existe también un retraso diagnóstico en el caso de la EII. En una serie de 1.591 pacientes con EII, en el 25% de los casos superaba los 2 años para la enfermedad de Crohn (EC) y un año para la colitis ulcerosa (CU)8. En otra serie de 1.196 pacientes, estos tiempos fueron de 18 meses para la EC y de 3 meses para la CU9.
Tanto para la SpA como para la EII, es muy importante evitar el retraso diagnóstico, ya que esto se asocia a un peor curso clínico y una peor respuesta al tratamiento10–13.
En la actualidad, no existen herramientas orientadas a facilitar un diagnóstico precoz de SpA en pacientes con EII, y viceversa, que estén adaptadas al contexto sanitario español. El objetivo de este trabajo fue definir criterios clínicos de cribado de SpA en pacientes con EII y a la inversa, que sirvan de referencia en la derivación entre los servicios de Reumatología y Aparato Digestivo para la detección precoz de estas patologías.
Material y métodosDiseño generalRevisión sistemática de la literatura y consenso mediante método Delphi a 2 rondas.
Elección del comité científico y miembros del panelPara la elección se valoró la experiencia (tanto clínica como investigadora) de los candidatos en relación con el tema del proyecto, así como su currículum investigador (publicaciones de los últimos 5 años y participación en proyectos de investigación). En el caso de los integrantes del comité científico, se valoraron también su actitud y cualidades personales para el trabajo en grupo. Para la elección de panelistas también se valoraron el criterio de representatividad geográfica del territorio español y el tipo de hospital (hospitales de nivel 1 o básicos, hospitales de nivel 2 o de referencia y hospitales de nivel 3 o de alta tecnología).
El comité científico ha estado formado por 2 reumatólogos y 2 digestólogos. Por su parte, los componentes del panel de expertos han sido 7 reumatólogos y 7 digestólogos.
Revisión de la literaturaSe llevaron a cabo 2 revisiones sistemáticas de la literatura, una de ellas centrada en herramientas de cribado o criterios de derivación por sospecha de EII al digestólogo, la otra centrada en herramientas de cribado o criterios de derivación por sospecha de SpA (excepto artritis psoriásica) al reumatólogo. Ambas se limitaron a población mayor de 18 años. Las búsquedas (anexo 1) se realizaron en Pubmed, Embase y Cochrane Library, e incluyen trabajos en español e inglés publicados hasta enero de 2016.
Definición de los criterios de cribadoCon los resultados obtenidos en la fase de revisión sistemática y considerando su experiencia, los miembros del comité científico definieron los componentes potenciales de los criterios de cribado. Para ello se tuvieron en cuenta criterios de sensibilidad, especificidad, facilidad de uso en la práctica clínica habitual y estandarización (buscando que la variabilidad en su aplicación sea lo menor posible).
A continuación, se puso en marcha la metodología Delphi a 2 rondas. Los panelistas seleccionados valoraron la propuesta de criterios a través de un formato electrónico. Previamente se facilitaron a los panelistas los informes de revisión sistemática de la literatura. Las puntuaciones a cada criterio se recogieron de acuerdo con la siguiente escala: 1 = desacuerdo absoluto; 2 = desacuerdo moderado; 3=ni de acuerdo ni en desacuerdo; 4 = acuerdo moderado, y 5 = acuerdo absoluto.
Para cada uno de los criterios, los panelistas pudieron realizar comentarios en los que recoger cambios que se considerasen pertinentes en la redacción del enunciado, argumentos que explicasen su valoración si lo consideraban necesario o evidencia adicional (no recogida en los informes de revisión sistemática) que apoyase su puntuación. Asimismo, los panelistas pudieron proponer criterios adicionales.
Tras el análisis de los resultados de esta primera ronda Delphi, el comité científico valoró los criterios para los que no hubo consenso, así como las propuestas de criterios adicionales. A continuación, se elaboró un segundo documento en el que se recogieron los criterios para los que no se había alcanzado consenso en primera ronda, junto con las modificaciones realizadas por el comité científico de acuerdo con los comentarios y criterios propuestos. Se incluyeron también las puntuaciones y los comentarios de los panelistas en primera ronda para los criterios sin consenso, así como la respuesta del comité científico a dichos comentarios.
En segunda ronda, se envió este documento a los panelistas, que valoraron de nuevo los criterios para los que no se había alcanzado consenso conociendo el resultado de la primera ronda, de manera que pudieron contrastar su puntuación inicial con la del resto de panelistas y las consideraciones del comité científico. Las valoraciones se realizaron de acuerdo con la misma escala empleada en primera ronda.
Durante todo el proceso Delphi se mantuvo el anonimato de los participantes.
Análisis de los resultados del DelphiSe definió el grado de acuerdo para cada ítem como el porcentaje de panelistas que valoraron con puntuación ≥ 4 y el grado de desacuerdo como el porcentaje de puntuaciones ≤ 2.
Se emplearon los siguientes umbrales para definir consenso:
- –
Acuerdo: puntuación ≥ 4 por al menos el 75% de los panelistas.
- –
Desacuerdo: puntuación ≤ 2 por al menos el 75% de los panelistas.
Aquellos ítems para los que hubo acuerdo en primera o segunda ronda del Delphi formaron parte de la versión final de los criterios de cribado.
ResultadosLas versiones iniciales de los criterios de cribado definidas por el comité científico se recogen en las figuras 1 y 2.
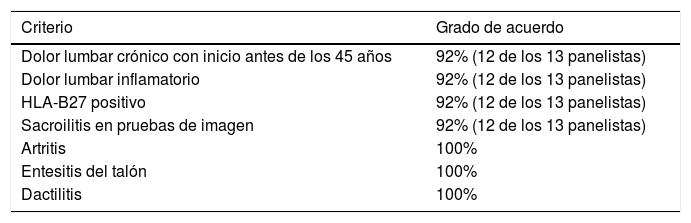
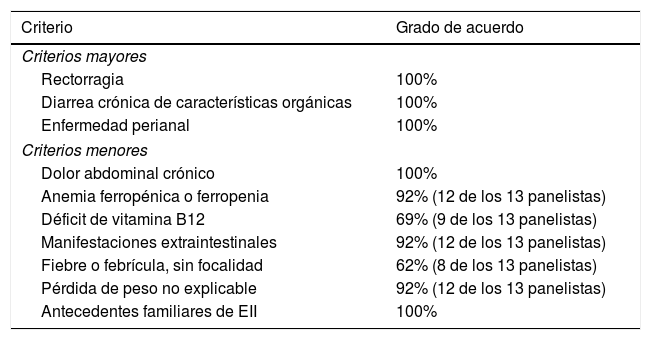
Resultados de la primera ronda del DelphiSe recogió la valoración de trece panelistas. Las tablas 1 y 2 muestran el grado de acuerdo alcanzado para cada ítem propuesto por el comité científico.
Criterios de cribado de SpA en pacientes con EII. Grado de acuerdo
| Criterio | Grado de acuerdo |
|---|---|
| Dolor lumbar crónico con inicio antes de los 45 años | 92% (12 de los 13 panelistas) |
| Dolor lumbar inflamatorio | 92% (12 de los 13 panelistas) |
| HLA-B27 positivo | 92% (12 de los 13 panelistas) |
| Sacroilitis en pruebas de imagen | 92% (12 de los 13 panelistas) |
| Artritis | 100% |
| Entesitis del talón | 100% |
| Dactilitis | 100% |
EII: enfermedad inflamatoria intestinal; SpA: espondiloartritis.
Criterios de cribado de EII en pacientes con SpA. Grado de acuerdo
| Criterio | Grado de acuerdo |
|---|---|
| Criterios mayores | |
| Rectorragia | 100% |
| Diarrea crónica de características orgánicas | 100% |
| Enfermedad perianal | 100% |
| Criterios menores | |
| Dolor abdominal crónico | 100% |
| Anemia ferropénica o ferropenia | 92% (12 de los 13 panelistas) |
| Déficit de vitamina B12 | 69% (9 de los 13 panelistas) |
| Manifestaciones extraintestinales | 92% (12 de los 13 panelistas) |
| Fiebre o febrícula, sin focalidad | 62% (8 de los 13 panelistas) |
| Pérdida de peso no explicable | 92% (12 de los 13 panelistas) |
| Antecedentes familiares de EII | 100% |
EII: enfermedad inflamatoria intestinal; SpA: espondiloartritis.
Para el cribado de EII, 4 de los panelistas propusieron incluir la calprotectina, un panelista consideró necesario incluir la edad de inicio de los síntomas y otro propuso incluir la presencia de moco en las heces como criterio menor.
En cuanto al cribado de SpA, se recogieron las siguientes propuestas de inclusión de criterios (cada una de ellas sugerida por un panelista): rigidez matutina mayor de una hora en eje axial; rigidez matinal superior a 30 min en caso de que haya síntomas articulares axiales o periféricos; presencia de uveítis actual o pasada; dolor articular de al menos 3 meses de duración, con inicio antes de los 45 años, y, finalmente, dolor alternante en nalgas.
El comité científico, tras valorar los criterios para los que no se alcanzó acuerdo (grado de acuerdo menor del 75%) y los comentarios de los panelistas, consideró:
- –
No hacer modificaciones en el criterio relativo al déficit de vitamina B12.
- –
Modificar el criterio relativo a fiebre o febrícula, sin focalidad aparente, quedando de la siguiente forma: fiebre o febrícula, sin focalidad aparente y de más de una semana de duración.
- –
En el criterio de rectorragia, aunque el acuerdo fue del 100%, se hizo la siguiente modificación basándose en comentarios de los panelistas: rectorragia, salvo que la semiología hemorroidal sea evidente y haya hemorroides en la exploración física.
Con respecto a posibles criterios adicionales, el comité científico valoró las sugerencias recibidas en esta primera ronda y se decidió incluir el dolor alternante en nalgas, incorporándolo al criterio de dolor lumbar inflamatorio, de forma que la redacción final del criterio fue la siguiente: dolor lumbar inflamatorio (de acuerdo con la definición de la Assessment of SpondyloArthritis international Society [ASAS]) o dolor alternante en nalgas.
El comité científico decidió no incluir la calprotectina fecal en el cribado de EII en pacientes con SpA al considerar que aún no es una herramienta accesible en gran parte de los servicios de Reumatología. Además, valoraron que incorporando este ítem se podía correr el riesgo de una sobreindicación en la solicitud de esta determinación. Por todo ello, se decidió que la solicitud de calprotectina en el momento actual se limitará al ámbito del gastroenterólogo. Los panelistas fueron informados de esta decisión en el momento en que se realizó la segunda ronda del Delphi. Uno de los panelistas comentó: «el hecho de que la calprotectina fecal no esté disponible en este momento no implica que no lo vaya a estar en los próximos meses o años de forma generalizada. Es una herramienta tan sencilla y con tanto valor predictivo negativo que hoy en día se propone su uso como cribado de patología orgánica intestinal en pacientes con diarrea crónica, recomendando su disponibilidad en el ámbito de la Atención Primaria».
Resultados de la segunda ronda del DelphiEn esta ronda del Delphi, los panelistas valoraron de nuevo los 2 criterios para los que no se alcanzó acuerdo en la primera ronda, teniendo en cuenta el cambio definido por el comité científico en el criterio relativo a fiebre o febrícula. Para ello, dispusieron de las puntuaciones y los comentarios realizados por los demás panelistas, así como de la respuesta del comité científico a dichos comentarios. También valoraron la incorporación del dolor alternante en nalgas al criterio de lumbalgia inflamatoria.
En total participaron 13 panelistas. La tabla 3 muestra el grado de acuerdo para cada uno de los criterios.
Grado de acuerdo para los criterios. Segunda ronda Delphi
| Criterio | Grado de acuerdo |
|---|---|
| Déficit de vitamina B12 | 77% (10 de 13 panelistas) |
| Fiebre o febrícula, sin focalidad aparente y de más de una semana de duración | 100% |
| Dolor lumbar inflamatorio (de acuerdo con la definición ASAS) o dolor alternante en nalgas | 100% |
Para el déficit de vitamina B12, uno de los panelistas, que puntuó este criterio con un 2 (desacuerdo moderado), aportó la revisión sistemática de Battat et al. para justificar su valoración y aportar más información14. Esta revisión sistemática incluye 42 estudios que analizan niveles séricos de cobalamina y test de absorción. Según los resultados de estos estudios, ni la EC ni la CU predispondrían al déficit de vitamina B12. El comité científico, teniendo en cuenta esta referencia y también la baja especificidad de este marcador, consideró oportuno no incluir finalmente el déficit de B12 en los criterios de cribado de EII en pacientes con SpA. Los panelistas fueron informados de esta decisión, sin que ninguno se manifestara en contra.
Versión final de los criterios de cribadoLos criterios de cribado definidos de acuerdo con el proceso descrito se recogen en las figuras 3 y 4.
DiscusiónEn estudios realizados en distintos países (no hemos encontrado datos publicados relativos a España), se ha observado que un porcentaje importante de pacientes con EII y manifestaciones músculo-esqueléticas atendidos en consulta de Gastroenterología no han sido valorados en Reumatología3,15. Asimismo, de acuerdo con datos de la cohorte suiza de EII, la presencia de manifestaciones extraintestinales (incluyendo artritis periférica y espondilitis anquilosante) podría estar asociada a retraso diagnóstico en la EC8.
En el presente trabajo se proponen unos criterios de cribado de EII en pacientes con SpA y de cribado de SpA en pacientes con EII, con el objetivo de facilitar el diagnóstico precoz. Dichos criterios están basados en la revisión sistemática de la literatura y en la experiencia de los miembros del comité científico y el panel de expertos. Para su definición se ha buscado la facilidad de uso en consulta y que la variabilidad entre médicos en su aplicación sea la menor posible.
Solo hemos encontrado un estudio sobre herramientas de detección precoz de SpA en pacientes con EII16. En él se describen el desarrollo y el análisis de la fiabilidad de un cuestionario orientado a detectar casos de SpA axial. Al igual que en el presente trabajo, la mayor parte de la información recogida se refiere a características típicas del dolor axial inflamatorio y a la existencia de artritis periférica, entesitis o dactilitis. Entre las diferencias, se debe subrayar que se trata de un cuestionario autoadministrado y de mayor extensión, ya que recoge algunos aspectos no incluidos en los criterios de cribado, en concreto, los antecedentes familiares de espondilitis anquilosante, la rigidez matinal de espalda, respuesta del dolor a antiinflamatorios y antecedentes personales de uveítis o psoriasis.
En relación con estas diferencias, en pacientes de la cohorte ESPeranza (programa multicéntrico a nivel estatal para el diagnóstico precoz y tratamiento de la SpA, en el que durante 3 años se derivó a pacientes con sospecha de SpA desde Atención Primaria a 25 unidades de SpA), de entre las distintas características de SpA, los antecedentes familiares y la respuesta a antiinflamatorios no esteroideos (AINE) tuvieron el menor valor diagnóstico en pacientes con SpA axial en fases iniciales (duración de los síntomas entre 3 y 24 meses)17. Por otro lado, la uveítis no se ha incluido en los criterios de cribado por ser una manifestación extraintestinal propia de la EII. El punto de partida para la definición de estos criterios han sido las recomendaciones de la ASAS para la derivación de pacientes con sospecha de SpA axial18.
No hemos encontrado en la revisión sistemática de la literatura ninguna herramienta clínica para la detección precoz de EII en pacientes con SpA. En los Países Bajos se validó el Dudley Inflammatory Bowel Symptom Questionnaire (DISQ; cuestionario autoadministrado desarrollado y previamente validado para valorar los síntomas intestinales en EII) para evaluar la presencia y la gravedad de síntomas intestinales en pacientes con SpA axial19. Encontraron diferencias significativas en la puntuación media entre controles sanos y pacientes con SpA, y entre SpA y EC. Además, la puntuación del DISQ se correlacionaba con la actividad de la SpA. El 31% de los pacientes con SpA obtuvieron una puntuación ≥ 11, lo que reflejaría síntomas intestinales de suficiente intensidad como para afectar a la calidad de vida, y aproximadamente el 7,8% presentaba síntomas compatibles con EII activa (puntuación DISQ ≥ 19). Este cuestionario no está adaptado a población española y no hemos localizado estudios de validación en otras poblaciones.
La calprotectina es una proteína producida por monocitos, macrófagos y neutrófilos, que es liberada por estas células en el lugar de inflamación. A pesar de la utilidad contrastada de la calprotectina fecal en la detección de EII en pacientes con síntomas gastrointestinales20, su validez como método de cribado de EII en pacientes con SpA no está bien definida en la actualidad; sus valores se correlacionan positivamente con parámetros de actividad de la SpA y están aumentados en pacientes sin síntomas gastrointestinales; su elevación podría ser un marcador de riesgo de desarrollar EII21,22. Teniendo en cuenta el riesgo de sobreindicación y la falta de acceso en gran parte de los servicios de Reumatología, se decidió que la solicitud de esta prueba en el momento actual se limitará al ámbito del gastroenterólogo. En un futuro, en función de su disponibilidad, su factibilidad y su adecuación de su uso en las consultas de Reumatología, podrá valorarse su inclusión.
Como fortalezas del estudio, se debe destacar que el grado de acuerdo ha sido muy alto (por encima del 90%) para todos los criterios incluidos. Algunos autores han propuesto el 80% como umbral para alcanzar la validez de contenido cuando hay al menos 10 expertos participando en el proceso de consenso23,24.
Ha promovido este proyecto la Sociedad Española de Reumatología (SER), en colaboración con la Asociación Española de Gastroenterología (AEG) y el Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU). Han participado digestólogos y reumatólogos que ejercen en distintas comunidades autónomas, permitiendo una representatividad geográfica suficientemente amplia del comité científico y el panel de expertos.
Como limitación, se debe mencionar que entre los miembros del comité científico y el panel no ha habido especialistas de hospitales de nivel 1. No obstante, al tratarse de criterios basados fundamentalmente en la clínica, su aplicabilidad no ha de depender de la complejidad técnica del hospital.
Son necesarios nuevos estudios para completar la validación de los criterios definidos (estudio de su correcta aplicación por parte de los especialistas implicados, sensibilidad, especificidad).
En conclusión, se han definido unos criterios de cribado de EII en pacientes con SpA y viceversa. Estos han de ser de utilidad en la detección precoz de dichas patologías, para permitir que los pacientes puedan verse beneficiados con el tratamiento integral de la enfermedad en sus fases iniciales. Su carácter fundamentalmente clínico permitirá su aplicación por especialistas de los distintos niveles hospitalarios.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste proyecto ha sido financiado por MSD, que no ha participado en el diseño, la recolección y el análisis de datos o redacción de esta publicación.
AutoríaJ. Sanz Sanz y X. Juanola Roura comparten la primera autoría.
Conflicto de interesesJSS declara no tener conflicto de intereses en relación con el artículo. XJR ha recibido financiación de MSD para una colaboración de docencia y asistencia a un congreso. MM ha dirigido 3 cursos financiados por MSD. FG ha recibido financiación de MSD por participar en conferencias y para investigación. DSM declara no tener conflicto de intereses en relación con el artículo. Ninguno de los miembros del Grupo de Trabajo del Proyecto PIIASER ha recibido pagos por participar en el estudio.
A Félix Manuel Francisco Hernández y María Rosa González Crespo, por su trabajo de revisión sistemática de la literatura. A Carlos Sánchez Piedra, por su participación en la redacción del informe final del estudio. A María Auxiliadora Martín Martínez, por su apoyo metodológico. A Mercedes Guerra Rodríguez, por realizar las búsquedas bibliográficas en la revisión sistemática de la literatura.
Comité científico: Jesús Sanz Sanz, Xavier Juanola Roura, Miguel Montoro, Fernando Gomollón.
Panel de expertos: Carlos Montilla Morales (Hospital Clínico Universitario de Salamanca).
Raquel Almodóvar González (Hospital Universitario Fundación Alcorcón).
Juan Cañete Crespillo (Hospital Clínic de Barcelona).
Rubén Queiro Silva (Hospital Universitario Central de Asturias).
María del Carmen Castro Villegas (Hospital Universitario Reina Sofía).
Enrique Ornilla Laraudogoitia (Clínica Universidad de Navarra).
Miguel Mínguez (Hospital Clínico Universitario de Valencia).
Montserrat Aceituno (Hospital Universitario Mútua de Terrasa).
Marta Carrillo (Hospital Universitario de Canarias).
Yolanda Arguedas (Hospital General San Jorge de Huesca).
Manuel Barreiro (Complejo Hospitalario Universitario de Santiago).
Belén Beltrán (Hospital Universitario y Politécnico La Fe de Valencia).
Ignacio Marín (Hospital General Universitario Gregorio Marañón de Madrid).
Este artículo también se publica en: Reumatología Clínica: 10.1016/j.reuma.2017.07.001, con el consentimiento de los autores y editores.
Los nombres de los componentes del Grupo de Trabajo del Proyecto PIIASER se relacionan en el anexo.