La insuficiencia hepática aguda sobre crónica (ACLF, acute-on-chronic liver failure) es un síndrome definido recientemente y caracterizado por una descompensación aguda de una hepatopatía crónica, asociada al fallo de diferentes órganos y a una elevada mortalidad. La ACLF es frecuente, y afecta al 30% de los pacientes ingresados por complicaciones de la cirrosis. Las infecciones bacterianas, el alcoholismo y la reactivación de hepatitis virales representan los factores precipitantes más frecuentes, aunque hasta en un 40% de los pacientes no se identifica ningún factor precipitante. La fisiopatología no es completamente conocida, pero se considera que la existencia de una respuesta inflamatoria excesiva juega un papel clave en su desarrollo. No existe ningún tratamiento específico para la ACLF y su manejo se basa en el tratamiento de soporte y el trasplante hepático. Actualmente se están evaluando nuevas estrategias de tratamiento, como mecanismos de soporte hepático y tratamientos inmunomoduladores, pero los datos son todavía limitados.
Acute-on-chronic liver failure (ACLF) is a recently defined syndrome characterised by acute decompensation of chronic liver disease, associated with organ failures and high mortality. ACLF is a common condition and may affect up to 30% of patients admitted to hospital for cirrhosis complications. Bacterial infections, alcoholism and reactivation of viral hepatitis are the most common precipitating factors in ACLF, although in up to 40% of patients no precipitating factor can be identified. Although the pathophysiology of ACLF is not completely understood, the presence of an excessive inflammatory response appears to play a key role. There is no specific treatment for patients with ACLF and management is based on organ support and liver transplantation. New treatment strategies based on liver support systems and immunomodulatory treatments are being evaluated but existing data are still limited.
La historia natural de la cirrosis hepática evoluciona desde la cirrosis compensada hasta la aparición de cirrosis descompensada, caracterizada por el desarrollo de las complicaciones típicas de la enfermedad (ascitis, encefalopatía hepática, infecciones bacterianas o hemorragia digestiva) y asociada a un empeoramiento del pronóstico1,2. En la práctica clínica diaria, se identifican pacientes con descompensación aguda de la cirrosis sin otros factores asociados, mientras que otros pacientes presentan una descompensación aguda asociada a la rápida aparición de fallo multiorgánico y a un pésimo pronóstico a corto plazo. Tradicionalmente, este concepto se ha denominado insuficiencia hepática aguda sobre crónica (ACLF, de sus siglas en inglés acute-on-chronic liver failure). En resumen y con base en la experiencia clínica, la ACLF se ha definido como una descompensación aguda en un paciente con una enfermedad hepática crónica de base, asociada a fallos de órganos diferentes al hígado y a una elevada mortalidad. No obstante, este ha sido y sigue siendo un concepto heterogéneo, ya que hasta hace poco tiempo no existía ninguna definición establecida y las definiciones existentes se basaban en consensos más que en datos de estudios prospectivos.
En 2009 la Asian Pacific Association for the Study of the Liver (APASL) estableció la primera definición de consenso, con la que se definió ACLF como «un insulto hepático agudo manifestado en forma de ictericia (bilirrubina ≥5mg/dL) y coagulopatía (INR ≥ 1,5), complicado en el plazo de 4 semanas con ascitis o encefalopatía»3. Más recientemente se han publicado dos estudios prospectivos dirigidos a establecer una definición de ACLF. Por un lado, el estudio del North American Consortium for the Study of End Stage Liver Disease realizado en Estados Unidos y Canadá, que incluyó únicamente a pacientes con cirrosis e infecciones bacterianas, por lo que no se consideró al resto de los pacientes4. Finalmente, el estudio CANONIC, realizado por el EASL-Chronic Liver Failure (EASL-CLIF) Consortium, incluyó a 1.343 pacientes consecutivos con cirrosis hepática ingresados por una descompensación aguda de la enfermedad en 21 hospitales europeos5. Por tanto, hasta el momento, este último es el estudio prospectivo realizado con mayor número de pacientes, que incluye a todos los pacientes que ingresan por complicaciones de la cirrosis, de cualquier etiología, y dirigido a establecer la definición de ACLF.
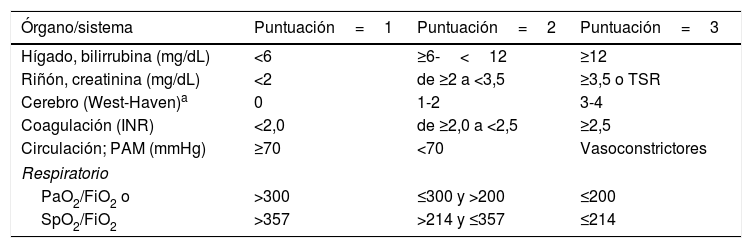
Definición y diagnósticoDe acuerdo con los resultados del estudio CANONIC, la ACLF se define como un síndrome caracterizado por una descompensación aguda de la cirrosis, asociada a fallos de diferentes órganos y a una elevada mortalidad a corto plazo (mortalidad a 28 días ≥ 15%). En este estudio, la existencia de fallos de órganos se evaluó utilizando una versión modificada del índice Sequential Organ Failure Assessment score (SOFA), índice ampliamente utilizado para la evaluación de fallos de órgano en pacientes críticos. En este caso, el índice SOFA se adaptó a las características de los pacientes con cirrosis y se denominó CLIF-SOFA, o su versión simplificada, el CLIF-C Organ Failure score (CLIF-C OF) (tabla 1)5,6. De acuerdo al número y al tipo de fallos de órgano según estos índices, se definió la presencia de ACLF y se clasificó su gravedad en 3 estadios (tabla 2)6.
Índice CLIF-C OF para el diagnóstico de ACLF
| Órgano/sistema | Puntuación=1 | Puntuación=2 | Puntuación=3 |
|---|---|---|---|
| Hígado, bilirrubina (mg/dL) | <6 | ≥6-<12 | ≥12 |
| Riñón, creatinina (mg/dL) | <2 | de ≥2 a <3,5 | ≥3,5 o TSR |
| Cerebro (West-Haven)a | 0 | 1-2 | 3-4 |
| Coagulación (INR) | <2,0 | de ≥2,0 a <2,5 | ≥2,5 |
| Circulación; PAM (mmHg) | ≥70 | <70 | Vasoconstrictores |
| Respiratorio | |||
| PaO2/FiO2 o | >300 | ≤300 y >200 | ≤200 |
| SpO2/FiO2 | >357 | >214 y ≤357 | ≤214 |
El área gris describe el criterio diagnóstico de fallo de cada órgano.
FiO2: fracción de oxígeno inspirado; INR; international normalized ratio; PAM: presión arterial media; PaO2: presión parcial de oxígeno arterial; SpO2 saturación de oxígeno; TSR: terapia de sustitución renal.
Criterios diagnósticos de ACLF
| Sin ACLF | Sin fallos de órganos o 1 un único fallo de órgano, excepto fallo renal, con una creatinina sérica <1,5mg/dL y sin encefalopatía hepática |
| ACLF-1 | Fallo renal único o 1 un único fallo de órgano asociado a disfunción renal (creatinina entre 1,5 y 1,9mg/dL) o encefalopatía hepática grado 1-2 |
| ACLF-2 | 2 fallos de órgano |
| ACLF-3 | ≥3 fallos de órgano |
Aunque los estudios prospectivos han incluido únicamente pacientes con cirrosis hepática, cabe destacar que en la actualidad se considera que la ACLF puede aparecer en pacientes con cirrosis tanto compensada como descompensada, pero también en pacientes con hepatopatía crónica sin cirrosis. En este sentido, y en un intento de aclarar el concepto, en una reciente reunión de consenso con el objetivo de unificar los criterios diagnósticos de ACLF se propuso definirlo como «un síndrome que aparece en pacientes con hepatopatía crónica, con o sin cirrosis previamente diagnosticada, que se caracteriza por una descompensación hepática aguda que resulta en fallo hepático (ictericia y coagulopatía) y asociado a uno o más fallos de órganos extrahepáticos»7. En este consenso se propuso clasificar la ACLF en 3 tipos, según el estadio de la hepatopatía crónica de base: ACLF de tipo A (pacientes con hepatopatía crónica sin cirrosis), ACLF de tipo B (pacientes con cirrosis compensada) y ACLF de tipo C (pacientes con cirrosis descompensada). Los pacientes con ACLF de tipos B y C son los pacientes incluidos en el estudio CANONIC5,7. Los pacientes con ACLF-A son los pacientes con hepatopatía crónica de base, sin cirrosis, y que típicamente se presentan como una hepatitis aguda sobre una hepatopatía crónica o como la reactivación de una hepatitis vírica. Como se describe en el siguiente apartado, teniendo en cuenta que la hepatitis vírica es el factor precipitante de ACLF más frecuente en Asia, la ACLF-A sería el más frecuente en esta región. Sin embargo, esta clasificación y el concepto de ACLF-A deberá ser validado en futuros estudios prospectivos para confirmar si realmente presenta características similares a las de los pacientes con ACLF-B y ACLF-C.
EpidemiologíaLa ACLF es una complicación frecuente de los pacientes con cirrosis hepática, que representa una causa frecuente de ingreso hospitalario y una de las causas más frecuentes de mortalidad en estos pacientes. En total, la prevalencia de ACLF es de aproximadamente el 30%. Estudios realizados en diferentes poblaciones muestran unos datos de prevalencia relativamente similares. Los resultados del estudio CANONIC, realizado en población europea, muestran una prevalencia del 30%, con 20% de los pacientes que presentaban ACLF en el momento del ingreso hospitalario y 10% que lo desarrollaron durante el ingreso. La ACLF-1 y ACLF-2 fueron los más frecuentes (16 y 11%, respectivamente), mientras que la ACLF-3 representó solo el 4%5. Un estudio realizado en Norteamérica utilizando los criterios diagnósticos del NASCELD y, por tanto, incluyendo únicamente a pacientes con infecciones bacterianas, describió una prevalencia del 24%4. Finalmente, un estudio realizado en Asia que incluía a pacientes con cirrosis hepática por virus de la hepatitis B (VHB) y que utilizó los criterios diagnósticos del CANONIC reportó una prevalencia del 34%8.
Factores precipitantesEn muchos casos se puede identificar un factor precipitante relacionado con el desarrollo de ACLF. Los factores precipitantes pueden clasificarse en «intrahepáticos», como el consumo de alcohol, reactivación del VHB o hepatitis aguda por VHA o VHE, y «extrahepáticos», principalmente infecciones bacterianas o hemorragia digestiva, entre otros9. A pesar de que los factores precipitantes pueden tener un papel crucial en el desarrollo de ALCF, los datos existentes muestran que la presencia y el tipo de factor precipitante no se asocian con el pronóstico, lo cual indica que el pronóstico depende de otros factores diferentes a los factores precipitantes, como la evolución clínica y el número de fallos de órgano5,10–13.
En general, los factores precipitantes más frecuentes son las infecciones bacterianas, seguidas del alcoholismo activo y de la reactivación del VHB10–13. No obstante, la prevalencia de los factores precipitantes varía en función del área geográfica. En Europa y en Estados Unidos, las infecciones bacterianas y el alcoholismo son los factores precipitantes identificables más frecuentes, que representan un 30 y un 20% de los casos de ACLF, respectivamente5. En Asia, la reactivación del VHB seguido de las infecciones bacterianas son los factores precipitantes más frecuentes, con un 36 y un 30% respectivamente9. No obstante, es importante destacar que en un número no despreciable de pacientes (hasta un 20-40%) no se consigue identificar ningún factor precipitante5.
FisiopatologíaLos mecanismos que caracterizan la fisiopatología que conduce al desarrollo de ACLF todavía se desconocen, pero actualmente se sabe que la ACLF ocurre en el contexto de una intensa respuesta inflamatoria sistémica11–15. En el estudio CANONIC se observó que los pacientes con ACLF presentaban una elevación marcada de la proteína C reactiva y de la cifra de leucocitos, ambos marcadores proinflamatorios que, además, se correlacionaban con el pronóstico del síndrome5. Estos hallazgos fueron los que llevaron a generar la hipótesis de la respuesta inflamatoria sistémica excesiva como base para explicar la patogenia de la ACLF. Esta hipótesis está ampliamente aceptada en la actualidad y, aunque los datos para detallar sus características todavía son limitados, es el área donde ha habido más avance en el estudio de la ACLF.
Existen dos estudios recientes que han evaluado el comportamiento de un gran número de citocinas en pacientes con ACLF en comparación con pacientes con cirrosis descompensada y pacientes sanos16,17. Los resultados de estos estudios han mostrado que en los pacientes con ACLF existe un aumento marcado de diversas citocinas y quemocinas proinflamatorias (IL-6, IL-8, TNF-α, MCP-1, etc.) en comparación con los pacientes con cirrosis hepática descompensada sin ACLF16,17. Asimismo, se observó que los niveles de algunas de estas citocinas se correlacionaban con la evolución de la enfermedad y el pronóstico. En este sentido, por ejemplo, los niveles bajos de IL-6 e IL-8 se asociaban con una mejoría de la ACLF, mientras que niveles elevados se asociaron con empeoramiento del síndrome y elevada mortalidad a corto plazo16.
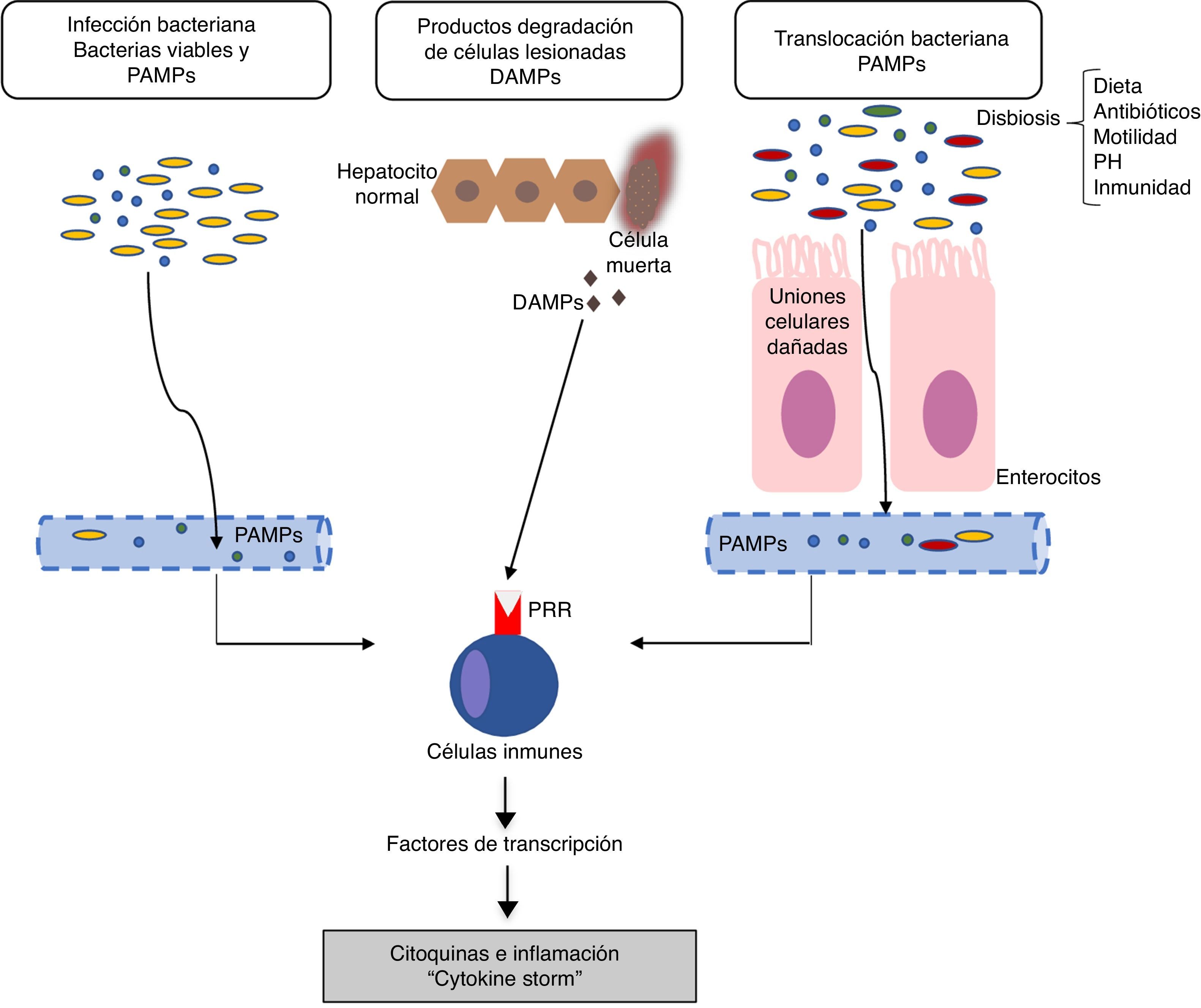
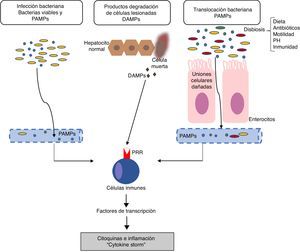
Mecanismos de inflamación en la insuficiencia hepática aguda sobre crónicaLos mecanismos responsables de la respuesta inflamatoria no están completamente aclarados. En general, los inductores de la inflamación pueden clasificarse en: a) inductores exógenos (sobre todo, infecciones bacterianas) y b) inductores endógenos (moléculas procedentes de células necróticas)18. La hipótesis actual señala que la intensa reacción inflamatoria sistémica que ocurre en los pacientes con ACLF puede ser inducida por factores exógenos como pathogen-associated molecular patterns (PAMP) procedentes de productos bacterianos existentes en la circulación sistémica, o factores endógenos como damage-associated molecular patterns (DAMP) procedentes de células del hígado lesionado (fig. 1).
Fisiopatología la insuficiencia hepática aguda sobre crónica (ACLF, del inglés acute-on-chronic liver failure). La hipótesis actual sobre la fisiopatología que conduce al desarrollo de ACLF se basa en la existencia de una respuesta inflamatoria excesiva. La figura describe los potenciales mecanismos implicados en la inducción de esta respuesta inflamatoria sistémica en pacientes con ACLF.DAMP: damage-associated molecular patterns; PAMP: pathogen-associated molecular patterns; PRR: pathogen recognition receptors.
Los patógenos bacterianos pueden inducir la inflamación a través de dos tipos de mecanismos: por PAMP o a través de factores de virulencia. Los PAMP son firmas moleculares procedentes de bacterias que son reconocidas por los receptores pattern recognition receptors (PPR) expresados en la células inmunes o epiteliales. Los PPR incluyen a los toll-like recepors (TLR), entre otros19. La unión de los PAMP con los PPR estimula una cascada de señales intracelulares que activan los factores de transcripción (por ejemplo, NF-kß) que, a su vez, inducen genes que codifican moléculas implicadas en la inflamación, como las citocinas proinflamatorias. Por otro lado, los factores de virulencia, en general, no están reconocidos por ningún receptor específico, sino que se detectan a partir del reconocimiento de los efectos de la actividad de un patógeno (reconocimiento de características funcionales), por ejemplo, la activación del inflamosoma NLRP3 por exotoxinas bacterianas18. Las infecciones bacterianas son una de las causas más frecuentes de ACLF, por lo que en este caso, los PAMP procedentes de estas bacterias serían las causantes de la inducción de la respuesta inflamatoria. No obstante, en los pacientes con cirrosis descompensada, la existencia de PAMP en la circulación sistémica es independiente de la existencia de infecciones bacterianas. La existencia de un aumento en la permeabilidad intestinal y de translocación bacteriana en los pacientes con cirrosis avanzada contribuye a la presencia de PAMP en la circulación que pueden inducir un aumento en la inflamación sistémica en ausencia de una infección bacteriana demostrada11,15.
Inductores endógenosLos DAMP son liberados por células necróticas, dañadas o como resultado de la rotura de la matriz extracelular para alertar al sistema inmune de la existencia de una lesión tisular. Los DAMP son reconocidos por receptores del huésped y esta unión induce una inflamación denominada estéril, es decir, inflamación en ausencia de infección. Por ejemplo, las proteínas de alta movilidad del grupo 1 se unen a los receptores para los compuestos de glicosilación avanzada e inducen una respuesta inflamatoria sistémica20.
Finalmente, la inflamación sistémica en respuesta a los DAMP y PAMP también está probablamente condicionada por factores genéticos. Recientemente se han descritos 2polimorfismos de un solo nucleótido en genes que codifican para IL-1 que protegen a los pacientes con cirrosis descompensada de una inflamación sistémica excesiva al disminuir la probabilidad de desarrollar ACLF21.
Mecanismos de fallo de órgano en la insuficiencia hepática aguda sobre crónicaLa inflamación sistémica excesiva en la ACLF se correlaciona con el número de fallos de órgano5. Según la hipótesis actual, la inflamación sistémica también sería la causa del fallo de órganos en estos pacientes.
A modo de resumen, el objetivo primario de la respuesta inflamatoria en las infecciones es eliminar la infección y, en el contexto de la inflamación estéril, el objetivo es promover la reparación de los tejidos. En ambos casos la respuesta inflamatoria puede ser excesiva y puede causar daño orgánico e incluso fracaso multiorgánico. Esto es lo que ocurre, por ejemplo, en los pacientes con sepsis, en los que la inflamación sistémica conduce a fallos de órgano por efecto directo de los mediadores inflamatorios en la función microvascular. Este impacto negativo de la respuesta inmune del huésped sobre los tejidos se conoce como inmunopatología22. Por ejemplo, de forma experimental, se ha demostrado que el fallo hepático en contexto de sepsis y cirrosis es el resultado de la muerte de los hepatocitos causada por la apoptosis inducida por TNF-α o por necrosis inducida por endotelina-123. Además de la inmunopatología, el daño tisular y el fallo de órgano podrían estar relacionados con la alteración de la homeostasis tisular por parte de las bacterias, al alterar directamente la funciones celulares. Asimismo, se ha relacionado el fallo de órgano con un fracaso en los mecanismos de tolerancia de los tejidos, que son los mecanismos dirigidos a proteger de la inmunopatología y del daño directo de las bacterias11,22.
En resumen, la disfunción celular, la inmunopatología y la disfunción de los mecanismos de tolerancia de los tejidos en el contexto de una respuesta inflamatoria excesiva podrían ser los mecanismos implicados en el fallo de órgano en los pacientes con ACLF11,15.
Inmunosupresión en la insuficiencia hepática aguda sobre crónicaAdemás del aumento en las citocinas proinflamatorias, los pacientes con ACLF también presentan un aumento de la producción de algunas citocinas antiinflamatorias como IL-10 e IL-1Ra16,17. Este hecho podría indicar la existencia de una respuesta inmune compensatoria que no es capaz de mitigar la excesiva respuesta inflamatoria. Asimismo, se ha demostrado que monocitos de pacientes con ACLF presentan ex vivo una disminución de la producción de citocinas inflamatorias en respuesta a la administración de LPS, así como una disminución de la expresión de marcadores de activación como HLA-DR24. Asimismo, un estudio reciente muestra que los monocitos circulantes de pacientes con ACLF presentan una sobreexpresión del receptor MERTK, un inhibidor de la señalización de la vía TLR, lo que suprime la respuesta inmune a la estimulación ex vivo con LPS25. Estos hallazgos señalan la existencia de una inmunosupresión que se podría explicar como consecuencia de una respuesta inflamatoria excesiva24-26. La existencia de estos mecanismos de inmunosupresión podría justificar la elevada susceptibilidad a segundas infecciones que presentan los pacientes con ACLF.
Relación entre los factores precipitantes y los mecanismos de inflamación en la insuficiencia hepática aguda sobre crónicaInfección bacterianaLos pacientes con cirrosis presentan una respuesta inflamatoria excesiva a las infecciones, con un aumento en la concentración de citocinas proinflamatorias más intensa que la de los pacientes con infecciones pero sin cirrosis27,28. Además, la mortalidad de los pacientes con shock séptico y cirrosis es mayor que la de los pacientes con shock séptico sin cirrosis23,29. Análisis iniciales del CANONIC muestran que cualquier infección puede causar ACLF, pero el riesgo es mayor para la peritonitis bacteriana espontánea, seguida de la peritonitis bacteriana secundaria y de la neumonía. Además, la gravedad de la infección aumenta el riesgo de ACLF, de manera que las sepsis o sepsis grave se asocian más frecuentemente a ACLF que aquellas infecciones sin síndrome de respuesta inflamatoria sistémica (15 vs. 4%)5,10. Los mecanismos que condicionan una respuesta inflamatoria sistémica excesiva a las infecciones en los pacientes con cirrosis en comparación con la población general son desconocidos. Estudios ex vivo han señalado que en los monocitos circulantes de pacientes con cirrosis existe un defecto en los mecanismos de inhibición de la vía de TLR430.
Hepatitis alcohólicaLa hepatitis alcohólica grave representa un 20% de los casos de ACLF. Se ha observado que los pacientes con hepatitis alcohólica grave presentan inflamación sistémica que se correlaciona con el pronóstico, lo cual apoya el papel de la inflamación en el desarrollo de fallos de órgano31. Esta inflamación podría estar relacionada con la elevada frecuencia de infecciones que se observa en los pacientes con hepatitis alcohólica (un 20-30% de los pacientes aproximadamente)31,32. Por otro lado, los pacientes con hepatitis alcohólica presentan una alteración de la composición de la microbiota intestinal y un aumento de la permeabilidad intestinal que favorece la translocación de bacterias viables o de productos bacterianos (PAMP) que, al unirse con los receptores TLR, estimularían la producción de citocinas, como IL-8, responsables de la atracción y activación de los neutrófilos, células clave en la hepatitis alcohólica33,34. Además, el metabolismo del acetaldehído (metabolito del alcohol) induce la producción de especies reactivas de oxígeno que, a su vez, inducen estrés del ADN mitocondrial, un tipo de DAMP, con lo que contribuyen a la inflamación hepática35.
Insuficiencia hepática aguda sobre crónica sin factor desencadenanteFinalmente, hasta en un 40% de los pacientes no se consigue identificar ningún factor desencadenante pero, a pesar de no identificarlo, estos pacientes presentan una inflamación sistémica significativamente mayor que los pacientes sin ACLF5. De nuevo, para explicar esta inflamación se han propuesto varias hipótesis: la disbiosis y la producción de metabolitos por parte de las bacterias intestinales, la translocación de PAMP y la acción de los DAMP podrían contribuir a la inflamación sistémica. Por último, no puede descartarse que en algunos casos exista una incapacidad para identificar los factores precipitantes como, por ejemplo, infecciones bacterianas que no hayan sido detectadas12,14. Futuros estudios y nuevas tecnologías —como la metabolómica, lipidómica y metagenómica— podrán explorar estas hipótesis.
A pesar de todos los avances, la información sobre los mecanismos que conducen al desarrollo de ACLF sigue siendo escasa, por lo que se necesitan más estudios para explorar los mecanismos de inflamación, inmunosupresión y tolerancia, para comprender la fisiopatología de la ACLF.
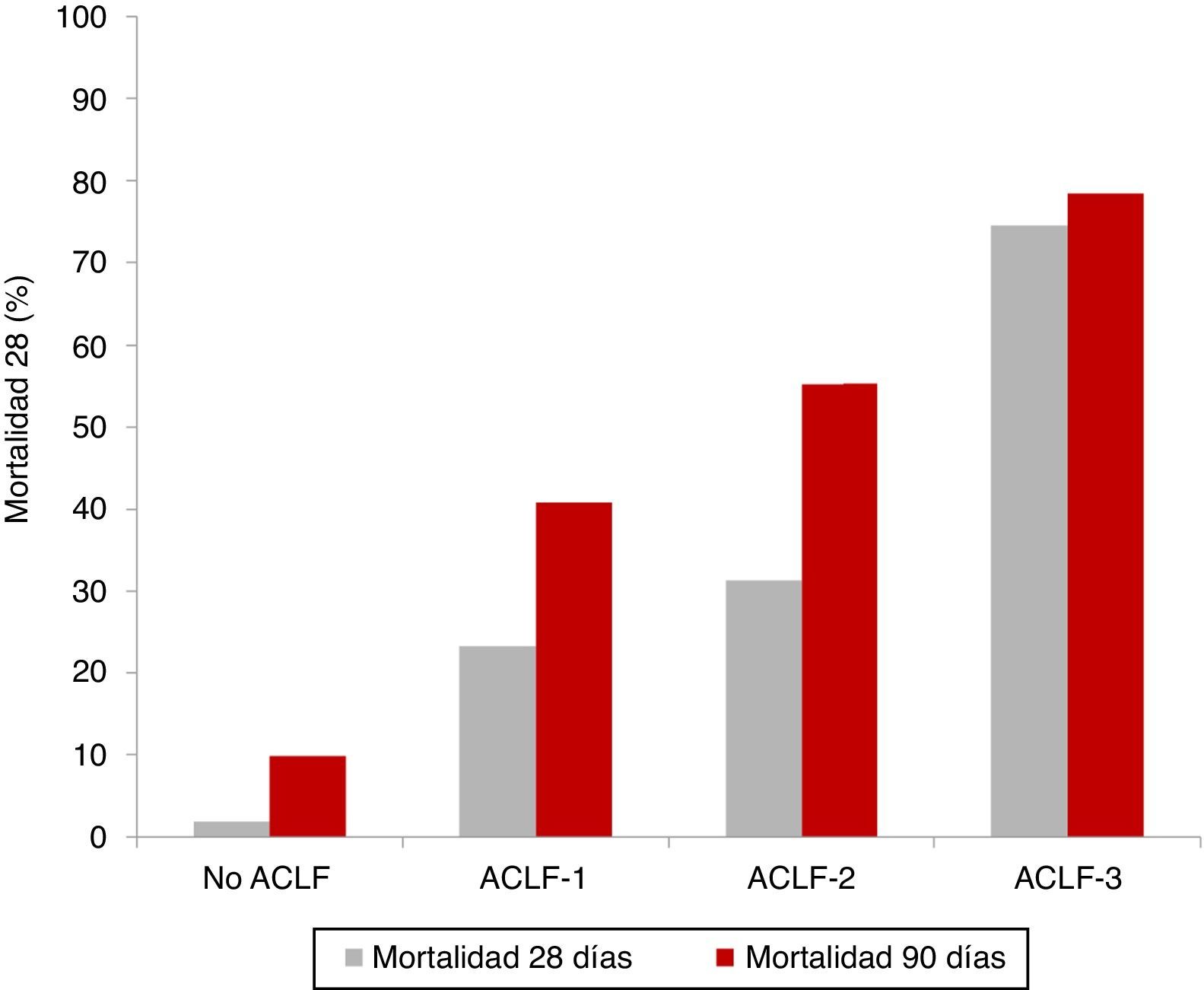
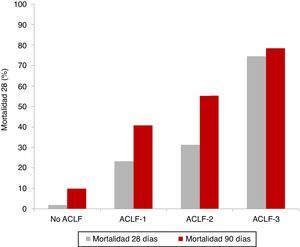
Evolución clínica y pronósticoComo se ha descrito anteriormente, la ACLF se caracteriza por una elevada mortalidad a corto plazo, que oscila entre el 30 y el 50%. Como es de esperar, los pacientes con ACLF-3 son los que presentan un peor pronóstico, en comparación con los pacientes con ACLF-1 y ACLF-25,8. Los resultados del estudio CANONIC mostraron una mortalidad global a 28 días de los pacientes con ACLF del 33% (23% en ACLF-1, 31% en ACLF-2 y 74% en ACLF-3) comparado con solo el 2% en pacientes con cirrosis descompensada sin ACLF5 (fig. 2).
No obstante, hay que tener en cuenta que la ACLF es un proceso dinámico y potencialmente reversible. En este sentido, un estudio reciente realizado con la cohorte de pacientes del estudio CANONIC investigó la evolución clínica de la ACLF36. En total, la ACLF se resolvió o mejoró en el 49% de pacientes, se mantuvo estable o tuvo un curso fluctuante en el 30% y empeoró en el 20%. Sin embargo, estas cifras variaron en función del grado inicial de ACLF: mientras que la ACLF se resolvió en el 55% de los pacientes con ACLF-1, solo se resolvió en el 15% de los pacientes con ACLF-3. Cabe destacar que, a pesar de que el grado inicial de ACLF tiene relación con el pronóstico, la evolución de la ACLF durante la hospitalización fue el mayor factor determinante de la mortalidad a corto plazo. La mayoría de los pacientes llegan a su grado final de ACLF durante la primera semana tras el diagnóstico, por lo que el grado de ACLF en los días 3-7 después del diagnóstico fue capaz de predecir el pronóstico a 28 y 90 días de forma más precisa que el grado de ACLF al diagnóstico36. Por tanto, la evaluación secuencial del pronóstico durante los primeros días de la hospitalización es fundamental para la estratificación del riesgo de estos pacientes12–14.
Factores predictivos de pronósticoLos datos existentes hasta el momento no muestran relación entre el tipo de factor precipitante y el pronóstico. En cambio, es interesante destacar que la historia de descompensaciones previas de la cirrosis se ha asociado con el pronóstico de la ACLF5. Se ha descrito que, hasta en un 20% de los casos, la ACLF aparece en pacientes con cirrosis previamente compensada, lo que representa la primera forma de descompensación de la enfermedad. En estos pacientes sin descompensaciones previas, la ACLF presenta un peor pronóstico, con una mortalidad a 28 días del 43% en comparación con el 30% de los pacientes con cirrosis previamente descompensada5.
En cuanto a datos analíticos, los pacientes con ACLF presentan valores de proteína C reactiva y leucocitos superiores a los de los pacientes con cirrosis descompensada sin ACLF. Además, los valores de leucocitos se han relacionado con el pronóstico, de manera que la probabilidad de mortalidad aumenta en paralelo a la cifra de leucocitos5.
Índices pronósticos para la estratificación del riesgo de los pacientes con insuficiencia hepática aguda sobre crónicaLos índices pronósticos habituales utilizados para evaluar el pronóstico de los pacientes con cirrosis descompensada, como el Child-Pugh y el MELD, no tienen en cuenta todos los posibles fallos de órgano que pueden aparecer en los pacientes con ACLF. El estudio CANONIC y análisis posteriores derivados de la misma cohorte de pacientes han definido nuevos índices que han mostrado una precisión mayor para predecir el pronóstico que el Child-Pugh y el MELD5,6,36.
El CLIF-C OF descrito anteriormente es útil para diagnosticar la presencia de ACLF y también para predecir el pronóstico. Su precisión pronóstica es ligeramente superior a la del Child-Pugh y el MELD6. No obstante, posteriormente se definió un nuevo índice, el CLIF-C ACLF, con capacidad pronóstica superior al CLIF-C OF. Este índice se compone del CLIF-C OF asociado a 2variables que fueron seleccionadas como las variables basales con mayor asociación con la mortalidad a corto plazo: la edad y la cifra de leucocitos. El índice puntúa de 0 a 100, con los valores elevados indicativos de peor pronóstico6. Se puede calcular fácilmente a través de la web del EF-CLIF: www.efclif.com. De acuerdo con lo descrito anteriormente, la evaluación del CLIF-C ACLF a los 3-7 días del diagnóstico fue mejor para predecir el pronóstico que el cálculo de este índice al diagnóstico de ACLF.
La evaluación del CLIF-C ACLF a los 3-7 días de haber iniciado el tratamiento también se ha propuesto como un posible criterio de futilidad, es decir, una manera objetiva de decidir la posible limitación del esfuerzo terapéutico en pacientes graves con un pésimo pronóstico a corto plazo. En pacientes con ACLF y sin posibilidad de acceder a un trasplante hepático (TH), la persistencia de 4 o más fallos de órgano o un CLIF-C ACLF superior a 64 a los 3-7 días comporta una mortalidad del 100% a los 6 meses de acuerdo con los resultados del estudio CANONIC36. No obstante, estos datos y la utilización de estos criterios deberían validarse en estudios futuros.
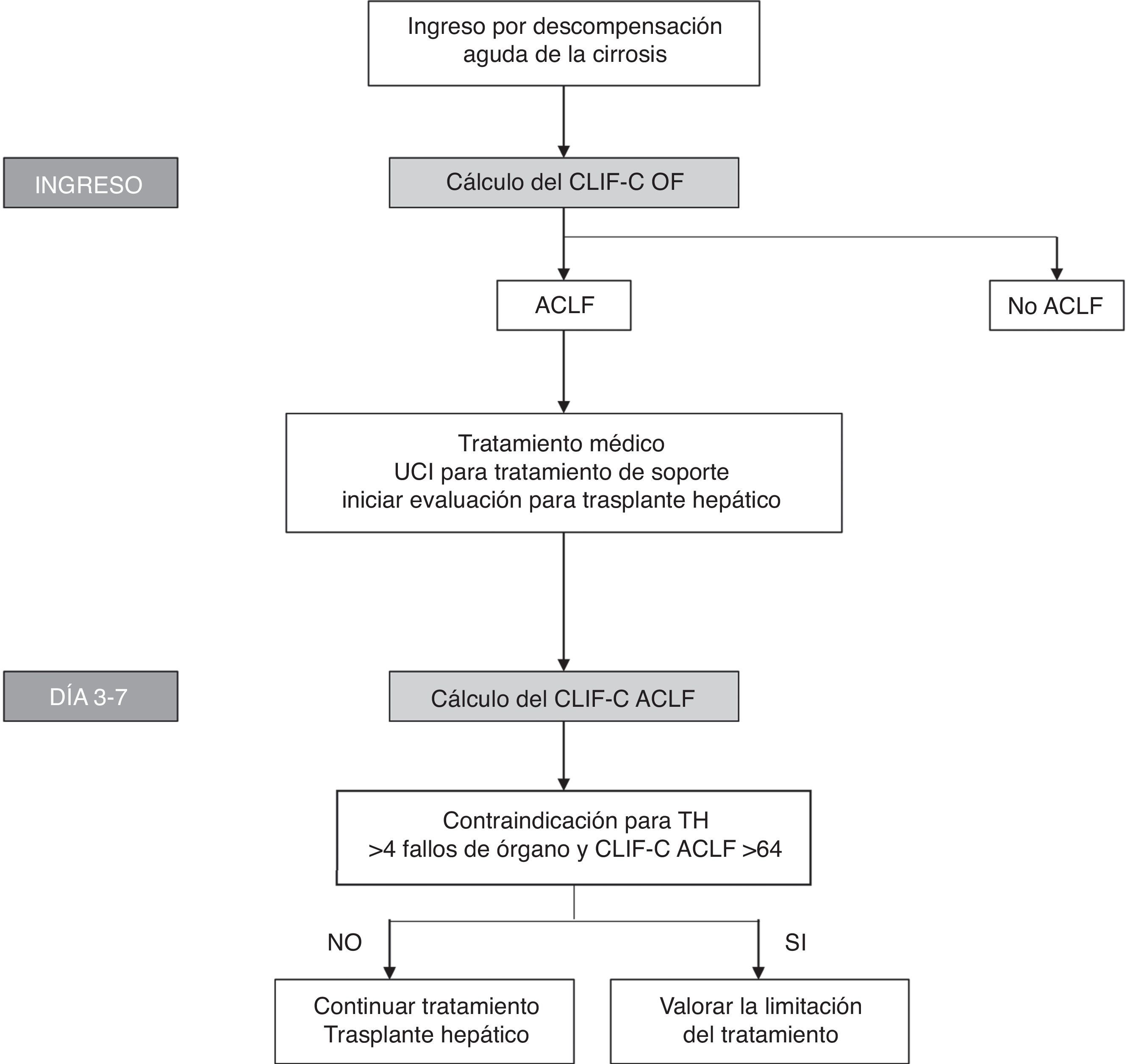
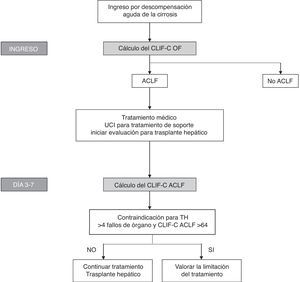
Teniendo en cuenta la definición de estos nuevos índices que muestran buena precisión diagnóstica y la importancia de evaluar el pronóstico de forma secuencial, se han propuesto algoritmos para evaluar el pronóstico y ayudar a la toma de decisiones en pacientes con ACLF (fig. 3).
Algoritmo para establecer el diagnóstico y la evaluación secuencial del pronóstico de los pacientes con ACLF. El cálculo del CLIF-OF al ingreso permite establecer el diagnóstico de ACLF de acuerdo a los criterios diagnósticos aceptados en la actualidad, basados en los resultados del estudio CANONIC. La evaluación del pronóstico a los 3-7 días de haber iniciado el tratamiento, utilizando el índice CLIF-C ACLF, parece la estrategia con mayor precisión para establecer el pronóstico de estos pacientes. En este punto (día 3-7), la existencia de 4 o más fallos de órgano junto con un CLIF-C ACLF > 64 en pacientes sin posibilidad de trasplante hepático se ha asociado con una mortalidad del 100% a los 6 meses, por lo que este se ha propuesto como un posible criterio para plantear la limitación del esfuerzo terapéutico. No obstante, estos criterios deberán validarse en futuros estudios.
Actualmente no existe un tratamiento específico para los pacientes con ACLF, por lo que el manejo se basa en la identificación precoz del síndrome, el tratamiento de los factores precipitantes (infecciones bacterianas, tratamiento para el VHB, corticoides en la hepatitis alcohólica, etc.) y el tratamiento de soporte para los diferentes fallos de órgano. Idealmente los pacientes con ACLF, sobre todo aquellos con ACLF-2 y ACLF-3, deberían ser tratados en unidades de cuidados intensivos o intermedios y, excepto que existan contraindicaciones, trasladados a centros con programa de TH.
En general, el manejo de estos pacientes debe realizarse de acuerdo con las guías clínicas actuales y con las revisiones recientes sobre el manejo del paciente cirrótico crítico37–39, por lo que esta revisión se focalizará únicamente en los posibles tratamientos específicos para la ACLF.
Trasplante hepáticoEl TH representa el tratamiento óptimo y definitivo para los pacientes con ACLF12–14. Por tanto, si a priori no existen contraindicaciones absolutas, los pacientes con ACLF deberían ser evaluados para TH. No obstante, la utilización del trasplante en pacientes con ACLF, en especial en aquellos con grados graves, es compleja y controvertida sobre todo por la elevada frecuencia de contraindicaciones que pueden presentar estos pacientes; el frecuente desarrollo de infecciones o de fallos de órgano determina que los pacientes estén en una situación de extrema gravedad como para recibir un TH. En este contexto, y debido a su elevada mortalidad a corto plazo, la ventana terapéutica para proponer TH a estos pacientes es muy estrecha. Asimismo, la mortalidad en lista de espera de estos pacientes es muy elevada. En este sentido, han surgido opiniones que proponen que, para mejorar el pronóstico de la ACLF, especialmente en grados graves, debería priorizarse a estos en la lista de espera de TH40.
Hasta el momento, los datos existentes sobre la evolución y el pronóstico de los pacientes con ACLF después de un trasplante son todavía escasos y la mayoría provienen de estudios retrospectivos y series cortas de pacientes. El estudio CANONIC aporta resultados limitados en este sentido porque solo el 9% de los pacientes se trasplantaron. No obstante, los resultados son optimistas teniendo en cuenta que en los pacientes con ACLF-2 o ACLF-3 la supervivencia a los 28 días sin TH fue inferior al 20%, pero aumentó hasta el 80% en aquellos pacientes que recibieron un trasplante. En esta serie, la mediana de tiempo entre el diagnóstico de ACLF y el trasplante fue de 11 días (1-28 días)5. Estos resultados refuerzan la idea de que el TH realizado de una forma precoz puede mejorar el pronóstico de estos pacientes. Los resultados de otro estudio que incluyó a 144 pacientes con ACLF, en este caso utilizando la definición del APASL, mostró una elevada mortalidad en lista de espera (superior al 50%), pero para aquellos pacientes que se trasplantaron, la supervivencia a los 5 años post-TH fue superior al 80%. No obstante, cabe destacar que solo el 49% de los pacientes entraron en lista de espera y solo el 23% recibió un TH; el resto no pudieron trasplantarse debido a edad avanzada, infecciones activas, alcoholismo u otras contraindicaciones41. Por otro lado, existen datos de estudios realizados en Asia que incluyen a pacientes con VHB y ofrecen también resultados respecto el trasplante de donante vivo (LDLT). Los resultados de uno de los estudios muestran que el TH de donante cadavérico vs. el LDLT no presentó diferencias significativas en cuanto a la supervivencia, ambos con buenos resultados, con una supervivencia a los 5 años del 74%42. Otro estudio reciente muestra que, a pesar de que el LDLT en pacientes con ACLF presenta buenos resultados, la supervivencia a 5 años postrasplante en los pacientes con ACLF fue significativamente inferior a la de los pacientes trasplantados sin ACLF (71 vs. 81%, respectivamente; p=0,035)43. A pesar de que el LDLT es una opción potencial en el contexto de la limitación de donantes, su utilización en el campo de la ACLF, donde idealmente el trasplante debería realizarse en un periodo corto de tiempo, hace que su aplicación en esta indicación sea compleja.
En contraste con los buenos resultados del TH en pacientes con ACLF descritos hasta el momento, un estudio reciente, retrospectivo, que incluye a 350 pacientes (140 con ACLF definido de acuerdo con los criterios del estudio CANONIC) muestra que el pronóstico post-TH de los pacientes con ACLF fue peor que el de los pacientes trasplantados sin ACLF. En este estudio la supervivencia a 3 y 12 meses post-TH de los pacientes con ACLF fue del 79 y del 70%, respectivamente, comparado con el 96 y el 91% de los pacientes sin ACLF (p<0,001). Asimismo, la estancia hospitalaria y la estancia en la unidad de cuidados intensivos de los pacientes con ACLF fue significativamente superior44.
En resumen, los datos sobre el impacto de la ACLF en el pronóstico post-TH todavía son limitados para establecer estrategias específicas dirigidas a estos pacientes. En la actualidad, el manejo de los pacientes con ACLF respecto a la evaluación e inclusión en lista de espera se realiza con el protocolo estándar utilizado para todos los pacientes con cirrosis descompensada. Teniendo en cuenta la elevada mortalidad a corto plazo de estos pacientes, se recomienda realizar la evaluación para un potencial TH de forma precoz y rápida. Deberían realizarse estudios para determinar el impacto de la ACLF sobre el TH y establecer criterios de selección y priorización objetivos para estos pacientes, así como criterios objetivos para la retirada de los pacientes de la lista de espera o para determinar la futilidad del tratamiento.
Sistemas de soporte hepáticoLos sistemas de soporte hepático se han propuesto como opciones terapéuticas que podrían actuar como puente al trasplante para los pacientes con ACLF45. Estos sistemas se basan en sustituir la función hepática así como eliminar diferentes sustancias de la circulación sistémica que se considera que pueden participar en la fisiopatología o en la progresión de la ACLF (por ejemplo, óxido nítrico, PAMP) con el objetivo de mejorar los parámetros clínicos y biológicos en estos pacientes.
Existen dos estudios aleatorizados, uno con MARS (molecular adsorbent recirculating system) y otro con Prometheus (fractioned plasma separation and absortion system), que han evaluado su utilidad para los pacientes con ACLF. Aunque ambos estudios mostraron algunos datos de mejoría respecto a la función hepática y renal y a la hemodinámica sistémica, ninguno de los 2mostró un beneficio significativo para la supervivencia46,47. No obstante, la ausencia de una definición de ACLF ampliamente aceptada hace que estos estudios no hayan incluido una población homogénea de pacientes sino pacientes con cirrosis descompensada con diferentes números y grados de fallos de órganos.
Por otro lado, existen estudios no aleatorizados que han evaluado la utilidad del recambio plasmático en pacientes con ACLF asociado al VHB, que señalan una mejoría de la supervivencia en comparación con los pacientes tratados con tratamiento estándar48. Otro estudio aleatorizado mostró también una mejoría de la supervivencia en pacientes con insuficiencia hepática aguda49. No obstante, hasta el momento no existen estudios que hayan evaluado la utilidad del recambio plasmático en pacientes con ACLF con etiologías diferentes al VHB.
En resumen, serán necesarios más estudios que incluyan una población homogénea de pacientes con ACLF de diferentes etiologías para establecer si realmente los sistemas de soporte hepático pueden jugar un papel en el manejo de estos pacientes.
Tratamiento inmunomodulador y regenerativoUna respuesta inflamatoria excesiva, así como la posible existencia de grados variables de inmunoparesia, centran actualmente la hipótesis sobre la fisiopatología de la ACLF y la alta susceptibilidad a desarrollar infecciones que presentan estos pacientes. En este sentido, los esfuerzos en investigación sobre tratamientos específicos para la ACLF se centran en parte en tratamientos para limitar la excesiva respuesta inflamatoria o para modular la respuesta inmunológica. Existen datos, aunque limitados, sobre el potencial papel de tratamientos como la administración de G-CSF (factor estimulante de colonias de granulocitos) o de células madre en los pacientes con ACLF.
El G-CSF es una citocina que activa la movilización de las células madre de la médula ósea, así como la proliferación y movilización de los granulocitos. Existen dos estudios aleatorizados que han evaluado el papel del G-CSF como tratamiento para pacientes con ACLF. En uno de ellos, se aleatorizaron 47 pacientes a recibir 5μg/kg de G-CSF administrado de forma subcutánea vs. tratamiento estándar, y mostraron una mejoría en la supervivencia a los 2 meses del 66 vs. el 26%, respectivamente. En los pacientes que recibieron G-CSF se detectó una mejoría en las puntuaciones de Child-Pugh y SOFA así como un menor riesgo de desarrollar síndrome hepatorrenal, encefalopatía hepática o sepsis50. En un segundo estudio, 55 pacientes con ACLF asociado a VHB se aleatorizaron a recibir G-CSF vs. tratamiento estándar. De forma similar a lo que ocurrió en el estudio anterior, los pacientes que recibieron G-CSF presentaron una mejoría de la supervivencia a 90 días (48 vs. 21%, respectivamente) así como una reducción en el MELD51. Aunque estos estudios apuntan resultados prometedores, cabe destacar que, en total, los datos provienen de un número limitado de pacientes y, además, en ambos estudios la ACLF se definió con los criterios del APASL, por lo que se incluyó a pacientes con grados leves de ACLF y quedaron excluidos los pacientes con grados más avanzados, definidos en la actualidad por los criterios del estudio CANONIC.
Por otro lado, también se ha propuesto la terapia con células madre como un potencial tratamiento con el objetivo de una terapia regenerativa, pero que, a la vez, puede asociar un efecto inmunomodulador. No obstante, hasta el momento solo existen resultados de un estudio en una serie corta de pacientes. En este estudio se incluyó a 43 pacientes con ACLF asociado a VHB a recibir células madre derivadas de cordón umbilical vs. placebo asociado a tratamiento estándar. La supervivencia a 90 días fue del 79% en los pacientes que recibieron células madre vs. 52% en el grupo control (p=0,015)52.
Por tanto, aunque los tratamientos basados en un efecto inmunomodulador o regenerativo ofrecen resultados interesantes, estos se encuentran todavía en una fase experimental, por lo que se deberán realizar futuros estudios para aclarar su potencial efecto beneficioso.
FinanciaciónElsa Solà es receptora de una beca Joan Rodés de la Asociación Española para el Estudio del Hígado (AEEH) y de una beca de la Sociedad Catalana de Digestología.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.