El diagnóstico de enfermedad inflamatoria intestinal (EII) se realiza, en un alto porcentaje, durante la edad reproductiva. La EII en remisión es el mejor escenario para planificar el embarazo.
ObjetivosDescribir las características clínicas del embarazo y del recién nacido, evaluando la actividad de la enfermedad en el momento de la concepción y en la evolución del embarazo en un centro terciario en Chile.
MétodosEstudio observacional, retrospectivo, incluyó a mujeres con EII que habían tenido un parto durante 2017-2020. Los datos demográficos, clínicos y obstétricos se obtuvieron del Registro de EII. Se realizó análisis estadístico descriptivo y de asociación (χ2, p ≤ 0,05).
ResultadosSe incluyeron 60 mujeres en el estudio. Al inicio del embarazo, 21 (35%) presentaban actividad inflamatoria y 39 (65%) estaban en remisión. Del grupo con actividad, 16 (66%) permanecieron activas y seis tuvieron un aborto espontáneo. Aquellas en remisión, 26 (69%) permanecieron en esta condición; nueve pacientes (15%) habían suspendido el tratamiento, seis de las cuales presentaron actividad durante el embarazo. El consejo preconcepcional fue realizado en 23/60 pacientes, siendo mayor en el grupo que permaneció en remisión durante el embarazo (65% vs. 35%, p = 0,02). Pacientes con brotes durante el embarazo tuvieron mayor probabilidad de embarazo pretérmino (< 37 semanas) y recién nacido de menor peso comparado con el grupo que permaneció en remisión (89 vs. 74%; p = 0,161) y (2,885 vs. 3,370 g; p = 0,0014), respectivamente.
ConclusiónLa remisión durante el embarazo presenta los mejores resultados y el consejo preconcepcional permite un mejor control de la EII durante el embarazo.
In inflammatory bowel disease (IBD) a high percentage of women are diagnosed during their reproductive age. IBD in remission is the ideal scenario when planning a pregnancy.
AimsTo describe the clinical characteristics of pregnancy/newborn and assess disease activity at the time of conception and throughout the pregnancy in patients with IBD treated at a tertiary centre in Chile.
MethodsWe retrospectively reviewed women diagnosed with IBD who were pregnant or delivered between 2017 and 2020. Demographic, clinical, obstetric and delivery data were obtained from the IBD registry, approved by the local IRB. Descriptive statistics and association tests were performed (χ2, p ≤ 0.05).
ResultsSixty women with IBD were included. At the beginning of pregnancy, 21 (35%) had active disease and 39 (65%) were in remission. Of those with active disease, 16 (66%) remained active and 6 had spontaneous abortions. In those who were in remission, 26 (69%) remained in this condition. Nine patients (15%) discontinued treatment, and 6 of these had inflammatory activity during pregnancy. Preconception counselling was performed in 23 of the 60 patients, being higher in the group that remained in remission during pregnancy (65% vs. 35%, p = 0.02). Patients who had a flare during pregnancy had more probability of preterm birth (<37 weeks) and newborn with lower weight compared with the group that always remained in remission (89% vs. 74%, p = 0.161) and (2.885 vs 3.370 g; p = 0.0014).
ConclusionRemission presents better outcomes in pregnancy and preconception counselling would allow a better IBD control during pregnancy.
La mayor incidencia de la enfermedad inflamatoria intestinal (EII), que incluye principalmente la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), es entre los 20 y 40 años de edad1, con 50 a 60% de los pacientes diagnosticados en este período2,3. Esto coincide con la edad reproductiva, lo que sin duda plantea preguntas sobre el impacto de la EII y su tratamiento sobre la fertilidad, la salud materna y fetal durante el embarazo, la seguridad de la lactancia y el desarrollo infantil4,5. Es la desinformación sobre estos puntos lo que puede llevar a las pacientes a evitar el embarazo o suspender terapias en caso de quedar embarazadas6,7.
Aunque la tasa de fertilidad comunicada en la mujer con EII inactiva es similar a la población general8, es importante considerar que la proctocolectomía total con reservorio ileoanal disminuye las tasas de fertilidad, sin embargo, esto ha disminuido con la laparoscopía9. Por otra parte, estudios han demostrado que en mujeres con EII al momento de la gestación, hasta 35% de ellas experimentarán un aumento de la actividad de la enfermedad10, siendo mayor en aquellas pacientes que se encontraban activas al momento de la concepción11. Controlar la actividad inflamatoria y mantener la remisión antes y durante el embarazo son las variables con mayor impacto en el desarrollo del embarazo y en los efectos sobre el feto. Estudios que se han centrado en evaluar el rol de la EII han demostrado que la presencia de actividad de la enfermedad se asocia a un aumento significativo de presentar resultados adversos, destacando un aumento en la incidencia de abortos, mortinatos, recién nacidos de bajo peso, partos pretérmino y cesáreas10–13. Por lo tanto, al planificar un embarazo, se recomienda que la paciente se haya mantenido de tres a seis meses en remisión clínica, idealmente con calprotectina fecal (CF) < 250 ug/g)7,14,15.
La mayoría de los fármacos utilizados actualmente en el tratamiento de la EII, incluyendo cinco aminosalicílicos (5-ASA), esteroides, tiopurínicos y antifactor de necrosis tumoral (anti-TNF) (infliximab, adalimumab, golimumab y especialmente certolizumab), presentan un buen perfil de seguridad durante el embarazo y la lactancia (Categoría B, C, D y B, respectivamente, según la FDA). Talidomida y metotrexato están contraindicados por el riesgo de teratogenicidad (categoría X por la FDA)16. Con relación al uso de otros biológicos como las anti-integrinas (vedolizumab) y anti-p40 IL-12/23 (ustekinumab), los estudios son limitados por lo que no es posible una recomendación. Tofacitinib, una molécula pequeña, estaría asociado a un riesgo de malformaciones en modelos animales, por lo que debiera evitarse durante el embarazo3,4. De modo que es obligación y responsabilidad del equipo tratante realizar un manejo adecuado desde la preconcepción, explicando los riesgos asociados a la actividad de la enfermedad, la necesidad de mantener una adherencia al tratamiento y los beneficios de lograr y mantener la remisión durante todo el embarazo3,4.
Los objetivos de este estudio son describir las características clínicas y demográficas del embarazo y del recién nacido, evaluando la actividad de la enfermedad al momento de la concepción, en la evolución del embarazo y del recién nacido en un centro terciario en Chile entre 2017-2020.
Pacientes y métodosEstudio observacional, descriptivo, retrospectivo y unicéntrico, realizado en pacientes mujeres ≥ 18 años con diagnóstico confirmado de EC, CU o EII no clasificable, que quedaron embarazadas o hayan tenido un parto entre los años 2017-2020 y que pertenecieran al Programa de EII de Clínica Las Condes.
Se incluyeron las variables demográficas y clínicas (diagnóstico, clasificación de Montreal, años de evolución de la enfermedad, tratamiento al momento de la concepción y durante el embarazo considerando el uso de 5-ASA, corticoides (prednisona y budesonida oral), inmunomoduladores (tiopurínicos y metotrexato), terapia biológica anti-TNF (infliximab o adalimumab), los antecedentes de cirugía por la EII y la actividad de la enfermedad al momento de la concepción o durante el desarrollo del embarazo. Para este último punto, se utilizaron índices clínicos, endoscópicos los cuales eran obtenidos al momento de realizar la evaluación de cada paciente. Además, para determinar la actividad de la enfermedad, se utilizó CF como biomarcador. Para remisión clínica se utilizó el índice parcial de Mayo en CU y Harvey Bradshaw (HB) para EC. Se definió remisión clínica un score de Mayo parcial < 2 para CU y un índice HB < 5 para EC7,17. Para evaluar remisión endoscópica se utilizaron los índices SES-CD en EC y Rutgeerts en EC postquirúrgico, y Mayo endoscópico en CU. Para CU, se definió remisión endoscópica un índice de Mayo endoscópico 0 o 1. En EC, se definió remisión endoscópica un SES-CD < 2 en caso de actividad luminal y un Rutgeerts i0 o i1 en caso de pacientes operados17. Se usó CF como biomarcador de seguimiento, considerando remisión bioquímica valores de CF < 250 μg/g14,15.
Con relación al embarazo, se evaluó si las pacientes recibieron consejería preconcepcional, si había presencia de actividad inflamatoria periconcepcional definida como cualquier actividad clínica de la enfermedad entre las ocho semanas antes de la concepción y hasta las primeras dos semanas del embarazo18, si las pacientes presentaron un brote durante el embarazo, si fue necesario optimizar la terapia, la evolución del embarazo (complicaciones durante el embarazo/parto y tipo de parto), peso, talla y Apgar del recién nacido y si se administró vacunas virus vivo (rotavirus) y/o vacuna BCG (bacilo atenuado) al recién nacido en aquellos con madres en terapia biológica. Los resultados adversos del embarazo [parto prematuro (< 37 semanas de gestación), bajo peso al nacer (< 2,5 kg) y pequeño para la edad gestacional (PEG)] se evaluaron como tasas. Se realizó clasificación PEG para curvas de referencia nacional19 y Organización Mundial de la Salud20, Apgar < 7 a los 1 y 5 minutos y mortinato.
Este estudio fue aprobado por el Comité de Ética de la institución y se realizó manteniendo los principios de la Declaración de Helsinki.
Análisis estadísticoLos resultados del estudio fueron analizados mediante el software R Commander. Las variables categóricas se analizaron a través de frecuencias absolutas y porcentuales. Las variables continuas se describieron con medidas de tendencia central y dispersión según la distribución de los datos (promedio/desviación estándar si siguieron o no una distribución normal y mediana/rango intercuántico si no distribuyeron normal). Las variables continuas se compararon usando Mann-Whitney o t-test según distribución. Para las variables categóricas se utilizó la frecuencia relativa porcentual y para el análisis estadístico comparativo X2. Se determinó significancia estadística a un valor de p ≤ 0,05.
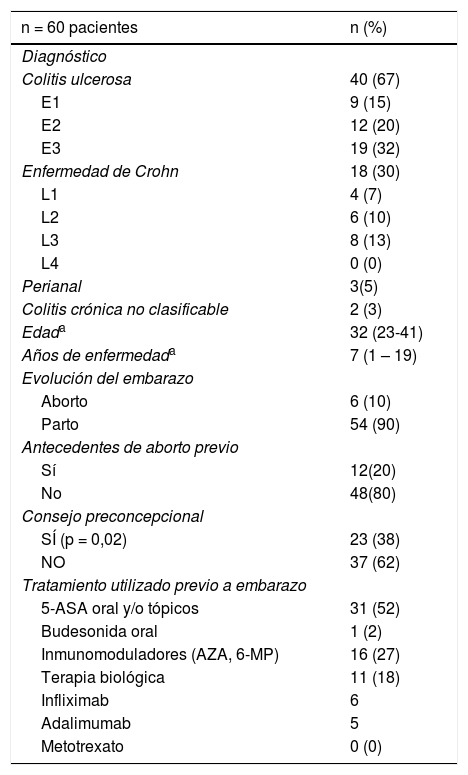
ResultadosPacientesSe incluyeron 60 pacientes, 40 con diagnóstico de CU, 18 con EC y dos con una EII no clasificable, con una mediana de edad de 32 años (rango 24-41) al inicio del embarazo, y una mediana de duración de enfermedad de siete años (rango 1-19). Doce pacientes habían tenido un embarazo previo, 10 de ellas con diagnóstico de EII. No hubo debut de enfermedad durante el embarazo en ninguna de ellas. Los datos demográficos y clínicos de las pacientes se presentan en la tabla 1; 23 pacientes recibieron consejo preconcepcional. El tratamiento más frecuente al momento del embarazo fue 5-ASA oral (52%) y azatioprina (AZT) (27%). Nueve pacientes habían descontinuado el tratamiento previo al embarazo o durante las primeras semanas de gestación, cinco por indicación de un médico externo al Programa de EII y cuatro por autoindicación. Ningún fármaco fue suspendido o modificado en sus dosis por parte de nuestro equipo al momento de conocer el diagnóstico de embarazo.
Características clínicas y demográficas de las pacientes embarazadas con EII
| n = 60 pacientes | n (%) |
|---|---|
| Diagnóstico | |
| Colitis ulcerosa | 40 (67) |
| E1 | 9 (15) |
| E2 | 12 (20) |
| E3 | 19 (32) |
| Enfermedad de Crohn | 18 (30) |
| L1 | 4 (7) |
| L2 | 6 (10) |
| L3 | 8 (13) |
| L4 | 0 (0) |
| Perianal | 3(5) |
| Colitis crónica no clasificable | 2 (3) |
| Edada | 32 (23-41) |
| Años de enfermedada | 7 (1 – 19) |
| Evolución del embarazo | |
| Aborto | 6 (10) |
| Parto | 54 (90) |
| Antecedentes de aborto previo | |
| Sí | 12(20) |
| No | 48(80) |
| Consejo preconcepcional | |
| SÍ (p = 0,02) | 23 (38) |
| NO | 37 (62) |
| Tratamiento utilizado previo a embarazo | |
| 5-ASA oral y/o tópicos | 31 (52) |
| Budesonida oral | 1 (2) |
| Inmunomoduladores (AZA, 6-MP) | 16 (27) |
| Terapia biológica | 11 (18) |
| Infliximab | 6 |
| Adalimumab | 5 |
| Metotrexato | 0 (0) |
E: extensión; L: localización 5-ASA: 5-aminosalicílicos; AZT: azatioprina; 6-MP: 6-mercaptopurina.
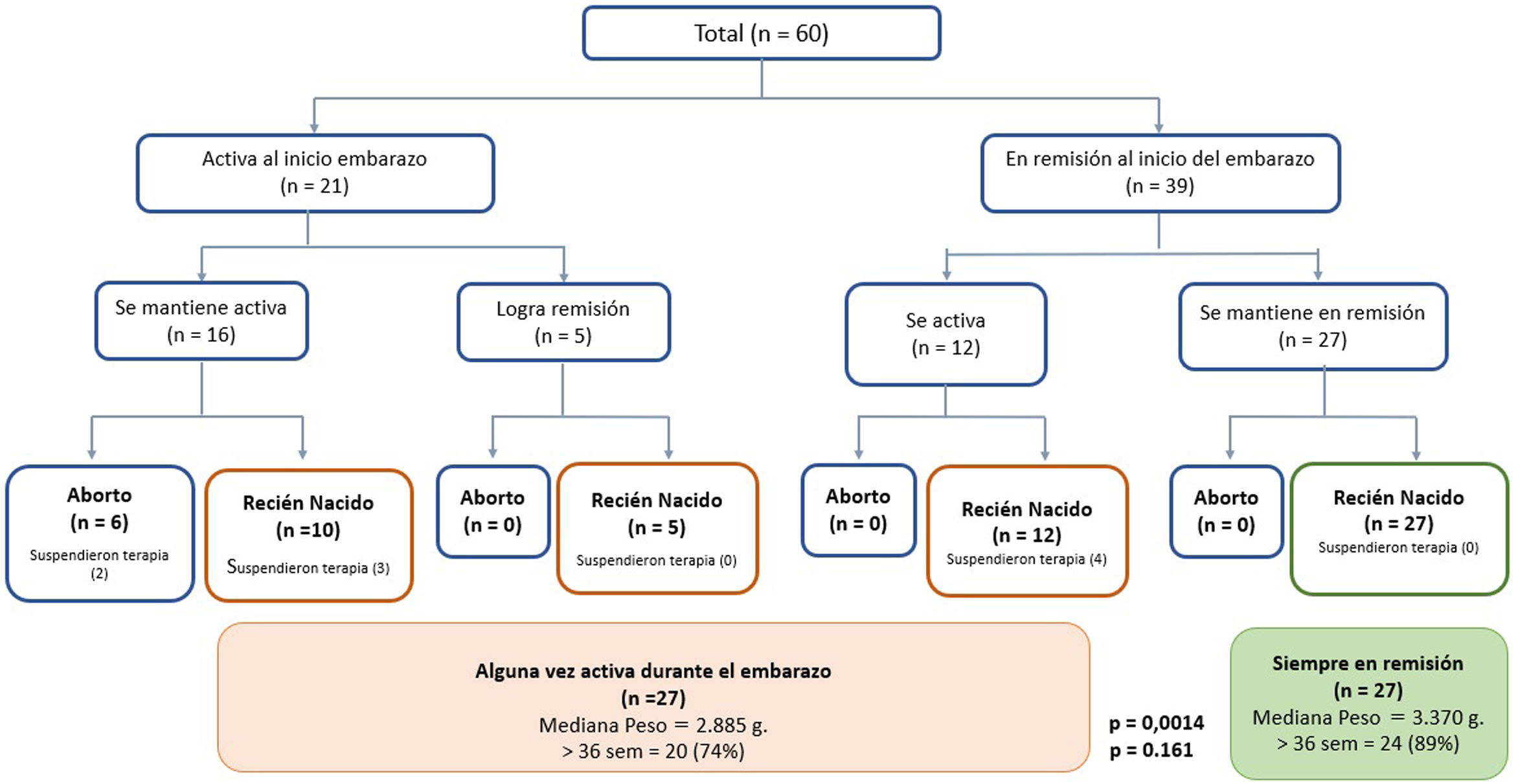
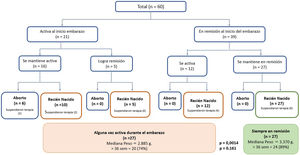
Al evaluar la actividad clínica al inicio del embarazo, 39 pacientes (65%) estaban en remisión, de las cuales 23 tenían CU, 15 EC y una paciente EII no clasificable. No hubo diferencias en la actividad clínica al momento de la concepción entre CU y EC; 27 pacientes (69%) en remisión al inicio del embarazo mantuvieron esta condición. Seis, cinco y una paciente, presentaron brotes durante el 1er, 2° o 3er trimestre del embarazo, respectivamente. Del grupo con actividad inflamatoria clínica al inicio del embarazo (35%, 21 pacientes), 17 tenían CU, tres EC y una paciente EII no clasificable; 66% (16 pacientes) mantuvieron la enfermedad activa durante la gestación (fig. 1). No hubo pacientes con antecedente de fístula perianal al momento de la concepción o que la desarrollara durante su embarazo.
En el grupo que se mantuvo en remisión, un mayor porcentaje había recibido consejo preconcepcional (65% vs. 35%, p = 0,02). De las nueve pacientes que suspendieron el tratamiento de la EII, cuatro presentaron brotes durante el primer trimestre (con un aborto a las ocho semanas) y dos durante el segundo trimestre. Las otras tres pacientes reiniciaron su tratamiento con mesalazina alcanzando la remisión clínica.
Se evaluó la actividad inflamatoria con CF durante el embarazo en 43 pacientes con un total de 67 mediciones (mediana 265 μg/g; rango; 9-1.700). En pacientes con brotes la mediana de la CF fue de 496 μg/g (rango: 163-1.700) vs. 35 μg/g (rango 5-600) en pacientes en remisión clínica (p < 0,0001). En cuatro pacientes (3 CU y 1 EC) se realizó un estudio endoscópico durante el embarazo; en tres una colonoscopía y una paciente requirió una reservorioscopía. Estos se realizaron en el 1er trimestre del embarazo (un caso) y durante el 2° trimestre (tres casos). La actividad inflamatoria endoscópica se confirmó en dos pacientes (10 y 21 semanas de embarazo). No se realizó estudio de imágenes en ninguna paciente.
En las 28 pacientes que presentaron brotes durante el embarazo (16 desde el inicio de la gestación y 12 durante el desarrollo del embarazo, fig. 1), los fármacos utilizados fueron 5-ASA (64%), AZT (14%), infliximab (7%), budesonida oral (7%) y prednisona (4%). Las tres pacientes que iniciaron AZT durante el primer trimestre del embarazo no presentaron eventos adversos. Sólo una paciente fue hospitalizada por un brote de CU con citomegalovirus positivo en las biopsias al 2do trimestre de embarazo, siendo tratada con ganciclovir con una respuesta favorable y fue posible mantener su terapia de mantenimiento (infliximab). No hubo cirugías en esta cohorte.
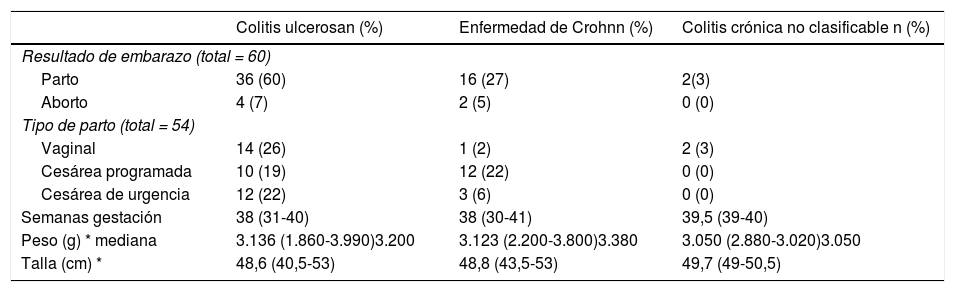
EmbarazoLa evolución de la actividad de la enfermedad y del embarazo se muestran en la fig. 1 y tabla 2, respectivamente. En el grupo que mantuvo actividad durante la gestación, seis pacientes tuvieron un aborto espontáneo, todas ellas con brotes moderados o grave. En comparación, ninguna paciente que estando activa y logró la remisión o que la mantuvo desde el inicio de la gestación, presentó un aborto espontáneo (fig. 1). En aquellas que mantuvieron remisión sólo el 11% presentó un parto de pretérmino (< 37 semanas) vs. el 26% de aquellas que presentaron brotes durante la gestación (p = 0,161). Al comparar la vía de parto, el parto vaginal fue más frecuente en pacientes con CU que en EC (39% vs. 6%, p = 0,016), sin existir instrumentalización del parto. Por el contrario, la cesárea programada fue más frecuente en EC (75% vs. 28%; p = 0,001). No hubo diferencias en la frecuencia de cesáreas de urgencia entre ambos grupos (tabla 2). Con relación al peso del recién nacido, la mediana fue de 3.370 g (rango; 2.220 – 3.950) en el grupo que se mantuvo en remisión en comparación a los 2.885 g (rango: 1.860 – 4.000) en el grupo que presentó algún brote durante el embarazo (p = 0,0014) (fig. 1). En el grupo que se mantuvo en remisión, dos recién nacidos quedaron en el rango PEG vs. tres en el grupo que presentó actividad durante el embarazo. Todos los recién nacidos presentaron un Apgar normal al primer y quinto minuto.
Evolución del embarazo según tipo de EII
| Colitis ulcerosan (%) | Enfermedad de Crohnn (%) | Colitis crónica no clasificable n (%) | |
|---|---|---|---|
| Resultado de embarazo (total = 60) | |||
| Parto | 36 (60) | 16 (27) | 2(3) |
| Aborto | 4 (7) | 2 (5) | 0 (0) |
| Tipo de parto (total = 54) | |||
| Vaginal | 14 (26) | 1 (2) | 2 (3) |
| Cesárea programada | 10 (19) | 12 (22) | 0 (0) |
| Cesárea de urgencia | 12 (22) | 3 (6) | 0 (0) |
| Semanas gestación | 38 (31-40) | 38 (30-41) | 39,5 (39-40) |
| Peso (g) * mediana | 3.136 (1.860-3.990)3.200 | 3.123 (2.200-3.800)3.380 | 3.050 (2.880-3.020)3.050 |
| Talla (cm) * | 48,6 (40,5-53) | 48,8 (43,5-53) | 49,7 (49-50,5) |
En ninguno de los hijos de madres en terapia biológica, se administró una vacuna virus vivo (rotavirus y vacuna anti TBC bacilo atenuado) antes del año de vida.
Se realizaron mediciones de niveles plasmáticos de terapia biológica en siete pacientes, cuatro de ellas con infliximab con una media de 6,8 μg/mL (rango 4,7-10,3) y tres pacientes con adalimumab (dos de ellas con niveles > 12 ug/mL y otra con 6 μg/mL). No fue necesario optimizar las dosis en estas pacientes.
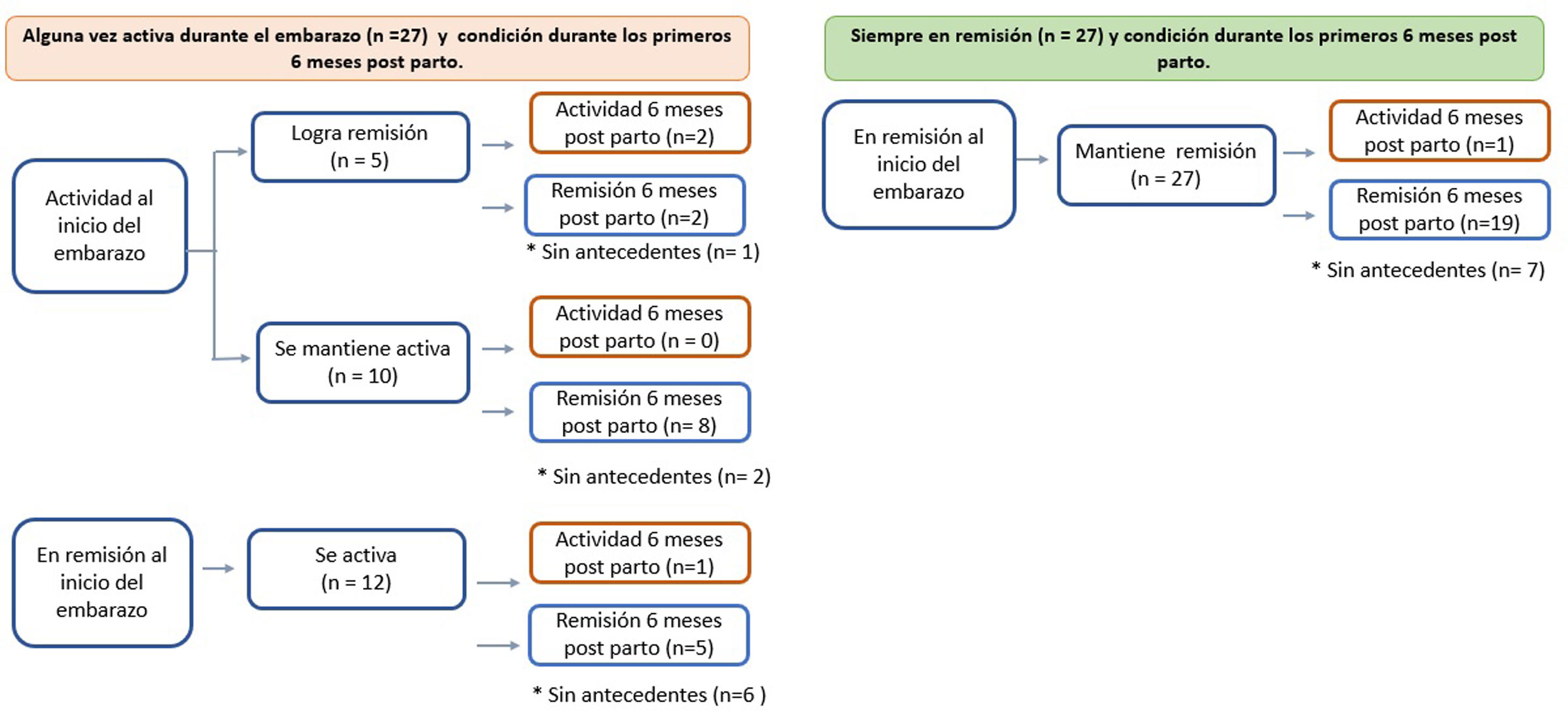
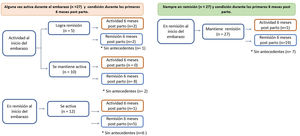
PostpartoDurante el postparto se obtuvo información del 80% de las pacientes, todas continuaban con sus terapias de mantenimiento (fig. 2). De aquellas que presentaron brotes en el embarazo, un 17% presentaron actividad inflamatoria durante el postparto vs. sólo un 5% en aquellas que iniciaron y mantuvieron la remisión durante todo el embarazo (p = 0,241).
DiscusiónLa evolución favorable no sólo del embarazo, sino también de la EII durante la gestación, dependerán de la colaboración entre un equipo multidisciplinario cohesionado y bien preparado y una paciente bien informada y proactiva. Nuestro estudio confirma que el control de la actividad y el mantenimiento de la remisión antes y durante el embarazo tienen un impacto en el desarrollo de este y del recién nacido.
Las mujeres con EII frecuentemente tienen preocupaciones sobre la seguridad de continuar con el tratamiento farmacológico para la EII durante el embarazo, particularmente por el riesgo de malformaciones congénitas u otros resultados fetales adversos21. Es este miedo al efecto negativo de los fármacos sobre el embarazo, principalmente durante el primer trimestre, la principal causa señalada por los pacientes para una disminución de la adherencia al tratamiento6. En nuestro estudio, nueve pacientes suspendieron el tratamiento previo al embarazo o durante las primeras semanas de gestación. No deja de ser preocupante que en cinco de estos casos fue por indicación de un médico, confirmando la necesidad de una educación no sólo a las pacientes sino también al equipo de salud4. De las nueve pacientes que suspendieron el tratamiento previo al embarazo o durante las primeras semanas de gestación, seis presentaron un brote.
El consejo preconcepcional es esencial para dar seguridad respecto a las terapias y enfatizar la importancia de lograr la remisión de la enfermedad previo a la concepción, permitiendo mejorar la evolución de la enfermedad y del embarazo22. En nuestro estudio, un mayor porcentaje de las pacientes que se mantuvieron en remisión habían recibido consejo preconcepcional, confirmando la importancia en la evolución de la EII durante la gestación.
La actividad inflamatoria al momento de la concepción es un importante predictor de la evolución de la enfermedad durante el embarazo. Un meta-análisis que incluyó 14 estudios, mostró que pacientes con actividad clínica al momento de la concepción tenían dos veces mayor riesgo de presentar algún grado de actividad durante el embarazo9,23. Esto también ha sido confirmado en un estudio prospectivo que incluyó 229 pacientes embarazadas con EII, donde la presencia de actividad al momento de la concepción se asoció a un mayor riesgo de presentar un brote durante la gestación con un odds ratio de 7,6624. Nuestro estudio está en línea con estos resultados, 31% de las pacientes en remisión al momento de la concepción presentaron algún grado de actividad inflamatoria vs. un 76% en el grupo que presentó actividad de la enfermedad al inicio del embarazo (p = 0,002).
En mujeres con EII en remisión al momento de la concepción, el riesgo de brotes durante el embarazo es de aproximadamente 30%25, similar a las pacientes no embarazadas. Se ha sugerido que esta probabilidad de actividad de la enfermedad sería mayor durante el primer y segundo trimestre del embarazo, y dentro de los seis meses postparto26,27. En nuestro estudio, 12 de las 39 pacientes en remisión al momento de la concepción presentaron algún grado de actividad inflamatoria durante el embarazo y de las 27 que alcanzaron la remisión durante la gestación, sólo una presentó un brote durante los seis meses postparto. Estos resultados confirman nuevamente que el equipo tratante debe enfatizar la necesidad de la adherencia al tratamiento farmacológico no sólo antes de la gestación, sino también durante el embarazo y puerperio.
Estudios han demostrado que la medición de CF no se afectaría durante el embarazo, siendo un biomarcador útil para evaluar la actividad inflamatoria en este período28–30. En un estudio que incluyó 219 mujeres embarazadas con EII en tratamiento con anti-TNF, mostró que los niveles de CF se correlacionaron con la actividad de la enfermedad; pacientes con enfermedad activa tenían concentraciones significativamente mayores de CF en comparación con aquellas que estaban en remisión clínica (p < 0,003)31. Nuestros resultados también muestran que CF fue significativamente mayor en pacientes con actividad clínica vs aquellas en remisión (mediana 496 μg/g vs. 35 μg/g; p < 0,0001), confirmando su utilidad en el seguimiento de la actividad de la enfermedad durante el embarazo.
Existe suficiente información que sustenta la seguridad de la colonoscopía en pacientes embarazadas que presentan signos y síntomas relacionados con un posible diagnóstico de EII o con deterioro de esta32. La sigmoidoscopía puede ser realizada sin sedación ni preparación en cualquier momento de la gestación4. Por lo tanto, cuando está indicado, este procedimiento no debe ser diferido ya que puede afectar directamente la toma de decisiones para alcanzar resultados óptimos tanto obstétricos como gastrointestinales. En nuestro estudio, el estudio endoscópico se realizó en cuatro pacientes sin complicaciones, permitiendo en dos de ellas optimizar su tratamiento al confirmar la presencia de actividad endoscópica.
En relación con el tratamiento, la literatura respalda la seguridad de continuar la mayoría de los fármacos para la EII durante el embarazo4,16, situación que ocurrió en todas las pacientes, incluyendo aquellas que se encontraban con tiopurínicos y anti-TNF. Con respecto al tratamiento de la crisis, tres pacientes iniciaron AZT durante el primer trimestre de gestación. Aunque ninguna de ellas presentó eventos adversos, recientemente se ha sugerido que el tratamiento con tiopurínicos no debería ser iniciado durante el embarazo dado el largo período de tiempo requerido para actuar (ocho a 12 semanas) y los potenciales eventos adversos en la madre, donde destaca la mielotoxicidad, hepatotoxicidad y la pancreatitis aguda por fármacos4. Por otra parte, los anti-TNF son fármacos seguros en fase de inducción y mantenimiento en caso de enfermedad durante el embarazo33, aunque se recomienda que la última dosis sea: infliximab 30-32 semanas, adalimumab 36-38 y golimumab 34-36 semanas5. En nuestro estudio, una paciente inicio IFX en la semana 10 de embarazo sin presentar complicaciones durante la gestación.
Se ha sugerido que la medición de los niveles séricos de los biológicos antes de la concepción permitiría optimizar y personalizar la terapia evitando alcanzar de esta manera niveles subterapéuticos que aumenten la probabilidad de presentar un brote durante el embarazo o supraterapéuticos que puedan incrementar el riesgo en la madre y en el feto4. Es importante considerar que, durante el embarazo, estos fármacos pueden sufrir modificaciones en su farmacocinética, variable que debe ser considerada al momento de interpretar estos resultados34. En nuestro estudio, la medición de los niveles de anti-TNF fue realizada en siete pacientes, sin realizar un cambio en la terapia en ninguna de ellas.
En lo que concierne a la evolución del embarazo, los abortos espontáneos ocurrieron en el 10%, cifra muy similar a lo publicado13. Los seis casos en nuestro estudio ocurrieron en el grupo que se encontraban activas al momento de la concepción y que mantuvo esta condición durante la gestación. Tres de estas pacientes tenían el antecedente de uso de AZT durante el primer trimestre del embarazo. A pesar de que esta asociación fue inicialmente planteada35, estudios recientes han descartado que la exposición de los tiopurínicos durante el primer trimestre se asocie a un mayor riesgo de aborto espontáneo o malformaciones congénitas36,37. Sin duda, el factor de riesgo más importante de aborto espontáneo es la presencia de actividad inflamatoria intestinal moderada a grave al momento de la concepción o durante el embarazo13, tal como sucedió en nuestro estudio.
En las pacientes embarazadas con EII, la vía del parto, ya sea vaginal o cesárea, debe estar basada principalmente en las indicaciones obstétricas4. La presencia de una enfermedad perianal activa, fístula rectovaginal o reservorio, son situaciones que deben plantear la cesárea como vía del parto38. A pesar de ello, la frecuencia de cesáreas es dos veces mayor en mujeres con EII que en la población general39. En nuestro estudio el 68% de los embarazos se resolvieron por cesárea, siendo un 40% de estas de urgencia debido a causas obstétricas. Estos resultados están sobre el porcentaje nacional, un estudio recientemente publicado con la experiencia de dos centros universitarios mostró que el porcentaje de cesáreas en población general fue entre 35,7-55,7%39. Sin duda, nuestro mayor porcentaje de cesáreas debe hacernos replantear el manejo de estos pacientes.
La información ha demostrado que 85% de las mujeres con EII tienen un embarazo sin complicaciones con tasas de eventos adversos fetales similares a los de la población general40. Sin embargo, la presencia brotes durante el embarazo tiene un impacto negativo en el feto pudiendo conducir a un parto prematuro, bajo peso al nacer e incluso muerte fetal41,42. Cuando se evalúan el riesgo de parto prematuro y muerte fetal, algunos estudios no han podido confirmar estos resultados13,43,44, lo cual puede explicarse por diferencias en la extensión y gravedad de la actividad de la enfermedad en las poblaciones estudiadas26,44. Nuestros resultados confirman que tener algún grado de actividad inflamatoria durante el embarazo aumenta de manera significativa la probabilidad de tener un menor peso al nacer.
De acuerdo con el programa de inmunización en el RN, se ha sugerido que las vacunas virus vivos o bacilos atenuados deben ser postergadas al menos seis meses postparto en los recién nacido de madres que han estado expuestas a terapia anti-TNF45. En nuestro estudio, ningún recién nacido de madre en tratamiento con este biológico recibió una vacuna virus vivo antes de los 12 meses.
Nuestro estudio tiene ciertas fortalezas; al mostrar la experiencia de un centro terciario con un Programa de EII establecido, proporciona una visión de la práctica clínica diaria del manejo del embarazo en pacientes con EII. Segundo, la actividad inflamatoria fue evaluada con CF en el 72% de las pacientes, lo que permite un manejo adecuado según objetivos1. Por otra parte, sabemos que existen también limitaciones. Primero, nuestro estudio es retrospectivo y carece de un grupo control con el cual comparar los resultados del embarazo y del recién nacido. Segundo, algunas pacientes tuvieron el término de su embarazo en otro centro, lo que nos impidió tener la información adecuada sobre la gravedad de la actividad inflamatoria previo al parto y la decisión de realizar una cesárea. Finalmente, la falta de acceso a la información durante los seis meses postparto en algunas pacientes puede afectar nuestros resultados.
En conclusión, la EII afecta a mujeres en edad reproductiva, planteando inquietudes importantes en la paciente y el equipo tratante. Un adecuado consejo preconcepcional y buena interacción entre obstetra/gastroenterólogo permitirán un acceso a información clara y adecuada. El objetivo principal es optimizar el tratamiento para lograr la remisión al momento de la concepción manteniendo está condición durante todo el embarazo. Lograr estas metas permitirá sin duda alcanzar con mayor probabilidad una evolución favorable en la madre y en el recién nacido.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.