En un estudio previo demostramos que un pequeño programa de formación mejoraba los indicadores de calidad de la esofagogastroduodenoscopia (EGD) que llegaban a los estándares recomendados. Sin embargo, desconocemos el efecto de esta formación a largo plazo. El objetivo de este estudio fue valorar la calidad de las EGD después de 3años de haber realizado un programa de mejora.
Material y métodosEstudio comparativo de 2 cohortes: EGD posteriores a un programa de formación realizado en 2016 (grupo A) y EGD en enero-marzo de 2019 (grupo B). El grupo B se dividió en 2 subgrupos: endoscopistas que habían participado en el programa de formación previo (B1) y los que no (B2). Se utilizaron los indicadores de calidad intraprocedimiento recomendados por la ASGE-ACG.
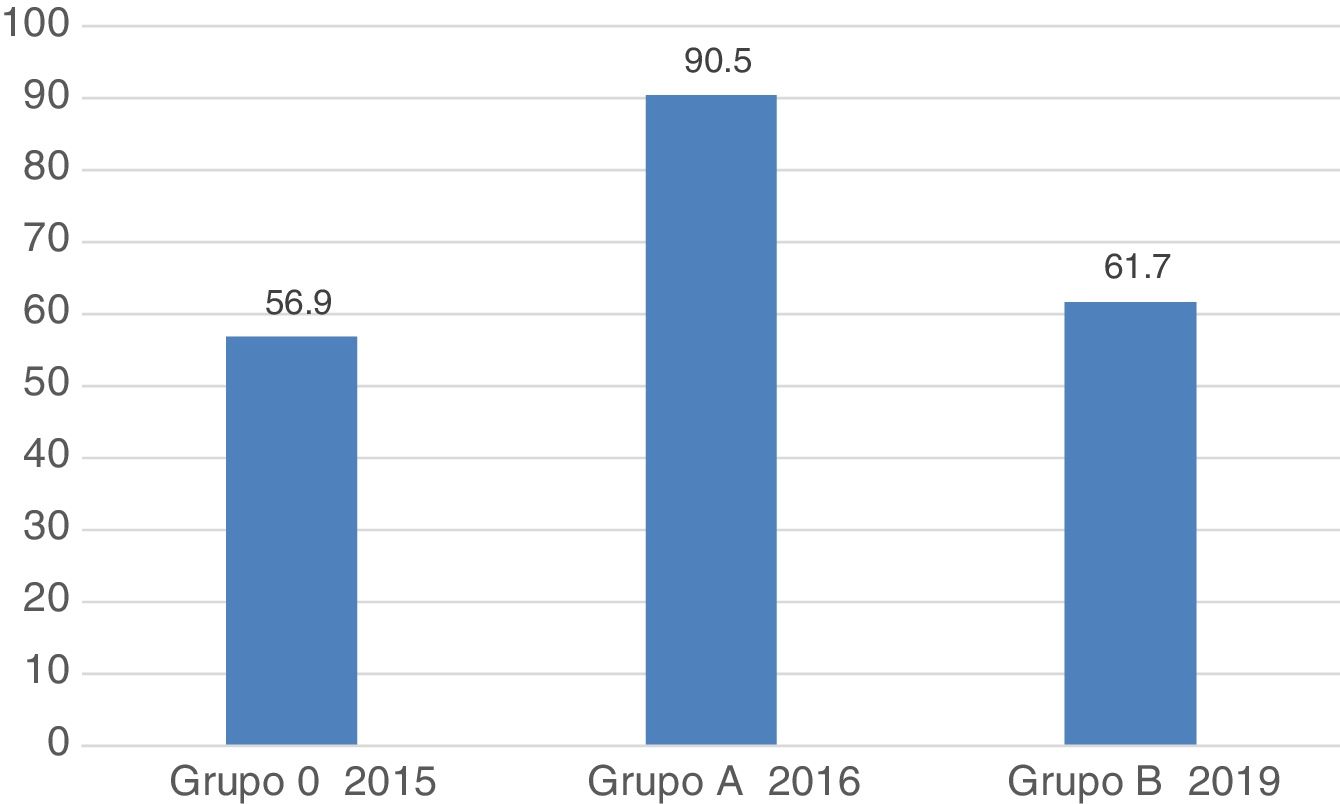
ResultadosSe analizaron un total de 1.236 EGD, 600 en el grupo A y 636 en el B (439 subgrupo B1 y 197 subgrupo B2). El número de exploraciones completas fue inferior en el grupo B (566 [94,3%] vs. 551 [86,6%]; p<0,001). Se observó una disminución significativa en prácticamente todos los indicadores de calidad que, además, no alcanzaron los estándares recomendados: retroversión gástrica (96% vs. 81%; p<0,001); protocolo de biopsias de Seattle (86% vs. 50%; p=0,03), descripción de la lesión en la hemorragia (100% vs. 62%; p<0,01), toma de ≥4 biopsias en sospecha de celiaquía (92,5% vs. 18%; p<0,001), fotodocumentación de lesión (94% vs. 90%; p<0,05). Cuando consideramos el global de la prueba (incluyendo la actuación correcta y la fotodocumentación adecuada), también se observó una disminución significativa (90,5% vs. 62%; p<0,001). No hubo diferencias entre los subgrupos B1 y B2.
ConclusionesLa mejora observada en 2016 tras un programa de formación no perdura a los 3años. Es necesario hacer programas de formación continuados para mantener la calidad de la EGD por encima de los estándares recomendados.
In a previous study we demonstrated that a simple training programme improved quality indicators of Oesophagogastroduodenoscopy (OGD) achieving the recommended benchmarks. However, the long-term effect of this intervention is unknown. The aim of this study was to assess the quality of OGDs performed 3 years after of having completed a training programme.
Material and methodsA comparative study of 2 cohorts was designed as follows: Group A included OGDs performed in 2016 promptly after a training programme and Group B with OGDs performed from January to March 2019, this group was also divided into 2 subgroups: subgroup B1 of Endoscopists who had participated in the previous training programme and subgroup B2 of Endoscopists who had not. The intra-procedure quality indicators proposed by ASGE-ACG were used.
ResultsA total of 1236 OGDs were analysed, 600 from Group A and 636 from Group B (439 subgroup B1 and 197 subgroup B2). The number of complete examinations was lower in Group B (566 [94.3%] vs. 551 [86.6%]; p<0.001). A significant decrease was observed in nearly all quality indicators and they did not reach the recommended benchmarks: retroflexion in the stomach (96% vs. 81%; p<0.001); Seattle biopsy protocol (86% vs. 50%; p=0.03), description of the upper GI bleeding lesion (100% vs. 62%; p<0.01), sufficient intestinal biopsy specimens (at least 4) in suspected coeliac disease (92.5% vs. 18%; p<0.001), photo documentation of the lesion (94% vs. 90%; p<0.05). Regarding the overall assessment of the procedure (including correct performance and adequate photo documentation), a significant decrease was also observed (90.5% vs. 62%; p<0.001). There were no differences between subgroups B1 and B2.
ConclusionsThe improvement observed in 2016 after a training programme did not prevail after 3 years. In order to keep the quality of OGDs above the recommended benchmarks, it is necessary to implement continuous training programmes.
La esofagogastroduodenoscopia (EGD) es un procedimiento relevante en el diagnóstico, tratamiento, seguimiento y prevención de afecciones gastrointestinales ya que permite una correcta visualización del lumen y la superficie mucosa del esófago, estómago y duodeno proximal, además de permitir la toma de fotografías, grabación de videos y toma de biopsias. Asimismo, se pueden realizar numerosos procedimientos terapéuticos: tratamientos de hemorragia digestiva alta, ligadura con bandas, escleroterapia, polipectomías, ablación de lesiones precancerosas, entre otros1.
Existe entre endoscopistas una gran variedad en la técnica de la EGD y en el uso de terminología y protocolos estandarizados, lo que determina una falta de uniformidad en el diagnóstico, interpretación y tratamiento de las patologías.
El objetivo más importante de la práctica médica es poder brindar la mejor calidad de atención al paciente. Por ello es crucial establecer parámetros que nos permitan medir la calidad y compararla con parámetros de referencia2.
Según la American Society for Gastrointestinal Endoscopy (ASGE) y el American College of Gastroenterology (ACG), la calidad de la atención de salud se puede medir comparando el desempeño de un individuo o un grupo de individuos con un ideal o punto de referencia3. El parámetro particular que se utiliza para la comparación se denomina indicador de calidad. Los indicadores de calidad deben ser objetivos, factibles de ser medidos y estar asociados a una mejora en el manejo del paciente y pueden ser reportados como una relación entre la incidencia del correcto desempeño y la oportunidad para el mismo o como la proporción de intervenciones que logran un objetivo predefinido3.
Cabe destacar que existen muchos estudios sobre calidad en la colonoscopia4 no así sobre la EGD5. La ASGE-ACG publicó una primera propuesta de indicadores de calidad de la EGD en 2006 y esta fue actualizada en 2015. Por otro lado, la European Society of Gastrointestinal Endoscopy (ESGE) y la United European Gastroenterology (UEG) presentaron su guía de indicadores de calidad en EGD en 20166. Utilizando los indicadores de calidad propuestos por la ASGE-ACG, nuestro grupo realizó un estudio para evaluar la calidad de las EGD realizadas en la Unidad de Endoscopia del Hospital Clínic antes y después de un programa de formación con el que se consiguió mejorar los indicadores de calidad que, además, alcanzaron los estándares recomendados en su mayoría7. Sin embargo, se desconoce la durabilidad del impacto de este programa de formación a largo plazo.
El objetivo de este estudio fue valorar el cumplimiento de los indicadores de calidad intraprocedimiento de las EGD realizadas en nuestro centro 3años después de un programa de formación y compararlo con los logrados en 2016 inmediatamente después de la realización del programa.
Materiales y métodosDiseñoEstudio comparativo de 2 cohortes: una prospectiva (grupo A) y otra retrospectiva (grupo B), inmediatamente después (en 2016) y a los 3años (en 2019) de un programa de formación, respectivamente. El estudio fue aprobado por el Comité de Ética e Investigación del Hospital Clínic.
Sujetos de estudioTodas las EGD realizadas en estos 2 periodos en la Unidad de Endoscopia del Hospital Clínic de Barcelona (hospital terciario de alta complejidad).
MétodoSe revisaron retrospectivamente las EGD realizadas desde el 1 de enero al 31 de marzo de 2019, a través de la minuciosa revisión de los informes elaborados con el software ENDOBASE® e información del sistema informático general del hospital (SAP). Se recogió información referente a 60 variables intraprocedimiento de cada EGD a través de hojas de recolección de datos y posteriormente volcadas a una plantilla de datos. Las EGD de este periodo se dividieron a su vez en 2 subgrupos según fueron realizadas por endoscopistas que habían participado en el programa de formación previo o no (subgrupo B1 y subgrupo B2, respectivamente). Por otro lado, la información referente a las EGD correspondientes al 2016 fue extraída de la base de datos del estudio previo.
La medición de los indicadores de calidad se realizó calculando la proporción de las intervenciones que lograron un objetivo predefinido y se expresaron en porcentajes.
Definiciones- –
Exploración completa y documentada: menciona llegada a segunda porción duodenal y realización de retroflexión en fundus gástrico que, además, están documentados por fotografía.
- –
Actuación correcta en realización de procedimientos: se ha realizado el protocolo de biopsias o el tratamiento correspondiente según la patología.
- –
Fotodocumentación correcta de lesiones: se han tomado fotografías de las anormalidades y/o lesiones que, además, se han documentadas correctamente.
- –
Valoración global correcta: exploración completa, actuación correcta y fotodocumentación de la lesión si procede.
Las variables cualitativas se expresan en valores absolutos y sus porcentajes y las cuantitativas como media ± desviación estándar. Para las comparaciones, se utilizó la prueba de chi cuadrado para las variables cualitativas y la prueba t de Student para las cuantitativas. La base de datos fue recodificada para el software estadístico SPSS v.22 de IBM con el que se hizo el análisis de los datos.
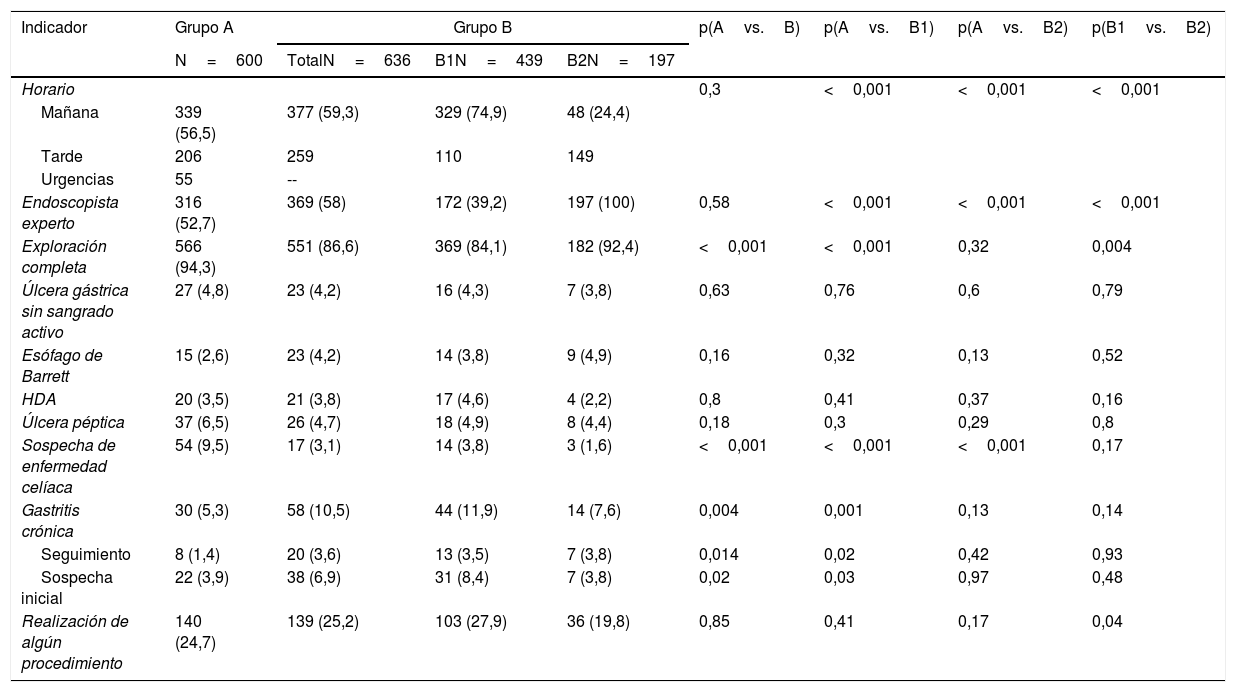
ResultadosSe incluyeron un total de 1.236 EGD, 600 en el grupo A y 636 en el grupo B (439 en el subgrupo B1 y 197 en el B2). El número de endoscopistas participantes fueron 31 en el grupo A y 33 en el grupo B (22 en el subgrupo B1 y 11 en el B2). En ambos grupos se realizaron mayor número de procedimientos por la mañana (grupo A, 339 [56,5%] vs. grupo B, 377 [59,3%]; p=0,3) y no hubo diferencias en cuanto al número de EGD realizadas por endoscopistas expertos (grupo A, 316 [52,7%] vs. grupo B, 369 [58%]; p=0,58) (tabla 1). En el grupo B no se diferenciaron las EGD realizadas de forma urgente. En cuanto al número de exploraciones completas, en el periodo 2019 el número fue inferior (grupo A, 566 [94,3%] vs. grupo B, 551 [86,6%]; p<0,001) (tabla 1). Al analizar las causas de las exploraciones incompletas, en el segundo periodo se realizaron más EGD terapéuticas (grupo A, 25[4,2%] vs. grupo B, 62 [9,75%]; p<0,001) y los pacientes presentaban restos de alimentos (grupo A, 5 [0,83%] vs. grupo B, 20 [3,14%]; p<0,001).
Características de los grupos
| Indicador | Grupo A | Grupo B | p(Avs.B) | p(Avs.B1) | p(Avs.B2) | p(B1vs.B2) | ||
|---|---|---|---|---|---|---|---|---|
| N=600 | TotalN=636 | B1N=439 | B2N=197 | |||||
| Horario | 0,3 | <0,001 | <0,001 | <0,001 | ||||
| Mañana | 339 (56,5) | 377 (59,3) | 329 (74,9) | 48 (24,4) | ||||
| Tarde | 206 | 259 | 110 | 149 | ||||
| Urgencias | 55 | -- | ||||||
| Endoscopista experto | 316 (52,7) | 369 (58) | 172 (39,2) | 197 (100) | 0,58 | <0,001 | <0,001 | <0,001 |
| Exploración completa | 566 (94,3) | 551 (86,6) | 369 (84,1) | 182 (92,4) | <0,001 | <0,001 | 0,32 | 0,004 |
| Úlcera gástrica sin sangrado activo | 27 (4,8) | 23 (4,2) | 16 (4,3) | 7 (3,8) | 0,63 | 0,76 | 0,6 | 0,79 |
| Esófago de Barrett | 15 (2,6) | 23 (4,2) | 14 (3,8) | 9 (4,9) | 0,16 | 0,32 | 0,13 | 0,52 |
| HDA | 20 (3,5) | 21 (3,8) | 17 (4,6) | 4 (2,2) | 0,8 | 0,41 | 0,37 | 0,16 |
| Úlcera péptica | 37 (6,5) | 26 (4,7) | 18 (4,9) | 8 (4,4) | 0,18 | 0,3 | 0,29 | 0,8 |
| Sospecha de enfermedad celíaca | 54 (9,5) | 17 (3,1) | 14 (3,8) | 3 (1,6) | <0,001 | <0,001 | <0,001 | 0,17 |
| Gastritis crónica | 30 (5,3) | 58 (10,5) | 44 (11,9) | 14 (7,6) | 0,004 | 0,001 | 0,13 | 0,14 |
| Seguimiento | 8 (1,4) | 20 (3,6) | 13 (3,5) | 7 (3,8) | 0,014 | 0,02 | 0,42 | 0,93 |
| Sospecha inicial | 22 (3,9) | 38 (6,9) | 31 (8,4) | 7 (3,8) | 0,02 | 0,03 | 0,97 | 0,48 |
| Realización de algún procedimiento | 140 (24,7) | 139 (25,2) | 103 (27,9) | 36 (19,8) | 0,85 | 0,41 | 0,17 | 0,04 |
Datos expresados como n (%).
Dentro de las exploraciones completas, se registró un descenso de casos con sospecha de enfermedad celíaca (grupo A, 54 [9,5%] vs. grupo B, 17 [3,1%]; p<0,01) y un aumento de pacientes con gastritis crónica (incluyendo seguimiento y sospecha inicial) (grupo A, 30 [5,3%] vs. grupo B, 58 [10,5%]; p<0,01). No hubo diferencias significativas entre grupos en otras situaciones que requieren un manejo concreto ni en cuanto al número de exploraciones que requirieron la realización de algún procedimiento (grupo A, 140 [24,7%] vs. grupo B, 139 [25,2%]; p=0,85) (tabla 1).
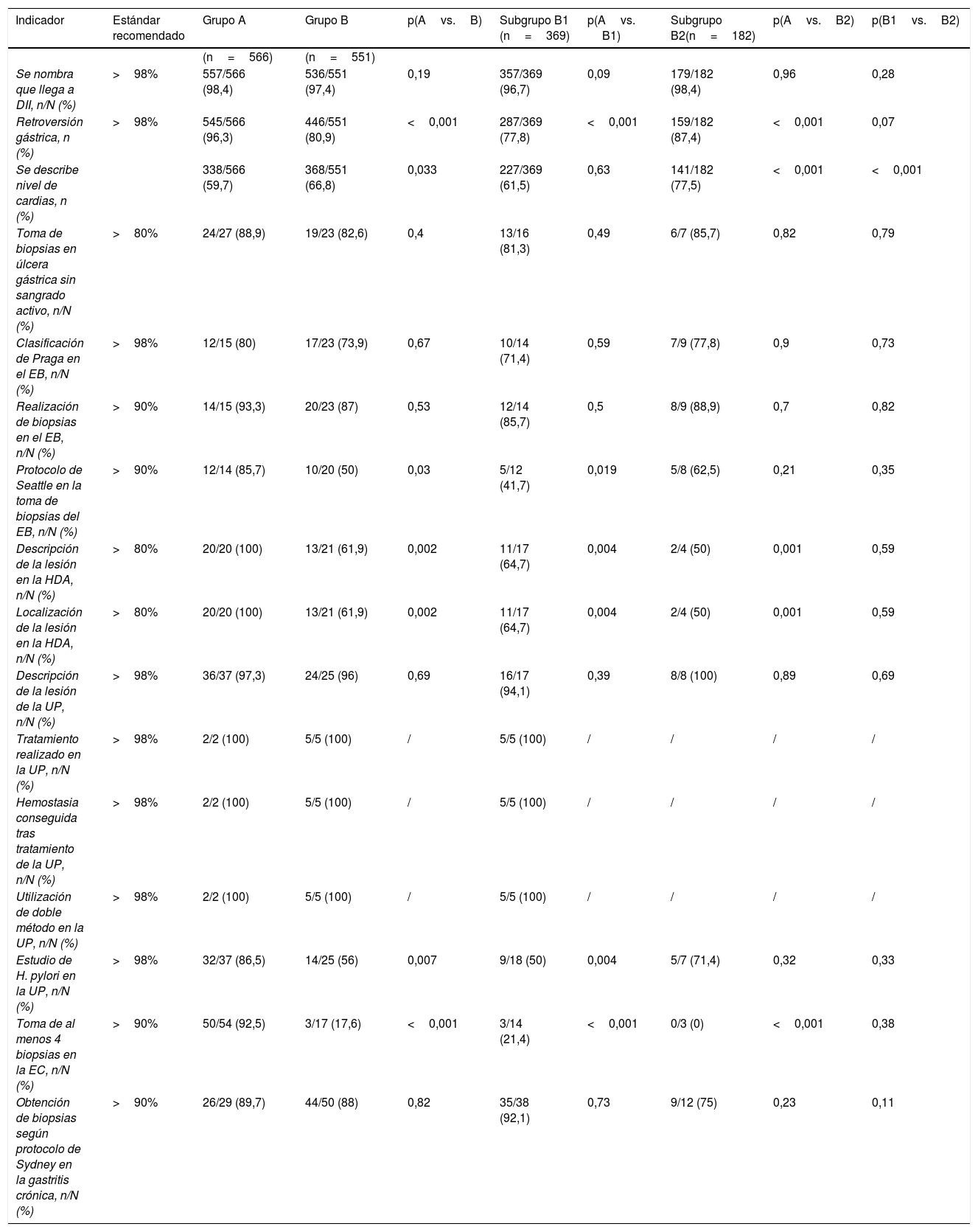
Los indicadores de calidad intraprocedimiento se midieron en las exploraciones completas y en varios de ellos se observó una disminución a los 3años de la formación que no llegó a alcanzar los estándares recomendados por ASGE-ACG como en el caso de mencionar que se llega a DII, la realización de retroversión en fundus y la descripción y localización de la lesión en la HDA. Este empeoramiento se observó en los dos subgrupos excepto en el caso de nombrar que se llega a DII que solo disminuyó por debajo del estándar en el subgrupo B1. El único indicador en el que hubo una mejora fue en la descripción del nivel del cardias (grupo A, 338 [59,7%] vs. grupo B, 368 [66,8%]; p=0,003), siendo esta mejoría a expensas del subgrupo de endoscopistas nuevos.
En el caso concreto del esófago de Barrett, no hubo mejoría en la utilización de la clasificación de Praga y el indicador siguió estando por debajo del 98% recomendado. En cuanto al cumplimiento del protocolo de Seattle, no solo seguimos por debajo del estándar sino que, además, hubo una disminución significativa que fue mayor en el subgrupo de endoscopistas que habían participado en la formación previa (tabla 2).
Indicadores de calidad intraprocedimiento en EGD
| Indicador | Estándar recomendado | Grupo A | Grupo B | p(Avs.B) | Subgrupo B1 (n=369) | p(Avs. B1) | Subgrupo B2(n=182) | p(Avs.B2) | p(B1vs.B2) |
|---|---|---|---|---|---|---|---|---|---|
| (n=566) | (n=551) | ||||||||
| Se nombra que llega a DII, n/N (%) | >98% | 557/566 (98,4) | 536/551 (97,4) | 0,19 | 357/369 (96,7) | 0,09 | 179/182 (98,4) | 0,96 | 0,28 |
| Retroversión gástrica, n (%) | >98% | 545/566 (96,3) | 446/551 (80,9) | <0,001 | 287/369 (77,8) | <0,001 | 159/182 (87,4) | <0,001 | 0,07 |
| Se describe nivel de cardias, n (%) | 338/566 (59,7) | 368/551 (66,8) | 0,033 | 227/369 (61,5) | 0,63 | 141/182 (77,5) | <0,001 | <0,001 | |
| Toma de biopsias en úlcera gástrica sin sangrado activo, n/N (%) | >80% | 24/27 (88,9) | 19/23 (82,6) | 0,4 | 13/16 (81,3) | 0,49 | 6/7 (85,7) | 0,82 | 0,79 |
| Clasificación de Praga en el EB, n/N (%) | >98% | 12/15 (80) | 17/23 (73,9) | 0,67 | 10/14 (71,4) | 0,59 | 7/9 (77,8) | 0,9 | 0,73 |
| Realización de biopsias en el EB, n/N (%) | >90% | 14/15 (93,3) | 20/23 (87) | 0,53 | 12/14 (85,7) | 0,5 | 8/9 (88,9) | 0,7 | 0,82 |
| Protocolo de Seattle en la toma de biopsias del EB, n/N (%) | >90% | 12/14 (85,7) | 10/20 (50) | 0,03 | 5/12 (41,7) | 0,019 | 5/8 (62,5) | 0,21 | 0,35 |
| Descripción de la lesión en la HDA, n/N (%) | >80% | 20/20 (100) | 13/21 (61,9) | 0,002 | 11/17 (64,7) | 0,004 | 2/4 (50) | 0,001 | 0,59 |
| Localización de la lesión en la HDA, n/N (%) | >80% | 20/20 (100) | 13/21 (61,9) | 0,002 | 11/17 (64,7) | 0,004 | 2/4 (50) | 0,001 | 0,59 |
| Descripción de la lesión de la UP, n/N (%) | >98% | 36/37 (97,3) | 24/25 (96) | 0,69 | 16/17 (94,1) | 0,39 | 8/8 (100) | 0,89 | 0,69 |
| Tratamiento realizado en la UP, n/N (%) | >98% | 2/2 (100) | 5/5 (100) | / | 5/5 (100) | / | / | / | / |
| Hemostasia conseguida tras tratamiento de la UP, n/N (%) | >98% | 2/2 (100) | 5/5 (100) | / | 5/5 (100) | / | / | / | / |
| Utilización de doble método en la UP, n/N (%) | >98% | 2/2 (100) | 5/5 (100) | / | 5/5 (100) | / | / | / | / |
| Estudio de H. pylori en la UP, n/N (%) | >98% | 32/37 (86,5) | 14/25 (56) | 0,007 | 9/18 (50) | 0,004 | 5/7 (71,4) | 0,32 | 0,33 |
| Toma de al menos 4 biopsias en la EC, n/N (%) | >90% | 50/54 (92,5) | 3/17 (17,6) | <0,001 | 3/14 (21,4) | <0,001 | 0/3 (0) | <0,001 | 0,38 |
| Obtención de biopsias según protocolo de Sydney en la gastritis crónica, n/N (%) | >90% | 26/29 (89,7) | 44/50 (88) | 0,82 | 35/38 (92,1) | 0,73 | 9/12 (75) | 0,23 | 0,11 |
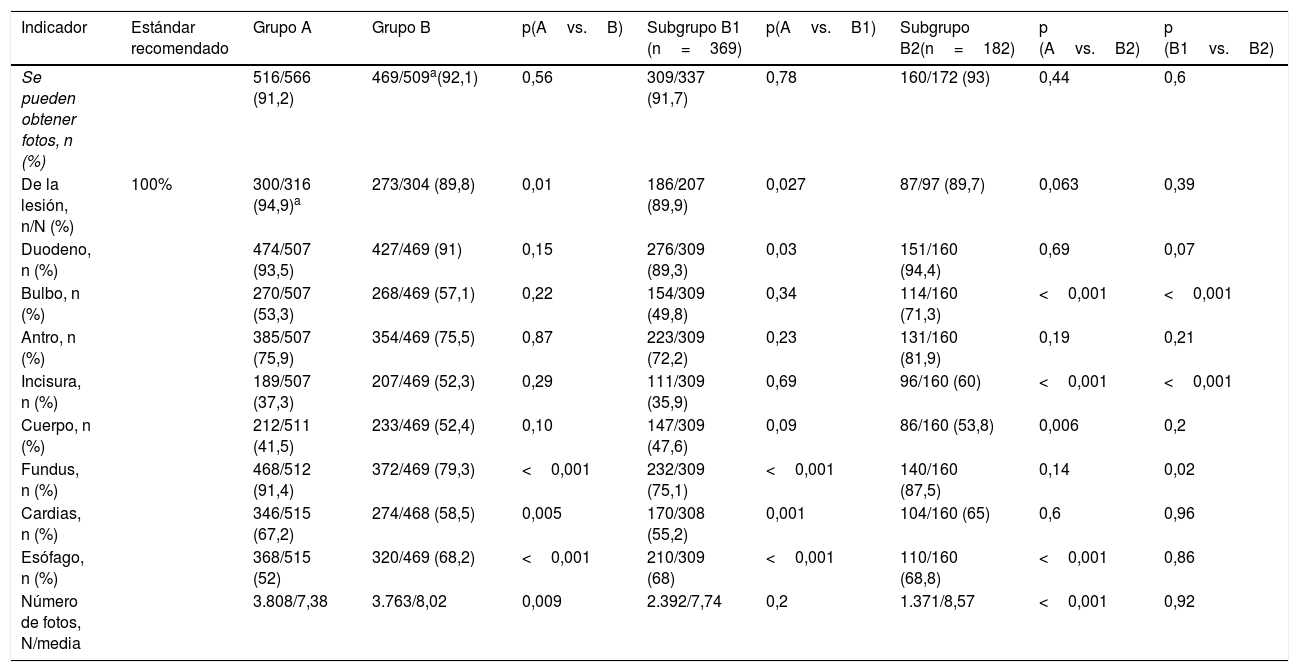
Respecto a la fotodocumentación (tabla 3), esta no pudo ser valorada en algunos casos del grupo B. Aunque no se objetivaron diferencias respecto a la cantidad de pruebas con fotografías (grupo A, 516/566 [91,2%] vs. grupo B, 469/509 [92,1%]; p=0,56), la media de fotografías fue mayor en el grupo B (grupo A, 7,38±3,75 vs. grupo B, 8,02±3,94; p<0,05). Sin embargo, la fotodocumentación de lesión/es muestra una caída significativa en el grupo B (300/316 [94,4%] vs. 273/304 [89,8%]; p=0,01), siendo el estándar recomendado por ASGE-ACG del 100%. Con relación a los puntos anatómicos, el cardias y fundus se fotografiaron más en el grupo A y el esófago en el grupo B.
Fotodocumentación
| Indicador | Estándar recomendado | Grupo A | Grupo B | p(Avs.B) | Subgrupo B1 (n=369) | p(Avs.B1) | Subgrupo B2(n=182) | p (Avs.B2) | p (B1vs.B2) |
|---|---|---|---|---|---|---|---|---|---|
| Se pueden obtener fotos, n (%) | 516/566 (91,2) | 469/509a(92,1) | 0,56 | 309/337 (91,7) | 0,78 | 160/172 (93) | 0,44 | 0,6 | |
| De la lesión, n/N (%) | 100% | 300/316 (94,9)a | 273/304 (89,8) | 0,01 | 186/207 (89,9) | 0,027 | 87/97 (89,7) | 0,063 | 0,39 |
| Duodeno, n (%) | 474/507 (93,5) | 427/469 (91) | 0,15 | 276/309 (89,3) | 0,03 | 151/160 (94,4) | 0,69 | 0,07 | |
| Bulbo, n (%) | 270/507 (53,3) | 268/469 (57,1) | 0,22 | 154/309 (49,8) | 0,34 | 114/160 (71,3) | <0,001 | <0,001 | |
| Antro, n (%) | 385/507 (75,9) | 354/469 (75,5) | 0,87 | 223/309 (72,2) | 0,23 | 131/160 (81,9) | 0,19 | 0,21 | |
| Incisura, n (%) | 189/507 (37,3) | 207/469 (52,3) | 0,29 | 111/309 (35,9) | 0,69 | 96/160 (60) | <0,001 | <0,001 | |
| Cuerpo, n (%) | 212/511 (41,5) | 233/469 (52,4) | 0,10 | 147/309 (47,6) | 0,09 | 86/160 (53,8) | 0,006 | 0,2 | |
| Fundus, n (%) | 468/512 (91,4) | 372/469 (79,3) | <0,001 | 232/309 (75,1) | <0,001 | 140/160 (87,5) | 0,14 | 0,02 | |
| Cardias, n (%) | 346/515 (67,2) | 274/468 (58,5) | 0,005 | 170/308 (55,2) | 0,001 | 104/160 (65) | 0,6 | 0,96 | |
| Esófago, n (%) | 368/515 (52) | 320/469 (68,2) | <0,001 | 210/309 (68) | <0,001 | 110/160 (68,8) | <0,001 | 0,86 | |
| Número de fotos, N/media | 3.808/7,38 | 3.763/8,02 | 0,009 | 2.392/7,74 | 0,2 | 1.371/8,57 | <0,001 | 0,92 |
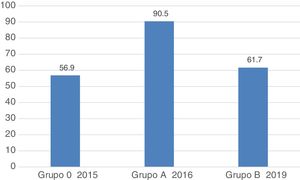
En cuanto a la valoración general a los 3años del programa de mejora, se registró un empeoramiento en los parámetros exploración completa y documentada, actuación correcta en la realización de procedimientos y fotodocumentación correcta de la lesión, por lo que el porcentaje de procedimientos valorados globalmente como correctos fue significativamente menor en el grupo B (grupo A, 512 [90,5%] vs. grupo B, 340 [61,7%]; p<0,001) (tabla 4, fig. 1). Este empeoramiento se observó en los 2 subgrupos, siendo peor los resultados globales en el subgrupo de endoscopistas que habían participado en el estudio previo.
Valoración general de la calidad de las EGD en los diferentes grupos
| Parámetro | Grupo A (N=566) | Grupo B (N=551) | p(Avs.B) | Subgrupo B1(N=369) | p(Avs.B1) | Subgrupo B2(N=182) | p(Avs.B2) | p(B1vs.B2) |
|---|---|---|---|---|---|---|---|---|
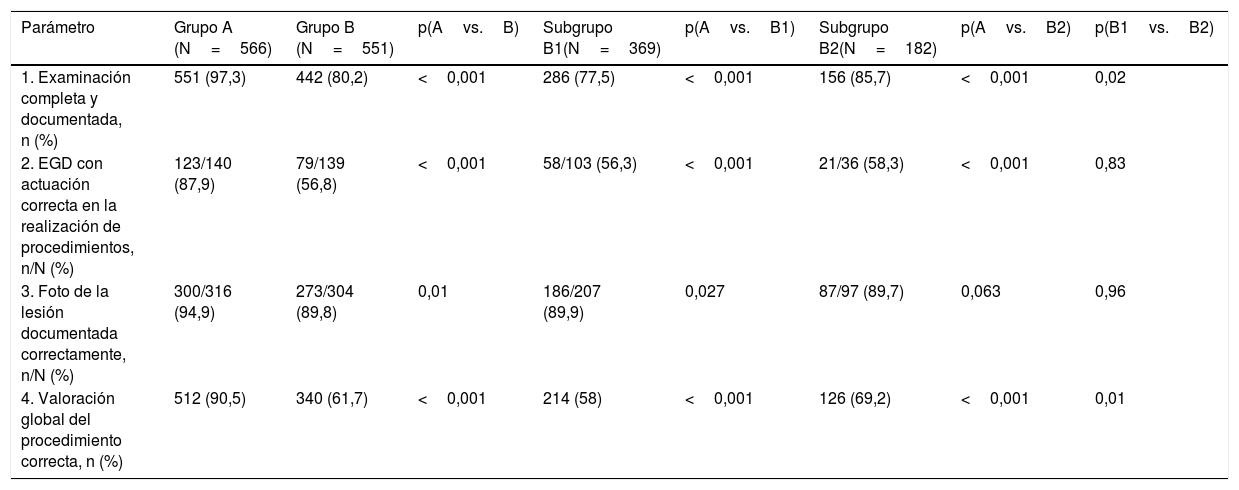
| 1. Examinación completa y documentada, n (%) | 551 (97,3) | 442 (80,2) | <0,001 | 286 (77,5) | <0,001 | 156 (85,7) | <0,001 | 0,02 |
| 2. EGD con actuación correcta en la realización de procedimientos, n/N (%) | 123/140 (87,9) | 79/139 (56,8) | <0,001 | 58/103 (56,3) | <0,001 | 21/36 (58,3) | <0,001 | 0,83 |
| 3. Foto de la lesión documentada correctamente, n/N (%) | 300/316 (94,9) | 273/304 (89,8) | 0,01 | 186/207 (89,9) | 0,027 | 87/97 (89,7) | 0,063 | 0,96 |
| 4. Valoración global del procedimiento correcta, n (%) | 512 (90,5) | 340 (61,7) | <0,001 | 214 (58) | <0,001 | 126 (69,2) | <0,001 | 0,01 |
La EGD es una prueba muy común en todas las Unidades de Endoscopia pero existe muy poca información acerca de cómo realizar una EGD de calidad. Además, y si lo comparamos con la colonoscopia de cribado, existe la dificultad añadida de que las indicaciones de la EGD son muy variadas y también lo son el tipo de lesiones detectadas, lo que conlleva una extensa variedad de posibles actuaciones. A todo esto, se suma la variabilidad que existe entre los propios endoscopistas y que no solo viene determinada por la experiencia sino también por la motivación y el conocimiento del manejo específico de ciertas patologías. Hasta donde sabemos, este es el primer estudio que ha evaluado la calidad de las EGD a largo plazo después de haber realizado un programa de formación y demuestra una caída significativa de la calidad global que prácticamente alcanza los valores previos a la formación.
En un primer estudio demostramos que, con un programa de formación sencillo que consistió en introducir unas mejoras en el programa Endobase y realizar una sesión informativa a los miembros de la Unidad, se consiguió mejorar los indicadores de calidad de la EGD7. Sin embargo, esta mejoría podría ser debida en parte a un factor ya conocido y es que los endoscopistas conocían que se estaba evaluando el impacto de la formación recibida. De este modo, las cifras actuales reflejarían una estabilidad de los indicadores (en muchos casos por debajo de los estándares recomendados) más que un empeoramiento de los mismos.
Al hablar de calidad de la EGD, el primer punto es establecer la definición de una EGD completa. Contrariamente a la colonoscopia, existen muy pocos datos y parece que alcanzar el duodeno es demasiado fácil como para que pueda relacionarse con una mejor detección de lesiones. En una guía reciente de la ESGE, los expertos estuvieron de acuerdo en aceptar que una exploración completa debe incluir la inspección del esófago, estómago y duodeno6. En nuestro estudio se observó una disminución de la mención de la llegada a duodeno a los 3años de la formación que no llegó a alcanzar los estándares recomendados por ASGE-ACG. Debido al aumento de la incidencia de cáncer gástrico a nivel del cardias8, la retroversión en fundus es también obligatoria para considerar que se ha explorado la totalidad del estómago y, sin embargo, también observamos una disminución en su cumplimiento.
El esófago de Barrett es una enfermedad con riesgo de progresión a neoplasia que puede prevenirse si se realiza un seguimiento adecuado. En los últimos años se ha hecho un esfuerzo por unificar la terminología que se utiliza para describirlo y se ha propuesto la clasificación de Praga9. Aunque en nuestro estudio el número de casos con esófago de Barrett fue pequeño, la utilización de la clasificación de Praga siguió estando por debajo del 98% recomendado. En cuanto al cumplimiento del protocolo de Seattle10, no solo seguimos por debajo del estándar sino que, además, hubo una disminución significativa respecto a la mejoría observada inmediatamente después de la formación. Estos resultados apoyan la recomendación de centralizar el seguimiento de estos pacientes en Unidades especializadas y con endoscopistas especialmente formados y dedicados. Esta misma recomendación sería aplicable al seguimiento de los pacientes con lesiones preneoplásicas gástricas como la gastritis crónica atrófica y la metaplasia intestinal11.
Para la descripción y localización documentada de la lesión en HDA el estándar recomendado es >80%. En nuestro caso, el 100% que se alcanzó después del programa de formación no se ha mantenido en el tiempo. Sin embargo, una posible explicación sería que en la cohorte reciente no se incluyeron las EGD realizadas de forma urgente por el equipo de guardia y ello podría haber influido en una documentación de peor calidad.
En todo paciente con enfermedad por úlcera péptica se debe realizar estudio de Helicobacter pylori, ya sea a través de biopsias para estudio histológico, test de aliento o test rápidos de ureasa12–14. Es por ello que el estándar recomendado del indicador de calidad es muy exigente y >98%. En nuestro medio sigue siendo práctica habitual la indicación de erradicación sin comprobación de infección en casos concretos como la existencia de úlcera duodenal, lo que podría explicar los bajos porcentajes reflejados en nuestro estudio en los dos periodos.
Respecto a la fotodocumentación, no existen datos que sugieran que el tomar fotos de todos los puntos anatómicos y de las lesiones mejore la capacidad diagnóstica de la EGD15. Sin embargo, y ya que actualmente se dispone de soporte informático adecuado para tomar y almacenar fotografías, la fotodocumentación debería considerarse un parámetro de calidad6. En este sentido, la ASGE-ACG es muy exigente y propone un estándar recomendado del 100%, estándar que en nuestro caso presentó un descenso significativo alcanzando tan solo el 89,8%. En cuanto al número de fotos, la ESGE recomienda un mínimo de 10 fotos que incluyen los siguientes puntos anatómicos de referencia: duodeno, papila mayor, antro, incisura, cuerpo, retroflexión en fundus, impronta diafragmática, borde superior de los pliegues gástricos, unión escamo-columnar, esófago proximal y esófago distal6,16. Hemos de destacar que en nuestro caso se observó un aumento de la media de fotografías.
Un dato llamativo referente al número de EGD completas es que, al dividir a los endoscopistas que participaron en el último periodo en 2 grupos según hubieran participado o no en el programa de formación previo, se observó una diferencia significativa favorable a estos últimos que, en general, eran endoscopistas más jóvenes incorporados más recientemente a la Unidad de Endoscopia y que, mayoritariamente, desarrollaban su trabajo en el horario de tardes. No se puede descartar que algunos de estos endoscopistas hubieran recibido una formación en endoscopia y redacción de informes previa a su incorporación.
La principal limitación de nuestro estudio es el diseño retrospectivo de la nueva cohorte, por lo que solo se analizaron los indicadores intraprocedimiento propuestos por la ASGE-ACG y no se pudo valorar el tiempo de las exploraciones. El tiempo ha demostrado aumentar la rentabilidad diagnóstica de la prueba de forma que, cuando se dedican 7min o más se detecta el doble de lesiones gástricas premalignas y malignas17 y, en el caso del esófago de Barrett, se detecta más displasia con un tiempo de inspección de un minuto por centímetro18. Sin embargo, la recolección retrospectiva evitó que los endoscopistas se vieran positivamente influidos por el hecho de participar en un estudio. Otra limitación es el pequeño número de casos de cada tipo de situación especial por separado, lo que impide sacar conclusiones robustas de los resultados. Asimismo, al tratarse de una Unidad de Endoscopia de un centro de tercer nivel, las exploraciones de algunas patologías concretas son realizadas por endoscopistas especializados y esto podría traducirse en que los resultados obtenidos no sean extrapolables a otros centros.
En base a los resultados presentados, creemos necesario implementar otros mecanismos para identificar vulnerabilidades y crear oportunidades de mejora con el fin último de asegurar una calidad en el servicio brindado a los pacientes. Tales mecanismos podrían ser auditorías periódicas que permitirían monitorizar la mejora tras la identificación de puntos débiles10. Este efecto, sumado a programas de entrenamiento y simulaciones en diferentes técnicas, podría resultar en un aumento significativo de la calidad de la EGD19.
ConclusionesLa mejoría observada en los indicadores de calidad intraprocedimiento de la EGD después de un programa de formación sencillo no se mantienen en el tiempo, de forma que no superan los estándares de calidad establecidos por la ASGE-AGA. Es por tanto necesario implementar programas de formación continuados.
Conflicto de interesesNinguno.