Los pacientes cirróticos presentan frecuentemente complicaciones graves de su enfermedad que requieren ingreso en la UCI. La encefalopatía hepática gradoIII-IV, el shock séptico, el fracaso agudo sobre crónico y la hemorragia variceal son descompensaciones que precisan un tratamiento intensivo específico en el paciente cirrótico. La mayor eficacia de los tratamientos empleados en cuidados intensivos y la generalización de los programas de trasplante hepático han mejorado de manera sustancial el pronóstico del paciente cirrótico crítico, hecho que ha facilitado su ingreso en las unidades de terapia intensiva. Sin embargo, el conocimiento de digestólogos e intensivistas sobre la patogenia, diagnóstico y tratamiento de estas complicaciones y sobre la evaluación pronóstica del paciente cirrótico crítico es limitado. Las alteraciones hemodinámicas y en la coagulación características de estos pacientes y la disfunción inmune que presentan aumentan la complejidad del tratamiento, el riesgo de presentar nuevas complicaciones y su mortalidad en comparación con la población general. Estas características diferenciales tienen implicaciones diagnósticas y terapéuticas clínicamente relevantes que deben ser conocidas por los intensivistas generales. En este contexto, la Sociedad Catalana de Digestología encomendó a un grupo de expertos la redacción de un documento de posicionamiento sobre la evaluación y el tratamiento del paciente cirrótico crítico. El presente artículo describe las recomendaciones acordadas en las reuniones de consenso y sus principales conclusiones.
Cirrhotic patients often develop severe complications requiring ICU admission. Grade III-IV hepatic encephalopathy, septic shock, acute-on-chronic liver failure and variceal bleeding are clinical decompensations that need a specific therapeutic approach in cirrhosis. The increased effectiveness of the treatments currently used in this setting and the spread of liver transplantation programs have substantially improved the prognosis of critically ill cirrhotic patients, which has facilitated their admission to critical care units. However, gastroenterologists and intensivists have limited knowledge of the pathogenesis, diagnosis and treatment of these complications and of the prognostic evaluation of critically ill cirrhotic patients. Cirrhotic patients present alterations in systemic and splanchnic hemodynamics, coagulation and immune dysfunction what further increase the complexity of the treatment, the risk of developing new complications and mortality in comparison with the general population. These differential characteristics have important diagnostic and therapeutic implications that must be known by general intensivists. In this context, the Catalan Society of Gastroenterology and Hepatology requested a group of experts to draft a position paper on the assessment and treatment of critically ill cirrhotic patients. This article describes the recommendations agreed upon at the consensus meetings and their main conclusions.
La evaluación y el tratamiento de los pacientes con cirrosis y complicaciones graves de la enfermedad están evolucionando de forma muy rápida en los últimos años. La generalización del trasplante hepático, no solo para los pacientes con cirrosis «estable» sino también para aquellos que presentan complicaciones graves de la enfermedad, la mayor eficacia de las terapias intensivas empleadas en las unidades de críticos y la detección y tratamiento precoces de las complicaciones graves de la cirrosis, entre otros factores, han motivado una mejoría sustancial del pronóstico de los pacientes cirróticos críticos. No obstante, existen todavía muchos aspectos susceptibles de mejora relacionados tanto con entidades para las que aún no existe tratamiento específico (como el fallo hepático agudo sobre crónico, o acute-on-chronic liver failure [ACLF]), o en las que el tratamiento actual es solo moderadamente eficaz (encefalopatía hepática [EH] o síndrome hepatorrenal [SHR]), como con las limitaciones que existen en la actualidad para el ingreso de pacientes cirróticos en unidades de cuidados intensivos (UCI). Es importante, asimismo, que el equipo médico (digestólogos, internistas, intensivistas, cirujanos) y de enfermería que atiende a estos pacientes tenga un conocimiento adecuado de las complicaciones graves que ocurren en la cirrosis. En este contexto, la Societat Catalana de Digestologia encomendó la redacción de un documento de posicionamiento sobre la evaluación y el tratamiento del paciente cirrótico crítico a un grupo de expertos en el tema. Aunque el paciente cirrótico crítico presenta con frecuencia diversas descompensaciones de manera simultánea, para una mejor organización y comprensión el documento se divide en 6 partes: 1)Sepsis grave y shock séptico. 2)Insuficiencia renal aguda. 3)Encefalopatía hepática. 4)Hemorragia digestiva por varices esofagogástricas. 5)ACLF. 6)Evaluación pronostica y reglas de futilidad. El presente artículo describe las recomendaciones acordadas en las reuniones de consenso y sus principales conclusiones.
Sepsis grave y shock sépticoLa sepsis es la consecuencia de la reacción del huésped frente a la infección y se caracteriza por la liberación de diversos mediadores de la inflamación, como citocinas pro y antiinflamatorias y sustancias procoagulantes1,2. Estos mediadores son responsables de la respuesta sistémica a la infección, que es más intensa en los pacientes con cirrosis en comparación con la de los pacientes con infección sin cirrosis. Esto supone un mayor riesgo de desarrollar sepsis, sepsis grave (es decir, fallo de órganos o hipoperfusión tisular), shock séptico (hipotensión refractaria a la administración de volumen que requiere fármacos vasopresores), fallo multiorgánico y muerte1-4. La mortalidad hospitalaria de los pacientes con cirrosis y sepsis grave o shock séptico es más alta que en la población general, superando el 50 y el 80%, respectivamente5.
Reanimación inicialEl inicio rápido y secuencial de la reanimación en la fase aguda de la sepsis grave es una medida muy importante en cualquier paciente. Esta reanimación debe iniciarse lo antes posible una vez detectados los signos de hipoperfusión periférica y sin esperar al ingreso del paciente en unidades de críticos. En la población general, las guías clínicas actuales recomiendan los siguientes objetivos a alcanzar en las primeras 6h: presión arterial media ≥65mmHg, presión venosa central entre 8 y 12mmHg (12-15mmHg en pacientes ventilados), saturación venosa central de oxígeno ≥70% y diuresis ≥0,5ml/kg/h (objetivos precoces del tratamiento [OPT])6. La normalización de la concentración de lactato sérico es otro objetivo clínico relevante. Estos objetivos se alcanzan mediante la administración secuencial de fluidos, fármacos vasopresores, transfusiones y, en determinados pacientes, fármacos inotrópicos. Dos estudios multicéntricos recientes, también en población general, no han confirmado que el paquete de medidas incluidas en la OPT mejore la supervivencia en pacientes con sepsis grave, lo que sugiere que la disminución en la mortalidad reportada en estudios previos podría estar relacionada con el inicio precoz de la terapia convencional (administración precoz y enérgica de fluidos y de antibióticos)7,8. Tras la reanimación precoz en el área de urgencias o en las salas de hospitalización convencional, guiada o no por la OPT, los pacientes deben ser trasladados a un área de cuidados intensivos o intermedios.
Aunque no hay estudios que hayan evaluado los OPT en la cirrosis, la práctica clínica habitual sugiere que la reanimación precoz es tanto o más importante en los pacientes con cirrosis debido a su fragilidad. Los objetivos, sin embargo, pueden ser diferentes a los de la población general, ya que los pacientes con cirrosis presentan habitualmente presiones arteriales más bajas, una saturación venosa central de oxígeno más elevada (circulación hiperdinámica), diuresis y hematocrito más bajos y alteraciones en el metabolismo del lactato9,10.
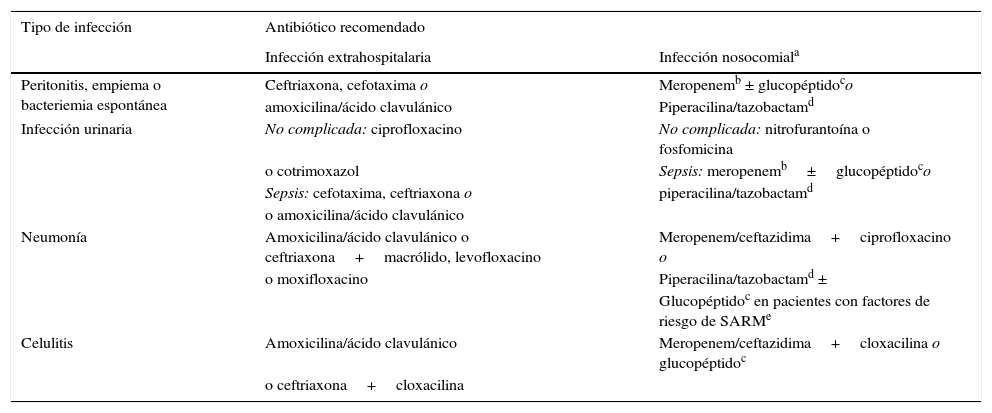
Diagnóstico precoz y tratamiento antibióticoEl diagnóstico precoz de la infección y el inicio del tratamiento antibiótico intravenoso lo antes posible son puntos esenciales en el manejo de estos pacientes. El diagnóstico de infección no siempre es fácil, ya que a menudo los pacientes presentan síntomas y alteraciones analíticas inespecíficas. La determinación de proteína C reactiva (PCR) sérica (≥10ng/ml) es útil para establecer la sospecha de infección, pero son frecuentes los falsos positivos y negativos2,4. Se llevará a cabo una evaluación clínica sistemática del paciente dirigida a identificar la causa de la infección: anamnesis y exploración física cuidadosas, hemocultivos (2 o más), paracentesis diagnóstica y cultivo de líquido ascítico, sedimento y cultivo de orina y radiografía de tórax. Es importante obtener las muestras para cultivo antes de administrar el tratamiento antibiótico empírico de amplio espectro, que siempre se debe iniciar lo antes posible, preferentemente dentro de la primera hora tras el diagnóstico. Un tratamiento antibiótico precoz adecuado mejora la supervivencia en la sepsis grave tanto en población general como en los pacientes con cirrosis11,12. La mortalidad aumenta un 10% por cada hora de retraso en el inicio de un tratamiento antibiótico adecuado. El tratamiento antibiótico empírico inicial debe cubrir los patógenos más probables teniendo en cuenta diferentes variables: el tipo de infección, si se trata de una infección comunitaria, asociada al sistema sanitario o intrahospitalaria (tabla 1), y la existencia de antecedentes de tratamientos antibióticos recientes o de infecciones o colonización por bacterias multirresistentes. Por otra parte, hay que considerar el perfil de resistencias de cada centro hospitalario. El tratamiento antibiótico empírico recomendado en las infecciones comunitarias son las cefalosporinas de tercera generación o la amoxicilina-ácido clavulánico. En las infecciones nosocomiales se recomienda un carbapenem o piperacilina-tazobactam, en áreas de alta y baja prevalencia de bacterias multirresistentes, respectivamente, asociados o no a un glucopéptido. Una vez se conocen los resultados de los cultivos y el antibiograma hay que ajustar el tratamiento (de-escalar) al(a los) antibiótico(s) más apropiado(s)4.
Tratamiento antibiótico empírico recomendado en infecciones bacterianas extrahospitalarias y nosocomiales en pacientes cirróticos
| Tipo de infección | Antibiótico recomendado | |
|---|---|---|
| Infección extrahospitalaria | Infección nosocomiala | |
| Peritonitis, empiema o bacteriemia espontánea | Ceftriaxona, cefotaxima o | Meropenemb ± glucopéptidoco |
| amoxicilina/ácido clavulánico | Piperacilina/tazobactamd | |
| Infección urinaria | No complicada: ciprofloxacino | No complicada: nitrofurantoína o fosfomicina |
| o cotrimoxazol | Sepsis: meropenemb±glucopéptidoco | |
| Sepsis: cefotaxima, ceftriaxona o | piperacilina/tazobactamd | |
| o amoxicilina/ácido clavulánico | ||
| Neumonía | Amoxicilina/ácido clavulánico o ceftriaxona+macrólido, levofloxacino | Meropenem/ceftazidima+ciprofloxacino o |
| o moxifloxacino | Piperacilina/tazobactamd ± | |
| Glucopéptidoc en pacientes con factores de riesgo de SARMe | ||
| Celulitis | Amoxicilina/ácido clavulánico | Meropenem/ceftazidima+cloxacilina o glucopéptidoc |
| o ceftriaxona+cloxacilina |
SARM: Staphylococcus aureus resistente a la meticilina.
Tratamiento recomendado asimismo en infecciones urinarias y neumonías asociadas al sistema sanitario. El tratamiento empírico de las infecciones espontáneas y de las celulitis asociadas al sistema sanitario debe decidirse en base a la gravedad de la infección (los enfermos con sepsis grave deberían recibir el esquema recomendado para infecciones nosocomiales) y a la prevalencia local de bacterias multirresistentes.
Las guías clínicas actuales en población general recomiendan la utilización de cristaloides (suero fisiológico y Ringer lactato) en la reanimación inicial del enfermo con sepsis grave. La dosis aconsejada es de al menos 30ml/kg las primeras 3h, aunque algunos pacientes pueden requerir dosis más elevadas6. Actualmente, el uso de hidroxietilalmidones está contraindicado en estos pacientes. Su administración en pacientes con sepsis grave o shock séptico se ha asociado con un aumento en la incidencia de insuficiencia renal y de terapia sustitutiva renal y, en algunos estudios, con una mayor mortalidad13,14.
El uso de albúmina en la reanimación en la sepsis grave y el shock séptico es un tema controvertido. Actualmente la albúmina se recomienda únicamente en enfermos que requieren cantidades sustanciales de cristaloides, para disminuir el riesgo de sobrecarga hídrica y de anasarca6. Este riesgo está aumentado en pacientes con cirrosis que frecuentemente presentan una hipoalbuminemia significativa, por lo que su uso podría estar más justificado en el paciente con cirrosis. Un estudio reciente en población general no ha demostrado beneficios sobre la supervivencia de la administración combinada de albúmina y cristaloides en comparación con cristaloides en pacientes con sepsis grave15. Pese a que su utilidad en pacientes con cirrosis y sepsis grave y shock séptico se debe evaluar específicamente, existen evidencias claras de que su administración en pacientes con peritonitis bacteriana espontánea, una minoría con sepsis grave, previene el desarrollo de SHR y mejora la supervivencia hospitalaria16.
Soporte vasoactivoLas guías actuales recomiendan la utilización de noradrenalina como agente vasoconstrictor de elección en pacientes con shock séptico6. La adrenalina (añadida a la noradrenalina o como sustituto de esta) puede utilizarse cuando se necesita otro agente vasopresor para mantener una presión arterial media adecuada. La vasopresina a dosis bajas (0,03U/min) y la terlipresina en perfusión constituyen alternativas a la adrenalina en este tipo de pacientes17. Actualmente la dopamina se usa solo en casos seleccionados debido a su mayor riesgo de inducción de arritmias en comparación con la noradrenalina18. La administración de dobutamina en enfermos con cirrosis y shock séptico es excepcional, ya que estos pacientes presentan habitualmente gastos cardíacos elevados. Solo se recomienda en pacientes con disfunción miocárdica clínicamente relevante.
Por otra parte, debemos tener en cuenta que los pacientes con cirrosis presentan hiporreactividad a los agentes vasopresores y, consecuentemente, un mayor riesgo de shock refractario. La presencia de insuficiencia suprarrenal relativa aumenta significativamente este riesgo10.
Insuficiencia suprarrenal relativa: esteroides a dosis de estrésLa insuficiencia suprarrenal relativa es frecuente en enfermos con cirrosis y sepsis grave o shock séptico (51-77%) y se asocia con inestabilidad hemodinámica, disfunción renal y una alta mortalidad (81% frente al 37% en pacientes sin disfunción adrenal)19-21. La eficacia de los esteroides a dosis estrés (50mg/6h i.v.) en pacientes con cirrosis y shock séptico no está clara. Un pequeño estudio de cohortes mostró que la administración de esteroides en pacientes con disfunción adrenal mejora la reversión del shock (96% vs 56%) y la supervivencia hospitalaria21. Sin embargo, un estudio aleatorizado reciente no mostró ningún beneficio de la administración de esteroides22. Las guías clínicas actuales en población general solo recomiendan la administración de esteroides a dosis de estrés en enfermos con shock refractario6.
Otras terapias de soporteVentilación mecánica protectoraLa mortalidad en la UCI de los pacientes con cirrosis y sepsis grave que requieren ventilación mecánica es muy alta (alrededor del 70%)23. Una ventilación protectora (volúmenes corrientes bajos: 6ml/kg de peso corporal ideal y presiones meseta <30cmH2O) mejora la supervivencia en pacientes con síndrome de distrés respiratorio del adulto (SDRA) en la población general6. Los pacientes con cirrosis con SDRA deben ser ventilados de acuerdo a estas recomendaciones establecidas en la población sin enfermedad hepática10.
Sedación y analgesiaAl igual que en la población general, en la cirrosis hepática deben utilizarse protocolos con un objetivo de sedación e interrupciones/disminuciones diarias de la sedación continua. Los fármacos con vida media corta como el propofol y el remifentanilo son las opciones preferidas. Las benzodiacepinas (midazolam) deben evitarse en estos pacientes, ya que la capacidad de eliminación del fármaco está reducida, lo que prolonga el tiempo de ventilación mecánica10,24.
Terapias de soporte renalLas terapias continuas de soporte renal y la hemodiálisis intermitente son equivalentes en pacientes sépticos con insuficiencia renal aguda. Las terapias continuas son preferibles en pacientes con inestabilidad hemodinámica. Los datos actuales indican que el soporte renal intensivo (35ml/kg/h en técnicas continuas o la hemodiálisis intermitente diaria) no es superior a las estrategias convencionales (20-25ml/kg/h)6,10,25. No hay datos específicos sobre soporte renal en pacientes con cirrosis y sepsis grave o shock séptico.
Control glucémicoLos pacientes con sepsis grave e hiperglucemia relevante (2 determinaciones >180mg/dl) que ingresan en la UCI deben recibir terapia insulínica. La hiperglucemia puede actuar como procoagulante, inducir apoptosis celular y alterar la función de los neutrófilos. Por otra parte, la estrategia del control estricto de la glucemia (80-110mg/dl) en pacientes sépticos no se recomienda, ya que aumenta los eventos hipoglucémicos y la mortalidad en comparación con un control glucémico convencional26. En la actualidad se recomiendan objetivos de control glucémico menos estrictos (140-180mg/dl), recomendación aplicable a los enfermos con cirrosis6,10.
HemoderivadosLas guías actuales en la población general recomiendan un umbral de transfusión de 7g/dl una vez que la hipoperfusión tisular se ha resuelto6. Un umbral similar (7-8g/dl) se ha recomendando en pacientes con cirrosis con hemorragia por hipertensión portal (BavenoVI)27. No deben corregirse las alteraciones de la coagulación en ausencia de hemorragia10.
Instrumentalización, nutrición y otras estrategias profilácticasLos pacientes con shock séptico y un porcentaje relevante de los pacientes con sepsis grave requieren la inserción de una vía central y de una sonda urinaria. La inserción de un catéter arterial es necesaria en pacientes con shock séptico y en enfermos con sepsis grave y fracaso respiratorio. La colocación de catéteres vasculares no requiere la corrección de las alteraciones de la coagulación excepto en los casos de trombocitopenia grave (≤20.000109/l). Vías y sondas deben ser retiradas de manera precoz tras la resolución del cuadro con el fin de prevenir infecciones nosocomiales secundarias.
El paciente con cirrosis presenta con frecuencia una desnutrición grave que requiere el inicio de soporte nutricional precoz. La nutrición enteral es la modalidad de elección. Debe evitarse el síndrome de realimentación y tratar las deficiencias de vitaminas y de oligoelementos. La nutrición parenteral se desaconseja de la sepsis grave excepto en desnutriciones graves.
La profilaxis de úlceras de estrés mediante inhibidores H2 o de la bomba de protones está indicada en pacientes con cirrosis y sepsis grave o shock séptico. La trombocitopenia y la coagulopatía grave contraindican la profilaxis de la trombosis venosa profunda con heparina de bajo peso molecular en muchos pacientes, en los que deben utilizarse medias neumáticas10.
Insuficiencia renalDefiniciónLa insuficiencia renal se define como una reducción significativa del filtrado glomerular (FG). Clásicamente la insuficiencia renal en los pacientes con cirrosis hepática se define como una creatinina sérica >1,5mg/dl28. Sin embargo, esta definición tiene limitaciones. En primer lugar, un valor de creatinina de 1,5mg/dl corresponde a un FG muy reducido (30ml/min), por lo que el diagnóstico se realiza cuando la insuficiencia renal ya es avanzada. Por otro lado, esta definición no tiene en cuenta las variaciones de la creatinina con respecto a los valores previos. La clasificación Acute Kidney Injury Network (AKIN), descrita inicialmente en pacientes críticos de la población general, define la insuficiencia renal no en base a un punto de corte, sino a pequeñas variaciones de la creatinina respecto a los valores previos29. Esta clasificación define Acute Kindey Injury (AKI) como un aumento de la creatinina ≥0,3mg/dl o del 50% respecto al valor basal en 48h. Se definen 3 estadios de AKI según la gravedad de la insuficiencia renal (AKI1, AKI2 y AKI3).
Estudios recientes en pacientes con cirrosis indican que la combinación de ambas definiciones, la AKIN y la clásica, es superior a ambas clasificaciones por separado, ya que permite realizar un diagnóstico más precoz y mejora su capacidad pronóstica. En este sentido, el estadio AKI1 se divide en 2 subgrupos en función de si la creatinina al diagnóstico de la insuficiencia renal es inferior o superior a 1,5mg/dl (AKI1A y AKI1B, respectivamente)30,31. A pesar de que esta nueva clasificación (AKI modificado; tabla 2) no se describe en las guías clínicas, la existencia de nueva información y el creciente interés en su utilización en la cirrosis sustentan su descripción en este consenso. La mayoría de los pacientes con cirrosis presentan insuficiencia renal en el momento del ingreso. Para establecer si presentan insuficiencia renal en base a criterios AKI al ingreso, es necesario utilizar una cifra de creatinina sérica previa, que por consenso es el último valor disponible en los 3meses previos (un año en caso de que no exista ningún valor disponible en ese periodo).
Propuesta de nueva clasificación de la insuficiencia renal en base a los criterios AKI adaptados a pacientes con cirrosis hepática
| Estadio | Criterio |
|---|---|
| AKI 1A | Aumento de la creatinina ≥0,3mg/dl o del 50% respecto al valor basal con un valor final ≤1,5mg/dl |
| AKI 1B | Aumento de la creatinina ≥0,3mg/dl o del 50% respecto al valor basal con un valor final >1,5mg/dl |
| AKI 2 | Aumento de la creatinina 2-3 veces respecto al valor basal |
| AKI 3 | Aumento de la creatinina >3 veces respecto al valor basal |
Los pacientes con cirrosis hepática pueden presentar insuficiencia renal por múltiples causas28. El diagnóstico etiológico es esencial, ya que el tratamiento y el pronóstico difieren sustancialmente. Las causas más frecuentes de insuficiencia renal son:
- a)
SHR: insuficiencia renal de carácter funcional secundaria a una vasoconstricción renal intensa. Los criterios diagnósticos de SHR se describen en la tabla 332.
Tabla 3.Criterios diagnósticos de síndrome hepatorrenal
Cirrosis con ascitis Creatinina sérica >1,5mg/dl* Ausencia de mejoría de la creatinina después de 2días de suspender el tratamiento diurético y de haber realizado expansión plasmática con dosis única de albúmina. La dosis recomendada es de 1g/kg de peso (dosis máxima 100g/día) Ausencia de shock Ausencia de tratamiento reciente con fármacos nefrotóxicos Ausencia de enfermedad renal parenquimatosa evidenciada por proteinuria >500mg/día, microhematuria (>50 hematíes/campo) y/o ecografía renal anormal - b)
Hipovolémica (disminución del volumen intravascular): las causas más frecuentes son las dosis excesivas de diuréticos, hemorragia digestiva y diarreas.
- c)
Infecciones bacterianas: Son la causa más frecuente de insuficiencia renal, por lo que en todo paciente con cirrosis que presente insuficiencia renal debe descartarse una infección de forma activa. Es importante subrayar que en la definición actual de SHR, la existencia de una infección bacteriana no se considera un criterio de exclusión en ausencia de shock séptico.
- d)
Nefrotóxicos: los fármacos que con más frecuencia ocasionan insuficiencia renal son los antiinflamatorios no esteroideos y los aminoglucósidos. Fármacos antihipertensivos como los betabloqueantes, los IECA o los ARA-II también pueden causar insuficiencia renal en la cirrosis.
- e)
Nefropatía parenquimatosa: los pacientes con cirrosis pueden presentar nefropatía parenquimatosa asociada al VHC, VHB, etiología alcohólica, diabetes o hipertensión, entre otros. Su presencia debe sospecharse en caso de alteración en el sedimento urinario (proteinuria y/o hematuria relevantes).
La insuficiencia renal es una complicación frecuente que se asocia a una morbimortalidad relevante en los pacientes con cirrosis. El pronóstico depende de la intensidad y de la causa de la insuficiencia renal. Respecto a la intensidad, estudios recientes indican que los pacientes con AKI1A presentan un buen pronóstico, similar al de los pacientes sin insuficiencia renal. Los pacientes con AKI1B presentan un pronóstico intermedio (supervivencia del 68% a los 3 meses)30,31. Los pacientes con AKI2 o 3 presentan un mal pronóstico, con una supervivencia a los 3meses del 30-40%.
La causa de la insuficiencia renal también tiene un impacto pronóstico33. Los pacientes con nefropatía parenquimatosa presentan un buen pronóstico, con una supervivencia del 73% a los 3meses. Los pacientes con insuficiencia renal por hipovolemia presentan un pronóstico intermedio (46% a los 3meses). Los pacientes con insuficiencia renal asociada a infecciones y SHR son los que presentan un peor pronóstico (supervivencia del 31 y del 15% a los 3meses, respectivamente).
Grupos de riesgoLos pacientes con cirrosis hepática presentan una mayor susceptibilidad a desarrollar insuficiencia renal en comparación con la población general. Los pacientes con un mayor riesgo son los que presentan ascitis y los ingresados por complicaciones agudas de la cirrosis, fundamentalmente infecciones bacterianas, hiponatremia y hemorragia digestiva. En estos pacientes debe monitorizarse la creatinina sérica cada 48-72h para detectar de forma precoz el desarrollo de insuficiencia renal.
TratamientoMedidas generalesTodos los pacientes con insuficiencia renal requieren un control clínico estrecho. Los pacientes con insuficiencia renal grave, en especial los que están en lista de espera de trasplante hepático, deberían ser ingresados en una UCI o en intermedios. Es esencial detectar de forma precoz la aparición de complicaciones intercurrentes, en especial infecciones bacterianas, EH o hemorragia digestiva34.
La colocación de una sonda urinaria y de un catéter venoso central en pacientes cirróticos críticos es imprescindible. En el resto de pacientes debe individualizarse, ya que pese a que aportan una monitorización más estricta, también aumentan el riesgo de infecciones.
Como regla general, en todo paciente con insuficiencia renal aguda debe suspenderse el tratamiento diurético. Los pacientes con ascitis de gran volumen deben tratarse con paracentesis evacuadoras con expansión con albúmina (8g/l de ascitis)34. En los enfermos con insuficiencia renal aguda secundaria a hipovolemia esta debe corregirse mediante la administración de fluidos. Sin embargo, en la mayoría de los pacientes con cirrosis e insuficiencia renal aguda se ha de reducir el aporte de sodio y de líquidos, ya que habitualmente presentan un aumento del volumen de líquido extracelular con ascitis, edemas e hiponatremia dilucional.
No existen datos definitivos para contraindicar el uso de betabloqueantes en pacientes con insuficiencia renal aguda. Sin embargo, es probable que en estos pacientes deba suspenderse la administración de los betabloqueantes por el efecto negativo que puedan tener: reducción del gasto cardíaco e hipotensión secundaria.
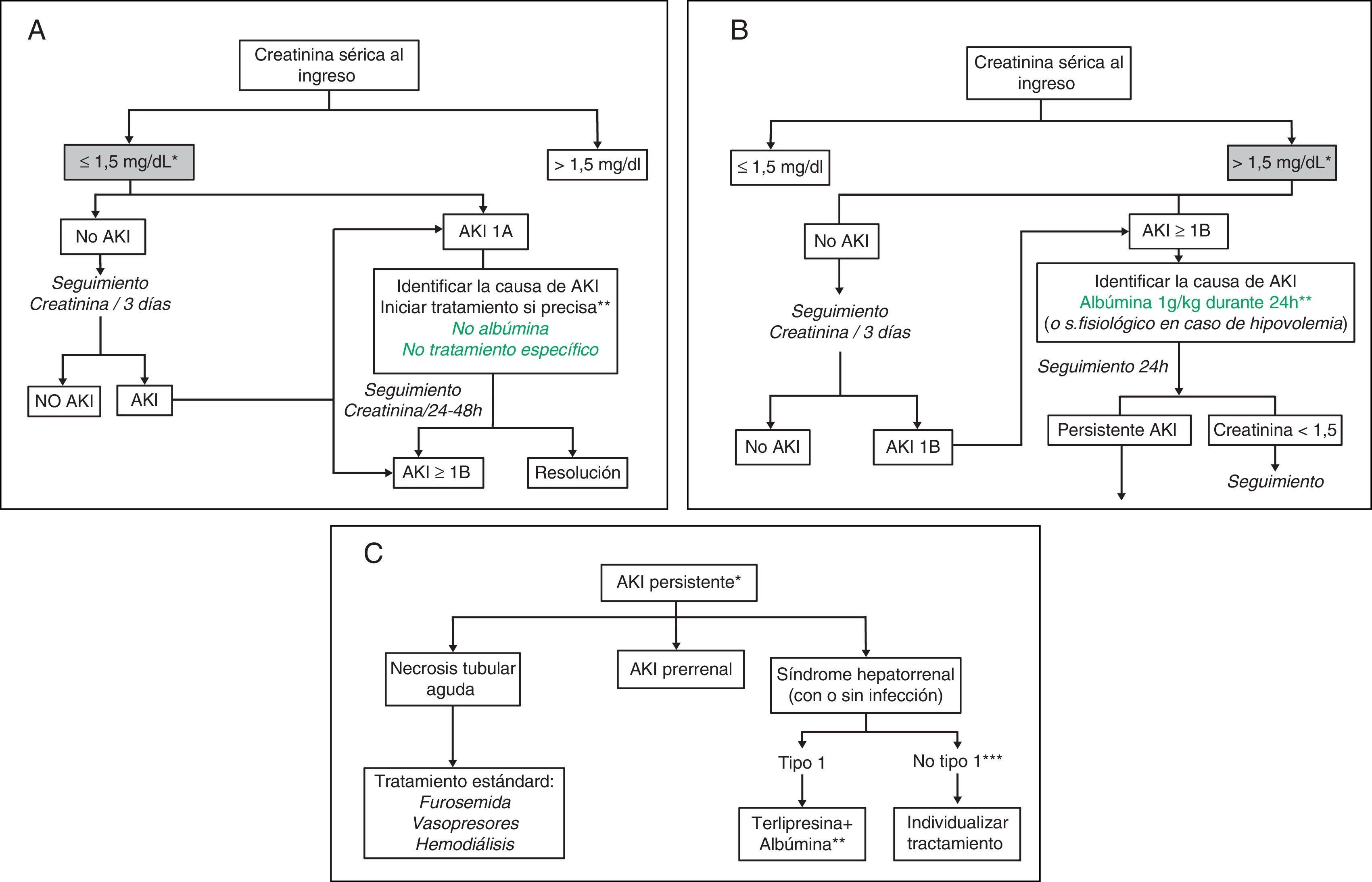
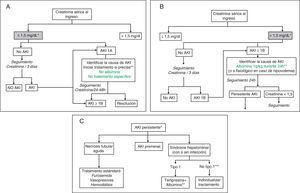
Algoritmos de tratamientoLas figura 1A-C muestran los algoritmos de evaluación y tratamiento de la insuficiencia renal en la cirrosis propuestos en función de la creatinina sérica al ingreso y del desarrollo de insuficiencia renal de acuerdo a los criterios AKI modificados30,31, algoritmos que también se han de aplicar a los pacientes que cumplan los criterios AKI durante la hospitalización.
Propuesta de algoritmo diagnóstico y terapéutico de insuficiencia renal aguda en pacientes con cirrosis en función del valor de creatinina sérica al ingreso y del desarrollo de insuficiencia renal: clasificación AKI adaptada a los pacientes con cirrosis hepática.
A) Pacientes con creatinina sérica al ingreso ≤ 1,5mg/dl.
* El valor basal de creatinina utilizada para la definición de AKI es la última creatinina disponible en los últimos 3 meses anterior al ingreso.
** Debe identificarse de forma precoz la causa de la insuficiencia renal para iniciar el tratamiento lo antes posible. Ante todo paciente con insuficiencia renal debe suspenderse el tratamiento diurético y eliminar fármacos potencialmente nefrotóxicos. Es esencial descartar la existencia de una infección bacteriana como causa de la insuficiencia renal. No existen datos sobre la eficacia de la albúmina intravenosa en pacientes con AKI1A.
B) Pacientes con creatinina sérica al ingreso ¿1,5mg/dl.
* El valor basal de creatinina utilizada para la definición de AKI es la última creatinina disponible en los últimos 3 meses anterior al ingreso.
** La administración de albúmina intravenosa se debe realizar de forma lenta para evitar la sobrecarga de volumen.
C) Pacientes con AKI persistente
* Se definirán como aquellos pacientes que presenten un empeoramiento progresivo de la función renal o aquellos pacientes con AKI1B en los que la creatinina sérica se haya reducido <25% con respecto a la creatinina de les 48h previas
** El tratamiento con terlipresina se inicia a dosis de 1mg/4h. Si a las 48h la creatinina sérica no ha disminuido un 25% respecto al valor basal, debe aumentarse la dosis a 2mg/4h. Se considerará respuesta completa cuando la creatinina sérica descienda hasta valores <1,5mg/dl. El tratamiento se mantendrá hasta obtener la respuesta o un máximo de 14 días. Si al día 7 de tratamiento la creatinina no ha bajado >25% se suspenderá el tratamiento. De forma concomitante debe administrarse albúmina intravenosa a dosis de 20-40g/dl7,8.
*** Pacientes con SHR pero que no cumplen criterio de SHR tipo1.
El tratamiento de primera elección en pacientes con SHR tipo1 es la administración de fármacos vasoconstrictores (terlipresina, noradrenalina o midodrina) y albúmina34,35. La mayoría de estudios y de información disponible hacen referencia a la terlipresina administrada en forma de bolo36-38, por lo que consideramos que el tratamiento de primera línea del SHR tipo1 en nuestro país, en el que está disponible la terlipresina, es su combinación con albúmina. Datos recientes sugieren que su administración en perfusión continua podría mejorar su eficacia y reducir los efectos secundarios. No obstante, los datos existentes, aún limitados, no permiten recomendar de manera firme esta forma de administración. En pacientes no candidatos a trasplante hepático, la decisión de tratar el SHR tipo1 con fármacos vasoconstrictores y albúmina debe ser individualizada.
Trasplante hepáticoEl trasplante hepático es el tratamiento definitivo de los pacientes con SHR tipo1 y tipo234,35. Por este motivo, todo paciente con SHR debe ser derivado a un centro de trasplante hepático. El SHR es reversible después del trasplante, por lo que en estos pacientes se debe indicar únicamente el trasplante hepático. El doble trasplante hepatorrenal solo debería considerarse en pacientes que hayan requerido tratamiento de soporte renal prolongado durante 6-8semanas, ya que en estos pacientes la probabilidad de reversión del SHR es muy baja.
A los pacientes con SHR tipo1 se les debe dar prioridad en la lista de espera de trasplante, ya que presentan una elevada mortalidad. La utilización del MELD como sistema de priorización en lista ha facilitado el acceso al trasplante en estos pacientes. Diversos grupos han propuesto que para calcular el MELD en estos pacientes se utilice la creatinina previa al inicio del tratamiento, dándoles así prioridad en la lista de trasplante39.
A pesar de que no existe información de estudios prospectivos, las guías clínicas actuales recomiendan que los pacientes con SHR tipo1 sean tratados con vasoconstrictores y albúmina antes del trasplante hepático, ya que la mejoría de la función renal previa al trasplante puede mejorar el pronóstico en el período postrasplante34,35.
Terapia de soporte renalNo existen estudios que hayan evaluado específicamente la utilidad de las terapias de soporte renal (TSR) en pacientes con SHR tipo1. La TSR no se considera un tratamiento de primera línea, ya que no actúa sobre la fisiopatología del SHR. La TSR, bien sea continua o intermitente en función de la tolerancia hemodinámica del paciente, estaría únicamente indicada en pacientes con SHR tipo1 que no responden al tratamiento farmacológico y que desarrollan criterios de diálisis urgente (hipervolemia, hiperpotasemia, acidosis metabólica, etc.)34,35. No obstante, la experiencia clínica indica que esta situación es poco frecuente en pacientes con SHR tipo1.
Otros métodos de diálisis alternativos, como el molecular adsorbent recirculating system (MARS) o el fractionated plasma separation and adsorption (Prometheus) se han propuesto como potenciales tratamientos del SHR40,41. No obstante, la información existente sobre su utilidad en estos pacientes todavía es limitada y poco concluyente.
Terapia de soporte renal en la insuficiencia renal en la cirrosis hepáticaComo se ha descrito anteriormente para el SHR, la TSR en general no es un tratamiento de primera elección en pacientes con cirrosis e insuficiencia renal. Sin embargo, existen situaciones concretas en las que debe considerarse su utilización. Respecto al tipo de TSR, continua o intermitente, la decisión debe individualizarse en función de la estabilidad hemodinámica del paciente y de su tolerancia. Las situaciones en las que se debe indicar TSR en paciente con cirrosis son: a)SHR tipo1 (ver apartado anterior) y b)necrosis tubular aguda: en pacientes que no responden al tratamiento estándar con perfusión de furosemida y/o vasopresores y que desarrollan criterios de TSR (hipervolemia, acidosis metabólica, hiponatremia grave, hiperpotasemia, etc.).
Indicaciones de ingreso en cuidados intensivos o intermediosLos pacientes con indicación de ingreso en unidades de críticos son los pacientes con SHR tipo1 candidatos a trasplante y los pacientes con insuficiencia renal asociada a otras complicaciones graves de la cirrosis que requieran monitorización intensiva (sepsis, hemorragia digestiva, etc.).
Indicaciones de contactar con un centro de referencia de trasplanteDurante el proceso agudo, debería contactarse con un centro de trasplante en el caso de pacientes con SHR tipo1 o con cualquier otro tipo de insuficiencia renal si el paciente está en lista de espera o es un potencial candidato a trasplante. En el caso de los pacientes con SHR tipo1 debe iniciarse tratamiento con terlipresina y albumina de acuerdo al protocolo y contactar para traslado. Al alta, debe contactarse con un centro de trasplante en los pacientes con SHR tipo2 o con insuficiencia renal parenquimatosa que cumplan criterios de trasplante.
Encefalopatía hepáticaDefinición, clínica y clasificaciónLa EH es una disfunción cerebral causada por insuficiencia hepática y/o shunts portosistémicos42. Otros elementos importantes en la fisiopatología de la EH en los pacientes con cirrosis son las alteraciones en la microbiota, la hiperamoniemia y la respuesta inflamatoria43. En la mayoría de los casos existe un factor precipitante, principalmente infecciones bacterianas, estreñimiento, hemorragia digestiva y fármacos como los diuréticos y los sedantes42. La EH se manifiesta por un amplio espectro de alteraciones neurológicas y/o psiquiátricas que van desde las alteraciones subclínicas (la EH mínima, solo detectable mediante tests neuropsicológicos o neurofisiológicos) hasta el coma. Al tratarse de un espectro continuo, no es fácil clasificarla. La clasificación más utilizada sigue siendo la de West Haven, que va desde el gradoI (pérdida de atención) hasta el gradoIV (coma), pasando por el gradoII (desorientación temporal, letargia) y el gradoIII (desorientación temporal y espacial, confusión grave, estupor, somnolencia pero el paciente puede ser despertado con estímulos)42. Con frecuencia no es fácil diferenciar entre el gradoI y el gradoII. Recientemente, la International Society for Hepatic Encephalopathy and Nitrogen Metabolism (ISHEN) ha establecido una nueva clasificación de la EH en la cirrosis: EH encubierta («covert»), que incluye la EH mínima y la EH grado I, y EH manifiesta («overt»), que incluye los gradosII, III y IV42,44.
Pronóstico y grupos de riesgoLa EH es una complicación frecuente, ya que el 30-40% de los pacientes con cirrosis presentan en algún momento de su evolución un episodio de EH manifiesta42,45. Además, determina un mal pronóstico, ya que la mortalidad al año de un episodio de EH es del 50% aproximadamente46. Es una causa de frecuentes reingresos y de un grave deterioro de la calidad de vida de los pacientes y de sus familias, y supone una elevada carga no solo familiar, sino también social y económica para la comunidad42,47,48. Por otro lado, recientemente se ha demostrado que los episodios repetidos de EH pueden dejar secuelas cognitivas permanentes en los pacientes49. Algunos factores predisponentes de EH manifiesta son la EH previa, la EH mínima, la hiponatremia, la insuficiencia renal, el grado de insuficiencia hepática y la presencia de shunts portosistémicos de gran calibre42,43,50,51.
DiagnósticoEl diagnóstico de la EH se basa en la historia y en la exploración clínica. La presencia de asterixis («flapping tremor») es frecuente pero no patognomónica42,42. Con frecuencia es preciso realizar una prueba de imagen como la TC craneal para descartar otras causas de la alteración neuropsicológica, como una hemorragia cerebral, un accidente vascular cerebral isquémico o un tumor cerebral42,43. Se ha descrito un riesgo de hemorragia cerebral 5 veces mayor en pacientes con cirrosis en comparación con la población general52, hallazgo no confirmado por otros autores53.
La determinación de la amoniemia es poco útil, ya que no contribuye al diagnóstico, estadificación ni pronóstico de la EH. Además, para que los resultados sean fiables, deben seguirse una serie de requisitos técnicos (muestra en frío y realización de la determinación con rapidez tras la extracción). Sin embargo, unos niveles normales de amonio cuestionan que nos encontremos ante un episodio de EH42.
Tratamiento de la encefalopatía hepática agudaEl tratamiento de la EH requiere una intervención rápida. Los objetivos de dicha intervención son 2: a)identificar y tratar lo antes posible el factor precipitante, que puede ser potencialmente grave, como una infección o una hemorragia digestiva, y b)evitar la progresión de la EH y las complicaciones derivadas de la disminución del nivel de conciencia, como la broncoaspiración42,43,47.
El tratamiento de los pacientes con cirrosis y EH debe adecuarse al grado de EH. Los pacientes con EH gradoI o II con frecuencia pueden ser dados de alta desde el servicio de urgencias si mejoran durante su estancia. Por el contrario, los pacientes más graves (gradoIII-IV) requieren ingreso en una UCI e intubación orotraqueal23,42. Los pacientes con gradosI o II suelen ingresarse en salas de hospitalización convencional.
En pacientes con EH gradoIII o IV, tras su intubación, debe colocarse una sonda nasogástrica para administrar la medicación y la nutrición hasta que el nivel de conciencia permita reiniciar la ingesta oral42,47.
El punto más importante del tratamiento de la EH es la búsqueda sistemática y el subsiguiente tratamiento del factor precipitante: infecciones bacterianas, hemorragia digestiva, estreñimiento, insuficiencia renal, alteraciones hidroelectrolíticas, o fármacos como los diuréticos y los sedantes42,43,47.
Otro aspecto importante del tratamiento de la EH aguda es la disminución de la amoniemia, actuando especialmente sobre la microbiota mediante disacáridos no absorbibles o antibióticos42,43. El tratamiento de primera línea son los disacáridos no absorbibles, lactulosa y lactitol. Suelen administrarse por vía oral (EH gradoI y potencialmenteII), pero también por sonda nasogástrica (gradosII-III-IV) o en enema cuando la situación del paciente no permite la vía oral42,43,47,54. Como alternativa a los disacáridos pueden utilizarse los antibióticos no absorbibles (neomicina, metronidazol y, más recientemente, rifaximina a dosis de 400mg/8h)42. Sin embargo, no existe suficiente evidencia sobre la utilidad de la rifaximina en combinación con los disacáridos en el tratamiento de un episodio de EH47. La rifaximina, añadida a la lactulosa, previene la recurrencia de la EH55. Otros tratamientos que disminuyen la amoniemia, como la L-ornitina-L-aspartato (LOLA) o el fenilacetato de ornitina, no se utilizan en la práctica clínica habitual debido a su falta de disponibilidad o a que aún están en fase de investigación.
El flumazenilo puede mejorar de forma transitoria el nivel de conciencia en los pacientes con EH, especialmente en pacientes con historia de ingesta previa de benzodiacepinas. Se puede ensayar en determinadas situaciones para confirmar el diagnóstico de EH desencadenado por benzodiacepinas, al comprobar la reversibilidad del cuadro clínico42.
Los sistemas de diálisis con albúmina (MARS) mejoran el nivel de conciencia en pacientes con EH gradosIII y IV que no responden al tratamiento convencional56. Sin embargo, la aplicación de este tratamiento está limitada por su complejidad, elevado coste y escasa disponibilidad, y por el hecho de que no ha demostrado que mejore la supervivencia47,56.
En los pacientes con EH hay que mantener el soporte nutricional sin restricción de proteínas. Las dietas hipoproteicas no están justificadas y pueden empeorar el estado nutricional y aumentar la amoniemia al favorecer la pérdida de masa muscular. Los aminoácidos ramificados por vía intravenosa no son útiles en el tratamiento de la EH, pero los suplementos por vía oral pueden contribuir a mejorar el estado nutricional42,43,57.
Indicaciones de ingreso en cuidados intensivos o intermediosComo hemos comentado previamente, los pacientes con EH gradoIII o IV precisan ingreso en una intermedios o en UCI para una monitorización estricta y ventilación mecánica si es preciso42,54. Se considera indispensable la intubación orotraqueal en los pacientes con una puntuación inferior a 8 en la escala de coma de Glasgow54. En estos pacientes se recomienda evitar los sedantes54. Cuando sean imprescindibles, es preferible utilizar los de vida media corta y escaso metabolismo hepático, como el remifentanilo y el propofol.
Trasplante hepáticoConsiderando el mal pronóstico de los pacientes que han presentado un episodio de EH, la mayoría deben ser evaluados para trasplante hepático y derivados al centro de referencia42. Esta evaluación podría posponerse en los pacientes con función hepática conservada, ya que tienen mejor pronóstico y pueden beneficiarse de otros tratamientos, como la embolización de shunts portosistémicos en pacientes con MELD bajo (<12)51.
Las medidas comentadas anteriormente permiten el tratamiento de los episodios de EH en un hospital sin precisar técnicas de alta complejidad. Sin embargo, un episodio de difícil control por su evolución o por los factores precipitantes (hemorragia digestiva, sepsis grave) en un paciente en lista de espera debe llevar a contactar con el centro de trasplante para valorar su traslado.
Prevención de la recurrenciaLa educación de los pacientes y sus familiares es muy importante: identificación de signos y síntomas precoces, consejo nutricional, adherencia y modificación del tratamiento, evitar el estreñimiento y administración de enemas42,47. Se recomiendan los disacáridos no absorbibles en la prevención de la recurrencia después de un primer episodio de EH y añadir rifaximina después del segundo episodio42,55. Estos tratamientos no se recomiendan de forma rutinaria después de la colocación de una derivación portosistémica percutánea intrahepática (DPPI o TIPS)58. La embolización de shunts portosistémicos detectados por ecografía o TC puede ser eficaz en la prevención de EH recurrente en pacientes con función hepática preservada51. En pacientes portadores de TIPS y EH recurrente puede considerarse la reducción del calibre del TIPS59.
Hemorragia digestiva por varices esofagogástricasDefinicionesSe considera que una hemorragia digestiva en un paciente con cirrosis es debida a varices esofagogástricas en cualquiera de las siguientes 3 situaciones: a)sangrado activo procedente de una variz esofágica o gástrica; b)presencia de signos de sangrado reciente en una variz (coágulo de fibrina o coágulo adherido), o c)presencia de sangre en el estómago en ausencia de otras lesiones potencialmente sangrantes.
Se considera inicio de la hemorragia (momento cero) el momento de la primera atención médica, o bien la hora en la que se manifiesta la hemorragia si esta se presenta en un paciente ingresado.
La duración del período hemorrágico abarca 120h (5días). En este intervalo es cuando se producen la mayoría de las recidivas precoces y complicaciones asociadas a la hemorragia.
Se considera fracaso terapéutico la muerte del paciente o la necesidad de cambiar el tratamiento, definido por: a)hematemesis o aspirado nasogástrico de más de 100ml de sangre fresca en 2h, a pesar de haber iniciado el tratamiento farmacológico y/o endoscópico; b)desarrollo de shock hipovolémico, o c)descenso de 3g o más de la cifra de hemoglobina (9% de hematocrito) en un período de 24h sin transfusión.
La recidiva hemorrágica precoz es la que sucede en los primeros 5días, siendo su incidencia del 10-15%27,60.
Factores pronósticosCon el tratamiento actual, que consiste en la combinación de fármacos vasoactivos, tratamiento endoscópico y antibióticos, se consigue el control de la hemorragia aguda hasta en un 80-90% de los casos. A pesar de la mejoría pronóstica en los últimos años, la mortalidad actual todavía es de un 15-20% durante las primeras 6semanas tras el episodio inicial (27,60).
La recidiva se produce hasta en un 15-20% de los pacientes tratados durante las primeras 6semanas. Aproximadamente el 40% de estas nuevas hemorragias aparecen durante los 5 primeros días después del episodio hemorrágico. Por otra parte, el fracaso del tratamiento inicial ocurre en un 10-20% de los casos, con una mortalidad que puede superar hasta el 50%27
En estudios previos, la presencia de una hemorragia activa en la endoscopia urgente, así como la visualización de varices grandes, eran factores de riesgo de recidiva hemorrágica27. No obstante, estudios recientes demuestran que la efectividad actual del tratamiento endoscópico (ligadura con bandas) hace que no se observen diferencias en el fracaso terapéutico en aquellos pacientes con hemorragia activa en el momento de la endoscopia, en comparación con los que no presentan hemorragia activa61.
Un gradiente de presión venosa hepática (GPVH) ≥20mmHg durante las primeras 48h se ha asociado a un riesgo elevado de recidiva hemorrágica y muerte. Por otro lado, otras variables clínicas, como el grado de insuficiencia hepática, determinado por la puntuación de Child-Pugh o MELD, también tienen un importante valor predictivo de fracaso del tratamiento a los 5días. Así, los pacientes con un ChildC o MELD ≥18 tienen una elevada probabilidad de recidiva o muerte.
La presencia de trombosis portal, las infecciones bacterianas, así como la presencia de insuficiencia renal también se asocian a un mayor riesgo de fracaso terapéutico a los 5días. La profilaxis antibiótica ha demostrado mejorar el pronóstico de estos pacientes, al reducir la tasa de recidiva y mortalidad. La insuficiencia renal, presente hasta en un 10% de los pacientes, es un factor independiente de mortalidad60. Los pacientes con creatinina basal ≥1,35mg/dl tienen una mayor mortalidad a las 6semanas.
Grupos de riesgoEl objetivo de estratificar a los pacientes en grupos de riesgo radica en identificar aquellos individuos con una mayor probabilidad de fracaso terapéutico o con un peor pronóstico y que, por tanto, pueden beneficiarse de una estrategia terapéutica más agresiva. En cohortes recientes se han evaluado diferentes modelos predictivos que permiten identificar los factores que definen a los pacientes con un mayor riesgo de fracaso terapéutico.
Así, los pacientes con un GPVH≥20mmHg en las primeras 24h del ingreso tienen un mayor riesgo de fracaso y un mayor probabilidad de complicaciones asociadas que los pacientes con un GPVH<20mmHg. Se ha demostrado que la determinación del GPVH es uno de los mejores factores predictivos de fracaso terapéutico y de supervivencia a largo plazo; la cateterización hepática permite además realizar una descompresión precoz del sistema venoso portal mediante la implantación de una DPPI o TIPS.
Por otro lado, los pacientes Child-PughB con hemorragia activa en el momento de la endoscopia o Child-PughC tienen un elevado riesgo de fracaso terapéutico y, por tanto, un mal pronóstico. A pesar de ello, se ha cuestionado si los pacientes Child-PughB con sangrado activo son realmente un grupo de alto riesgo61.
Debido a que la determinación del GPVH no puede realizarse en todos los centros y que ciertos modelos utilizan variables subjetivas (Child-Pugh, hemorragia activa en la endoscopia), se ha propuesto un modelo más objetivo basado en la puntuación MELD. En este estudio los pacientes con un MELD≤11 presentaron un riesgo de mortalidad del 5% (bajo riesgo) y los pacientes con MELD≥19, una mortalidad del 20% (alto riesgo)62. El único modelo predictivo de estratificación del riesgo que ha sido validado en cohortes externas es el que se basa en la puntuación MELD. Por tanto, son necesarios más estudios para validar estos modelos de estratificación y poder identificar correctamente a los pacientes que se beneficiarían de una estrategia terapéutica diferente.
La implantación de un TIPS en las primeras 72h del episodio hemorrágico (idealmente en las primeras 24h) es un tratamiento que podría beneficiar a los pacientes previamente definidos como de alto riesgo63. No obstante, en el estudio que describía el GPVH para definir a los pacientes de alto riesgo, en el brazo de tratamiento médico no se utilizaba el tratamiento estándar actual, hecho que puede justificar que los resultados en este grupo fuesen inferiores a los esperados64.
Otras situaciones especiales, como la presencia de hepatocarcinoma avanzado, el shock hemorrágico, el coma hepático o la sepsis, pueden empeorar el pronóstico del paciente cirrótico con hemorragia por varices.
TratamientoMedidas generalesComprenden las medidas iniciales de reanimación y protección de la vía aérea. En pacientes con hemorragia masiva o presencia de EH el riesgo de complicaciones respiratorias y de broncoaspiración es elevado, motivo por el que se ha de valorar la necesidad de intubación orotraqueal.
La reposición del volumen ha de iniciarse de forma precoz para mantener una presión arterial sistólica entre 90-100mmHg. Los coloides son las soluciones de elección por presentar menos alteraciones de la hemostasia y reacciones anafilácticas que los dextranos. No existe una recomendación específica sobre el uso de plasma fresco congelado y plaquetas en estos pacientes, aunque parece razonable transfundir a aquellos pacientes con hemorragia activa y coagulopatía severa. El uso de factores de coagulación, como el factorVII recombinante, no se recomienda. A pesar de que las recomendaciones recientes abogan por mantener cifras de hemoglobina entre 7-8g/dl, estas están basadas en opiniones de expertos27. Estas recomendaciones han sido validadas y confirmadas en el único estudio publicado hasta la fecha, en el que los pacientes con transfusión restrictiva (transfusión si Hb<7g/dl, para mantenerla entre 7-9g/dl) tenían una menor tasa de recidiva hemorrágica y una mejor supervivencia que los pacientes con transfusión liberal (transfusión si Hb<9g/dl, para mantenerla entre 9-10g/dl). Este beneficio se observó en pacientes Child-PughA y B, sin mostrar diferencias significativas en los Child-PughC65. Este estudio refuerza la recomendación de evitar la sobretransfusión en pacientes con hemorragia por varices esofagogástricas, a pesar de que la decisión final ha de ser individualizada en función de la edad y de las comorbilidades asociadas, como la cardiopatía isquémica o la insuficiencia cardíaca, entre otras.
Un metaanálisis reciente confirma que la profilaxis antibiótica se asocia a una reducción significativa de la mortalidad, recidiva hemorrágica y tiempo de hospitalización66. A pesar de que el norfloxacino sigue siendo de elección, en pacientes con enfermedad hepática avanzada (Child-PughB y C), en aquellos que estén en profilaxis con quinolonas y en ámbitos con elevada prevalencia de resistencia a quinolonas, la ceftriaxona i.v. es el antibiótico de elección27. La duración del tratamiento es de 7días.
Tratamiento específicoEl tratamiento combinado de agentes vasoactivos y terapia endoscópica constituye el tratamiento hemostático primario, que consigue un control inicial del episodio hemorrágico entre el 80 y 90% de los casos.
Fármacos vasoactivosSu administración ha de ser lo más precoz posible, y antes de la endoscopia, puesto que esta estrategia mejora el control inicial de la hemorragia, facilita la realización de terapéutica endoscópica y disminuye el riesgo de recidiva precoz. Las pautas habituales son:
- a)
Somatostatina: 250μg/h en infusión continua. Bolos de 250μg/h (se pueden repetir hasta en 3 ocasiones en las primeras 3h). Los pacientes con hemorragia activa pueden beneficiarse de dosis dobles (500μg/h).
- b)
Terlipresina: 2mg/4h i.v. en bolo (1,5mg pacientes con peso entre 50-70 kg, 1mg en pacientes con peso inferior a 50 kg) durante las primeras 48h, y 1mg/4h hasta el 5.°día. No existen evidencias que permitan recomendar el uso de ambos fármacos vasoactivos combinados.
La recomendación actual es mantener el tratamiento vasoactivo de 2 a 5días.
Tratamiento endoscópicoLa ligadura endoscópica de varices (LEV) constituye el tratamiento de elección en el episodio agudo27. La escleroterapia únicamente está indicada cuando la ligadura no es técnicamente posible. En general, la LEV debe realizarse lo antes posible, y preferiblemente en las primeras 6-12h, una vez estabilizado al paciente. Para la sedación de la endoscopia, el propofol es preferible a otros agentes sedantes por sus características farmacocinéticas.
Derivación portosistémica percutánea intrahepáticaTradicionalmente, la principal indicación de la DPPI o TIPS ha sido como tratamiento de rescate tras el fracaso del tratamiento endoscópico y farmacológico combinados. El TIPS permite el control de la hemorragia en más del 95% de los casos, a pesar de que se asocia a una elevada mortalidad. Este hecho se debe a que los pacientes con fracaso del tratamiento estándar tienen una enfermedad hepática más grave (Child-PughC), han presentado recidiva hemorrágica y presentan un deterioro intenso de la función hepática, hechos que inciden en una mayor mortalidad cuando se implanta el TIPS. Con la finalidad de evitar el fracaso terapéutico en pacientes de alto riesgo y así mejorar la supervivencia, se ha propuesto el concepto de TIPS precoz (early TIPS). Un estudio preliminar demostró que la colocación del TIPS precoz no-recubiertos en pacientes de alto riesgo (identificados con un GPVH>20mmHg), se asoció a una menor tasa de recidiva hemorrágica precoz y una mayor supervivencia64. Un estudio reciente exploró este concepto en pacientes de alto riesgo de fracaso (Child-PughB con sangrado activo y Child-Pugh C≤13). Los pacientes con TIPS precoz presentaron una menor tasa de recidiva hemorrágica o fracaso en el control inicial (3% vs 45%; p=0,001) y una menor mortalidad (12% vs 39%; p=0,01) respecto al grupo control, sin observar diferencias en cuanto a la presencia de EH63. A pesar de que su eficacia en el control de la hemorragia inicial y en la prevención de la recidiva precoz han sido confirmadas en un escenario de práctica clínica real67,68, su impacto real sobre la supervivencia debe ser más contrastado69.
Taponamiento con balón y prótesis esofágicasEn pacientes con hemorragia masiva o inestabilidad hemodinámica refractaria es necesario instaurar un tratamiento puente para controlar el episodio hemorrágico, con el objetivo de realizar un tratamiento más definitivo como el TIPS. El balón de Sengstaken-Blakemore y el balón de Linton (para varices esofágicas y gástricas, respectivamente) consiguen hemostasia en casi el 90% de los casos, a pesar de que su utilización se asocia a una elevada tasa de complicaciones graves como neumonía, úlceras esofágicas e incluso perforación. Es muy conveniente proceder a la intubación previa del paciente y mantener el taponamiento el menor tiempo posible, no más de 24h. Recientemente, y con la finalidad de evitar estos inconvenientes, se ha explorado la eficacia de la colocación de prótesis esofágicas autoexpandibles en estos pacientes en pequeñas series de casos, reportándose tasas de control de la hemorragia del 100%69. Las ventajas de las prótesis radican en un mayor control de la hemorragia, una importante disminución de los efectos adversos graves, y en el hecho de que pueden dejarse en el esófago hasta 7-10días, permitiendo alimentar al paciente. Aun así, su verdadero papel en el manejo de la hemorragia grave debe establecerse en ensayos clínicos aleatorizados y controlados.
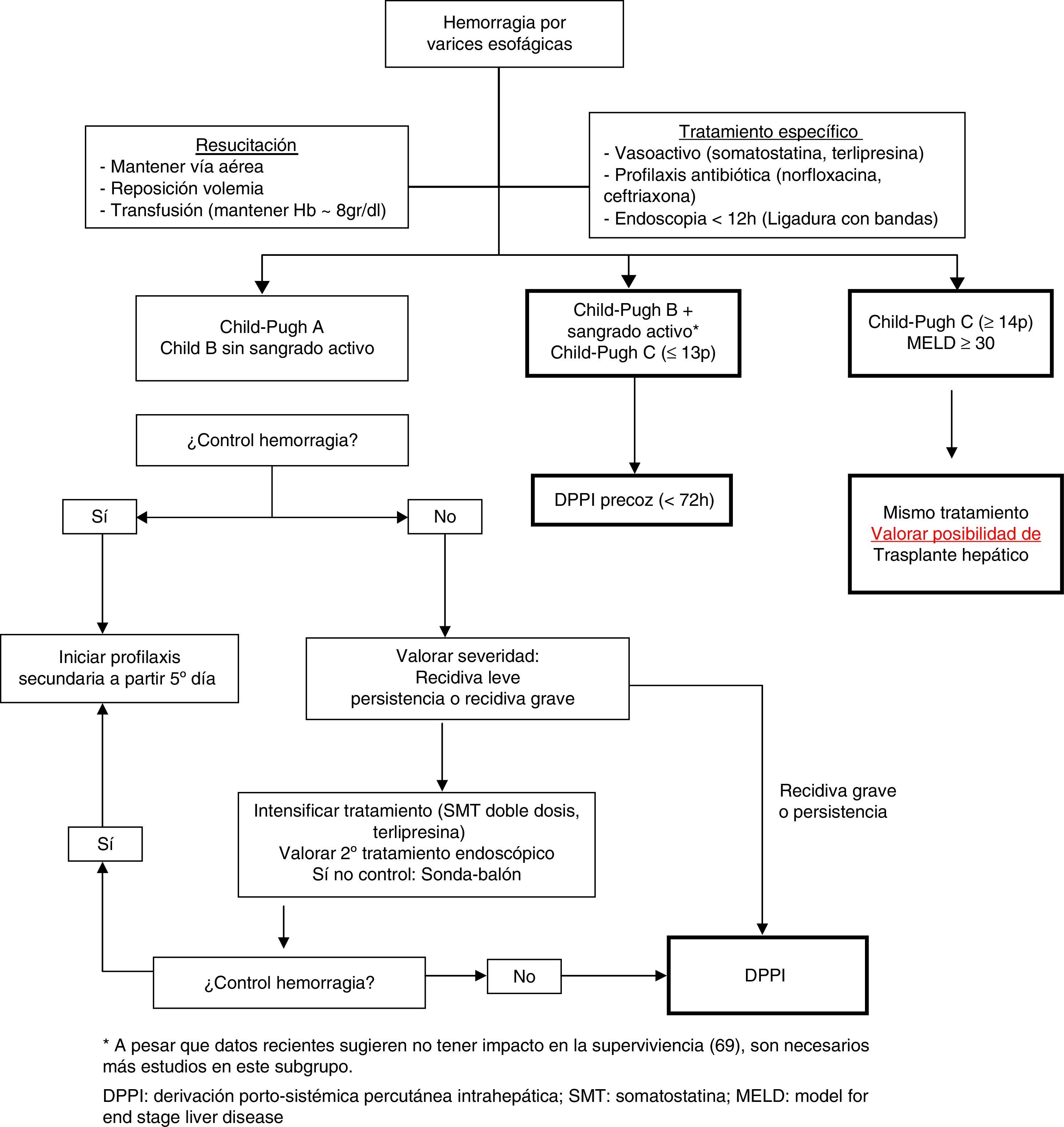
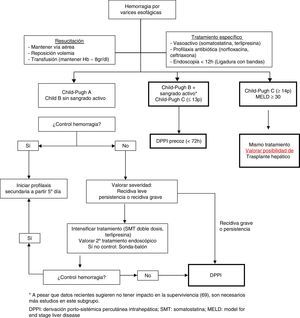
En la figura 2 se presenta un algoritmo de tratamiento de la hemorragia digestiva alta por varices esofagogástricas en la cirrosis hepática.
Criterios de ingreso en cuidados intensivos e intermediosLos pacientes con cirrosis que necesitan ingreso en la UCI presentan una mayor mortalidad que otro tipo de paciente crítico, debido a que su pronóstico no solo depende de la severidad de la enfermedad hepática, sino también de la disfunción de otros órganos10. A pesar de ello, la hemorragia aguda por varices, como complicación de la HTP, presenta un mejor pronóstico que otras complicaciones de la cirrosis, como la sepsis grave o el SHR. A pesar de que los índices pronósticos son de gran utilidad, no deben ser utilizados de forma categórica para excluir pacientes que precisen atención superespecializada, sino como herramientas de soporte al juicio clínico. Recientemente se ha demostrado que la admisión precoz en la UCI es una de las acciones que permiten mejorar la supervivencia de estos pacientes70.
Debe valorarse ingreso en la UCI en las diferentes situaciones: a)HDA grave o HDA no controlada que requiera la utilización de un balón de taponamiento; b)pacientes con criterios de trasplante, independientemente de la gravedad de la hemorragia, y c)pacientes con fracaso terapéutico en los primeros 5días.
A pesar de las recomendaciones, es necesario individualizar cada caso y valorar la derivación a un centro de referencia de forma precoz (preferiblemente dentro de las primeras 24-48h) para valoración de la colocación TIPS y/o trasplante hepático.
Situaciones de futilidadA pesar de que ha de individualizarse en función de la situación y de las características específicas de cada paciente, deben considerarse situaciones de futilidad: insuficiencia hepática avanzada (Child-Pugh≥14), en la que el TIPS está contraindicado, aunque puede intentarse optimizar el tratamiento inicial; hepatocarcinoma multifocal (estadioD de la clasificación BCLC); hemorragia aguda en pacientes con MELD≥30, y pacientes con fallo hepático agudo sobre crónico tipo3 (fracaso de 3 órganos).
Fallo hepático agudo sobre crónicoAproximadamente un 30% de los pacientes ingresados como consecuencia de una descompensación de la cirrosis presentan un fallo hepático agudo sobre crónico (acute-on-chronic liver failure [ACLF]). Este síndrome, recientemente redefinido, se caracteriza por el desarrollo de fracaso(s) de órgano(s), con o sin un factor precipitante, y presenta una elevada mortalidad a corto plazo (33% al mes y 51% a los 3meses)71,72. Esta elevada mortalidad exige un diagnóstico precoz del síndrome y de su potencial factor precipitante, el ingreso del paciente en la UCI o en cuidados intermedios en muchos de los casos, y la derivación del paciente a centros especializados.
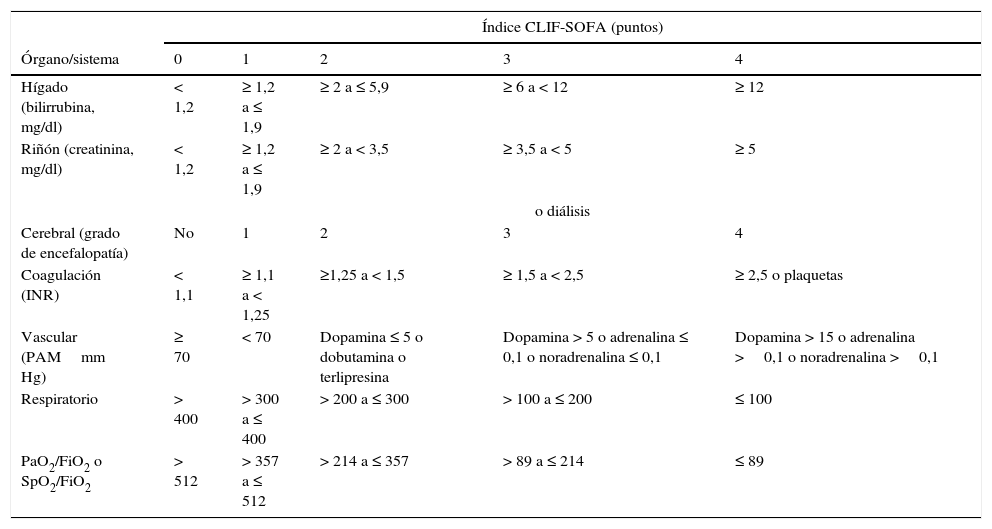
Los criterios de fracaso de órgano utilizados para definir el ACLF derivan de una adaptación del sepsis-related organ failure assessment (SOFA) para pacientes con cirrosis (tabla 4). El fallo hepático se define en base a una bilirrubina sérica ≥12mg/dl; el renal como una creatinina ≥2mg/dl; el fracaso cerebral como una EH grado3 o 4; el fallo de la coagulación en base a un INR≥2,5 o a un recuento de plaquetas ≤20.000109/l; el fracaso vascular en base a la necesidad de emplear vasopresores para mantener la presión arterial, y el fracaso respiratorio en base a una PaO2/FiO2≤200 o SpO2/FiO2≤21471. El alcoholismo activo y las infecciones bacterianas, especialmente la peritonitis bacteriana espontánea, la bacteriemia y la neumonía, son los desencadenantes más frecuentes del ACLF. En un 40-50% de los pacientes no se consigue identificar un factor precipitante. El ACLF no es un síndrome propio de pacientes con cirrosis en fase terminal, sino una entidad compleja observada frecuentemente en pacientes jóvenes (edad media 56±12años vs 58±12años en pacientes sin ACLF), que en muchos casos constituye la primera manifestación de su hepatopatía (27%). La mortalidad a corto plazo (28días) de los pacientes que ingresan con un ACLF sin descompensaciones previas es mayor a la observada en pacientes previamente descompensados (42% vs. 30%)71,72.
Definición de fracaso de órgano en pacientes con cirrosis hepática
| Índice CLIF-SOFA (puntos) | |||||
|---|---|---|---|---|---|
| Órgano/sistema | 0 | 1 | 2 | 3 | 4 |
| Hígado (bilirrubina, mg/dl) | < 1,2 | ≥ 1,2 a ≤ 1,9 | ≥ 2 a ≤ 5,9 | ≥ 6 a < 12 | ≥ 12 |
| Riñón (creatinina, mg/dl) | < 1,2 | ≥ 1,2 a ≤ 1,9 | ≥ 2 a < 3,5 | ≥ 3,5 a < 5 | ≥ 5 |
| o diálisis | |||||
| Cerebral (grado de encefalopatía) | No | 1 | 2 | 3 | 4 |
| Coagulación (INR) | < 1,1 | ≥ 1,1 a < 1,25 | ≥1,25 a < 1,5 | ≥ 1,5 a < 2,5 | ≥ 2,5 o plaquetas |
| Vascular (PAMmm Hg) | ≥ 70 | < 70 | Dopamina ≤ 5 o dobutamina o terlipresina | Dopamina > 5 o adrenalina ≤ 0,1 o noradrenalina ≤ 0,1 | Dopamina > 15 o adrenalina >0,1 o noradrenalina >0,1 |
| Respiratorio | > 400 | > 300 a ≤ 400 | > 200 a ≤ 300 | > 100 a ≤ 200 | ≤ 100 |
| PaO2/FiO2 o SpO2/FiO2 | > 512 | > 357 a ≤ 512 | > 214 a ≤ 357 | > 89 a ≤ 214 | ≤ 89 |
El CLIF-SOFA incluye sub-scores del 0 al 4 para los 6 órganos/sistemas evaluados; a mayor disfunción de órgano, mayor puntuación. Las dosis de catecolaminas se muestran en μg/kg/min.
FiO2: fracción de oxígeno inspirado; PAM: presión arterial media; PaO2: presión parcial de oxígeno arterial; SpO2: saturación de oxígeno por pulsioximetría.
El área sombreada define los fallos de órgano.
La patogenia del ACLF es desconocida. Estudios realizados en la década de 1990 demostraron que en la cirrosis hepática descompensada existe una importante respuesta inflamatoria sistémica, con aumento de citoquinas proinflamatorias en plasma (IL-6, TNF-alfa) y del estrés oxidativo73,74. Se ha sugerido que esta respuesta inflamatoria, moderada en la cirrosis descompensada, sería más intensa en los pacientes con ACLF, lo que conduciría a la afectación de otros órganos o sistemas72. La gravedad del ACLF se correlaciona con el grado de inflamación sistémica. Los pacientes con formas más graves de ACLF presentan un recuento de leucocitos en sangre periférica mayor y niveles más elevados de PCR que los pacientes con formas menos graves. La susceptibilidad/tolerancia individual al fracaso de órganos es otro aspecto probablemente implicado en su patogenia.
Grados de ACLFEl estudio Canonic clasifica a los pacientes con ACLF en 3 grados en base al número de fracasos de órganos en el momento del diagnóstico del síndrome y la mortalidad asociada (tabla 5). Los pacientes sin ACLF son aquellos que: a)no presentan fracasos de órgano; b)tienen fracaso de un órgano no renal (insuficiencia hepática, coagulación, circulación o pulmonar) con creatinina sérica<1,5mg/dl y sin EH, o c)presentan fallo cerebral y función renal con creatinina <1,5mg/dl. Estos pacientes sin ACLF presentan una mortalidad a los 28días muy baja (1,9%). Los pacientes con ACLF grado1 son aquellos que presentan insuficiencia renal o el fallo de un órgano con creatinina sérica ≥1,5mg/dl y/o EH grado1-2. El ACLF grado2 es definido en base a la presencia de 2 fracasos de órgano, y el ACLF grado3, ante la presencia de 3-6 fallos de órgano. En el estudio Canonic el 51% de los pacientes con ACLF presentaron un grado1, el 35% un grado2 y el 14% un grado371.
Definición de ACLF y grados
| Grado de ACLF | Definición |
|---|---|
| No | Pacientes sin fallos de órgano |
| Fracaso de un órgano (hepático, coagulación, circulación o respiratorio)+creatinina<1,5mg/dl+no encefalopatía hepática | |
| Fracaso cerebral+creatinina<1,5mg/dl | |
| Grado 1 | Fracaso renal aislado |
| Fracaso de un órgano (hepático, coagulación, circulación o respiratorio)+creatinina 1,5-1,9mg/dl y/o encefalopatía hepática grado 1-2 | |
| Fracaso cerebral+creatinina 1,5-1,9mg/dl | |
| Grado 2 | Dos fracasos de órgano |
| Grado 3 | Tres o más fracasos de órgano |
Como hemos comentado con anterioridad, el pronóstico de los pacientes con ACLF depende del número de fallos de órgano, tal y como se define por la puntuación CLIF-SOFA (tabla 4). La mortalidad global a los 28días es remarcable, de alrededor del 30%, y varía entre el 22% en pacientes con ACLF grado1, el 32% en enfermos con ACLF grado2, el 68% en pacientes con 3 fallos de órgano y el 89% en pacientes con 4 o más fallos de órgano al diagnóstico del ACLF71.
Un estudio reciente demuestra que el ACLF es un proceso dinámico cuyo pronóstico se precisa mejor tras analizar la evolución del paciente75. El ACLF se resuelve o mejora a un grado1 en casi un 50% de los enfermos y empeora en alrededor del 20% de los casos. La mortalidad sin trasplante a los 28días es relativamente baja (6-18%) en pacientes con una evolución favorable (no ACLF o ACLF-1 final) y alta (42-92%) en pacientes con evolución desfavorable (ACLF-2 o -3 final) independientemente del grado de ACLF inicial. Los factores predictivos independientes de un curso desfavorable (ACLF-2 o -3 final) son el índice CLIF-Consortium ACLF (CLIF-C ACLFs) y la presencia de insuficiencia hepática (bilirrubina total ≥12mg/dl) en el momento del diagnóstico del síndrome. La gran mayoría de los enfermos alcanzan el grado final de ACLF durante la primera semana tras el diagnóstico, por lo que su evaluación a los 3-7días permite predecir de forma más precisa su mortalidad a corto plazo que la evaluación inicial. Sin trasplante, los pacientes con 4 o más fallos de órgano a los 3-7días del diagnóstico o con un índice CLIF-C ACLFs>64 puntos presentan una mortalidad a los 28días del 100%. Por el contrario, los pacientes con ACLF grado2-3 que se trasplantan de manera precoz tienen una tasa de supervivencia del 75% al año75. Estos datos sugieren que en pacientes con ACLF, el pronóstico y las decisiones terapéuticas que de este derivan se han de establecer no en el momento del diagnóstico del síndrome, sino tras evaluar a corto plazo su respuesta al tratamiento (3-7días).
TratamientoLa alta mortalidad de los pacientes con ACLF exige un diagnóstico precoz del síndrome y el ingreso de muchos de estos pacientes en UCI o intermedios. Dicho ingreso es necesario si existe un fracaso vascular (shock), respiratorio o cerebral (encefalopatía gradoIII-IV) y es aconsejable en pacientes con fracaso renal10. En el estudio Canonic el 50% de los pacientes con ACLF fueron ingresados en la UCI (86% de los enfermos con ACLF grado3)71.
Si por la edad del paciente o por las comorbilidades asociadas el trasplante hepático no está contraindicado, los pacientes deben ser derivados a un centro de trasplante, ya que este es en la actualidad el único tratamiento que mejora la supervivencia de estos pacientes. En el caso de pacientes alcohólicos activos es asimismo aconsejable su derivación a unidades especializadas, ya que estos enfermos pueden beneficiarse de potenciales terapias en investigación.
Un aspecto clave en el manejo de los pacientes con ACLF es tratar de manera precoz y adecuada el factor precipitante (antibióticos correctos en pacientes infectados, esteroides en pacientes con hepatitis alcohólica aguda grave, etc.)10. En los últimos años se dispone asimismo de sistemas de soporte hepático artificial que utilizan técnicas de diálisis para eliminar tanto sustancias hidrosolubles como liposolubles del plasma (diálisis con albúmina). El más utilizado de estos sistemas es el MARS®, aunque existen otros 2 sistemas similares: el PROMETHEUS® y el Single-Pass Albumin Dialysis (SPAD®)76,77.
Diferentes estudios han demostrado que el sistema MARS®: a)reduce significativamente los niveles séricos de bilirrubina total y conjugada, ácidos biliares, amoníaco, aminoácidos aromáticos, benzodiacepinas, ácidos grasos, cobre, urea, creatinina y lactato; b)mejora la hemodinámica sistémica, y c)disminuye la presión portal. Dos estudios aleatorizados demuestran asimismo que el MARS® es eficaz en el tratamiento de pacientes con fracaso cerebral (EH grado3-4)56,76,77. Sin embargo, la diálisis con albúmina (MARS® o PROMETHEUS®) no mejora la supervivencia de los pacientes con ACLF. Dos estudios recientes soportan esta afirmación40,41. La supervivencia a los 28días de los pacientes que fueron tratados con sistemas de soporte hepático fue superponible a la observada en los que recibieron tratamiento médico estándar (61-66% vs 60-63%, respectivamente). No obstante, un subanálisis del estudio que evaluó el sistema PROMETHEUS® sugiere que este tratamiento podría mejorar la supervivencia en el subgrupo de pacientes con un MELD>30puntos (57% vs. 42%; p=0,02)41.
Un pequeño estudio aleatorizado contra placebo sugiere que la administración de factores estimulantes de colonias granulocíticas en pacientes con ACLF mejora su supervivencia a los 60días (66% vs. 26%, p=0,001)78. Estos interesantes resultados deberían ser confirmados en otros estudios.
La heterogeneidad de los pacientes incluidos en todos estos estudios y de las definiciones de ACLF empleadas, la diversidad de los eventos precipitantes y la falta de tratamientos que promuevan la regeneración hepática en el paciente con cirrosis hacen extremadamente difícil la evaluación de la eficacia de una única estrategia terapéutica. Son por ello necesarias mejoras técnicas en los sistemas de soporte hepático artificial y nuevos ensayos controlados que reevalúen indicaciones, momentos del tratamiento, otras terapias como el recambio plasmático o la terapia celular y terapias combinadas.
Pronóstico del paciente cirrótico críticoLos pacientes con cirrosis requieren con frecuencia cuidados intensivos por descompensaciones graves de su enfermedad hepática. Independientemente del motivo de ingreso, la cirrosis añade complejidad y un mal pronóstico al paciente crítico, pronóstico que en cualquier caso ha mejorado en los últimos años10,79. Datos recientes muestran una mortalidad en la UCI del 35-48%, que depende básicamente de 2 variables: el motivo de ingreso y el número de fracasos de órgano. Los pacientes con hemorragia variceal o EH tienen un excelente pronóstico (supervivencia del 87-90% y del 74%, respectivamente) en comparación con los ingresados por causas sépticas (mortalidad en la UCI: 64%)80,81. Por otra parte, la presencia de un solo fracaso de órgano (criterio SOFA) se asocia a una mortalidad del 30-48%, que aumenta al 65% y 70-89% si existen 2 o 3 fracasos de órgano, respectivamente82. Otros factores que empeoran el pronóstico son la necesidad de ventilación mecánica o de TSR y la presencia de sepsis. Un 59% de los pacientes con cirrosis que requieren ventilación mecánica mueren durante su estancia en la UCI, tasa que se eleva al 70% si el soporte ventilatorio es secundario a una sepsis grave23. La necesidad de 3 o más tratamientos de soporte (diálisis, ventilación mecánica, soporte vasoactivo o MARS) eleva la mortalidad en la UCI al 96%80. Esta mortalidad es mayor a la observada en pacientes críticos sin cirrosis. La mayoría de las muertes se producen durante la primera semana y su causa principal es el fracaso multiorgánico (ACLF)81,83. La ausencia de sistemas de soporte hepático artificial eficientes y la cascada de eventos que abocan al paciente a un círculo vicioso, deterioro de la función hepática que promueve la aparición de otros fracasos de órganos que a su vez acentúan el deterioro de la función hepática, explican este mal pronóstico del paciente con cirrosis crítico. Poder identificar de manera precisa los pacientes que pueden sobrevivir al ingreso en la UCI, evitando en lo posible un ingreso fútil, es por ello necesario10,83.
A pesar de que el pronóstico de los pacientes con cirrosis en estado crítico es relativamente pobre, existe un interés renovado en estos pacientes tras la generalización del sistema MELD como criterio de asignación de órganos («primero el más enfermo»), que prioriza el trasplante de pacientes con una mayor puntuación MELD. De hecho, el número de pacientes con cirrosis que ingresan en UCI está aumentando en estos últimos años79.
Limitaciones de los índices MELD y Child-PughEl índice de MELD, basado en las cifras de la bilirrubina sérica, INR y creatinina, es un excelente factor predictivo de la mortalidad a 3meses en pacientes con cirrosis no críticos. Sin embargo, el MELD valora únicamente la función de hígado, riñón y coagulación, y no considera otros órganos clave en pacientes críticos (vascular, cerebral y respiratorio). Aunque los pacientes con un MELD más elevado al ingreso en la UCI tienen una mayor mortalidad, este índice no discrimina de manera adecuada la población de pacientes con una probabilidad razonable de supervivencia en la UCI. El MELD-Na, Refit MELD y Refit MELD-Na no mejoran su capacidad pronóstica80,82,83. Por el contrario, el MELD integrado, o iMELD, basado en el MELD, la edad y el grado de encefalopatía, tiene una excelente capacidad pronóstica en pacientes con ACLF cuyo factor precipitante es un evento hepático (virus hepatotropos, fármacos hepatotóxicos, alcohol)84. Las limitaciones del MELD son aplicables al índice Child-Pugh.
Utilidad y limitaciones de los índices pronósticos generales de la unidad de cuidados intensivosSe han propuesto distintos índices generales de UCI con el objetivo de evaluar la gravedad de la enfermedad y su evolución (APACHEII, APACHEIII, SAPSII y MPM) o de estratificar a los pacientes por el número de fallos de órgano (LODS, MODS y SOFA). Los índices APACHEII y SOFA son los más utilizados para valorar el pronóstico de los pacientes ingresados en las UCI generales, siendo el SOFA el más utilizado en pacientes con cirrosis críticos80,82,83.
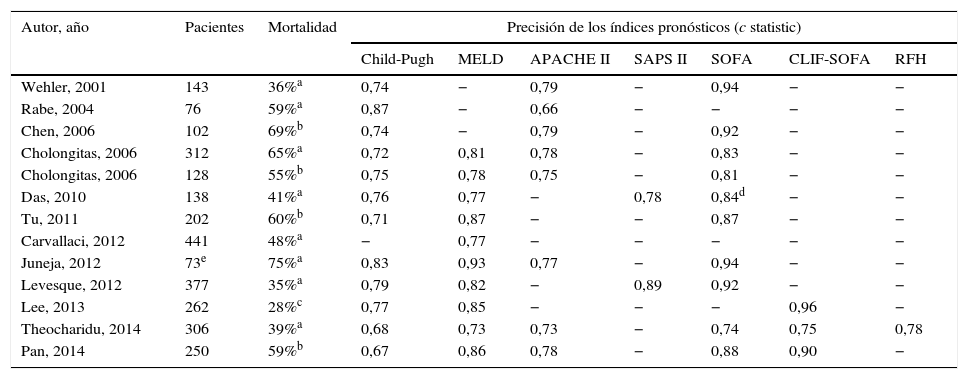
Varios estudios han comparado los índices hepáticos (Child-Pugh y MELD) con los generales de UCI (APACHEII, SAPSII y SOFA) en pacientes con cirrosis críticos (tabla 6). Estos estudios muestran que el SOFA es el más útil en la predicción de la mortalidad en la UCI en estos pacientes probablemente porque incluye marcadores de función cerebral, cardiovascular, renal, respiratoria, hematológica y hepática. Su modificación, excluyendo la valoración de las plaquetas (mSOFA o SOFA no hematológico), parece ser el mejor índice pronóstico general en la población de pacientes con cirrosis críticos. Su precisión aumenta cuando se reevalúa al segundo o tercer día del ingreso81,85. Las limitaciones pronósticas de los índices generales de la UCI en la población con cirrosis probablemente están en relación con una evaluación inapropiada de la función hepática, central en el pronóstico de estos pacientes10.
Capacidad de diferentes índices pronósticos para predecir la mortalidad de pacientes cirróticos críticos ingresados en la UCI
| Autor, año | Pacientes | Mortalidad | Precisión de los índices pronósticos (c statistic) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Child-Pugh | MELD | APACHE II | SAPS II | SOFA | CLIF-SOFA | RFH | |||
| Wehler, 2001 | 143 | 36%a | 0,74 | − | 0,79 | − | 0,94 | − | − |
| Rabe, 2004 | 76 | 59%a | 0,87 | − | 0,66 | − | − | − | − |
| Chen, 2006 | 102 | 69%b | 0,74 | − | 0,79 | − | 0,92 | − | − |
| Cholongitas, 2006 | 312 | 65%a | 0,72 | 0,81 | 0,78 | − | 0,83 | − | − |
| Cholongitas, 2006 | 128 | 55%b | 0,75 | 0,78 | 0,75 | − | 0,81 | − | − |
| Das, 2010 | 138 | 41%a | 0,76 | 0,77 | − | 0,78 | 0,84d | − | − |
| Tu, 2011 | 202 | 60%b | 0,71 | 0,87 | − | − | 0,87 | − | − |
| Carvallaci, 2012 | 441 | 48%a | − | 0,77 | − | − | − | − | − |
| Juneja, 2012 | 73e | 75%a | 0,83 | 0,93 | 0,77 | − | 0,94 | − | − |
| Levesque, 2012 | 377 | 35%a | 0,79 | 0,82 | − | 0,89 | 0,92 | − | − |
| Lee, 2013 | 262 | 28%c | 0,77 | 0,85 | − | − | − | 0,96 | − |
| Theocharidu, 2014 | 306 | 39%a | 0,68 | 0,73 | 0,73 | − | 0,74 | 0,75 | 0,78 |
| Pan, 2014 | 250 | 59%b | 0,67 | 0,86 | 0,78 | − | 0,88 | 0,90 | − |
RFH: Royal Free Hospital.
Pese a que el índice SOFA tiene mejor capacidad pronóstica que las escalas Child-Pugh y MELD, sus componentes no tienen en cuenta características fisiopatológicas y clínicas de la cirrosis. Por ello, el EASL CLIF-Consortium modificó dicho índice, creando una nueva escala denominada CLIF-SOFA adaptada a pacientes hepáticos (tabla 4)71. Sus principales cambios son la sustitución del recuento de plaquetas y de la escala de Glasgow por el INR y la escala de West-Haven para valorar los fracasos de la coagulación y cerebral, respectivamente. Este índice pronóstico, recientemente creado, ha demostrado tener una capacidad pronóstica superior al SOFA y al APACHEIII en algunos estudios, especialmente si se valora a las 48h del ingreso en intensivos (AUROC: 0,85-0,90)86.
Dos nuevos índices pronósticos de potencial aplicabilidad en el paciente con cirrosis crítico han sido generados recientemente: el Royal Free Hospital (RFH) score y el CLIF-C ACLFs score87,88. El RFH score es complejo e incluye bilirrubina, INR, lactato, gradiente de presión alveoloarterial de O2, urea y causa de ingreso en UCI (sepsis, hemorragia variceal u otras). El CLIF-C ACLFs score simplifica y mejora la capacidad pronóstica del CLIF-SOFA score, reduce de 5 a 3 los subscores para definir la disfunción de órgano, e incluye la edad y el recuento de leucocitos en sangre. Su capacidad pronóstica es superior a la de los índices hepáticos en pacientes con ACLF y mejora si se reevalúa a las 48h y a los 3-7días. Su capacidad pronóstica parece ser inferior al iMELD en pacientes con ACLF desencadenado por eventos hepáticos. La verdadera utilidad clínica de estos nuevos scores en el paciente con cirrosis crítico debe ser evaluada en nuevos estudios.
Criterios de futilidadComo se ha comentado previamente, el pronóstico global de los pacientes con cirrosis ingresados en la UCI es relativamente pobre. Sin embargo, a nivel individual, qué probabilidad de supervivencia justifica un ingreso en la UCI y cuál lo impide es todavía un tema de debate. La decisión de proporcionar un tratamiento intensivo depende de una serie de factores, incluyendo el pronóstico a corto y a largo plazo del paciente, la posibilidad de realizar un trasplante de «rescate» y la disponibilidad de recursos. Por otra parte, varios estudios han demostrado buenos resultados en pacientes con cirrosis críticos seleccionados. Por tanto, las reticencias al ingreso en la UCI de estos pacientes deben de ser matizadas. En general, cualquier paciente con una complicación aguda potencialmente mortal con un MELD bajo debe ser admitido en la UCI antes de que desarrolle complicaciones más graves. Por el contrario, en los pacientes con una cirrosis avanzada (MELD¿30), 3 o más fracasos de órgano y sin perspectivas de trasplante de «rescate», el manejo intensivo es cuestionable. Un enfoque práctico es proporcionar a estos enfermos un apoyo intensivo sin restricciones durante 3días10. De acuerdo con esta política, la presencia de 3 o 4 fracasos de órgano no hematológicos no debe contraindicar el ingreso en la UCI. Sin embargo, su persistencia (3 o más fallos) tras 3días de intervención debe considerarse como un criterio para establecer una limitación del tratamiento intensivo, ya que la evolución fatal es prácticamente constante. Más recientemente se ha sugerido otro criterio de futilidad basado en la evolución de los pacientes con ACLF a los 3-7días del inicio del tratamiento. Según los resultados de este estudio, los pacientes con 4 o más fallos de órgano o con un índice CLIF-C ACLFs>64puntos a los 3-7días del diagnóstico del ACLF presentan una mortalidad a los 28días muy elevada (100% en el estudio), por lo que, si no existe posibilidad de un «trasplante de rescate», se debería plantear la limitación del esfuerzo terapéutico75.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Documento de Posicionamiento de la Societat Catalana de Digestologia.