Analizar la evolución analítica, clínica y de la fibrosis en pacientes F3-F4 curados con antivirales de acción directa (AAD).
Pacientes y métodosEstudio unicéntrico, observacional y prospectivo. Se incluyeron todos los pacientes con hepatitisC F3-F4 curados con AAD del 1 de noviembre de 2014 al 31 de agosto de 2019. Se realizó una visita basal (VB) y a las 12semanas (12s), 1, 2, 3 y 4años tras finalizar el tratamiento.
Se recogieron variables demográficas, analíticas, medición no invasiva de la fibrosis, marcadores indirectos de hipertensión portal, presencia de varices esofágicas, descompensaciones de la cirrosis y hepatocarcinoma.
ResultadosSe trataron 169 pacientes: 123 (72,8%) hombres, edad 57,5±12 años; 117 (69,2%) presentaban cirrosis, 99 (84,6%) ChildA. El 96,4% consiguieron respuesta virológica sostenida (RVS).
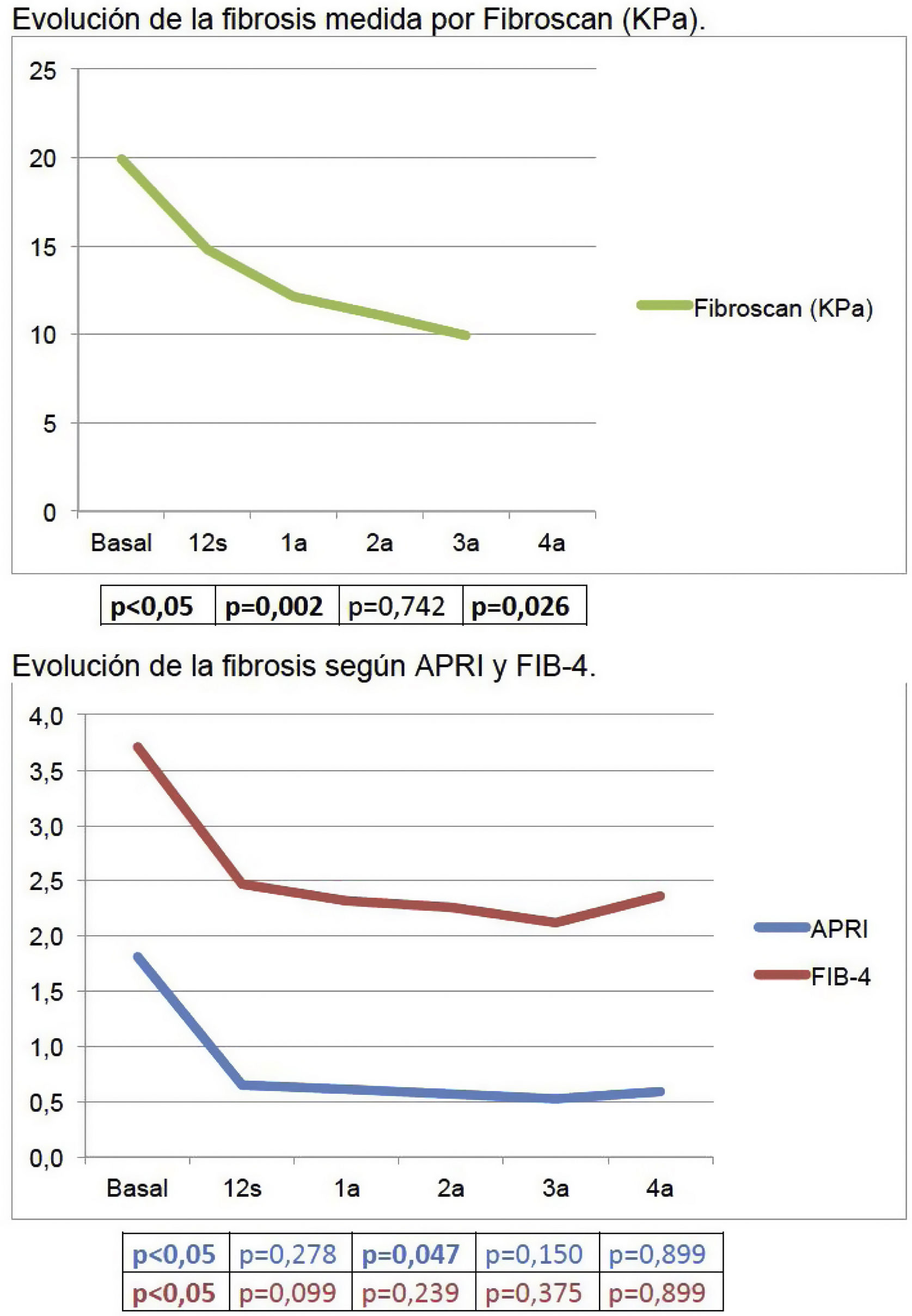
La mediana de seguimiento fue de 46,14 (2,89-62,55) meses. Durante el seguimiento se observó precozmente un aumento significativo de plaquetas (155×103/μl [VB]; 163×103/μl [12s]), colesterol (158mg/dl [VB]; 179mg/dl [12s]) y albúmina (4,16g/dl [VB]; 4,34g/dl [12s]), y un descenso significativo de GPT (82UI/l [VB]; 23UI/l [12s]), GOT (69UI/l [VB]; 26UI/l [12s]), GGT (118UI/l [VB]; 48UI/l [12s]), y bilirrubina (0,9mg/dl [VB]; 0,7mg/dl [12s]). La fibrosis disminuyó, también inicialmente, tanto con métodos serológicos como Fibroscan (19,9KPa [VB]; 14,8KPa [12s]); p<0,05).
El 8,1% de los pacientes con cirrosis compensada presentaron alguna descompensación. El 4,5% desarrollaron varices esofágicas.
Nueve (5,52%) pacientes presentaron hepatocarcinoma de novo; seis (3,68%) lo presentaban basalmente, y el 40% sufrieron recidiva.
Durante el seguimiento la mortalidad fue del 9,2%.
ConclusionesExiste mejoría de los parámetros analíticos y de la fibrosis hepática medida por métodos no invasivos en los pacientes F3-F4 curados con AAD. Sin embargo, el riesgo de descompensación y de hepatocarcinoma persiste, por lo que se debe mantener el seguimiento.
To analyze laboratory parameters, clinical and fibrosis evolution in F3-F4 patients cured with direct-acting antivirals (DAA).
Patients and methodsUnicenteric, observational and prospective study. All F3–F4 hepatitis C patients cured with DAA from 01/11/2014 to 31/08/2019 were included. A basal visit (BV) was performed and at 12 weeks (12w), 1, 2, 3 and 4 years after treatment.
Demographic and laboratory variables, fibrosis measured by non-invasive tests, indirect markers of portal hypertension, the presence of esophageal varices, cirrhosis decompensation and hepatoceullar carcinoma were collected.
Results169 patients were treated: 123 (72.8%) men, age 57.5±12 years; 117 (69.2%) with cirrhosis, 99 (84.6%) ChildA. 96,4% achieved SVR.
The study was conducted for a median follow-up of 46.14 (2.89-62.55) months. It was observed a significant increase in platelets [155×103/μL (BV); 163×103/μL (12w)], cholesterol [158mg/dL (BV); 179mg/dL (12w)] and albumin [4.16g/dL (BV); 4.34g/dL (12w)] and a significant decrease in ALT [82UI/L (BV); 23UI/L (12w], AST [69UI/L (BV); 26UI/L (12w)], GGT [118UI/L (BV); 48UI/L (12w)] and bilirrubin [0.9mg/dL (BV); 0.7mg/dL (12w)]. Fibrosis also improved early in follow-up, both by serological methods and Fibroscan [19.9kPa (BV); 14.8kPa (12w; P<.05].
8.1% of compensated cirrhosis patients had some decompensation. 4.5% developed esophageal varices.
Nine patients (5.52%) had de novo hepatocellular carcinoma; 6 (3.68%) had hepatoceullar carcinoma in BV and 40% had a recurrence.
During follow-up mortality was 9.2%.
ConclusionsThere is an improvement in laboratory parameters and fibrosis measured by non-invasive methods in F3-F4 patients cured with DAA. However, the risk of decompensation and the incidence/recurrence of hepatocellular carcinoma still remain, so there is a need to follow these patients.
La infección por el virus de la hepatitisC (VHC) afecta aproximadamente a 170 millones de personas en el mundo1, produciendo la aparición de complicaciones como cirrosis hepática y hepatocarcinoma (HCC), que pueden acabar, en última instancia, con la necesidad de un trasplante hepático o incluso con el fallecimiento del paciente2. Los tratamientos basados en interferón (INF) fueron la única opción terapéutica para los pacientes con infección por el VHC durante mucho tiempo. Estas terapias no solo tenían unas tasas de respuesta virológica sostenida (RVS) relativamente bajas3, sino que se asociaban a importante toxicidad y mala tolerancia, por lo que muchos pacientes no podían ser tratados. Además, en pacientes con enfermedad hepática descompensada el tratamiento con INF estaba contraindicado, dado el riesgo tan elevado de descompensación4. Teniendo en cuenta estos sesgos de selección, existen estudios que demuestran que la RVS obtenida tras terapias basadas en INF se relacionaban con una mejoría clínica del paciente5-7.
Con la aparición de los antivirales de acción directa (AAD), el abanico de pacientes que pueden ser tratados ha aumentado considerablemente y las tasas de RVS se han visto también aumentadas de forma importante en todos los estadios de fibrosis8, por lo que se considera uno de los logros terapéuticos más importantes de los últimos 20años9. Lo que todavía queda por determinar es si la RVS asociada al tratamiento con AAD se relaciona también con beneficios clínicos para el paciente a corto y a largo plazo. Estos beneficios pueden estar relacionados directamente con la enfermedad hepática (mejoría de la fibrosis y regresión de la cirrosis, mejoría de la función hepática, disminución del riesgo de HCC y mortalidad relacionada con la enfermedad hepática) o con la supervivencia global del paciente. Documentar estos beneficios potenciales relacionados con la eliminación del virus con AAD son básicos para establecer la utilidad real de estos tratamientos en los pacientes con VHC9.
La finalidad de nuestro estudio fue analizar la evolución de las variables analíticas, la de la fibrosis y la aparición de eventos clínicos (aparición de varices esofágicas, descompensaciones de la cirrosis, HCC) en los pacientes con fibrosis avanzada o cirrosis tratados y curados con AAD a lo largo del seguimiento.
Pacientes y métodosDiseño del estudioSe trata de un estudio observacional, prospectivo, realizado en un hospital español de tercer nivel (Hospital Universitario de Burgos). Se incluyeron de forma consecutiva todos los pacientes con infección crónica por el virus de la hepatitisC (VHC) con fibrosis avanzada (F3) o cirrosis (F4) tratados con antivirales de acción directa (AAD) desde noviembre de 2014 hasta agosto de 2019 y con RVS. Se clasificaron como F3 los pacientes con un valor de elastografía de transición (ET) comprendido entre 9,5 y 12,5kPa y como F4 los que presentaban un valor de ET>12,5kPa, biopsia o datos clínicos, analíticos y/o ecográficos compatibles con cirrosis. El tratamiento fue prescrito libremente por cada médico de acuerdo con la ficha técnica y las guías española y europea para el manejo de la infección por el VHC vigentes en el momento de iniciar el tratamiento. Tras la finalización del tratamiento antiviral se realizó el seguimiento de los pacientes de acuerdo con dichas guías, estableciendo como fecha de corte el 16 de junio de 2020. El protocolo del estudio incluyó una visita basal (VB), en la que se evaluó al paciente y se instauró el tratamiento con AAD. Las visitas de seguimiento se realizaron a las 12 semanas (12s) tras el fin de tratamiento y a 1 año (1a), 2 años (2a), 3 años (3a) y 4 años (4a) tras fin de tratamiento.
VariablesEn la visita basal se recogieron variables demográficas y epidemiológicas relativas a la enfermedad hepática (edad, sexo, talla, peso, índice de masa corporal [IMC], presencia de diabetes mellitus [DM], coinfección con el virus de la hepatitisB [VHB], uso de drogas por vía parenteral, ingesta de alcohol, antecedente de tratamiento previo y tipo, genotipo del virus y tratamiento actual). Tanto en la visita basal como en las de seguimiento se recogieron variables analíticas (hemoglobina, plaquetas, GPT, GOT, GGT, FA, colesterol, triglicéridos, albúmina, bilirrubina, creatinina, INR), puntuación de Child-Pugh y puntuación de MELD. La fibrosis hepática fue medida con marcadores no invasivos: serológicos (APRI, FIB-4) y mediante ET (Fibroscan®, EchoSens, París). La RVS se definió como un RNA VHC no detectable en la semana12 postratamiento. Los niveles de RNA VHC se determinaron mediante el analizador COBAS AmpliPrep®/COBAS TaqMan® (Roche Molecular Systems, Pleasanton, CA, Estados Unidos), con un límite de detección de 15UI/ml.
Igualmente, tanto de forma basal como en el seguimiento, se valoró la presencia de marcadores indirectos de hipertensión portal (volumen del bazo, diámetro portal, circulación colateral). Se registró también la presencia basal y la aparición posterior al tratamiento de: varices esofágicas (VE), descompensaciones de la cirrosis (ascitis, hemorragia digestiva secundaria a VE y encefalopatía hepática) y HCC, así como la recepción de un trasplante hepático o la muerte durante el seguimiento.
En los pacientes que de forma basal presentaban VE, descompensaciones o HCC, se estudió la evolución de los mismos tras el tratamiento.
Consideraciones éticasEl estudio fue realizado de acuerdo a las guías de la Declaración del Helsinki y fue aprobado por el Comité de Ética de nuestro centro. Los pacientes firmaron el consentimiento informado para su participación en el estudio.
Análisis estadísticoLos datos se analizaron mediante el programa estadístico IBM SPSS Statistics 20.0. El análisis descriptivo se expresó mediante medias (desviación estándar [DE]), medianas (rango intercuartílico) y frecuencias (porcentajes) en función de las características de las variables y del tipo de distribución.
Para valorar la evolución de las variables se utilizaron test de medidas repetidas, según el tipo de variable y distribución: t de Student (continuas que cumplen la normalidad o muestras grandes), McNemar (dicotómicas) y Wilcoxon (muestras sin distribución normal).
Se consideró significativo cualquier valor de p por debajo del nivel de significación 0,05.
ResultadosDurante el período de estudio, 169 pacientes con infección crónica por el VHC F3-F4 fueron tratados con AAD. De ellos, 123 (72,8%) fueron hombres, con una edad media de 57,5 (±12) años, y 117 (el 69,2%) presentaban cirrosis, 99 (84,6%) en estadio Child-PughA. De los pacientes con cirrosis, 27 pacientes (23,1%) presentaban VE de forma basal. Ningún paciente había presentado una hemorragia digestiva alta (HDA) por VE, 10 (8,5%) presentaba ascitis y un paciente (5,1%) había presentado encefalopatía hepática. Tras un primer tratamiento con AAD, 160 pacientes (94,7%) alcanzaron la RVS. Tras el segundo tratamiento con AAD, se curaron otros 3 pacientes (1,8%). En total, la RVS de nuestra cohorte fue del 96,4%.
La mediana de seguimiento fue de 46,14 (2,89-62,55) meses. Cincuenta pacientes (el 29,6% de la cohorte) completaron 4años de seguimiento.
En la tabla 1 se reflejan las características basales de los pacientes de la cohorte completa y de los pacientes con RVS.
Características basales de la cohorte completa y de los pacientes con RVS tras AAD
| Total | n=169 | SÍ RVS | n=163 | |
|---|---|---|---|---|
| n/media | %/DE | n/media | %/DE | |
| Edad | ||||
| Años | 57,56 | ±12,03 | 57,60 | ±12,16 |
| Sexo | ||||
| Mujer | 46 | 27,2% | 45 | 27,6% |
| Hombre | 123 | 72,8% | 118 | 72,4% |
| Talla | ||||
| Metros | 1,68 | ±0,10 | 1,69 | ±0,10 |
| Peso | ||||
| Kg | 76,05 | ±16,98 | 75,70 | ±16,99 |
| IMC | 26,98 | ±5,38 | 26,90 | ±5,37 |
| DM | ||||
| No | 139 | 82,2% | 133 | 81,6% |
| Sí | 30 | 17,8% | 30 | 18,4% |
| VHB | ||||
| No | 167 | 98,8% | 161 | 98,80% |
| Sí | 2 | 1,2% | 2 | 1,20% |
| ADVP | ||||
| Actual | 0 | 0,0% | 0 | 0% |
| Nunca | 117 | 69,2% | 114 | 69,9% |
| EX-ADVP | 48 | 28,4% | 45 | 27,6% |
| Metadona | 4 | 2,4% | 4 | 2,5% |
| Alcohol | ||||
| Actual | 8 | 4,7% | 8 | 4,9% |
| Nunca | 121 | 71,6% | 118 | 72,4% |
| EX-OH | 40 | 23,7% | 37 | 22,7% |
| Genotipo | ||||
| 1 | 101 | 59,8% | 99 | 60,7% |
| 2 | 2 | 1,2% | 2 | 1,2% |
| 3 | 42 | 24,9% | 40 | 24,5% |
| 4 | 22 | 13,0% | 20 | 12,3% |
| 5 | 2 | 1,2% | 2 | 1,2% |
| Tratam. previo | ||||
| No | 94 | 55,6% | 92 | 56,4% |
| Sí | 75 | 44,4% | 71 | 43,6% |
| Tipo tratam. previo | ||||
| INF | 9 | 12,0% | 9 | 12,7% |
| INF +RBV | 48 | 64,0% | 47 | 66,2% |
| AAD | 18 | 24,0% | 15 | 21,1% |
| Trasplante hepático | ||||
| No | 165 | 97,6% | 159 | 97,5% |
| Sí | 4 | 2,4% | 4 | 2,5% |
| Cirrosis | ||||
| No | 52 | 30,8% | 52 | 31,9% |
| Sí | 117 | 69,2% | 111 | 68,1% |
| CHILD | 5,62 | ±1,23 | 5,57 | ±1,21 |
| CHILD | ||||
| A | 100 | 85,4% | 97 | 86,6% |
| B | 15 | 12,8% | 12 | 10,7% |
| C | 2 | 1,7% | 2 | 2,7% |
| MELD | 8,51 | ±3,52 | 8,44 | ±3,51 |
| Fibrosis | ||||
| KPa | 20,11 | ±12,91 | 19,90 | ±13,00 |
| APRI | 1,96 | ±2,03 | 1,81 | ±1,77 |
| FIB-4 | 3,94 | ±3,49 | 3,68 | ±2,91 |
| Volumen bazo | ||||
| Normal | 87 | 57,6% | 86 | 58,9% |
| Aumentado | 64 | 42,4% | 60 | 41,4% |
| Calibre portal | ||||
| Normal | 124 | 81,0% | 121 | 82,3% |
| Aumentado | 29 | 19,0% | 26 | 17,7% |
| Circulación colateral | ||||
| Ausente | 148 | 96,1% | 145 | 98,0% |
| Presente | 6 | 3,9% | 3 | 2,0% |
Con respecto a los niveles basales, tras el tratamiento se evidenció un aumento estadísticamente significativo del valor de plaquetas (155×103/μl [VB]; 163×103/μl [12s]), colesterol (158mg/dl [VB]; 179mg/dl [12s]) y albúmina (4,16g/dl [VB]; 4,34g/dl [12s]), y un descenso significativo de GPT (82UI/l [VB]; 23UI/l [12s]), GOT (69UI/l [VB]; 26UI/l [12s]), GGT (118UI/l [VB]; 48UI/l [12s]) y bilirrubina (0,9mg/dl [VB]; 0,7mg/dl [12s]). Estos cambios analíticos se produjeron de manera precoz, entre las visitas basal y 12s, y posteriormente se mantuvieron estables a lo largo de todo el periodo de seguimiento.
En la tabla 2 se resume la evolución de los distintos parámetros analíticos a lo largo del tiempo.
Evolución de valores analíticos en los pacientes con RVS
| Basal | p ΔB-12s | 12s | p Δ12-1a | 1a | p Δ1a/2a | 2a | p Δ2-3a | 3a | p Δ3-4a | 4a | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | Media | DE | n | Media | DE | n | Media | DE | n | Media | DE | n | Media | DE | n | Media | DE | ||||||
| Plaquetas (×109/l) | 163 | 154,63 | ±62,62 | 0,000 | 160 | 163,36 | ±63,17 | 0,003 | 132 | 169,34 | ±62,66 | 0,219 | 110 | 173,94 | ±70,63 | 0,811 | 94 | 173,86 | ±63,28 | 0,431 | 56 | 164,79 | ±61,66 |
| Hemoglobina (g/dl) | 163 | 14,85 | ±2,03 | 0,886 | 160 | 14,85 | ±1,98 | 0,169 | 131 | 15,11 | ±1,70 | 0,000 | 110 | 14,90 | ±1,70 | 0,134 | 94 | 14,83 | ±1,68 | 0,836 | 56 | 14,75 | ±2,00 |
| GPT (UI/l) | 163 | 81,78 | ±57,64 | 0,000 | 157 | 23,24 | ±15,62 | 0,364 | 132 | 24,21 | ±17,44 | 0,691 | 110 | 24,07 | ±17,96 | 0,314 | 93 | 23,49 | ±15,86 | 0,165 | 56 | 26,05 | ±25,16 |
| GOT (UI/l) | 162 | 68,83 | ±44,98 | 0,000 | 150 | 26,47 | ±17,81 | 0,983 | 123 | 26,33 | ±19,55 | 0,067 | 97 | 24,86 | ±17,14 | 0,915 | 82 | 25,31 | ±20,48 | 0,653 | 49 | 24,31 | ±9,07 |
| GGT (UI/l) | 162 | 118,22 | ±148,96 | 0,000 | 155 | 48,03 | ±78,93 | 0,097 | 132 | 59,20 | ±119,06 | 0,371 | 108 | 57,90 | ±96,22 | 0,340 | 89 | 58,54 | ±103,70 | 0,972 | 55 | 69,80 | ±142,18 |
| FA (UI/l) | 155 | 90,86 | ±57,56 | 0,652 | 151 | 88,70 | ±71,16 | 0,109 | 128 | 81,15 | ±40,24 | 0,841 | 105 | 81,51 | ±49,65 | 0,924 | 89 | 76,03 | ±40,19 | 0,229 | 54 | 76,87 | ±44,15 |
| Colesterol (mg/dl) | 153 | 158,09 | ±34,49 | 0,000 | 145 | 179,47 | ±36,81 | 0,235 | 128 | 178,05 | ±34,25 | 0,097 | 109 | 177,06 | ±33,91 | 0,436 | 89 | 180,45 | ±37,36 | 0,596 | 53 | 183,55 | ±31,85 |
| Triglicéridos (mg/dl) | 153 | 115,98 | ±66,44 | 0,748 | 143 | 114,01 | ±73,15 | 0,454 | 127 | 122,38 | ±72,99 | 0,675 | 108 | 123,93 | ±71,20 | 0,635 | 89 | 131,44 | ±83,10 | 0,303 | 54 | 123,26 | ±74,66 |
| Albúmina (g/dl) | 146 | 4164,72 | ±509,50 | 0,000 | 147 | 4335,78 | ±467,62 | 0,133 | 126 | 4420,10 | ±416,73 | 0,230 | 97 | 4342,12 | ±471,21 | 0,478 | 82 | 4349,90 | ±424,69 | 0,071 | 48 | 4452,88 | ±813,88 |
| Bilirrubina (mg/dl) | 163 | 0,87 | ±0,68 | 0,000 | 156 | 0,71 | ±0,51 | 0,990 | 130 | 0,72 | ±0,42 | 0,877 | 106 | 0,71 | ±0,39 | 0,924 | 92 | 0,76 | ±0,56 | 0,264 | 55 | 0,84 | ±1,07 |
| Creatinina (mg/dl) | 160 | 0,99 | ±1,16 | 0,452 | 160 | 1,01 | ±1,00 | 0,047 | 131 | 1,03 | ±0,94 | 0,130 | 111 | 1,04 | ±0,92 | 0,110 | 94 | 1,03 | ±0,93 | 0,426 | 55 | 1,03 | ±0,97 |
| INR | 139 | 1,10 | ±0,30 | 0,677 | 88 | 1,09 | ±0,21 | 0,068 | 98 | 1,11 | ±0,38 | 0,621 | 81 | 1,07 | ±0,16 | 0,049 | 62 | 1,10 | ±0,24 | 0,823 | 38 | 1,07 | ±0,11 |
En cuanto a los índices que evalúan la función hepática, no se observaron diferencias significativas en la media del valor numérico del Child-Pugh (VB: 5,57; 12s: 5,28; 1a: 5,13; 2a: 5,15; 3a: 5,23; 4a: 5,41) ni del MELD (VB: 8,44; 12s: 8,32; 1a: 8,15; 2a: 8,16; 3a: 8,69; 4a: 8,69) a lo largo del periodo de seguimiento del estudio en los pacientes que presentaron RVS.
Con respecto a los marcadores indirectos de hipertensión portal, a excepción del recuento plaquetario, no se observaron cambios significativos en el volumen del bazo, en el diámetro portal o en la presencia de circulación colateral a lo largo del seguimiento (datos no mostrados).
Al estratificar los resultados en dos grupos en función de la fibrosis basal (F3 y F4) se observó que la mejoría inicial de la GPT, GOT, GGT y el aumento de colesterol sucedían en ambos grupos de forma estadísticamente significativa. En cambio, la mejoría en el recuento plaquetario, en la albúmina y en la bilirrubina únicamente era significativa en los pacientes F4, que por otra parte tenían valores más alterados de forma basal (tabla 3).
Evolución de la fibrosis medida por ET y de los valores analíticos según la fibrosis basal (F3-F4) en el primer año tras tratamiento
| Basal | 12s | 1a | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n | Media | DE | p ΔB-12s | n | Media | DE | p Δ12s-1a | n | Media | DE | |
| F3 | |||||||||||
| Fibrosis (Kpa) | 52 | 11,07 | ±0,94 | 0,000 | 37 | 8,62 | ±3,16 | 0,010 | 41 | 7,48 | ±1,85 |
| Plaquetas (×109/l) | 52 | 186,17 | ±67,40 | 0,218 | 50 | 191,08 | ±67,76 | 0,381 | 44 | 192,93 | ±58,60 |
| Hemoglobina (g/dl) | 52 | 15,36 | ±1,77 | 0,174 | 50 | 15,15 | ±1,71 | 0,430 | 44 | 15,30 | ±1,61 |
| GPT (UI/l) | 52 | 72,77 | ±45,49 | 0,000 | 50 | 20,12 | ±9,88 | 0,330 | 44 | 21,55 | ±11,93 |
| GOT (UI/l) | 52 | 56,13 | ±30,80 | 0,000 | 46 | 22,24 | ±12,31 | 0,957 | 39 | 22,36 | ±7,63 |
| GGT (UI/l) | 52 | 81,69 | ±56,22 | 0,000 | 50 | 30,36 | ±32,44 | 0,372 | 44 | 28,52 | ±25,23 |
| FA (UI/l) | 50 | 74,86 | ±23,50 | 0,464 | 50 | 84,32 | ±88,10 | 0,244 | 42 | 67,12 | ±19,60 |
| Colesterol (mg/dl) | 48 | 164,08 | ±37,15 | 0,000 | 45 | 188,80 | ±40,38 | 0,861 | 43 | 186,26 | ±34,64 |
| Triglicéridos (mg/dl) | 48 | 120,31 | ±66,14 | 0,886 | 44 | 119,41 | ±101,25 | 0,648 | 43 | 128,95 | ±67,89 |
| Albúmina (g/dl) | 45 | 4289,56 | ±434,04 | 0,605 | 47 | 4320,06 | ±454,19 | 0,238 | 41 | 4431,95 | ±460,10 |
| Bilirrubina (mg/dl) | 52 | 0,66 | ±0,34 | 0,099 | 50 | 0,59 | ±0,32 | 0,566 | 44 | 0,58 | ±0,31 |
| Creatinina (mg/dl) | 52 | 0,98 | ±0,93 | 0,088 | 50 | 1,01 | ±1,00 | 0,008 | 44 | 1,10 | ±1,18 |
| INR | 38 | 1,09 | ±0,49 | 0,435 | 19 | 1,02 | ±0,09 | 1,000 | 26 | 1,17 | ±0,63 |
| F4 | |||||||||||
| Fibrosis (Kpa) | 92 | 26,33 | ±13,47 | 0,000 | 70 | 18,11 | ±10,03 | 0,020 | 59 | 15,59 | ±10,38 |
| Plaquetas (×109/l) | 92 | 138,93 | ±53,60 | 0,000 | 92 | 150,60 | ±56,55 | 0,008 | 74 | 159,66 | ±64,14 |
| Hemoglobina (g/dl) | 92 | 14,66 | ±2,07 | 0,299 | 92 | 14,80 | ±2,00 | 0,359 | 73 | 15,01 | ±1,68 |
| GPT (UI/l) | 92 | 92,95 | ±64,56 | 0,000 | 90 | 25,16 | ±18,75 | 0,622 | 74 | 25,91 | ±21,09 |
| GOT (UI/l) | 91 | 81,73 | ±50,67 | 0,000 | 88 | 29,25 | ±20,83 | 0,875 | 73 | 28,67 | ±24,32 |
| GGT (UI/l) | 91 | 144,78 | ±186,95 | 0,000 | 88 | 57,89 | ±96,52 | 0,172 | 74 | 76,68 | ±150,03 |
| FA (UI/l) | 87 | 94,87 | ±36,00 | 0,003 | 86 | 86,27 | ±30,07 | 0,224 | 73 | 83,07 | ±25,90 |
| Colesterol (mg/dl) | 86 | 155,30 | ±33,84 | 0,000 | 85 | 177,02 | ±35,35 | 0,018 | 72 | 172,29 | ±34,52 |
| Triglicéridos (mg/dl) | 86 | 111,28 | ±67,26 | 0,708 | 84 | 111,27 | ±57,57 | 0,917 | 71 | 116,15 | ±73,13 |
| Albúmina (g/dl) | 83 | 4123,75 | ±534,32 | 0,000 | 84 | 4375,88 | ±430,01 | 0,395 | 71 | 4417,90 | ±369,31 |
| Bilirrubina (mg/dl) | 92 | 0,96 | ±0,74 | 0,002 | 89 | 0,76 | ±0,55 | 0,623 | 73 | 0,78 | ±0,46 |
| Creatinina (mg/dl) | 89 | 0,86 | ±0,26 | 0,073 | 92 | 0,89 | ±0,32 | 0,143 | 73 | 1,00 | ±0,87 |
| INR | 87 | 1,11 | ±0,18 | 0,968 | 58 | 1,12 | ±0,23 | 0,135 | 62 | 1,10 | ±0,24 |
La media de fibrosis medida mediante métodos no invasivos, bien serológicos o ET, experimentó, en líneas generales, una reducción de los valores durante todo el seguimiento, pero de forma muy significativa inicialmente, una vez conseguida la RVS. Concretamente, el valor medio de la ET mejoró 5,5kPa (de 19,90 a 14,78kPa) entre la visita basal y la de 12s.
La mejoría progresiva de los valores de ET fue significativa tanto en los pacientes con fibrosis basal F3 como en los F4 (tabla 3).
La media de los valores de APRI y FIB-4 a lo largo del seguimiento fueron los siguientes: VB: 1,81; 12s: 0,65; 1a: 0,61; 2a: 0,57; 3a: 0,52; 4a: 0,59, y VB: 3,71; 12s: 2,47; 1a: 2,32; 2a: 2,26; 3a: 2,12; 4a: 2,36, respectivamente. En la figura 1 se puede visualizar gráficamente la reducción de los valores de fibrosis en estos pacientes.
Evolución clínica. Aparición de descompensacionesDe los 117 pacientes con cirrosis, 111 (94,9%) presentaron RVS. De estos, 9 pacientes (8,1%) presentaron algún tipo de descompensación de novo de su hepatopatía.
La más frecuente fue la ascitis en 8 (7,2%) de los casos, seguida de la HDA por VE en 3 pacientes (2,7%) y de la aparición de encefalopatía hepática en 3 (2,7%) pacientes. En 5 pacientes (4,5%) se objetivó la aparición de VE.
De estos 9 pacientes, 3 (33,3%) eran genotipo1, 1paciente genotipo2 (11,1%) y 5 pacientes genotipo3 (55,6%). Los pacientes con genotipo1 recibieron tratamiento con sofosbuvir +simeprevir ±ribavirina. El resto de pacientes (genotipo2 y3) recibieron sofosbuvir +daclatasvir ±ribavirina.
De forma basal, 24 pacientes (21,6%) presentaban VE. Diez pacientes (9%) estaban descompensados antes de iniciar el tratamiento (todos presentaban ascitis y uno de ellos, además, encefalopatía hepática pretratamiento).
Durante el seguimiento de los pacientes con VE basales, en 15 pacientes (62,5%) las VE se mantuvieron estables, en uno (4,2%) hubo una progresión de las mismas, 3 pacientes (12,5%) presentaron una HDA secundaria a las VE y en 5 (20,8%) pacientes desaparecieron las VE.
De los pacientes basalmente descompensados durante el seguimiento, 3 (30%) presentaron un grado de ascitis similar, 3 (30%) un empeoramiento de la misma, 2 (20%) un mejor control de la ascitis con menor necesidad de diuréticos y en 2 pacientes (20%) desapareció la ascitis. El paciente con encefalopatía hepática basal no presentó nuevos episodios de encefalopatía tras el tratamiento.
En cuanto a la evolución del Child-Pugh, de los 97 pacientes que presentaban Child-PughA inicialmente, 96 (99%) mantuvieron un Child-PughA durante el seguimiento y uno (1%) evolucionó a Child-PughC a las 12s por aparición de HCC. De los 12 pacientes con Child-PughB de forma basal, 3 (25%) se mantuvieron en el mismo estadio de Child-Pugh, uno (8,3%) se trasplantó a las 12s, 5 (41,7%) progresaron a Child-PughC con el tiempo (uno de ellos se descompensó durante el tratamiento y los otros progresaron a partir de los 2a). Los otros 3 (25%) pacientes restantes mejoraron a Child-PughA, 2 a las 12s y el tercero a 1a.
Por último, de los dos pacientes con Child-PughC, uno (50%) se mantuvo en el mismo estadio y el otro (50%) mejoró de forma progresiva hasta conseguir un estadio Child-PughA en la visita de 1a.
Aparición de HCC. Incidencia y recurrenciaNueve pacientes (5,52%) presentaron HCC de novo tras el tratamiento con AAD en una mediana de tiempo de 14 (6-37) meses tras finalizar el tratamiento antiviral; 2 de ellos (22,22%) tenían un estadio3 de fibrosis según el Fibroscan, el resto eran cirróticos. Dos de los 9 pacientes que desarrollaron un HCC habían recibido dos tratamientos con AAD por falta de respuesta al primer tratamiento. El primero de ellos presentaba cirrosis hepática y recibió el segundo tratamiento a los 9meses del primero, siendo diagnosticado de HCC 12meses después del inicio del segundo tratamiento. El otro paciente presentaba fibrosis F3 según el Fibroscan, recibió los dos tratamientos en el intervalo de 15meses y fue diagnosticado de HCC a los 9meses del inicio del segundo tratamiento.
Todos los pacientes que desarrollaron un HCC de novo presentaban al menos una de las siguientes comorbilidades antes de iniciar el AAD. La más frecuente fue el sobrepeso, presente en 6 de los pacientes. Además, 4 pacientes presentaban antecedente de ingesta de alcohol de riesgo, 3 presentaban antecedente de uso de drogas por vía parenteral y un paciente era diabético. Como nota, los dos pacientes F3 que desarrollaron HCC tenían sobrepeso, y uno de ellos, además, presentaba antecedente de uso de drogas por vía parenteral.
Respecto a la recurrencia del HCC, 6 pacientes (3,68%) presentaban un HCC de forma basal (previo al inicio del AAD). De estos, 5 pacientes (83,33%) recibieron tratamiento para el HCC antes de iniciar el tratamiento antiviral y se encontraban en remisión radiológica; la mediana de tiempo transcurrido entre el tratamiento del HCC y el inicio del tratamiento antiviral fue de 49 meses (10-132). De estos, 2 pacientes (40%) presentaron recidiva del HCC en el plazo de 4 y 10 meses tras el tratamiento antiviral.
Los 3 pacientes que no presentaron recurrencia del HCC habían tenido una LOE única (estadios 0 y A de la BCLC). Dos de ellos habían sido intervenidos mediante resección quirúrgica 14 y 132 meses antes de iniciar tratamiento con AAD, y el tercero había recibido un trasplante hepático 31 meses antes de recibir el tratamiento antiviral. Las características de los HCC pretratamiento se resumen en la tabla 4.
Evolución de los pacientes con HCC previo al tratamiento con AAD
| Fecha diagnóstico HCC | LOE mayor tamaño | Número de LOES | BCLC | Tipo tratamiento HCC | Comorbilidades pre-AAD | Fecha AAD | Recidiva | Tiempo entre AAD y recidiva | Observaciones |
|---|---|---|---|---|---|---|---|---|---|
| 19/3/14 | 4 | B | IQ+RF intraoperatoria (×3) | ExOH/DM | 14/1/15 | Sí | 10 meses | ||
| 20/8/07 | 33 | 1 | A | Ablación por RF | No | 19/12/15 | Sí | 4 meses | |
| 8/6/16 | 18 | 1 | 0 | Ablación por RF | ExADVP | 15/6/16 | Sí | 19 meses | AAD antes de tratamiento para HCC. |
| 5/5/11 | 26 | 1 | A | TOH | DM | 27/1/15 | No | ||
| 14/11/13 | 14 | 1 | 0 | IQ | DM | 30/1/15 | No | ||
| 2005 | IQ | No disponemos de datos | 23/6/16 | No | No disponemos de datos del HCC basal |
AAD: antivirales de acción directa; DM: diabetes mellitus; ExADVP: antecedente de adicción a drogas por vía parenteral; ExOH: antecedente de alcohol de riesgo; HCC: hepatocarcinoma; LOE: lesión ocupante de espacio; RF: radiofrecuencia; RQ: resección quirúrgica; TH: trasplante hepático.
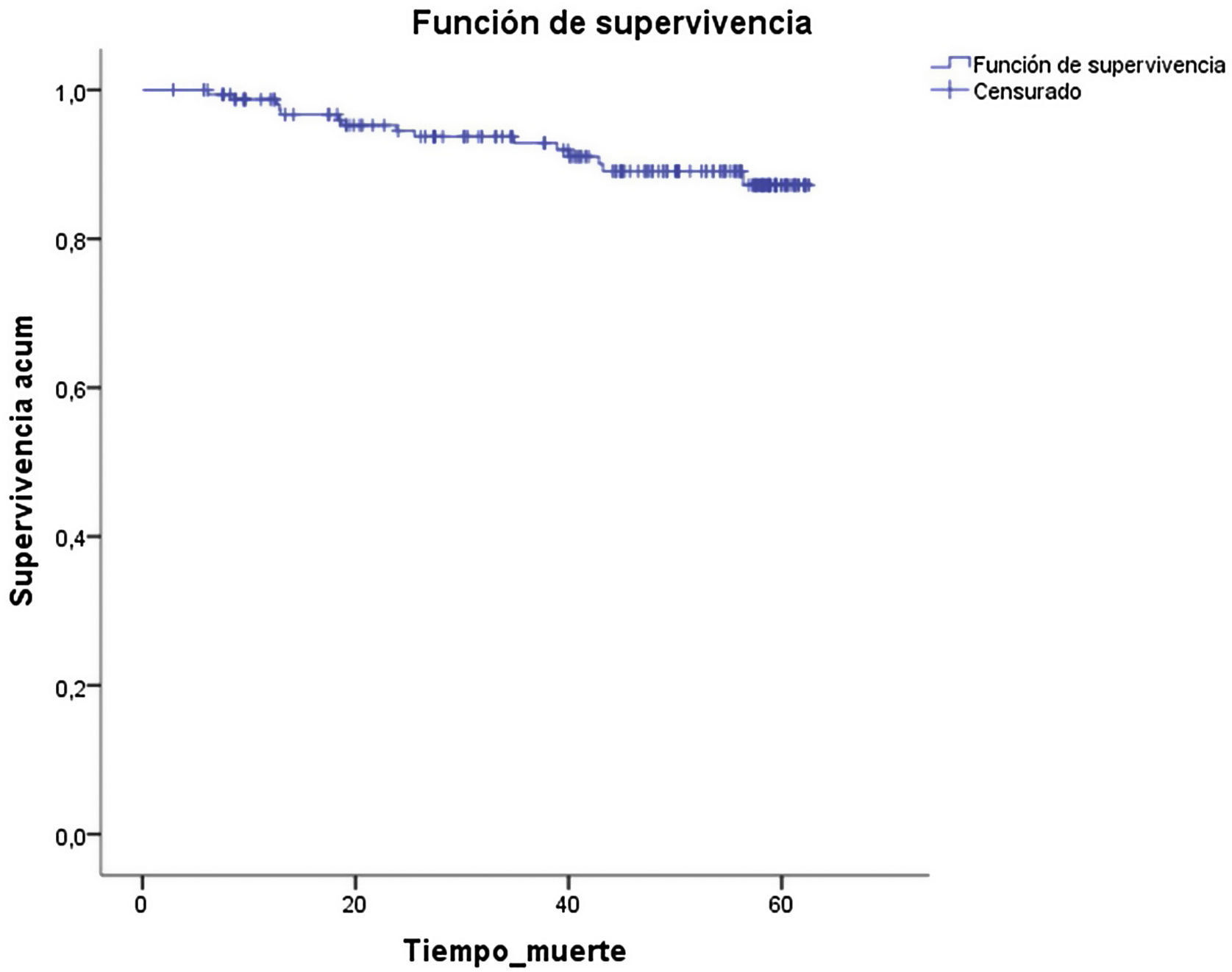
Durante el seguimiento fallecieron 15 pacientes (9,2%). Cuatro fallecieron por progresión del HCC, 3 por infecciones, 2 por otros tumores (colangiocarcinoma y adenocarcinoma de pulmón), 2 por progresión de su hepatopatía, y en los otros 4 desconocemos la causa del fallecimiento.
La probabilidad de supervivencia a los 60 meses fue >85% (fig. 2).
DiscusiónLa introducción de los AAD ha supuesto una revolución en el tratamiento de los pacientes con hepatitisC, permitiendo no solo la posibilidad de tratar, sino de curar a un gran número de pacientes que previamente no disponían de esta opción. El tratamiento etiológico de todas las enfermedades hepáticas ha demostrado un impacto beneficioso en la evolución de la enfermedad, con mejoría en la fibrosis y en el pronóstico de los pacientes. En el caso de la hepatitisC, la curación con tratamiento con INF ya había demostrado una mejoría de la fibrosis10 y un aumento de la supervivencia3. Los recientes tratamientos con AAD tendrán probablemente el mismo efecto beneficioso a largo plazo, que es necesario demostrar. Este ha sido el objetivo de nuestro estudio.
Nuestros datos muestran una mejoría general de todos los parámetros analíticos relacionados con la inflamación, la fibrosis y la función hepática una vez conseguida la RVS. Como dato llamativo, destaca el hecho de que esta mejoría se produce de manera muy precoz tras las RVS, a las 12s, y que posteriormente se mantiene e incluso continúa mejorando, aunque más discretamente, a lo largo del tiempo. Esto sugiere que la eliminación del virus es un hito fundamental en la historia natural de la enfermedad y que, una vez conseguida esta, la enfermedad mejora de manera rápida y este efecto beneficioso es duradero en el tiempo.
Este beneficio no solo afecta a las transaminasas y otros datos analíticos que son marcadores subrogados de la función hepática (albúmina, bilirrubina) o la hipertensión portal (plaquetas), sino que, como hemos visto, se traduce en una mejoría en los valores de fibrosis hepática medida por métodos no invasivos tras el tratamiento. Hay que destacar que la mejoría de la fibrosis es independiente del estado de fibrosis basal (F3-F4), al igual que las transaminasas, que son indicadores de inflamación hepática. En cambio, la bilirrubina, la albúmina y las plaquetas, que se relacionan con una enfermedad más avanzada, mejoran de forma significativa solo en los pacientes F4, probablemente porque estos pacientes presentan valores basales más alterados y la mejoría es más notable.
De manera paralela a la mejoría de las transaminasas, en nuestro estudio se objetiva también un descenso significativo de la fibrosis a las 12s medida con los test serológicos (APRI y FIB 4). Esta disminución de la fibrosis estimada mediante test serológicos no invasivos como el APRI o el FIB-4 también está descrita en la literatura11. Estos test parecen bastante precisos a la hora de valorar la rigidez hepática tras la RVS, en comparación con la biopsia, en pacientes con fibrosis avanzada pretratamiento. Sin embargo, se sabe que los valores de corte utilizados antes del tratamiento no son válidos una vez conseguida la RVS, por lo que estos puntos de corte tras el tratamiento con AAD están aún por determinar11. En cuanto a la fibrosis medida por ET, también se produce una disminución de los valores de ET tras el tratamiento, e igualmente esta mejoría se observa sobre todo entre la visita basal y la de las 12s, con una mediana de descenso de la misma del 25,7% (IQR 11,85-40,56). Estos resultados son similares a otros publicados en la literatura12,13. En un metaanálisis que incluyó 24 estudios en los que se comparaba la fibrosis medida por ET antes y después del tratamiento13, se describió una media de disminución de la fibrosis del 28% (IQR 21,8-34,8) entre la medida basal y la medida tras 6-12 meses tras fin de tratamiento en los pacientes con RVS, si bien la mayoría de estudios incluidos estaban desarrollados con tratamientos con INF. A pesar de esto, el patrón oro para la determinación de la fibrosis es la biopsia hepática, y debido a la falta de estudios comparativos con biopsias hepáticas pareadas pre y postratamiento, no se puede determinar si la mejoría de los parámetros de rigidez hepática medidos por ET se deben a la resolución de la inflamación hepática o a la regresión de la fibrosis. Es por esto que la Guía de Práctica Clínica publicada recientemente por la EASL sobre métodos no invasivos para evaluar la gravedad y el pronóstico de las enfermedades hepáticas11 reconoce que, en el momento actual y con la evidencia disponible, la ET no es válida para detectar la regresión de la fibrosis tras la RVS en los pacientes con hepatitisC y enfermedad hepática avanzada compensada previa al inicio del tratamiento antiviral.
Intentando evaluar si esta mejoría bioquímica y de marcadores no invasivos de fibrosis tiene repercusión clínica, existen estudios que demuestran una reducción significativa de las descompensaciones tras conseguir la RVS con tratamientos basados en INF en pacientes con cirrosis compensada14. La mayoría de estos pacientes presentaban un Child-PughA debido a las limitaciones del tratamiento con INF, lo que condiciona una tasa baja de descompensación independientemente de la respuesta al tratamiento antiviral15. Con el uso de AAD, estas limitaciones han disminuido notablemente, por lo que se han tratado pacientes con cirrosis más avanzada. Los resultados en pacientes tratados con AAD son más heterogéneos, pero está descrita en la literatura16 una incidencia menor de descompensaciones en los pacientes tratados y curados con AAD.
Algunos datos parecen indicar que esta mejoría de la tasa de descompensaciones ocurre mayormente en pacientes curados con Child-PughA, lo que puede hacer sospechar que el tratamiento antiviral sea menos beneficioso en pacientes con enfermedad hepática más avanzada17.
La incidencia acumulada de descompensaciones de novo en nuestra cohorte es superior a la descrita en otros estudios16, aunque sigue siendo notablemente más baja a la descrita en cohortes históricas de pacientes tratados con INF o no tratados18. Hay que destacar el alto porcentaje de pacientes con genotipo3 entre los pacientes con descompensaciones de novo de nuestra cohorte; es conocido el mayor riesgo de progresión de la enfermedad hepática en estos pacientes19, por lo que probablemente sea especialmente importante el tratamiento de los pacientes con genotipo3 antes de que desarrollen una fibrosis avanzada.
Los datos de nuestro estudio también indican que en los pacientes con Child-PughA la tasa de progresión a estadios más avanzados tras la RVS es menor que en los pacientes Child-PughB, lo que parece respaldar los hallazgos de estudios anteriores que sugieren un efecto más beneficioso en pacientes con estadios más precoces17. Ahora bien, a pesar de que en nuestro estudio únicamente se han tratado 2 pacientes en estadio Child-PughC, lo que dificulta la extracción de conclusiones, observamos que en uno de estos pacientes existe una importante mejoría clínico-analítica, regresando la enfermedad a un estadio Child-PughA, lo que puede sugerir que el beneficio clínico del paciente puede aparecer en cualquier estadio de la enfermedad.
Con respecto a la incidencia de HCC, existen varios estudios donde se confirma que conseguir la RVS tras tratamiento con INF reduce el riesgo de aparición de HCC entre 0,5-1% al año20,21. Sin embargo, sabemos que con este tratamiento las tasas de RVS eran marcadamente más bajas y la tolerancia mucho peor que con los nuevos AAD por la aparición de múltiples efectos adversos22, por lo que los pacientes más graves y con mayor riesgo de desarrollar HCC no podían ser tratados. Con la llegada de los AAD se publicaron inicialmente dos estudios23,24 en los que se describía un alto riesgo de incidencia y recurrencia tras el tratamiento con los nuevos AAD, por lo que posteriormente se realizaron numerosos estudios donde se intentaba esclarecer la relación real entre el tratamiento con los AAD y la aparición de HCC. Existe una revisión publicada recientemente22 donde se analizan los distintos estudios que se han realizado respecto a la incidencia y la recurrencia de HCC con AAD. En relación con la incidencia de HCC, los datos aportados son muy variables, desde una incidencia del 0,93% en el estudio español de Calleja et al.25 hasta una tasa de 9,1% en el estudio de Ravi et al.26. Los diferentes estudios presentados son metodológicamente muy distintos, pero sí parece que la evidencia actual sostiene que existe una menor tasa de incidencia de HCC tras conseguir la RVS mediante tratamiento con AAD22.
En nuestra cohorte la tasa de incidencia está comprendida entre las descritas en los estudios, aunque es llamativo el alto porcentaje de pacientes con HCC sobre un hígado no cirrótico (F3 en ET), lo que parece apoyar la necesidad de seguir con el cribado semestral en todos los pacientes F3 (aparte de los pacientes con cirrosis), tal y como recomiendan las guías en la actualidad27.
Es llamativo que el sobrepeso esté presente en la mayoría de los pacientes que presentan HCC de novo, especialmente en los dos pacientes que presentan HCC con F3 basal. La relación entre el HCC y el síndrome metabólico está descrita27, y aunque nuestra cohorte es pequeña, parece una comorbilidad claramente relacionada. Así pues, debería considerarse un factor importante a tratar y en el que hacer hincapié una vez curada la hepatitisC.
En 2016 hubo una alarma respecto al alto porcentaje de recurrencia del HCC tras tratamiento con AAD a raíz de la publicación de los dos estudios mencionados previamente23,24, en los que se presentaban tasas de recurrencia del 27,6 y del 28,81%, respectivamente. Posteriormente se han publicado varios estudios28-30 en los que se compara la tasa de recurrencia en los pacientes tratados con AAD y los pacientes que no reciben tratamiento antiviral, concluyendo que el tratamiento con AAD no se asocia a una mayor tasa de recurrencia del HCC; más bien al contrario, produce un aumento de la supervivencia en los pacientes tratados con AAD28, y se define una reducción de >60% en la recurrencia del HCC en los pacientes tratados frente a los no tratados30. Así pues, los datos de los que disponemos en la actualidad parecen sostener la idea de que, al igual que con el HCC incidente, existe una menor tasa de recurrencia del HCC tras conseguir RVS mediante el tratamiento con AAD22.
En nuestro estudio la tasa de recurrencia del HCC en los pacientes con RVS es similar a la descrita en los estudios mencionados con anterioridad. Además, podemos apreciar que los 3 pacientes que no presentan recidiva en el tiempo de seguimiento habían recibido tratamiento con intención curativa (resección quirúrgica o trasplante hepático), tenían una única LOE de pequeño tamaño (BCLC 0 o A) y el tratamiento antiviral se inició años después del tratamiento dirigido al HCC, pudiendo confirmar una respuesta completa durante años, por lo que estos factores podrían relacionarse con una disminución en la recurrencia del HCC.
Las principales limitaciones de este estudio las constituyen, en primer lugar, el diseño unicéntrico y el pequeño tamaño muestral, por lo que las conclusiones deben tomarse con cautela. En segundo lugar, a pesar de que algunos pacientes tienen un tiempo de seguimiento largo, la mayoría de pacientes no han completado el seguimiento de los 4años. En tercer lugar, solo se han analizado los datos de los pacientes con RVS, por lo que no podemos realizar comparaciones con los pacientes no curados. Por último, utilizamos la ET para valorar la evolución de la fibrosis tras la RVS, pero a día de hoy no disponemos de datos suficientes a largo plazo comparando con biopsias pareadas que avalen la utilización del Fibroscan para este fin. La fortalezas de nuestro estudio residen, en primer lugar, en que se incluyen todos los pacientes F3 y F4 curados durante el tiempo de estudio, por lo que es una cohorte en vida real que arroja datos probablemente extrapolables a otras cohortes de pacientes en nuestro medio; en segundo lugar, observamos que la mejoría en los parámetros analíticos y en los marcadores de fibrosis se produce de manera muy precoz, por lo que aumentar el periodo de seguimiento probablemente no cambiaría estos resultados.
ConclusionesCon los datos de nuestro estudio, podemos concluir que existe una mejoría general de todos los parámetros analíticos y de la fibrosis hepática medida por métodos no invasivos en los pacientes con fibrosis avanzada o cirrosis que presentan RVS tras el tratamiento con AAD. A pesar del tratamiento antiviral, el riesgo de descompensación y de aparición de HCC (tanto de novo como de recurrencia) no es despreciable, por lo que se debe realizar seguimiento en estos pacientes.
Consideraciones éticasEl estudio fue realizado de acuerdo a las guías de la Declaración del Helsinki y fue aprobado por el Comité de Ética de nuestro centro. Los pacientes firmaron el consentimiento informado para su participación en el estudio.
FinanciaciónEste estudio no ha precisado financiación.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.