El tratamiento de la enfermedad inflamatoria intestinal (EII) ha sufrido una gran transformación tras la introducción de los fármacos biológicos. Gracias a ellos, los objetivos del tratamiento han evolucionado desde la respuesta y remisión clínica a objetivos más ambiciosos, como la remisión endoscópica o radiológica. Sin embargo, aunque los biológicos son muy eficaces, un porcentaje importante de pacientes no obtendrá una respuesta inicial o la perderá a lo largo del tiempo. Sabemos que existe una relación directa entre las concentraciones valle del biológico y su eficacia terapéutica, que cuanto más exigente sea el objetivo terapéutico serán necesarios niveles superiores del fármaco y que es frecuente la exposición insuficiente al mismo. La monitorización terapéutica de medicamentos biológicos, así como los modelos farmacocinéticos, nos brindan la posibilidad de ofrecer un enfoque personalizado del abordaje en pacientes con EII. Durante los últimos años se ha acumulado información relevante respecto a su utilidad durante o después de la inducción, así como en el mantenimiento del tratamiento biológico, en estrategias reactivas o proactivas y antes de la retirada o desintensificación del esquema.
El objetivo de este documento es establecer recomendaciones sobre la utilidad de la monitorización terapéutica de biológicos en pacientes con EII, en los diferentes escenarios de la práctica clínica e identificar las áreas donde su utilidad es evidente, prometedora o controvertida.
The treatment of inflammatory bowel disease has undergone a significant transformation following the introduction of biologic drugs. Thanks to these drugs, treatment goals have evolved from clinical response and remission to more ambitious objectives, such as endoscopic or radiologic remission. However, even though biologics are highly effective, a significant percentage of patients will not achieve an initial response or may lose it over time. We know that there is a direct relationship between the trough concentrations of the biologic and its therapeutic efficacy, with more demanding therapeutic goals requiring higher drug levels, and inadequate exposure being common.
Therapeutic drug monitoring of biologic medications, along with pharmacokinetic models, provides us with the possibility of offering a personalized approach to treatment for patients with IBD. Over the past few years, relevant information has accumulated regarding its utility during or after induction, as well as in the maintenance of biologic treatment, in reactive or proactive strategies, and prior to withdrawal or treatment de-escalation.
The aim of this document is to establish recommendations regarding the utility of therapeutic drug monitoring of biologics in patients with inflammatory bowel disease, in different clinical practice scenarios, and to identify areas where its utility is evident, promising, or controversial.
- 1.
Recomendamos monitorizar siempre con la misma técnica y en el mismo laboratorio.
- 2.
Niveles de referencia en inducción/posinducción:
Infliximab: Recomendamos medir niveles en la semana 14 en todos los pacientes.
La concentración valle mínima para la remisión clínica es> 5μg/mL y para la curación endoscópica, 7-10μg/mL.
En pacientes con una mayor carga inflamatoria basal, como en la CU grave y en la EC perianal, recomendamos medir precozmente los niveles durante la inducción con el objetivo de obtener concentraciones mayores de fármaco: 20–25μg/mL en semana 2 y 10–15μg/mL en la semana 6.
Adalimumab: Recomendamos determinar los niveles de adalimumab en todos los pacientes en la semana 4.
En aquellos con EC, la concentración valle sugerida es> 5μg/mL y en la CU> 6,36μg/mL.
Considerando el objetivo de curación endoscópica, los niveles propuestos son> 10-12μg/mL.
Vedolizumab: No existen datos suficientes para recomendar niveles objetivo.
Ustekinumab: Existe información limitada para una recomendación formal. A falta de mejor evidencia, podría realizarse una determinación de niveles en la semana 8.
En EC, los niveles de referencia en la semana 8 son de 3,9μg/mL (rango de 2 a 7,3μg/mL) para la remisión clínica y> 11,1μg/mL para la remisión endoscópica.
En pacientes con CU, la concentración valle asociada a la respuesta clínica en la semana 8 es de≥3,7μg/mL.
- 3.
Niveles durante el mantenimiento:
Infliximab: Recomendamos niveles> 5 - 7μg/mL para mantener la remisión clínica. En caso de no alcanzar la curación mucosa intensificar con un nivel objetivo en torno a 10 μg/mL.
Adalimumab: Recomendamos niveles> 10-12μg/mL para la remisión clínica y endoscópica.
Vedolizumab: Consideramos que no existe suficiente evidencia para recomendar la monitorización terapéutica de niveles de vedolizumab en el mantenimiento.
Ustekinumab: Recomendamos niveles entre 1,5 a 3μg/mL para la remisión clínica y> 4,5μg/mL para la respuesta endoscópica.
- 4.
Portadores del alelo HLA-DQA1*05.
En espera de ensayos clínicos, recomendamos a pacientes portadores del alelo HLADQA1*05 que requieran un anti-TNF, un tratamiento combinado inmunosupresor y valorar utilizar estrategias que mejoren la persistencia del fármaco (monitorización proactiva) o utilizar una diana alternativa.
- 5.
Fallo farmacodinámico.
Se debe confirmar la presencia de inflamación y descartar complicaciones. Tras ello, se recomienda cambiar a un fármaco con un mecanismo de acción diferente.
- 6.
Estrategia proactiva
Se desaconseja una estrategia de monitorización proactiva generalizada.
En espera de información adicional, debe valorarse su utilización al finalizar la fase de inducción o durante la misma, sobre todo en escenarios clínicos de difícil manejo (enfermedad perianal, elevada carga inflamatoria), durante el mantenimiento del fármaco si existe riesgo de pérdida de respuesta secundaria (monoterapia, segundo anti-TNF, portador de HLA-DQA1*05) y ante estrategias de desescalada o reintroducción tras una suspensión prolongada.
- 7.
Desescalada de fármacos anti-TNF
Recomendamos una adecuada selección de pacientes y una estrecha monitorización.
La monitorización terapéutica de niveles es obligatoria después de la reducción de la dosis de infliximab y adalimumab.
- 8.
Retirada de un anti-TNF
Recomendamos, previa a la retirada de un anti-TNF, una determinación de concentraciones del fármaco y de anticuerpos antifármaco.
- 9.
Tras «vacaciones del fármaco»
Recomendamos determinar la presencia de anticuerpos anti-TNF, sobre todo, antes de la segunda dosis. Si se detectan anticuerpos antes o después de la primera dosis es necesario el cambio de anti-TNF o de diana.
La terapia biológica ha revolucionado el tratamiento de la enfermedad inflamatoria intestinal (EII). Sin embargo, hasta un tercio de los pacientes tratados con anti-TNF no presenta respuesta primaria (NRP) y, hasta 50% de los sujetos, desarrolla una pérdida de respuesta secundaria (PRS)1. De forma simplificada, esto puede deberse a una exposición insuficiente al fármaco por un rápido consumo de este (fallo farmacocinético) provocado por una elevada carga inflamatoria, una afectación intestinal extensa, la presencia de hipoalbuminemia o de anticuerpos antifármaco (AAF) (fallo inmunogénico); o bien, debido a procesos inflamatorios, probablemente relacionados con una vía inflamatoria alternativa (fallo farmacodinámico).
En los últimos años, se ha producido un cambio en los objetivos terapéuticos en la EII. Actualmente, se recomienda tratar no solo para obtener la remisión de los síntomas sino también para alcanzar la remisión endoscópica de los pacientes con enfermedad de Crohn (EC) y colitis ulcerosa (CU). Este cambio de paradigma implica la utilización de datos biológicos y morfológicos que condicionarán el uso de los fármacos en una medicina más personalizada. En este sentido, parece existir una correlación clara entre las concentraciones de los fármacos biológicos y la respuesta clínica y endoscópica obtenida. Este hecho ha motivado explorar la utilidad de diferentes estrategias de monitorización del tratamiento biológico para mejorar su efectividad y seguridad.
De forma muy resumida, existen dos abordajes posibles. La monitorización reactiva implica determinar niveles del fármaco y AAF en el paciente que presenta una PRS con el fin de orientar el cambio del tratamiento (intensificación o elección de un nuevo fármaco). La estrategia proactiva propone monitorizar los niveles de medicamentos, con independencia de la actividad clínica y/o biológica y realizar ajustes de dosis con el fin de alcanzar un determinado nivel prefijado. La finalidad última de la estrategia proactiva es mejorar la tasa de respuesta durante la inducción, prevenir la recidiva clínica y/o realizar una retirada más segura del fármaco inmunosupresor (IMS).
En el presente documento, un equipo amplio de expertos en monitorización terapéutica de biológicos, formado por especialistas en gastroenterología y farmacia, ha participado en la elaboración de estas recomendaciones del Grupo de Trabajo Español de Enfermedad de Crohn y Colitis Ulcerosa. En este, se revisan las técnicas actualmente disponibles para la monitorización de biológicos y anticuerpos (Ac), así como sus posibles aplicaciones en los diferentes escenarios de práctica clínica en la EII.
Técnicas de monitorización¿Qué técnicas están disponibles para la determinación de las concentraciones séricas de fármacos biológicos?La monitorización terapéutica de biológicos en la EII supone un desafío, en gran medida, debido a la falta de estandarización de los métodos analíticos para la determinación de las concentraciones del fármaco y de sus AAF2,3. El desarrollo y validación de las técnicas analíticas se ha realizado principalmente para infliximab y adalimumab2–4 y, posteriormente, se ha adaptado para vedolizumab y ustekinumab2,5,6.
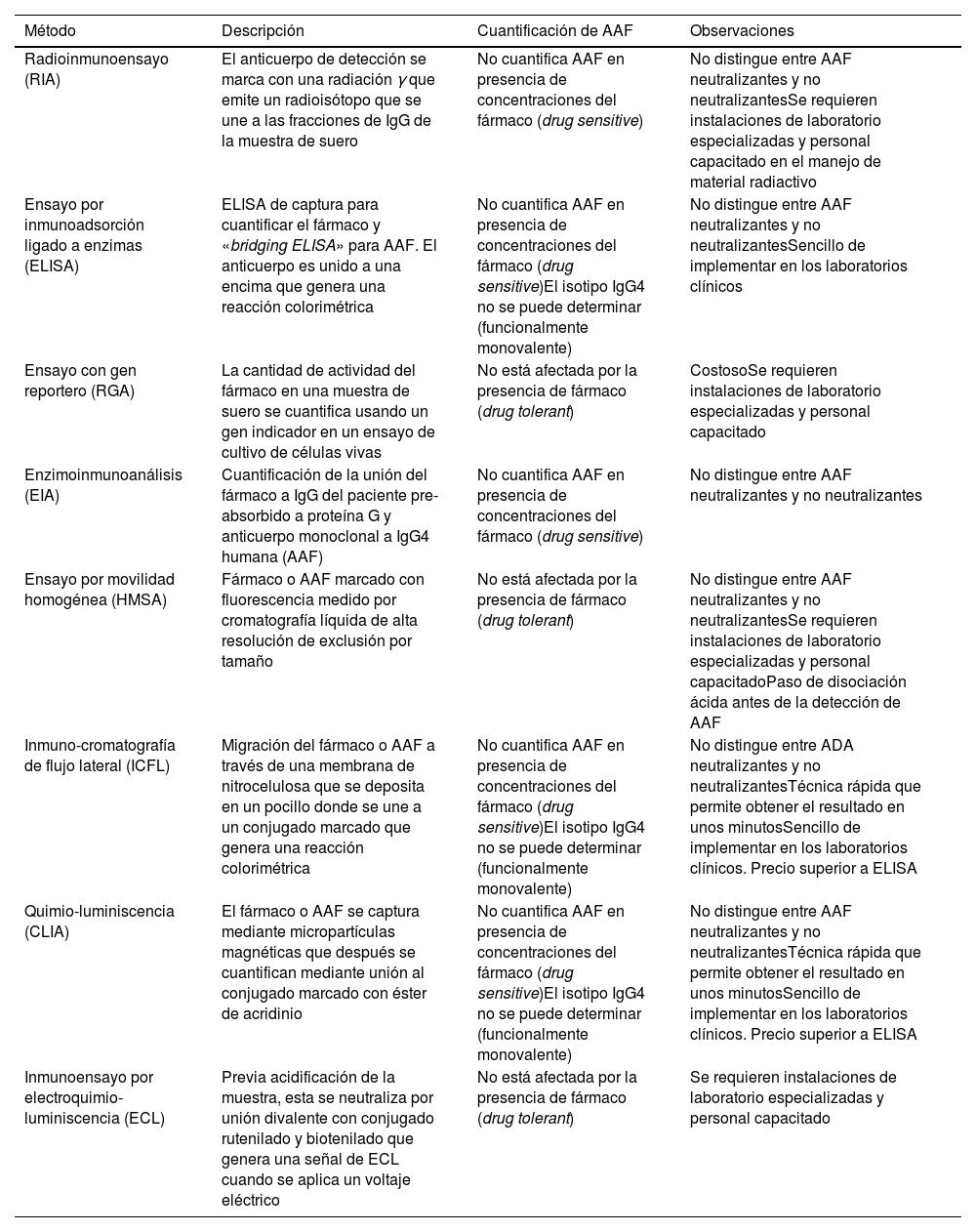
La tabla 1 resume el fundamento técnico y las principales características operativas para cada uno de los métodos utilizados.
Características de los principales métodos analíticos para determinar las concentraciones de fármacos biológicos y Ac con indicación en enfermedad inflamatoria intestinal
| Método | Descripción | Cuantificación de AAF | Observaciones |
|---|---|---|---|
| Radioinmunoensayo (RIA) | El anticuerpo de detección se marca con una radiación γ que emite un radioisótopo que se une a las fracciones de IgG de la muestra de suero | No cuantifica AAF en presencia de concentraciones del fármaco (drug sensitive) | No distingue entre AAF neutralizantes y no neutralizantesSe requieren instalaciones de laboratorio especializadas y personal capacitado en el manejo de material radiactivo |
| Ensayo por inmunoadsorción ligado a enzimas (ELISA) | ELISA de captura para cuantificar el fármaco y «bridging ELISA» para AAF. El anticuerpo es unido a una encima que genera una reacción colorimétrica | No cuantifica AAF en presencia de concentraciones del fármaco (drug sensitive)El isotipo IgG4 no se puede determinar (funcionalmente monovalente) | No distingue entre AAF neutralizantes y no neutralizantesSencillo de implementar en los laboratorios clínicos |
| Ensayo con gen reportero (RGA) | La cantidad de actividad del fármaco en una muestra de suero se cuantifica usando un gen indicador en un ensayo de cultivo de células vivas | No está afectada por la presencia de fármaco (drug tolerant) | CostosoSe requieren instalaciones de laboratorio especializadas y personal capacitado |
| Enzimoinmunoanálisis (EIA) | Cuantificación de la unión del fármaco a IgG del paciente pre-absorbido a proteína G y anticuerpo monoclonal a IgG4 humana (AAF) | No cuantifica AAF en presencia de concentraciones del fármaco (drug sensitive) | No distingue entre AAF neutralizantes y no neutralizantes |
| Ensayo por movilidad homogénea (HMSA) | Fármaco o AAF marcado con fluorescencia medido por cromatografía líquida de alta resolución de exclusión por tamaño | No está afectada por la presencia de fármaco (drug tolerant) | No distingue entre AAF neutralizantes y no neutralizantesSe requieren instalaciones de laboratorio especializadas y personal capacitadoPaso de disociación ácida antes de la detección de AAF |
| Inmuno-cromatografía de flujo lateral (ICFL) | Migración del fármaco o AAF a través de una membrana de nitrocelulosa que se deposita en un pocillo donde se une a un conjugado marcado que genera una reacción colorimétrica | No cuantifica AAF en presencia de concentraciones del fármaco (drug sensitive)El isotipo IgG4 no se puede determinar (funcionalmente monovalente) | No distingue entre ADA neutralizantes y no neutralizantesTécnica rápida que permite obtener el resultado en unos minutosSencillo de implementar en los laboratorios clínicos. Precio superior a ELISA |
| Quimio-luminiscencia (CLIA) | El fármaco o AAF se captura mediante micropartículas magnéticas que después se cuantifican mediante unión al conjugado marcado con éster de acridinio | No cuantifica AAF en presencia de concentraciones del fármaco (drug sensitive)El isotipo IgG4 no se puede determinar (funcionalmente monovalente) | No distingue entre AAF neutralizantes y no neutralizantesTécnica rápida que permite obtener el resultado en unos minutosSencillo de implementar en los laboratorios clínicos. Precio superior a ELISA |
| Inmunoensayo por electroquimio-luminiscencia (ECL) | Previa acidificación de la muestra, esta se neutraliza por unión divalente con conjugado rutenilado y biotenilado que genera una señal de ECL cuando se aplica un voltaje eléctrico | No está afectada por la presencia de fármaco (drug tolerant) | Se requieren instalaciones de laboratorio especializadas y personal capacitado |
AAF: anticuerpo antifármaco; Ac: anticuerpos.
Las técnicas utilizadas para determinar niveles de anti-TNF (tabla 1) muestran una excelente correlación lineal entre ellas (R2 = 0,97 a 0,99)7 y, al compararlas entre sí, se han informado pequeñas diferencias (entre 0,48 y 1,55μg/mL)8–11. Por otro lado, existen variaciones significativas entre las concentraciones obtenidas a lo largo de un día, en días distintos o entre individuos4. Respecto a ustekinumab y vedolizumab, los estudios comparativos entre técnicas analíticas son escasos, aunque, con los datos disponibles, no se deberían considerar intercambiables12.
¿Qué son los anticuerpos antifármaco neutralizantes y no neutralizantes?Los fármacos biológicos utilizados en EII son Ac monoclonales con una estructura de inmunoglobulina (Ig) G1. Estas proteínas presentan inmunogenicidad e inducen una respuesta de Ac contra ellas, ya que el organismo las detecta como moléculas extrañas1,2,4,5,13.
Las consecuencias clínicas de la formación de Ac frente a los fármacos biológicos dependen del epítopo del AAF. Los Ac neutralizantes se unen al sitio activo del fármaco inhibiendo su mecanismo de acción. Por el contrario, los Ac no neutralizantes son aquellos cuyo epítopo es la región constante de la Ig por lo que se unen al fármaco sin neutralizarlo. En ambos casos, la cinética del medicamento se ve modificada, ya que la formación de inmunocomplejos fármaco-AAF acelera su eliminación afectando a la eficacia terapéutica14. La prevalencia de AAF frente a los diferentes fármacos es variable y depende de la técnica analítica empleada. Las moléculas con estructura quimérica (infliximab) presentan tasas superiores (17-70%) que aquellas con estructura humanizada o humana: 12,7-25,0% para adalimumab, 2,8-21,8% para golimumab, 4,0-8,0% para vedolizumab y 2,3-5,7% para ustekinumab5,6,15. Otros factores que aumentan el desarrollo de AAF son la administración subcutánea (sc), la elevada masa corporal y la presencia de concentraciones plasmáticas bajas de los fármacos16,17.
¿Qué técnicas se utilizan para determinar anticuerpo antifármaco?La técnica ideal debería ser sensible, específica y capaz de detectar AAF en presencia de fármaco14 (tabla 1). Existen dos grupos de técnicas en función de su capacidad para detectar AAF en presencia de concentraciones detectables del medicamento. Las técnicas tolerantes a fármaco cuantifican AAF cuando el biológico se encuentra en concentraciones medibles (p. ej., técnicas ELISA que usan una cadena lambda antihumana)18. Las técnicas sensibles a fármaco no detectan AAF en presencia de este debido a interferencias por inhibición competitiva o por formación de inmunocomplejos2,11,14,19–21. Las pruebas tolerantes al fármaco podrían ser útiles durante la inducción, por su capacidad de detectar AAF cuando la concentración de anti-TNF es elevada22. La presencia de AAF en este periodo no es identificable por las pruebas sensibles a fármaco y, sin embargo, predicen NRP o PRS. En cambio, durante el mantenimiento, el uso de un ensayo sensible a fármaco sería suficiente, ya que los AAF podrían ser no neutralizantes o transitorios, aunque su relevancia clínica aún es incierta22.
¿Cómo se interpretan las concentraciones de fármacos biológicos y anticuerpos?El ensayo por ELISA es la técnica analítica más utilizada y fácil de implementar en la práctica clínica debido a su alta sensibilidad, bajo coste y características operativas. Además, es la técnica empleada en la mayoría de los estudios que caracterizan el margen terapéutico de estos fármacos2,5,12,13. La mayoría de los kits ELISA comercializados han demostrado una aceptable precisión, especificidad, reproducibilidad, correlación interclase y concordancia con los valores objetivo23–25. Como limitaciones, es una técnica sensible al fármaco y es incapaz de detectar Ac monoméricos. Por ello, la técnica ELISA presenta un alto porcentaje de falsos negativos de AAF. Esto podría no tener relevancia clínica debido a que estos únicamente son importantes (al menos en el mantenimiento) con un título elevado y estos valores altos sí son detectables mediante un ensayo sensible al fármaco21.
Al interpretar los resultados, hay que considerar que no se dispone de estándares universales y los hallazgos de las concentraciones de AAF no son comparables entre los diferentes métodos analíticos2–6,12,13,26. Además, se recomienda realizar múltiples cuantificaciones para identificar los Ac transitorios o persistentes, ya que solo aquellos persistentes en el tiempo tienen repercusión clínica14.
Una estrategia de detección y manejo de la inmunogenicidad cuando no se dispone de una técnica tolerante a fármaco podría ser la aplicación de modelos farmacocinéticos poblacionales (MPk) y estimación bayesiana debido a que, en su desarrollo, se ha cuantificado la influencia de los AAF en el aclaramiento plasmático27–32.
¿Qué papel desempeñan los ensayos rápidos para la monitorización de biológicos?Una limitación de la monitorización de biológicos es el retraso entre la extracción de la muestra y la obtención del resultado, demorando la actuación clínica33–35. Esto se debe a que las técnicas ELISA requieren agrupar un número elevado de muestras para mejorar la eficiencia de los kits33–36.
Esta limitación podría evitarse con el uso de ensayos rápidos en el punto de atención (point of care [POC])10,37–39 que permiten obtener el resultado en minutos8,10,40. Por contra, necesitan suero en lugar de sangre total e infraestructura de laboratorio. La técnica analítica de gota de sangre seca (dried blood samples) permite, a través de una punción capilar, cuantificar rápidamente las concentraciones de fármaco y AAF. Podría utilizarse como test rápido sin necesidad de equipamiento adicional41–44. Sin embargo, requiere más estudios para determinar la correlación y comparabilidad con los métodos tradicionales.
El rendimiento de la monitorización terapéutica mejoraría combinando ensayos rápidos POC con la farmacocinética (Pk) poblacional y ajuste posológico bayesiano, optimizando la dosis precisa de fármaco en tiempo real y una reacción inmediata e individualizada sobre la exposición real al fármaco6,45. Un enfoque multidisciplinar donde se combinen las habilidades de los médicos especialistas en EII junto con expertos en Pk clínica podría contribuir a un mejor manejo integral del paciente6,46,47.
El coste del POC es superior al ELISA convencional por lo que, por motivos de eficiencia, debería reservarse para situaciones donde una demora en los resultados no fuera admisible (p. ej., ante una PRS o para el manejo de la inducción)6.
Niveles de referencia de biológicosMonitorización de fármacos biológicos durante la inducciónAunque la mayoría de los estudios se han realizado en la fase de mantenimiento, hay un interés emergente en el uso de la monitorización proactiva durante la etapa de inducción con la finalidad de prevenir el fallo primario48. La reciente adopción de estrategias dirigidas a alcanzar objetivos terapéuticos más exigentes (remisión endoscópica o histológica) hacen que los niveles adecuados del fármaco sean diferentes según el objetivo considerado49.
Concentraciones de biológicos durante la inducciónUn aspecto esencial, aunque muy controvertido, es establecer cuáles se consideran niveles adecuados del fármaco para tomar decisiones terapéuticas (tabla 2). Los valores de referencia para la medición de niveles de fármaco y AAF son, aún hoy en día, difíciles de definir ya que los estudios son muy heterogéneos. Estos dependen de la técnica utilizada, el objetivo a alcanzar y, sobre todo, el momento de la medición.
Asociación de concentraciones valle de los biológicos y objetivos terapéuticos durante la inducción y el mantenimiento en la enfermedad inflamatoria intestinal13,141,186,267
| Biológico | EII | Extracción | ug/mL | Objetivo |
|---|---|---|---|---|
| Infliximab | EC | Semana 2 | >16,9->11,5>9,2->20,4>23,1>9,2 | Respuesta clínica (sem. 14)Remisión clínica (sem. 14)Remisión endoscópica (sem. 12)Respuesta fístula (sem. 14 y 30) |
| CU | >11,5>15,3->21,3≥28,3 | Respuesta clínica (sem. 14 y 30)Remisión clínica (sem. 14)Curación mucosa (sem. 10-14) | ||
| EC | Semana 6 | >10>7,2>8,6 | Remisión endoscópica (sem. 12)Respuesta fístula (sem. 14)Respuesta fístula (sem. 30) | |
| CU | >22>6,6≥15 | Respuesta clínica (sem. 8)Respuesta endoscópica (sem. 8)Curación mucosa (sem. 10-14) | ||
| EC | Semana 14 | <1>3,5>3>12,7 | Pérdida respuesta (sem. 54)Respuesta clínica (sem. 54)Respuesta clínica sostenidaRespuesta fístula (sem. 24) | |
| CU | >5,1>5,5≥2,1 | Respuesta clínica (sem. 30)Remisión clínica (sem. 54)Curación mucosa (sem. 14) | ||
| EC | Mantenim. | >0,6->3,4>1,5>1,1>5,7≥9,7≥9,8>10,1≥2-≥6 | PCR normalRemisión clínicaCF <300 ug/gCF <59 ug /gRemisión endoscópicaRemisión histológicaCuración fístulaRecidiva tras susp. anti-TNF | |
| CU | >2,4>3>2,7-10,1≥10,5 | Respuesta clínica (sem. 54)CF <250 ug/mLCuración mucosaCuración histológica | ||
| EC/CU | >6,8>7,3>2,1->4>10>4,9->5,1>5->8,3>20 | PCR ≤5 mg/LCF <250 u/gRemisión clínicaRemisión clínica (Infliximab sc)Rem clínica+PCR<5 +CF<50 u/gCuración mucosaCF<250 u/g (Infliximab sc) | ||
| Adalimumab | EC | Semana 2 | >6,7 | Remisión clínica (sem 14) |
| EC | Semana 4 | >12>13 | PCR normalRespuesta clínica (sem. 14) | |
| CU | >4,6>7>7,5 | Respuesta clínica (sem. 12)Respuesta clínica (sem. 52)Curación mucosa (sem. 10-14) | ||
| EC | Mantenim. | >3,7->5,9>8,5>10,5>5 (sem 26)>6,8>9,5>7,9->10,3≥12≥12,2 | PCR normalPCR N+CF <250 u/gPCR N+CF <100 u/gRemisión clínica (sem. 52)Curación EPACierre de EPACuración mucosaRemisión endoscópicaRemisión histológica | |
| CU/EC | >6,6>9>7,3>4,9->7,1>7,8>12,2 | PCR normalRespuesta clínicaRemisión clínicaCuración mucosaRemisión histológicaReducción dosis exitosa | ||
| Certolizumab | EC | Semana 6 | >31,8>31,9>32,7>34,5>36,1 | Remisión clínica (sem. 6)PCR normal (sem. 6)CF <250 u/g (sem. 6)Rem. clínica+CF <250 u/g (sem. 6)Rem. clínica+CF <250 u/g (sem. 26) |
| EC | Semana 8 | >23,3 | Remisión endoscópica (sem. 10) | |
| EC | Semana 12 | >13,8>14,8 | CF <250 mg/g (sem. 26)CF <250+Rem. clínica (sem. 26) | |
| Golimumab | CU | Semana 2 | >8,9 | Respuesta clínica (sem. 6) |
| CU | Semana 4 | >7,4 | Respuesta clínica (sem. 6) | |
| CU | Semana 6 | >2,5>3,2>3,8 | Respuesta clínica (sem. 6)Remisión clínicaRem. clínica+bioquímica | |
| CU | Mantenim. | >0,9->1,4 | Remisión clínica | |
| Vedolizumab | EC | Semana 2 | >35,2 | Remisión biológica (sem. 6) |
| CU | >28,9>23,7 | Respuesta clínica (sem. 14)Curación mucosa (sem. 14) | ||
| CUEC/CU | Semana 6 | >20,8≥27,5>18 | Respuesta clínica (sem. 14)Respuesta clínica sostenidaCuración mucosa (sem. 54) | |
| CU | Semana 14 | >12,6>17 | Respuesta clínica (sem. 14)Curación mucosa (sem. 14) | |
| EC | Mantenim | >13,6>12 | Curación mucosa (sem. 22)Remisión biológica (sem. 22) | |
| Ustekinumab | EC | Semana 8 | >3,3->3,9>11,1 | Remisión clínica (sem. 8)Remisión endoscópica (sem. 24) |
| CU | ≥3,5≥3,7 | Mejoría endoscópica (sem. 8)Mejoría histológica (sem. 8) | ||
| EC | Mantenim. | >0,8-1,4>4,5 | Remisión clínicaRespuesta endoscópica | |
| CU | ≥1,1≥1,3 | Mejoría endoscópicaMejoría histológica |
AC: anticuerpo; EII: enfermedad inflamatoria intestinal; EC: enfermedad de Crohn; CU: colitis ulcerosa; PCR: proteína C reactiva; CF: calprotectina fecal.
En total, 30% de los pacientes no responde a la inducción con infliximab y se consideran NRP en la semana 14. Estudios retrospectivos han observado que niveles bajos de infliximab, ya en la semana 2 y 6, se asociaban a NRP en la semana 1450. Diferentes trabajos han evidenciado que los NRP tienen niveles de infliximab significativamente menores en las semanas 6 y 14 comparados con los respondedores (semana 6: 7,3 vs. 11,2μg/mL y semana 14: 1,5 vs. 4,7μg/mL, respectivamente)48,51. Un análisis post-hoc de los estudios ACT 1 y 2 demuestra que los niveles de infliximab> 22μg/mL en la semana 6 se asocian a respuesta clínica en la semana 8 y niveles > 5,1μg/mL en la semana 14 predicen la respuesta en la semana 3052.
La curación mucosa constituye un objetivo terapéutico en la actualidad. Los niveles requeridos para obtener este objetivo son superiores a los de la remisión clínica. En los ensayos ACT 1 y 2, la remisión endoscópica se asoció con niveles de infliximab ≥ 18,6μg/mL en la semana 2, ≥ 10,6μg/mL en la semana 6 y ≥ 34,9μg/mL en la semana 853. En el estudio de Papamichael et al.54, los valores de infliximab en CU fueron superiores en la fase de inducción cuando el objetivo era la remisión endoscópica, en la semana 2 (22,9 vs. 19,3mg/mL, p: 0,018), semana 6 (17,6 vs. 10,3mg/mL, p: 0,001), y semana 14 (7,4 vs. 4mg/mL, p: 0,014) frente a los pacientes que no presentaron curación mucosa.
En la EC, parece que los niveles a alcanzar para obtener los objetivos terapéuticos son inferiores55,56 con excepción de la EC perianal57 (tabla 2). El análisis del estudio ACCENT 158 concluye que niveles> 3,5μg/mL en la semana 14 predicen una adecuada respuesta a largo plazo. En el estudio PANTS, el fallo primario ocurría en 21,9% de los pacientes tratados con infliximab y solo los niveles bajos de infliximab en la semana 14 se asociaban con NRP y con la no remisión en la semana 54. El nivel óptimo de infliximab, en la semana 14, vinculado a la remisión en esa semana y en la 54 era 7μg/mL59.
En un estudio de práctica clínica, el punto de corte de 15μg/mL en la semana 6 predijo la curación mucosa en las semanas 10-1448. En un análisis post-hoc de la fase de inducción del estudio TAILORIX, niveles de infliximab> 23,1μg/mL en la semana 2 y> 10,0μg/mL en la semana 6 predecían la remisión endoscópica en la semana 1260.
Recomendación: recomendamos medir los niveles de infliximab en la semana 14 en todos los pacientes.
La concentración valle mínima para la remisión clínica es> 5μg/mL y para la curación endoscópica, 7-10μg/mL.
En sujetos con una mayor carga inflamatoria basal, como en la CU grave y en la EC perianal, se recomienda medir precozmente los niveles durante la inducción con el objetivo de obtener concentraciones mayores de fármaco: 20–25μg/mL en semana 2 y 10–15μg/mL en semana 6.
Aunque algunos estudios establecen una asociación entre los niveles de adalimumab y NRP, por la heterogeneidad de su diseño es difícil establecer un nivel valle sólido en la inducción. En el estudio PANTS, la NRP (semana 14) ocurre en 26,8% de los pacientes tratados con adalimumab y solo los niveles de adalimumab en la semana 14 se asociaron con la NRP59. El análisis post-hoc de los ensayos clínicos CLASSIC I y II observa que los niveles de adalimumab en la semana 4 son mayores en los sujetos respondedores que en los NRP (8,1 vs. 5,1μg/mL, respectivamente)61. Asimismo, niveles de adalimumab> 12μg/mL en la semana 4 se relacionan con remisión biológica. Estudios prospectivos de práctica clínica han observado que los niveles ya en la semana 2 se vinculan con la remisión clínica en la semana 14 (6,8 vs. 4,8μg/mL) estableciendo el punto de corte de niveles de adalimumab> 6,7μg/mL (área bajo la curva [AUC]=0,73)48.
En la CU, estudios de cohortes también observan una asociación entre los niveles de adalimumab, la remisión clínica y la curación mucosa precoz en la fase de inducción48. Una concentración de adalimumab ≥ 4,58μg/mL y ≥ 7,5μg/mL en la semana 4 es un factor independiente vinculado con la remisión clínica y la curación mucosa precoz en la semana 12, respectivamente48,62.
Cabe destacar que la presencia de AAF (determinados por una prueba tolerante al fármaco) es frecuente y precoz con adalimumab (32% en la semana 44 de los que 55% aparece en la semana 2 y 79% en la semana 14) y su presencia se asocia tanto con la NRP como la PRS en los pacientes con EII.
GolimumabLos niveles de golimumab están poco disponibles en la práctica habitual. En la fase de inducción del estudio PURSUIT la mediana de concentración de golimumab en la semana 6 en los pacientes con remisión clínica y curación mucosa fueron de 3,14μg/mL y 3,14μg/mL, respectivamente63.
En un estudio de práctica clínica con 21 pacientes con CU moderada-grave, las concentraciones medias de golimumab en las semanas 2 y 6 fueron 8 (5,3–10,3) μg/mL y 4,3 (2–6,9) μg/mL, respectivamente, y los niveles de 2,6μg/mL se asociaron a respuesta clínica en la semana 14, datos similares a los observados en el estudio PURSUIT64.
Los resultados de los ensayos clínicos sugieren una concentración mínima de golimumab en la semana 6 y mantenimiento≥2,5μg/mL y>1,4μg/mL, respectivamente63, aunque no disponemos de datos suficientes para hacer una recomendación.
VedolizumabLos análisis por cuartiles de los niveles de vedolizumab en los estudios pivotales establecen una clara relación entre la exposición y la respuesta65,66. La mediana de la concentración valle en la semana 6 es mayor en los pacientes en remisión clínica tanto en CU (34,7 vs. 23,7μg/mL) como en EC (26,8 vs. 23,5μg/mL) aunque la superposición de resultados en este último grupo es elevada65,66. La relación exposición–respuesta es más clara en la semana 10 (que en la 6) en sujetos con EC, sugiriendo que la eficacia de vedolizumab en este grupo podría ser más tardía67.
Estudios de práctica clínica han analizado la relación exposición-respuesta de vedolizumab en EII48,68. Unos niveles> 28,0μg/mL en la semana 6 predicen una respuesta clínica sostenida en pacientes con CU (AUC: 0,723). En los sujetos con EC, los niveles valle en la semana 2> 29,8μg/mL se asocian a remisión clínica y biológica en la semana 6. Considerando de forma global a las personas con EII, se concluye que la remisión clínica y la mejoría endoscópica en la semana 14 se relacionan con concentraciones de vedolizumab> 30μg/mL en la semana 2,> 24 - 37μg/mL en la semana 6 y> 14-20μg/mL en la semana 1413,69.
Recomendación: no existen datos suficientes para realizar una recomendación formal respecto a la utilidad de vedolizumab. No obstante, los valores de referencia, con los datos actuales en pacientes con EII, la remisión/respuesta clínica y la mejoría endoscópica en la semana 14 están asociadas a concentraciones de vedolizumab> 30μg/mL en la semana 2, 24μg/mL en la semana 6 y> 14μg/mL en la semana 14.
Los datos de los ensayos clínicos de inducción UNITI-1 y UNITI-2 en EC confirman la relación entre exposición y eficacia clínica de ustekinumab. En la semana 8 posinducción, la mediana de concentración de ustekinumab es de 2,1 y 6,4μg/mL para las dosis de 130mg y 6mg/kg, respectivamente y se correlacionan con la remisión clínica en esa semana. Basado en el análisis de cuartiles, solo la dosis de 6mg/kg se vincula con un incremento de la remisión clínica siendo la concentración valle de 3,2 a 3,9μg/mL. Utilizando la concentración sérica de ustekinumab de la semana 8 para establecer su correlación con la remisión en ese punto, el análisis del AUC identificó un punto de corte de 3,3μg/mL63,70. Diferentes estudios observacionales, de práctica clínica en EC también han observado una relación exposición – respuesta favorable48,70. La mayoría de estos analiza las concentraciones de ustekinumab en la semana 8 tras la administración de la dosis de 6mg/kg y la relacionan con su eficacia. El análisis conjunto de estos trabajos permite estimar una media ponderada de 3,9μg/mL para la remisión clínica (rango de 2 a 7,3μg/mL) y de 11,1μg/mL para la remisión endoscópica70,71.
Sin embargo, aunque la evidencia sobre la monitorización de niveles de ustekinumab en fase precoz es limitada, se ha observado que los niveles en las semanas 2 y 4 posinducción podrían ayudar a estimar la probabilidad de respuesta en la semana 2471. De hecho, las concentraciones de ustekinumab obtenidas tan pronto como a la hora de la infusión endovenosa (>105μg/mL) identifican a los pacientes con mayor probabilidad de alcanzar la remisión endoscópica, con un rendimiento similar a la determinación en las semanas 2 y 471. Un análisis tan precoz permitiría la opción de adelantar la primera dosis sc.
Los datos de los ensayos clínicos en fase 2 y 3 de los pacientes con CU (UNIFI 1 y 2) determinan que las concentraciones de ustekinumab son proporcionales a las dosis y que no están afectadas por la exposición previa a otros biológicos o a IMS concomitantes, con una relación exposición/respuesta bien definida. El análisis de las curvas Receiver-Operating-Characteristic (ROC) identifica que la concentración valle asociada a la respuesta clínica en la semana 8 es≥3,7μg/mL; asimismo, para otros objetivos terapéuticos (remisión clínica, mejoría endoscópica e histológica) oscila entre 3,5 y 3,7μg/mL72.
Recomendación: aunque consideramos que existe información limitada sobre la utilidad de los niveles de ustekinumab para una recomendación formal, podría realizarse una determinación de niveles en la semana 8 en pacientes con EC. Los niveles de referencia en esta semana son de 3,9μg/mL (rango de 2 a 7,3μg/mL) para la remisión clínica y> 11,1 para la endoscópica.
En sujetos con CU, la concentración valle asociada a la respuesta clínica en la semana 8 es de≥3,7μg/mL.
Se han publicado numerosos estudios y guías clínicas en pacientes bajo tratamiento de mantenimiento, especialmente con anti-TNF. En ellas se proponen intervalos y puntos de corte para interpretar la PRS.
InfliximabLas concentraciones valle> 5 μg/mL se relacionan con un menor riesgo de inmunogenicidad73. Las diferentes guías clínicas recomiendan unos niveles objetivo en mantenimiento entre 3,5 y 7μg/L para la remisión clínica74–76. Tras una PRS se deberían conseguir niveles> 10μg/mL13.
Sin embargo, uno de los principales objetivos de la EII es la curación mucosa y los niveles requeridos para conseguirlo son superiores a los descritos previamente (en este caso ≥ 9,7)77,78. Del mismo modo, los niveles en mantenimiento para la EC perianal fistulizante son superiores (≥13μg/L)57,79,80.
Respecto a infliximab sc, un reciente estudio transversal en pacientes con EII en mantenimiento, identificó una concentración de>10μg/mL asociada a remisión clínica y de> 20μg/mL a remisión biológica (calprotectina fecal [CF]<250μg/g)81.
AdalimumabLas guías de las sociedades científicas recomiendan niveles para el mantenimiento de la remisión clínica entre 5-12μg/mL75,76. El porcentaje de pacientes que no está en remisión con un umbral mínimo de adalimumab ≥ 5μg/mL es de 17% y se reduce a<10% con niveles> 7,5μg/mL75,82. El límite superior del rango terapéutico de adalimumab para alcanzar la remisión clínica está mal definido. Sin embargo, para la remisión endoscópica, los niveles valle recomendados de adalimumab son ≥ 12μg/L, umbral donde 90% de los sujetos alcanza este objetivo terapéutico83. Un punto de corte similar (≥ 12,2μg/L) ha sido identificado como predictor de remisión histológica84.
VedolizumabLos estudios son escasos y apenas existen datos para una estrategia reactiva. Las concentraciones superiores de vedolizumab se asocian a mayores tasas de respuesta y aumentar la dosis a infusiones cada cuatro semanas incrementa las tasas de remisión clínica85. El grupo BRIDGe13 recomienda medir niveles de vedolizumab en aquellos pacientes con NRP o PRS.
Un estudio reciente estimó que aquellos sujetos con PRS y niveles <7,4μg/mL respondían mejor a la escalada de dosis que aquellos con cifras iguales o superiores antes de la escalada86. Otro estudio de práctica clínica87 analizó 141 mediciones de niveles, la mayoría de ellas (75,9%) en mantenimiento. Se aceptó un rango entre 5 y 15μg/mL como el adecuado para conseguir la remisión. No obstante, aunque solo a 44% de los pacientes se les realizó la medición de niveles por PRS, la mayoría de ellos estaba en este rango o incluso, por encima del mismo. Por otro lado, algunos datos sugieren que la PRS a vedolizumab no se deba a causas Pk, por lo que ante una respuesta incompleta o una PRS, unos niveles valle en rango no descartarían la intensificación del biológico88.
Recomendación: actualmente, consideramos que no existe suficiente evidencia para recomendar la monitorización terapéutica de niveles de vedolizumab en el tratamiento de mantenimiento.
UstekinumabSe tienen pocos datos y los disponibles son contradictorios. No obstante, diversos análisis de los ensayos clínicos confirman que mayores concentraciones del fármaco se correlacionan con mayores tasas de respuesta tanto en EC63 como en CU89.
Unos niveles> 1,5μg/mL (semana 40) se asociaron a remisión clínica63. En la semana 26, unas concentraciones> 4,5μg/mL conseguían mayores tasas de respuesta endoscópica90. Por otro lado, tras una PRS, los pacientes que responden a la intensificación alcanzaban cifras superiores a las descritas previamente (> 6μg/mL)91. Por ello, puede resultar útil disponer de niveles previos del paciente en remisión como punto de referencia y, en caso de que desciendan (y se produzca una PRS), sería nuestro nivel objetivo.
Estrategia de monitorización reactivaLa PRS al tratamiento biológico se define como la aparición de síntomas atribuibles a la actividad de la enfermedad (evaluada mediante proteína C reactiva [PCR], CF, endoscopia o técnicas de imagen) en pacientes previamente en remisión. Un metaanálisis de 39 estudios con adalimumab92 y una revisión sistemática de 16 trabajos con infliximab93 estableció un riesgo anual de PRS de 20,3 y 13% por paciente-año, respectivamente. La PRS, con frecuencia, comporta la suspensión del tratamiento94 por lo que es crucial detectarla y optimizar la terapia de forma precoz y adecuada.
Los factores más importantes implicados en la PRS incluyen, entre otros, la exposición a niveles subterapéuticos del fármaco y la formación de AAF95–97.
En práctica clínica, la determinación de niveles valle de fármaco se realiza ante la sospecha de una PRS con enfermedad activa confirmada. Numerosos estudios han demostrado la utilidad de combinar los niveles valle de fármaco y los AAF en el manejo de la PRS respecto al tratamiento empírico98–102. Estos trabajos han demostrado que:
- 1)
Los pacientes con niveles subterapéuticos de fármaco sin AAF obtienen mejores resultados con la intensificación comparados con el cambio a otro anti-TNF.
- 2)
El cambio a un fármaco con mecanismo de acción diferente debe considerarse cuando los niveles están en rango terapéutico,
- 3)
En presencia de AAF, el cambio a otro anti-TNF es eficaz, aunque si los títulos de AAF son bajos y/o transitorios, puede intensificarse el fármaco y/o al asociar un IMS52,103,104.
El manejo de la PRS basado en niveles valle de fármaco es más coste-efectivo en comparación con el tratamiento empírico24–26. En un estudio danés multicéntrico y aleatorizado, 69 pacientes con EC y PRS a infliximab, fueron asignados a intensificación empírica (5mg/kg/4 semanas) o a un algoritmo de tratamiento basado en niveles valle y AAF. Ambas estrategias obtuvieron resultados clínicos similares (respuesta de 58 y 53% en el grupo con manejo basado en niveles y el grupo intensificado empíricamente, respectivamente) pero el coste de la terapia fue sustancialmente menor (34%) en el grupo con abordaje basado en niveles105,106. Estos resultados se han corroborado en estudios posteriores y en un metaanálisis107.
En conclusión, la PRS a los fármacos anti-TNF es una situación clínica frecuente. La determinación de niveles de medicamento y AAF ha demostrado ser eficaz y coste-efectiva en la toma de decisiones en práctica clínica.
Pérdida de respuesta secundaria con niveles bajos de fármaco. Fallo farmacocinéticoAnte una PRS con niveles bajos de fármaco se recomienda intensificar el tratamiento, doblando la dosis, acortando el intervalo de administración o ambos108. Existe poca evidencia acerca de cuál de estas es la mejor estrategia para recuperar la respuesta.
Un total de 28% de los pacientes en mantenimiento con infliximab en el ensayo ACCENT I requirió aumentar la dosis a 10mg/kg/8 semanas observando recuperación de la respuesta en 88% de ellos, aunque no se comunicó ni la duración de la respuesta ni se comparó esta estrategia con otras109.
Un modelo matemático en pacientes con artritis reumatoide110 y algunos MPk en EII111,112, sugieren que acortar el intervalo puede ser superior a aumentar la dosis de infliximab. En cambio, un estudio multicéntrico retrospectivo en 169 individuos con PRS a infliximab, comparó la eficacia de la intensificación de infliximab doblando la dosis a 10mg/kg/8 semanas o acortando el intervalo con dosis de 5mg/kg/4 semanas113. No hubo diferencias significativas en cuanto a eficacia, aunque duplicar la dosis supuso una reducción de los costes directos por lo que, a falta de validación en estudios diseñados específicamente, esta estrategia podría ser preferible.
En el caso de adalimumab las estrategias de intensificación más recomendadas108 son la administración de 40mg/semana u 80mg/2 semanas. En este caso, los estudios clínicos controlados con adalimumab abogaron por acortar el intervalo entre las inyecciones en lugar de incrementar la dosis114,115.
No existen estudios que comparen la eficacia clínica de la intensificación de adalimumab 40mg/semana comparada con 80mg/2 semanas en pacientes con EII y PRS. Un estudio prospectivo incluyó 62 sujetos con EII en remisión clínica sostenida tras la intensificación de adalimumab a 40mg/semana en los que se modificó el tratamiento a 80mg/2 semanas. No hubo diferencias en la Pk del fármaco, ningún paciente requirió volver al régimen de 40mg/semana y fue la pauta preferida por los participantes. Por lo tanto, es factible proponer el cambio de 40mg/semana a 80mg/2 semanas de adalimumab116.
Un estudio prospectivo, multicéntrico y observacional evaluó la eficacia de una segunda intensificación de adalimumab hasta 80mg/semana obteniendo una respuesta y remisión clínica de 50 y 33%, respectivamente, sin observar efectos secundarios significativos117.
Por último, la reinducción podría ser una estrategia eficaz y comparable a la intensificación y con un menor coste118. No obstante, cabe destacar que la información disponible sobre la eficacia de la reinducción es escasa por lo que son necesarios más estudios.
Pérdida de respuesta secundaria en presencia de anticuerpo antifármaco. Fallo inmunogénicoUna de las causas principales de PRS es el desarrollo de AAF17,94,97,119. Esta inmunogenicidad puede aparecer tan pronto como en la segunda semana del tratamiento120. Parece estar en relación con factores clínicos121, genéticos122–125 y farmacológicos59,126–128, así como con el tratamiento IMS convencional concomitante. Por otra parte, se ha descrito, la aparición de AAF a títulos bajos, no detectables por métodos convencionales. Su significado es desconocido. Se ha observado que, si bien (en un elevado porcentaje de casos) desaparecen a lo largo del tiempo, ello ha ocurrido en un contexto de intensificación proactiva20. Por otro lado, su presencia se ha relacionado con una menor supervivencia del fármaco129.
Los niveles bajos de anti-TNF se asocian a un mayor riesgo de inmunogenicidad59,95,126,127,130. Por el contrario, la intensificación del tratamiento anti-TNF (incremento de la dosis, disminución del intervalo de administración o una pauta de reinducción) es capaz de recuperar la respuesta en pacientes con PRS73,118,131–136. En cuanto a la indicación de intensificar la terapia, un estudio multicéntrico y aleatorizado danés en 69 pacientes con EC que habían experimentado una PRS a un anti-TNF demostró que el esquema individualizado (basado en la determinación de niveles de fármaco y AAF) es más coste-efectivo a corto plazo (12 semanas) que la intensificación empírica, guiada por la clínica105,137.
El tratamiento con anti-TNF combinado de inicio con IMS (tiopurinas o metotrexato), resulta más eficaz que el esquema anti-TNF en monoterapia, especialmente en el caso de infliximab85,138. El beneficio del tratamiento combinado parece relacionarse con una menor proporción de pacientes que desarrollan AAF97,128,137–144. No se ha observado relación con la dosis del IMS145 aunque sí con los niveles de tioguaninas146. En aquellos sujetos que reciben monoterapia con anti-TNF y experimentan una PRS, añadir un IMS podría ser una estrategia eficaz en términos de recuperación de la respuesta terapéutica. No obstante, aunque es una práctica ampliamente utilizada en la práctica clínica, no existen estudios aleatorizados con este objetivo132,147–149. No obstante, parece que no existe beneficio de añadir azatioprina, en términos de inmunogenicidad, en personas con niveles elevados de infliximab146. Por otra parte, la premedicación con esteroides convencionales, administrados por vía intravenosa (iv) inmediatamente antes de cada infusión de infliximab, demostró, en un ensayo aleatorizado150, disminuir la proporción de pacientes con AAF en sujetos con EC tratados con infliximab, y es una práctica clínica frecuente. No obstante, este efecto protector de los esteroides (demostrado en pautas de infliximab a demanda) no está tan claro con la estrategia actual de inducción y mantenimiento de infliximab151.
Finalmente, la presencia de AAF a títulos altos y/o en individuos con efectos secundarios relacionados con la inmunogenicidad hace recomendable el cambio de molécula. La eficacia de un segundo anti-TNF es muy variable en función del motivo del cambio del primer fármaco, siendo mayor en aquellos pacientes en los que este se realiza por intolerancia (en torno a 60%) que en aquellos en los que se efectúa por PRS (45%) o por fallo primario, en los que la eficacia es de 30%152. En cualquier caso, es muy posible que la decisión del siguiente fármaco a emplear en personas con PRS deba basarse en la determinación de niveles de fármaco y AAF153,154.
¿Cómo podemos manejar el riesgo genético a desarrollar inmunogenicidad?Existen evidencias que sugieren un riesgo innato de desarrollar inmunogenicidad. Los pacientes con AAF frente al primer anti-TNF tienen hasta 11 veces más probabilidades de desarrollarlos frente al segundo155,156. Se han descrito genotipos de human leukocyte antigen (HLA), en artritis reumatoide y hidradenitis supurativa, asociados a un menor (HLA-DQB1*05, HLA-DRB1*01 y HLA-DRB1*07) y mayor (HLA-DRB1*03 y HLA-DRB1*01) riesgo de inmunogenicidad157.
El estudio de la cohorte PANTS incluyó, prospectivamente, 1.240 pacientes con EC en tratamiento anti-TNF a partir de un análisis Genome-wide association studies (GWAS) con el objetivo de identificar marcadores genéticos de riesgo de desarrollar inmunogenicidad, detectada mediante un ensayo tolerante al fármaco. A los 12 meses, 44% desarrolló AAF. El riesgo fue superior para infliximab que para adalimumab y mayor en monoterapia que en terapia combinada con IMS. Se identificó que los portadores del alelo HLA-DQA1*05 (presente en 40% de los europeos) tenían el doble de riesgo de desarrollar inmunogenicidad con independencia del anti-TNF o tratamiento IMS. Los pacientes con mayor riesgo eran los portadores del haplotipo desfavorable en monoterapia con infliximab (probabilidad de 92% a 12 meses). Por contra, los de menor riesgo eran aquellos sin el haplotipo desfavorable tratados con adalimumab en tratamiento combinado (10% a 12 meses)216. Resultados similares fueron observados en un estudio de cohortes retrospectivo de 262 pacientes con EII expuestos a infliximab. Los portadores de esta variante tenían un riesgo superior de PRS y de interrupción del tratamiento (hazard ratio [HR]=2,27)217. La magnitud del riesgo identificado ha sido muy similar en otros estudios observacionales122,123,158,159.
Sin embargo, aquellas estrategias que reducen la inmunogenicidad (como la adicción de un IMS122,123 o la monitorización proactiva de niveles160 han demostrado reducir el impacto de la presencia de HLA-DQA1*05 en el riesgo de inmunogenicidad.
Recomendación: en espera de evidencia firme, parece prudente sugerir, que en los pacientes portadores del haplotipo HLA-DQA1*05 y que requieran tratamiento con un anti-TNF, un tratamiento combinado con IMS (especialmente con infliximab) y valorar utilizar estrategias que mejoren la persistencia del fármaco (como la monitorización proactiva) o emplear una diana alternativa.
Se define fallo farmacodinámico al fracaso primario o secundario del tratamiento biológico en presencia de niveles adecuados del fármaco13,153,161 que podría explicarse por la activación de vías de inflamación no mediadas por la diana del tratamiento153,162. Se han identificado algunos mecanismos que podrían explicar la no respuesta a los fármacos biológicos153,163,164 (tabla 3).
Mecanismos propuestos para el fallo farmacodinámico
| ANTI-TNF |
| Factores inmunológicos locales161,268–272 |
| - Respondedores: sobreexpresión pre tratamiento del receptor 2 del TNF |
| - No respondedores: sobreexpresión del receptor 2 del IL23, niveles elevados de oncostatina M, sobreexpresión IL22 binding protein derivada de células T y de IL7R |
| Polimorfismos relacionados con la inmunidad (receptores toll-like, citoquinas)164,273,274 |
| - No respondedores: |
| • aumento de expresión de los genes de IL1B, IL1RN, TNF, IL6, IL17A, IL23, receptor de IL23, IL1B, IL17A y S100A8 |
| • Inhibición de expresión de los genes de IL6 e IL23p19. |
| Cambios en el microbioma275,276 |
| - Respondedores: |
| • incremento de Faecalibacterium prausnitzii, Bifidobacterium ssp., Eubacterium rectale, Clostridium colinum, Clostridiales sin cultivar y Vibrio |
| • disminución de Streptococcus mitis |
| VEDOLIZUMAB |
| - No respondedores: baja/ausente expresión de integrina α4β7, aumento de la expresión de α4β1 en células T277–279 |
| USTEKINUMAB |
| - SNP en el receptor de la IL23164,280. |
| - Cambios inmunológicos locales y en la microbiota164,280 |
Ante la sospecha de que un paciente con EII no ha respondido al anti-TNF por persistencia de síntomas en las semanas 12-14, se debe confirmar la actividad, descartar infección u otras complicaciones, así como asegurar que el diagnóstico inicial es correcto.
La presencia de niveles óptimos de anti-TNF (tabla 2) definirá la existencia de NRP de origen farmacodinámico153. En estos casos, se recomienda el cambio a un fármaco con diferente mecanismo de acción102,153,165 dado que la eficacia de un segundo anti-TNF, en este escenario, es muy baja166,167. Los pacientes con fallo primario al anti-TNF son intrínsecamente más difíciles de tratar con biológicos de segunda línea166. En el caso de personas con CU, más de 50% de aquellos con NRP a infliximab requerirá cirugía168. Por ello, existe la necesidad de validar biomarcadores capaces de determinar el orden en el que se debe indicar los distintos tratamientos biológicos e identificar a los sujetos que serán refractarios a uno u otro tratamiento biológico, estableciendo la base de la medicina personalizada.
Estrategia de monitorización proactiva¿Qué implica una estrategia de monitorización proactiva?La monitorización terapéutica de niveles proactiva, teóricamente, podría permitir mejorar resultados clínicos, disminuyendo las tasas de NRP y PRS;48 mejorar la calidad de vida del paciente, obteniendo una remisión más rápida. Por otro lado, permitiría una mayor rapidez en la obtención de niveles de fármaco adecuados con reducción de la inmunogenicidad; incrementar el tiempo de utilidad del primer biológico, con menor necesidad de intensificación y posterior desescalada. Finalmente, podría ser coste-efectiva y mejorar la seguridad de estos fármacos aumentando el intervalo de administración y/o evitando la combinación con IMS en casos de niveles supraterapéuticos169.
Un estudio retrospectivo analizó 264 pacientes en tratamiento con infliximab con seguimiento durante 10 años. Identificaron que la estrategia proactiva se asociaba a una mayor durabilidad del fármaco, menor necesidad de cirugía u hospitalizaciones y menor riesgo de inmunogenicidad o reacciones infusionales graves170–173.
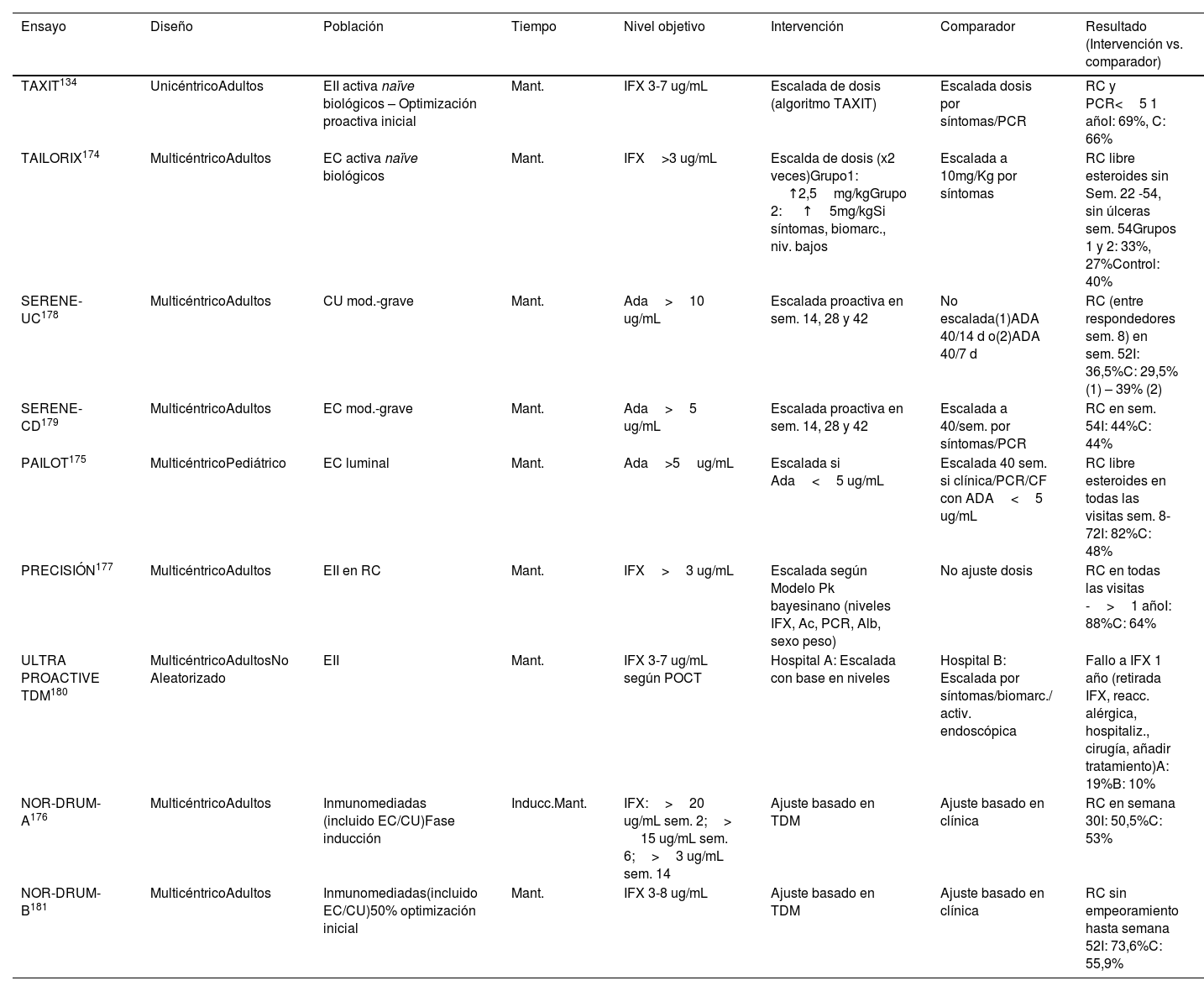
Actualmente disponemos de nueve ensayos clínicos134,174–181 que comparan una estrategia proactiva con una convencional (o reactiva) con resultados contradictorios (tabla 4). Un reciente metaanálisis que incluye 26 estudios (nueve ensayos clínicos) concluye que la estrategia proactiva se asocia a una mayor tasa de remisión clínica y endoscópica, así como una menor tasa de hospitalización y cirugía182. En cambio, otros metaanálisis183,184 sugieren que la estrategia proactiva, globalmente, no mejora la tasa de remisión clínica en el mantenimiento, con 56% de incremento de la probabilidad de intensificación de la dosis de anti-TNF, sin observar una menor tasa de inmunogenicidad (tampoco de efectos adversos). Por lo tanto, actualmente no podemos recomendar de forma rutinaria esta estrategia de monitorización.
Ensayos clínicos que han evaluado una estrategia proactiva
| Ensayo | Diseño | Población | Tiempo | Nivel objetivo | Intervención | Comparador | Resultado (Intervención vs. comparador) |
|---|---|---|---|---|---|---|---|
| TAXIT134 | UnicéntricoAdultos | EII activa naïve biológicos – Optimización proactiva inicial | Mant. | IFX 3-7 ug/mL | Escalada de dosis (algoritmo TAXIT) | Escalada dosis por síntomas/PCR | RC y PCR<5 1 añoI: 69%, C: 66% |
| TAILORIX174 | MulticéntricoAdultos | EC activa naïve biológicos | Mant. | IFX>3 ug/mL | Escalda de dosis (x2 veces)Grupo1: ↑2,5mg/kgGrupo 2: ↑5mg/kgSi síntomas, biomarc., niv. bajos | Escalada a 10mg/Kg por síntomas | RC libre esteroides sin Sem. 22 -54, sin úlceras sem. 54Grupos 1 y 2: 33%, 27%Control: 40% |
| SERENE-UC178 | MulticéntricoAdultos | CU mod.-grave | Mant. | Ada>10 ug/mL | Escalada proactiva en sem. 14, 28 y 42 | No escalada(1)ADA 40/14 d o(2)ADA 40/7 d | RC (entre respondedores sem. 8) en sem. 52I: 36,5%C: 29,5% (1) – 39% (2) |
| SERENE-CD179 | MulticéntricoAdultos | EC mod.-grave | Mant. | Ada>5 ug/mL | Escalada proactiva en sem. 14, 28 y 42 | Escalada a 40/sem. por síntomas/PCR | RC en sem. 54I: 44%C: 44% |
| PAILOT175 | MulticéntricoPediátrico | EC luminal | Mant. | Ada>5ug/mL | Escalada si Ada<5 ug/mL | Escalada 40 sem. si clínica/PCR/CF con ADA<5 ug/mL | RC libre esteroides en todas las visitas sem. 8-72I: 82%C: 48% |
| PRECISIÓN177 | MulticéntricoAdultos | EII en RC | Mant. | IFX>3 ug/mL | Escalada según Modelo Pk bayesinano (niveles IFX, Ac, PCR, Alb, sexo peso) | No ajuste dosis | RC en todas las visitas ->1 añoI: 88%C: 64% |
| ULTRA PROACTIVE TDM180 | MulticéntricoAdultosNo Aleatorizado | EII | Mant. | IFX 3-7 ug/mL según POCT | Hospital A: Escalada con base en niveles | Hospital B: Escalada por síntomas/biomarc./ activ. endoscópica | Fallo a IFX 1 año (retirada IFX, reacc. alérgica, hospitaliz., cirugía, añadir tratamiento)A: 19%B: 10% |
| NOR-DRUM-A176 | MulticéntricoAdultos | Inmunomediadas (incluido EC/CU)Fase inducción | Inducc.Mant. | IFX:>20 ug/mL sem. 2;> 15 ug/mL sem. 6;>3 ug/mL sem. 14 | Ajuste basado en TDM | Ajuste basado en clínica | RC en semana 30I: 50,5%C: 53% |
| NOR-DRUM-B181 | MulticéntricoAdultos | Inmunomediadas(incluido EC/CU)50% optimización inicial | Mant. | IFX 3-8 ug/mL | Ajuste basado en TDM | Ajuste basado en clínica | RC sin empeoramiento hasta semana 52I: 73,6%C: 55,9% |
EII: enfermedad inflamatoria intestinal; EC: enfermedad de Crohn; CU: coltiis ulcerosa; RC: remisión clínica; IFX: infliximab; ADA: adalimumab; TDM: monitorización terapéutica de medicamento; I: grupo de intervención; C: control; PCR: proteína C reactiva.
Sin embargo, lo que todavía no han resuelto los ensayos clínicos, son los escenarios en los que el paciente tiene un mayor riesgo de infraexposición al biológico y que, en teoría, podría beneficiarse de una estrategia de escalada de dosis más intensiva y personalizada. Por ello, las distintas guías clínicas vigentes no han establecido recomendaciones firmes sobre el uso proactivo de los niveles, aunque la tendencia es ir introduciendo algunas especificaciones y escenarios en los que se puede utilizar13,76,185,186. Entre estos escenarios cabe destacar el periodo de inducción (ya discutido previamente), la enfermedad perianal, la CU grave, las situaciones de mayor riesgo de inmunogenicidad (p. ej., el tratamiento en monoterapia o el estado portador de HLADQA1*05), la enfermedad pediátrica y previa a la desescalada/retirada del tratamiento.
Hay que tener en cuenta, además, situaciones clínicas de alta carga inflamatoria con mayor eliminación del fármaco que pueden requerir una dosificación más ajustada de forma precoz como el brote grave de CU o la EC grave51,187–189.
En varios estudios se propone, además, que la monitorización proactiva puede evitar la necesidad de terapia concomitante con IMS, manteniendo niveles> 5μg/mL190,191. De hecho, en un estudio post-hoc del ensayo clínico SONIC, la estratificación por niveles de infliximab mostró un resultado similar independiente del uso de IMS79,192. Esto podría ser más relevante con infliximab iv193 que con infliximab sc194 o adalimumab139,195, en los que la utilidad del tratamiento combinado durante el mantenimiento es menos evidente. De igual modo, la monitorización proactiva tras la retirada del IMS, podría prolongar la vida del biológico y tener una eficacia comparable a la de la terapia combinada196.
La población pediátrica es especial, por una mayor variabilidad de exposición a los biológicos. En este caso, niveles elevados de adalimumab e infliximab en la inducción se asocian con la remisión clínica en semana 52197,198. Por otro lado, el único ensayo publicado en esta cohorte (ensayo PAILOT) demostró que la monitorización proactiva con intensificación de adalimumab (nivel objetivo> 5μg/mL), resulta en tasas superiores de remisión libre de corticoides que la estrategia reactiva (82 vs. 48% p: 0,002)175.
Recomendación: con la evidencia actual, se desaconseja una estrategia de monitorización proactiva generalizada. En cambio, en espera de información adicional, debe valorarse su utilización al finalizar la fase de inducción o durante la misma, sobre todo en escenarios clínicos de difícil manejo (como la enfermedad perianal, o elevada carga inflamatoria), durante el mantenimiento del fármaco, si existe riesgo de PRS (monoterapia, segundo anti-TNF, portador de HLA-DQA1*05) y ante estrategias de desescalada o reintroducción tras una suspensión prolongada.
La reducción de la dosis de anti-TNF durante el mantenimiento parece tener poco impacto sobre la remisión de la enfermedad, siempre que los niveles mínimos del fármaco permanezcan dentro de los considerados «adecuados» y siempre que el paciente esté en remisión profunda. La desescalada mediante reducción de la dosis del fármaco biológico o aumento del intervalo entre dosis podría disminuir los costes, aunque no se haya confirmado la capacidad de reducir los eventos adversos en los sujetos con EII199,200. Los datos actuales para la EII no demuestran que concentraciones superiores de anti-TNF estén asociadas con una mayor toxicidad, a diferencia de la espondiloartritis donde concentraciones de infliximab> 20,3μg/mL se relacionaron con un mayor riesgo de infecciones201.
Antes de reducir (o retirar) la dosis de cualquier tratamiento de mantenimiento en la EII, se debe reevaluar la enfermedad y confirmar la remisión clínica, biológica, endoscópica y/o radiológica e incluso histológica199,202. Los antecedentes, gravedad y extensión de la enfermedad son factores importantes a considerar202. Estudios no guiados por monitorización terapéutica de niveles de pacientes que han necesitado un aumento de dosis previo debido a una PRS, la subsiguiente desescalada se asocia con una alta tasa de recaída a corto plazo y, además, solo un tercio de ellos responderá a la nueva escalada de tratamiento202–204.
La disminución de dosis basada en los síntomas y en niveles de PCR en pacientes con EII en remisión clínica con infliximab, se asocia con un alto riesgo de recaídas, mientras que el manejo basado en la monitorización terapéutica de niveles podría evitar una proporción significativa de las mismas76,134,205. La monitorización proactiva de niveles permite la desescalada de forma segura en sujetos con respuesta sostenida y concentraciones farmacológicas séricas elevadas, reduciendo la exposición innecesaria al fármaco y los costes76,200,205. El algoritmo TAXIT demostró el efecto de la monitorización terapéutica de niveles en la optimización y la reducción del coste del tratamiento134. La desescalada se realizó mediante la reducción de la dosis a 5mg/kg (si previamente llevaba 10mg/kg) o aumentando el intervalo entre las infusiones en dos semanas (hasta un intervalo máximo de 12 semanas). La desescalada de la dosis de infliximab supuso una reducción de 28% de los costes de medicamentos en la EII que inicialmente habían tenido una respuesta total o parcial a la terapia de mantenimiento, sin producir cambios clínicos significativos134. Un estudio reciente analizó la rentabilidad de la desescalada de infliximab biosimilar y observó que en dos años, la reducción guiada por la monitorización terapéutica de niveles, supuso un ahorro de 6%, unos 25,4 millones de euros por 10.000 pacientes206.
Otros estudios observacionales y de práctica clínica apoyan el uso de la monitorización terapéutica de niveles en la desescalada de dosis207–209 En pacientes en remisión clínica y biológica con concentraciones de infliximab> 7μg/mL, la disminución de la dosis no suponía un mayor riesgo de recaída207. En cambio, si tras la desescalada, los sujetos presentaban niveles <2,4μg/mL, sufrían un mayor riesgo de PRS208. La reducción progresiva de la dosis hasta los 5mg/kg originales o hasta lograr una concentración de entre 3-7μg/mL permitía obtener unas tasas elevadas de remisión a largo plazo209.
Papamichael et al. aconsejan disminuir la dosis de infliximab cuando las concentraciones sean repetidamente >15μg/mL. Dado que no se ha demostrado una mayor toxicidad asociada a niveles altos de anti-TNF, habrá casos en los que se pueda continuar con las dosis elevadas, especialmente en aquellos pacientes que han mantenido actividad de la EII a pesar de tener altas concentraciones de fármaco o en aquellos a los que les costó más tiempo alcanzar la remisión1.
Alargar el intervalo entre dosis también ha demostrado su utilidad en la desescalada de pacientes tratados con adalimumab210. Un estudio evaluó retrospectivamente 40 sujetos con EC que pasaron a recibir el fármaco cada tres semanas. De ellos, 65% permaneció en remisión clínica con concentraciones valle de adalimumab> 4μg/mL y se asoció con la resolución de efectos secundarios (manifestaciones cutáneas, artralgia e infecciones leves) en la mitad de los individuos210.
Sin embargo, los datos no son homogéneos. Un estudio en 25 personas con EII en remisión profunda, mostró que los niveles de anti-TNF previos a la desescalada no eran predictores de fracaso211. Un total de 64% permaneció en remisión a los 12 meses tras la desescalada y la reescalada fue eficaz en todos los casos211. Este estudio ofrece la esperanza de que la reducción de la dosis de anti-TNF se puede llevar a cabo con éxito y de forma segura en la EII bajo un seguimiento estrecho. Sin embargo, son necesarios estudios prospectivos y con mayor número de pacientes que investiguen este escenario212.
¿Deberíamos determinar niveles antes de la retirada del tratamiento biológico?La suspensión de fármacos en un paciente con EII, especialmente el tratamiento biológico, debe individualizarse y tener en cuenta la preferencia del individuo. En general, en caso de terapia combinada, se prefiere la retirada del IMS por asociarse a una baja probabilidad de recidiva clínica (comparado con la retirada del anti-TNF)213. La posibilidad de recaída tras interrumpir biológico es alta: 19% por paciente/año y 40-50% durante un periodo de dos años tras la interrupción del anti-TNF213–215. Un reciente ensayo clínico en sujetos con EC demostró una tasa de recaídas de 49%, tras la suspensión de infliximab (por 0% entre los que lo mantenían)216. No obstante, la reincorporación del fármaco restituye la respuesta también en 80%217. Asimismo, la relación riesgo-beneficio de cualquier IMS también debe considerarse en el contexto de la edad y las comorbilidades.
Varios estudios han analizado los factores predictivos de recaída. Los factores clínicos identificados son la edad temprana al inicio de la EII, el sexo masculino, enfermedad extensa, cirugía previa, enfermedad perianal, uso precoz de anti-TNF y/o IMS213,218. Los marcadores de laboratorio predictores de recaída tras la interrupción de anti-TNF en la EC incluyen la PCR, leucocitos elevados, hemoglobina baja y CF elevada. Un modelo del ensayo STORI219 incorporó estos marcadores de laboratorio (hemoglobina ≤ 14,5g/dL, leucocitos ≥ 6 x109, PCR ≥ 5mg/dL, CF ≥ 300μg/g), junto con el sexo masculino y la ausencia de resección quirúrgica. Concluyó que los pacientes con ≤ 2 factores (29% de la población estudiada) tenían un riesgo de recaída de 15% en un año. Por último, la evidencia de curación de la mucosa ya sea en la endoscopia o en imágenes y por ende, niveles bajos de CF, se asocian con un riesgo reducido de recaída en la EC220.
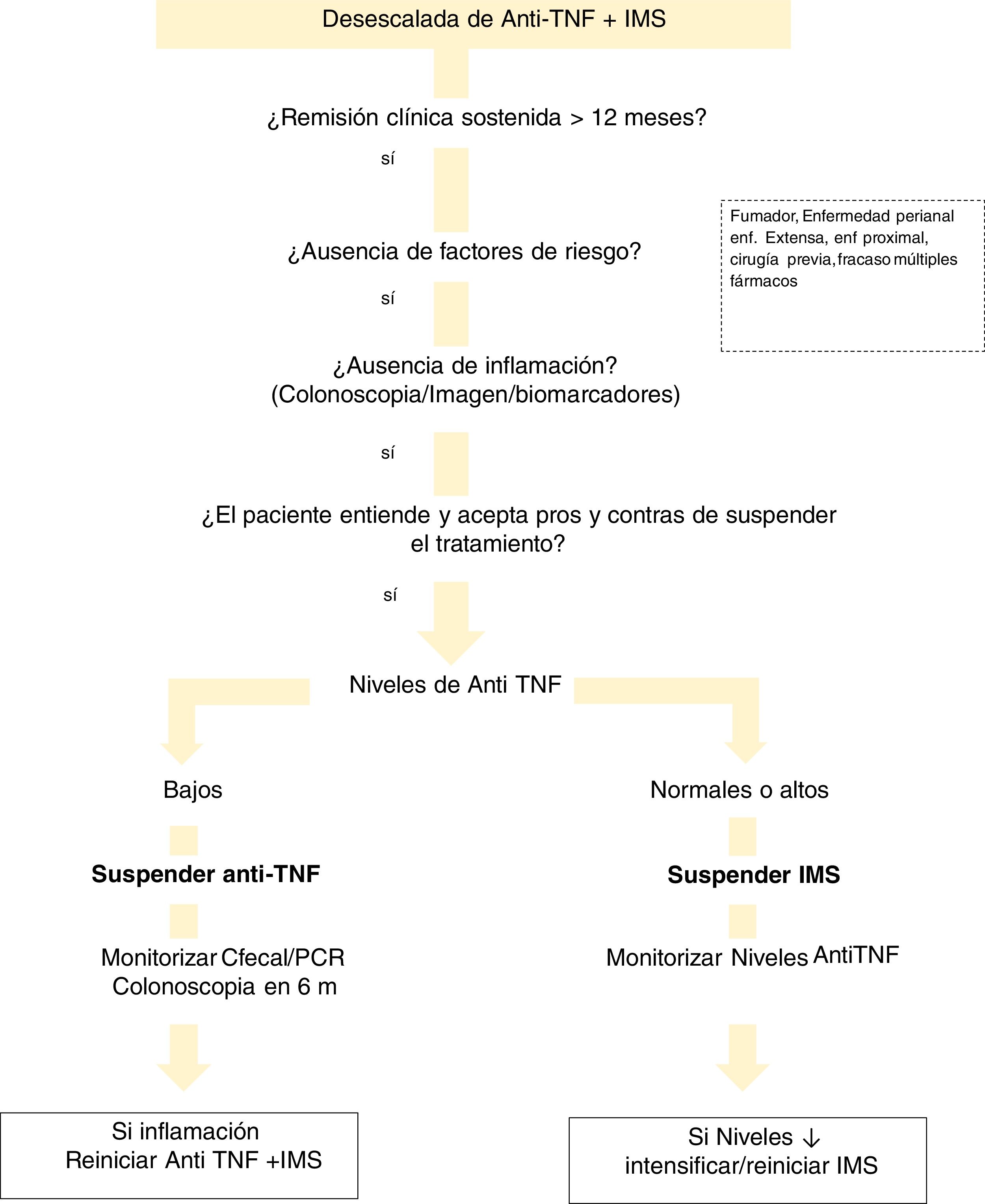
En cuanto a los niveles del fármaco, existen diversas situaciones que se deben valorar (fig. 1). Si el paciente está en tratamiento combinado y tiene niveles elevados de anti-TNF, proponemos la retirada del IMS. En el caso de que los niveles del biológicos sean bajos o indetectables, recomendamos la interrupción del biológico, manteniendo el IMS. Esto se justifica por la demostración de que los pacientes con concentraciones indetectables del fármaco tienen un riesgo significativamente menor de recaída tras la suspensión del anti-TNF, en comparación con aquellos que lo interrumpieron con niveles detectables221. Esto puede explicarse por la hipótesis de que la remisión en los sujetos con niveles bajos o indetectables del fármaco anti-TNF se mantiene, independientemente de la continuación del anti-TNF, por la propia historia natural de su enfermedad o por el IMS. Por otro lado, la interrupción de este último (manteniendo el anti-TNF) muestra un riesgo menor de recaída si las concentraciones de anti-TNF eran> 5μg/mL191. Esta idea general de retirada de anti-TNF también sería aplicable en los casos en el que el paciente esté sin IMS.
Hay pocos estudios que analicen el nivel de fármaco para considerar la retirada del biológico. Se ha observado un menor riesgo de recaída en pacientes con niveles de anti-TNF <6μg/mL222. Sin embargo, en el ensayo STORI219 se concluyó que las concentraciones <2μg/mL eran las requeridas para dotar de mayor seguridad esta estrategia.
No hay estudios que aborden la retirada de fármacos no anti-TNF.
Determinación de anticuerpos al reintroducir el anti-TNF tras vacaciones de fármacoLa terapia episódica aumenta la presencia de AAF y las reacciones infusionales, especialmente, en pacientes sin terapia IMS o pausas prolongadas223.
Un estudio posterior, en una pequeña cohorte de 27 pacientes retratados con infliximab o adalimumab, tras una suspensión de al menos cuatro meses, observó que 3/5 sujetos con AAF tuvieron una reacción infusional, frente a 11/22 sin presencia de AAF, lo que no sugiere una gran utilidad en este contexto. Se realizó seguimiento de los 22 portadores de AAF. Se pudo demostrar la negativización de los AAF tras un año de la suspensión de infliximab y, algo más tarde, en el caso de adalimumab224.
Por otro lado, la ausencia de AAF tras la reexposición al fármaco (antes de la segunda dosis) se asocia con una mejor respuesta a corto plazo mientras que la presencia de AAF se relaciona con mayores tasas de reacciones infusionales225.
Un metaanálisis que incluyó 1.351 pacientes demostró que el riesgo de reacción infusional y reacción infusional grave era mayor en los sujetos con presencia de AAF (riesgo relativo [RR] 2,4 y RR 5,8, respectivamente). El riesgo disminuía en aquellos en terapia combinada226.
Modelos farmacocinéticos¿Qué son los modelos farmacocinéticos y qué nos aportan?Los ensayos clínicos pivotales establecen la eficacia de un fármaco y la forma inicial de utilizarlo que se reflejará en la ficha técnica. Las dosis aconsejadas son iguales para todos los pacientes o se ajustan a variables antropométricas. Sin embargo, la exposición al fármaco es muy diferente entre personas. El porcentaje de adultos con niveles bajos de infliximab (< 3μ/mL) puede ser superior a 40%227,228 y, en la población pediátrica, hasta 68%229. En el caso de adalimumab, se añade la variable de la absorción sc y la administración en dosis fijas por lo que su variabilidad es mayor. Tras una dosis de 160mg de adalimumab, las concentraciones en el día 7 oscilan entre 7,1 y 26,8μg/mL31 Esta variabilidad podría ser crítica en la inducción puesto que niveles bajos (< 2μg/mL para adalimumab y <4μg/mL para infliximab) en la semana 2, identifican a los pacientes que van a desarrollar inmunogenicidad y, por tanto, con mayor probabilidad de NRP o PRS. Esto ocurre hasta en 22% de los que son tratados con adalimumab y 26% con infliximab230.
Los MPk intentan simplificar los complejos procesos por los que pasa un fármaco en el organismo intentando predecir su comportamiento mediante ecuaciones matemáticas. En práctica clínica, permiten individualizar la posología de un medicamento (para alcanzar la máxima eficacia terapéutica minimizando los efectos adversos) e identifica a aquellos pacientes en riesgo de una exposición insuficiente. La elaboración de un MPk se realiza a partir del estudio de una población concreta. De esta se obtienen determinaciones de los niveles del fármaco en diferentes momentos y se identifican qué covariables influyen en la Pk y explican mejor la variabilidad interindividual. Posteriormente, se valida en ese grupo y en una población distinta231. Se utiliza un sistema de probabilidad bayesiano que mejora las predicciones dado que existe un porcentaje apreciable de variabilidad no explicada por los MPk (entre 28 y 51%)232,233.
¿Cuáles son los modelos farmacocinéticos disponibles? (Tabla 1 anexo)InfliximabExisten numerosos MPk publicados, muchos de ellos validados234,235. Con una única determinación de concentración del fármaco permiten calcular la dosis para obtener un nivel objetivo. Su capacidad de predicción aumenta si disponemos de más de una determinación de concentración del fármaco del paciente concreto. Permiten identificar correctamente a> 80% de los sujetos que tras la intensificación tendrán niveles bajos28,235. La presencia de inmunogenicidad reduce su capacidad de predicción235. Las covariables incluidas en la mayoría de los MPk son el peso o el índice de masa corporal (IMC), la albúmina, la presencia de AAF y el sexo27,236,237. Algunos modelos incluyen biomarcadores de inflamación como la CF47,232, la PCR233,238,239 o la velocidad de sedimentación globular (VSG)240 o índices clínicos232,233. Existen MPk pediátricos específicos238,240 cuyas covariables son similares a las de los adultos. Recientemente, se dispone de un modelo poblacional de infliximab sc241 bicompartimental que incluye el peso, la albúmina y la presencia de AAF. Las concentraciones séricas valle del fármaco sc son mayores con la administración sc que con la iv, pero sin diferencias de eficacia. Debe tenerse en cuenta que la concentración valle de infliximab sc no explica completamente su eficacia y, probablemente, debe tenerse en cuenta su exposición acumulada (el AUC)81. Por lo tanto, los niveles valle de infliximab ev y sc no son extrapolables.
AdalimumabHay un menor número de MPk publicados29–32,242,243. La absorción sc es el factor con mayor variabilidad interindividual y determina una menor biodisponibilidad244,245. Las variables incluidas son la presencia de AAF (o su sospecha)243, el peso corporal o el IMC, la dosis empleada30,31,243. Un modelo incluye la CF y el tipo de pluma (40mg vs. 80mg)116.
UstekinumabActualmente, la monitorización de niveles de ustekinumab no se ha recomendado debido a la falta de evidencia, con excepción de un reciente consenso publicado que sugiere su uso ante una PRS186. Aunque no están suficientemente definidos los niveles terapéuticos63,72,90,246, la intensificación en pacientes con respuesta parcial o PRS es eficaz247. Asimismo, aquellos que logran la remisión endoscópica tienen niveles de fármaco superiores a los aconsejados 91,248. Los modelos bayesianos podrían ayudar a conseguir una mayor exposición al fármaco y, por tanto, a mejorar la eficacia249. Existen dos modelos publicados en EII, uno en CU y otro en EC que incluyen la albúmina y el peso como covariables250,251. No hay estudios que exploren la utilidad de estos modelos en la práctica clínica pero podrían tener un papel relevante en la inducción, puesto que la determinación de niveles tan precoces como una hora tras la infusión inicial se correlacionan con la remisión endoscópica en la semana 2471.
VedolizumabSe han publicado cuatro MPk de vedolizumab252–255, construidos a partir de los ensayos pivotales. Identifican, como covariables, valores extremos del peso, la albúmina253,254 y el título de AAF253. Un modelo realizado a partir de los datos del estudio LOVE-CD utiliza, además, la exposición previa a anti-TNF, que aumenta el aclaramiento de vedolizumab en 25%252.
Existe una clara relación entre exposición al fármaco y eficacia256. Sin embargo, ante una PRS, el incremento de niveles con la intensificación del tratamiento no se correlaciona con la probabilidad de respuesta88. Por este motivo, aún está por dilucidar la utilidad de los MPk en el tratamiento con vedolizumab.
¿Cómo aplicar los modelos predictivos?Los MPk permiten identificar aquellos pacientes con mayor probabilidad de fracaso terapéutico por exposición inadecuada al fármaco y elegir la mejor pauta posológica en inducción y mantenimiento para cada sujeto concreto.
La predicción poblacional (previa a la determinación de niveles en el paciente) con un MPk, no tiene una precisión optima; sin embargo, nos puede ayudar a identificar a aquellos con peor pronóstico por un mayor aclaramiento del fármaco257, siendo en algunos estudios en CU grave el único factor independiente asociado con la colectomía189.
En un análisis retrospectivo de los pacientes incluidos en los estudios ACT se detecta que un aclaramiento basal <0,397 L/d se asocia con remisión clínica en la semana 853. Recientemente, se ha propuesto una herramienta de decisión258 elaborada a partir de los estudios ACT con objeto de identificar a los sujetos con CU que alcanzan la curación mucosa en las semanas 8 y 30. En su cálculo incluye el aclaramiento inicial y alcanza un buen rendimiento diagnóstico (sensibilidad 82-90%, especificidad 80-87%). Está disponible online con acceso gratuito (www.premedibd.com).
Por último, el cálculo del aclaramiento de forma dinámica nos permite identificar a pacientes con alta sospecha de inmunogenicidad, pero que no podemos detectar si no disponemos de pruebas tolerantes a fármaco cuando se producen aumentos importantes del aclaramiento238. Por otro lado, un aclaramiento elevado predice la posibilidad de niveles bajos y por tanto de inmunogenicidad240. De hecho, se ha calculado que el aumento del riesgo de AAF es de 61% por cada incremento del aclaramiento de 0,1 L/d259.
¿Cuál es la utilidad de los modelos farmacocinéticos en mantenimiento?Buscan conseguir un nivel objetivo del fármaco que supone adoptar una estrategia proactiva. El punto de corte elegido no siempre es el mismo entre estudios y, probablemente, deba adaptarse al objetivo de tratamiento elegido y a las circunstancias del paciente concreto186. Así, en una enfermedad perianal los niveles valle requeridos van a ser más altos260 al igual que, probablemente, en el intestino delgado261.
Los modelos permiten aproximar el porcentaje de pacientes que conseguirá el nivel objetivo con las dosis de ficha técnica e identificar subgrupos con mayor riesgo de no alcanzarlo; así, se ha descrito que en población pediátrica solo 24,2% de los sujetos alcanza un nivel ≥ 5μg/mL240 con las dosis habituales de infliximab. Asimismo, los modelos de adalimumab262 nos permiten aproximar que con la pauta habitual <75% de los pacientes conseguirá un nivel valle> 8μg/mL y que aquellos con un IMC> 30 o con una CF elevada (> 200) no conseguirán el nivel objetivo con la pauta convencional243.
También ayudarán a optimizar la dosificación, escogiendo la pauta con mayor probabilidad de conseguir niveles altos. Podremos acortar el intervalo de administración en lugar de incrementar la dosis de infliximab111,112 puesto que alcanzaremos niveles más elevados con la misma cantidad de fármaco empleado263.
Varios estudios apoyan el empleo del modelo bayesiano. El ensayo clínico Precision177 incluye a 80 pacientes con EII en remisión tratados con infliximab durante cuatro años de media, aleatorizados a realizar ajustes (entre 3 y 5μg/mL) según un modelo comercial (i-Dose) frente a un grupo control en el que no se permiten ajustes. Al año de seguimiento, 88% de los asignados al modelo estaban en remisión mantenida frente a 64% en el grupo control (p: 0,017). La principal limitación, aparte de los intervalos elegidos o la no realización de endoscopia, es que no se permite intensificar el tratamiento en el grupo control, lo que no refleja en absoluto la actuación en la práctica clínica habitual. La serie abierta de Eser et al.264 compara pacientes con EII en tratamiento con infliximab que recibe ajustes según un modelo bayesiano frente a los realizados a criterio de los facultativos (ciegos a la propuesta del modelo) encontrando una mayor durabilidad del fármaco (51,5 meses vs. 4,6 meses; p: 0,00004) en el primer grupo. Una serie española227 compara de forma retrospectiva una estrategia de manejo de niveles basada en el algoritmo del estudio TAXIT134 frente al empleo de un modelo bayesiano en 47 sujetos con EII tratados con infliximab. El porcentaje de personas que consiguen niveles adecuados es significativamente mayor con el modelo (odds ratio [OR]: 8,94; intervalo de confianza [IC] 95%: 2,24-35,6) y este tipo de ajuste es el único factor identificado en el análisis multivariado. La principal limitación, además del número de pacientes incluido, es la diferencia temporal entre una cohorte y otra.
Por lo tanto, aunque la utilización de MPk en la práctica clínica es prometedora, son necesarios más estudios que avalen las teóricas ventajas sobre las estrategias habitualmente empleadas en la práctica clínica (empírica, reactiva y proactiva).
¿Son aplicables los modelos farmacocinéticos poblacionales en la inducción?Existen pocos datos publicados sobre la utilidad de los modelos en la inducción. Un modelo farmacocinético-farmacodinámico sobre una cohorte retrospectiva de pacientes con CU, el AUC acumulada de infliximab fue el parámetro que mejor se correlacionaba con la curación mucosa en la semana 12233. En este se propone una dosis inicial de 10mg/kg/d con un ajuste de la dosis por niveles en la semana 2. Sin embargo, las dosis altas universales para todos los pacientes no se han mostrado más eficaces con adalimumab265 y no fueron útiles en otro modelo del mismo grupo para aquellos con EC232.
Mould et al.266 hacen una simulación con pacientes pediátricos reales (procedentes del estudio Precision) comparando la dosificación con el MPk i-Dose frente a las pautas de 5 y 10mg/kg durante la inducción. El porcentaje con niveles <10μg/mL en la semana 14 era de 29,4% si se dosificaba con el MPk y de 94,6 y 82,5% si se utilizaba una dosis fija de 5 y 10mg/kg, respectivamente.
ConclusiónLa monitorización terapéutica de niveles de los fármacos biológicos ha emergido como una valiosa herramienta en la personalización del manejo de los pacientes con EII. Aunque, evidentemente, no responde todas las preguntas, aporta una información adicional y complementaria a los datos clínicos, biológicos y morfológicos. Actualmente, se considera bien justificada la monitorización terapéutica de niveles en el manejo de la PRS y en la optimización del tratamiento durante la inducción para reducir el riesgo de NRP. Asimismo, aunque con resultados contradictorios, existe un interés creciente en la utilidad de la monitorización terapéutica de niveles como estrategia proactiva en el mantenimiento (especialmente en grupos de riesgo de PRS, segundo anti-TNF, portadores de HLADQA1*05, enfermedad perianal, monoterapia, etc.) y para guiar la desescalada o retirada de los tratamientos biológicos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores han recibido financiación para investigación, formación, asistencia a reuniones científicas y asesorías de las siguientes compañías:
F. Rodríguez Moranta: Janssen, MSD, AbbVie, Pfizer, Takeda, Pfizer, Lillie Ferring, Faes Farma y Falk Pharma.
J. Hinojosa: MSD, Abbvie, Ferring, Pfizer, Janssen, Takeda y Kern Pharma.
M. Iborra: MSD, Abbvie, Pfizer, Takeda, Janssen, Galapagos, Kern Pharma, Amgen y Sandoz.
M.D. Martín Arranz: MSD, AbbVie, Hospira, Pfizer, Takeda, Janssen, Shire Pharmaceuticals, Tillotts Pharma y Faes Pharma.
L. Menchén: MSD, Abbvie, Pfizer, Janssen, Takeda, Biogen, Sandoz, Dr. Falk-Pharma, FAES, Ferring, General Electric y Medtronic.
F. Muñoz: Tillots Pharma, Kern Pharma, Abbvie, Janssen, Pfizer y Takeda.
E. Ricart: MSD, AbbVie, Janssen, Takeda, Ferring, Pfizer, Amgen y Fresenius Kabi.
T. Valdés-Delgado: MSD, Abbvie, Pfizer, Takeda, Janssen, Galapagos, Kern Pharma, Amgen y Sandoz.
J. Guardiola: Roche, MSD, Abbvie, Kern Pharma, Takeda, Janssen, Pfizer, Ferring, Chiesi y GE Healthcare.
M. Barreiro-de Acosta: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical y Vifor Pharma.
M. Mañosa Ciria: MSD, Abbvie, Kern, Takeda, Janssen, Pfizer, Ferring, FaesFarma, Dr. Falk Pharma, Tillots Pharma y Adacyte.
Y. Zabana: Shire, Ferring, Abbvie, MSD, Takeda, FAES Pharma, Falk, Adacyte, Janssen, Almirall, Amgen, Tillots y Pfizer. También ha recibido honorarios por consultoría de Tillots, Janssen y Ferring.
A. Gutiérrez: AbbVie, MSD, Kern, Ferring, FAES, Amgen, Roche, Sandoz, Janssen, Pfizer, Dr. Falk Pharma, Tillots y Galapagos.
F. Argüelles-Arias: MSD, Abbvie, Pfizer, Kern Pharma, Takeda, Janssen, Ferring, Faes Farma, Shire Pharmaceuticals, Tillotts Pharma, Galápagos, Chiesi.
JG Sánchez-Hernández: sin conflictos de intereses.