Los regímenes libres de interferón ofrecen tasas de respuesta virológica sostenida (RVS) por encima del 90%, efectos adversos generalmente bien tolerados y duraciones de tratamiento de 12 semanas para la mayoría de pacientes con hepatitisC crónica, incluyendo pacientes naive o previamente tratados y pacientes con o sin cirrosis. Sin embargo, algunas de las opciones de tratamiento recomendadas por las guías requieren la adición de ribavirina (RBV) o extender la duración del tratamiento para aumentar la eficacia. El uso de RBV es una herramienta útil en aquellos pacientes difíciles de curar como los pacientes con cirrosis descompensada o infectados por el genotipo 3 y aquellos que no han logrado una RVS después de un tratamiento con antivirales de acción directa (AAD). Globalmente, la adición de RBV a las diferentes combinaciones causa efectos adversos relacionados con una disminución de la hemoglobina y añade inconvenientes como su posología, por la que los pacientes deben tomar varios comprimidos dos veces al día. Sin embargo, la anemia grave es rara y fácilmente manejable con una reducción de dosis. Además, la RBV es teratogénica. En la práctica, debido a que la RBV es barata y bien tolerada cuando se combina con un régimen sin interferón, sigue siendo una herramienta útil para optimizar los resultados de algunos regímenes de tratamiento contra el VHC. Los regímenes libres de RBV eliminan los efectos adversos relacionados con la misma, resultando en una mejor tolerabilidad, mejorando la adherencia y la calidad de vida del paciente y disminuyendo el coste del tratamiento.
Interferon-free regimens achieve sustained virologic response (SVR) rates of over 90%, have generally well-tolerated adverse effects and involve 12-week treatment durations for most patients with chronic hepatitis C, including naive or previously treated patients and patients with or without cirrhosis. However, some of the treatment options recommended by the guidelines require the addition of ribavirin (RBV) or extend the duration of treatment to increase efficacy. The use of RBV is a useful tool in those difficult-to-cure patients such as patients with decompensated or genotype-3-infected cirrhosis and those who have not achieved SVR after treatment with direct-acting antivirals (DAA). Overall, adding RBV to the different combinations causes adverse effects related to a decrease in haemoglobin and involves inconveniences such as its dosage, which requires patients to take several tablets twice daily. However, severe anaemia is rare and easily manageable with a dose reduction. In addition, RBV is teratogenic. In practice, because RBV is inexpensive and well tolerated when combined with an interferon-free regimen, it continues to be a useful tool to optimise the results of some HCV treatment regimens. RBV-free regimens eliminate RBV-related adverse effects related, resulting in better tolerability, improving patient adherence and quality of life and reducing the cost of treatment.
La infección crónica por el virus de la hepatitis C (VHC) es la causa principal de disfunción hepática, desarrollo de carcinoma hepatocelular y la principal indicación de trasplante hepático en nuestro medio. Los datos epidemiológicos y de la historia natural de la enfermedad sugieren claramente que todos los pacientes deberían ser tratados. Varios estudios han demostrado que la respuesta virológica sostenida (RVS) (negativización del ARN del VHC al menos 12-24 semanas tras la finalización del tratamiento) se asocia a una disminución de la morbimortalidad de los pacientes con infección crónica por el VHC, presentando un mayor impacto en los pacientes con enfermedad hepática avanzada1-3. El año 2015 fue un año trascendental para los pacientes infectados por el VHC, pues desde entonces podemos disponer de un arsenal terapéutico variado compuesto por numerosos agentes antivirales de acción directa (AAD) capaces de eliminar de forma sostenida la replicación viral en más del 90% de los casos con escasos efectos adversos, buena tolerabilidad y una duración del tratamiento limitada a 8, 12 o 24 semanas, según el grado de enfermedad. Las opciones actuales de tratamiento pueden verse en la tabla 1 e incluyen el sofosbuvir (SOF), un análogo de nucleótidos de uridina que inhibe la proteína no estructural 5B (NS5B) polimerasa, en combinación con otros compuestos AAD de diferentes familias (ledipasvir [LDV], daclatasvir [DCV], simeprevir [SMV] o velpatasvir [VEL]), el paritaprevir-ritonavir ([PTV/r] inhibidor de proteasa) más ombitasvir ([OBV] inhibidor de la NS5A) y dasabuvir ([DSV] inhibidor de polimerasa NS5B no análogo de nucleósido) y grazoprevir ([GZR] inhibidor de proteasa) más elbasvir ([EBR] inhibidor de la NS5A) y también la ribavirina (RBV)4-6. La terapia combinada con RBV mejoró notablemente la respuesta al interferón-pegilado (Peg-IFN) mediante la prevención de la recaída7. Además, la RBV ha sido un componente importante del tratamiento basado en Peg-IFN con inhibidores de proteasa de primera generación, previniendo la recaída8, pero los ensayos clínicos fase 2 de regímenes libres de IFN basados en AAD sugirieron que la RBV no siempre es necesaria9,10. El poder prescindir de la RBV comporta una serie de ventajas, como mejoría de la adherencia, disminución de los efectos indeseables, mejoría en la calidad de vida y disminución del coste del tratamiento. Aunque la RBV parece tener menos toxicidad en ausencia de Peg-IFN, la RBV es teratogénica y está asociada con anemia hemolítica y a otros efectos indeseables como astenia, prurito, molestias gastrointestinales, insomnio, cefalea, etc. Y otro inconveniente es su posología, por la que los pacientes deben tomar varios comprimidos dos veces al día.
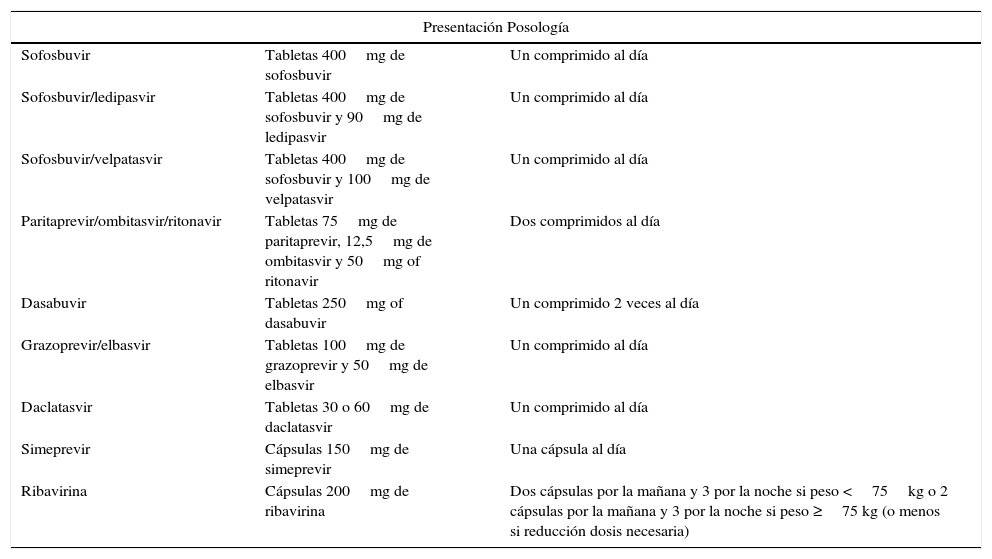
Tratamientos con antivirales de acción directa aprobados en Europa para el VHC
| Presentación Posología | ||
|---|---|---|
| Sofosbuvir | Tabletas 400mg de sofosbuvir | Un comprimido al día |
| Sofosbuvir/ledipasvir | Tabletas 400mg de sofosbuvir y 90mg de ledipasvir | Un comprimido al día |
| Sofosbuvir/velpatasvir | Tabletas 400mg de sofosbuvir y 100mg de velpatasvir | Un comprimido al día |
| Paritaprevir/ombitasvir/ritonavir | Tabletas 75mg de paritaprevir, 12,5mg de ombitasvir y 50mg of ritonavir | Dos comprimidos al día |
| Dasabuvir | Tabletas 250mg of dasabuvir | Un comprimido 2 veces al día |
| Grazoprevir/elbasvir | Tabletas 100mg de grazoprevir y 50mg de elbasvir | Un comprimido al día |
| Daclatasvir | Tabletas 30 o 60mg de daclatasvir | Un comprimido al día |
| Simeprevir | Cápsulas 150mg de simeprevir | Una cápsula al día |
| Ribavirina | Cápsulas 200mg de ribavirina | Dos cápsulas por la mañana y 3 por la noche si peso <75kg o 2 cápsulas por la mañana y 3 por la noche si peso ≥75 kg (o menos si reducción dosis necesaria) |
La experiencia en el tratamiento con AAD ha permitido acortar el tratamiento y eliminar la RBV en la mayoría de los pacientes. Sin embargo, la RBV sigue teniendo un papel en la maximización de las tasas de RVS en ciertos pacientes, incluyendo aquellos con infección por genotipo 3, cirrosis descompensada o aquellos que no han logrado una RVS después de un tratamiento con AAD. Por lo tanto, el objetivo de esta revisión es identificar los grupos de pacientes en los que se recomienda el uso de RBV de acuerdo con los diferentes regímenes libres de IFN aprobados en la actualidad, resaltando las poblaciones de pacientes difíciles de tratar en los que la RBV sigue jugando un papel importante.
Papel de la ribavirina según severidad de la enfermedad hepática, genotipo y tratamiento previoComo se puede observar en las tablas 2 y 3, para los pacientes infectados por genotipo 1, genotipo 2, genotipo 4 y genotipos 5 o 6 ya disponemos de combinaciones terapéuticas en las que no es necesaria la adición de RBV. Vamos a repasar brevemente los regímenes de tratamiento recomendados por las guías que requieren la adición de RBV para optimizar los resultados. Las recomendaciones de tratamiento en los pacientes infectados por genotipo 3 se tratarán en el siguiente apartado. Como se verá a continuación, con determinadas combinaciones terapéuticas la utilización de RBV se asocia a un aumento de la eficacia y/o menor duración del tratamiento.
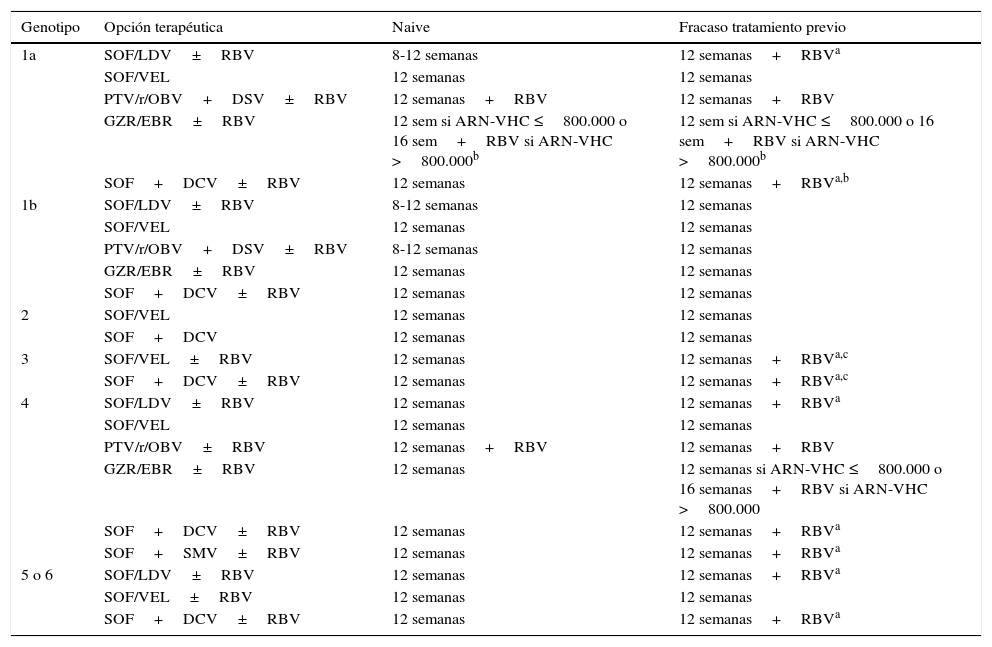
Opciones de tratamiento recomendadas en pacientes sin cirrosis
| Genotipo | Opción terapéutica | Naive | Fracaso tratamiento previo |
|---|---|---|---|
| 1a | SOF/LDV±RBV | 8-12 semanas | 12 semanas+RBVa |
| SOF/VEL | 12 semanas | 12 semanas | |
| PTV/r/OBV+DSV±RBV | 12 semanas+RBV | 12 semanas+RBV | |
| GZR/EBR±RBV | 12 sem si ARN-VHC ≤800.000 o 16 sem+RBV si ARN-VHC >800.000b | 12 sem si ARN-VHC ≤800.000 o 16 sem+RBV si ARN-VHC >800.000b | |
| SOF+DCV±RBV | 12 semanas | 12 semanas+RBVa,b | |
| 1b | SOF/LDV±RBV | 8-12 semanas | 12 semanas |
| SOF/VEL | 12 semanas | 12 semanas | |
| PTV/r/OBV+DSV±RBV | 8-12 semanas | 12 semanas | |
| GZR/EBR±RBV | 12 semanas | 12 semanas | |
| SOF+DCV±RBV | 12 semanas | 12 semanas | |
| 2 | SOF/VEL | 12 semanas | 12 semanas |
| SOF+DCV | 12 semanas | 12 semanas | |
| 3 | SOF/VEL±RBV | 12 semanas | 12 semanas+RBVa,c |
| SOF+DCV±RBV | 12 semanas | 12 semanas+RBVa,c | |
| 4 | SOF/LDV±RBV | 12 semanas | 12 semanas+RBVa |
| SOF/VEL | 12 semanas | 12 semanas | |
| PTV/r/OBV±RBV | 12 semanas+RBV | 12 semanas+RBV | |
| GZR/EBR±RBV | 12 semanas | 12 semanas si ARN-VHC ≤800.000 o 16 semanas+RBV si ARN-VHC >800.000 | |
| SOF+DCV±RBV | 12 semanas | 12 semanas+RBVa | |
| SOF+SMV±RBV | 12 semanas | 12 semanas+RBVa | |
| 5 o 6 | SOF/LDV±RBV | 12 semanas | 12 semanas+RBVa |
| SOF/VEL±RBV | 12 semanas | 12 semanas | |
| SOF+DCV±RBV | 12 semanas | 12 semanas+RBVa |
DCV: daclatasvir; GZR/EBR: grazoprevir/elbasvir; PTV/r/OBV+DSV: paritaprevir/ritonavir/ombitasvir+dasabuvir; RBV: ribavirina; SMV: simeprevir; SOF: sofosbuvir; SOF/LDV: sofosbuvir/ledipasvir; SOF/VEL: sofosbuvir/velpatasvir.
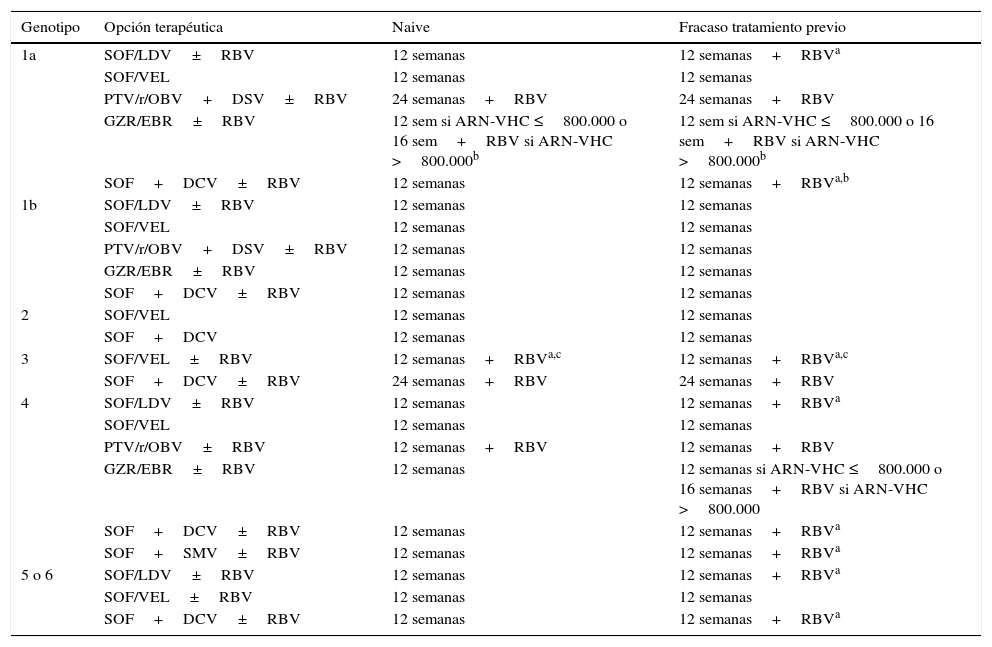
Opciones de tratamiento recomendadas en pacientes con cirrosis
| Genotipo | Opción terapéutica | Naive | Fracaso tratamiento previo |
|---|---|---|---|
| 1a | SOF/LDV±RBV | 12 semanas | 12 semanas+RBVa |
| SOF/VEL | 12 semanas | 12 semanas | |
| PTV/r/OBV+DSV±RBV | 24 semanas+RBV | 24 semanas+RBV | |
| GZR/EBR±RBV | 12 sem si ARN-VHC ≤800.000 o 16 sem+RBV si ARN-VHC >800.000b | 12 sem si ARN-VHC ≤800.000 o 16 sem+RBV si ARN-VHC >800.000b | |
| SOF+DCV±RBV | 12 semanas | 12 semanas+RBVa,b | |
| 1b | SOF/LDV±RBV | 12 semanas | 12 semanas |
| SOF/VEL | 12 semanas | 12 semanas | |
| PTV/r/OBV+DSV±RBV | 12 semanas | 12 semanas | |
| GZR/EBR±RBV | 12 semanas | 12 semanas | |
| SOF+DCV±RBV | 12 semanas | 12 semanas | |
| 2 | SOF/VEL | 12 semanas | 12 semanas |
| SOF+DCV | 12 semanas | 12 semanas | |
| 3 | SOF/VEL±RBV | 12 semanas+RBVa,c | 12 semanas+RBVa,c |
| SOF+DCV±RBV | 24 semanas+RBV | 24 semanas+RBV | |
| 4 | SOF/LDV±RBV | 12 semanas | 12 semanas+RBVa |
| SOF/VEL | 12 semanas | 12 semanas | |
| PTV/r/OBV±RBV | 12 semanas+RBV | 12 semanas+RBV | |
| GZR/EBR±RBV | 12 semanas | 12 semanas si ARN-VHC ≤800.000 o 16 semanas+RBV si ARN-VHC >800.000 | |
| SOF+DCV±RBV | 12 semanas | 12 semanas+RBVa | |
| SOF+SMV±RBV | 12 semanas | 12 semanas+RBVa | |
| 5 o 6 | SOF/LDV±RBV | 12 semanas | 12 semanas+RBVa |
| SOF/VEL±RBV | 12 semanas | 12 semanas | |
| SOF+DCV±RBV | 12 semanas | 12 semanas+RBVa |
DCV: daclatasvir; GZR/EBR: grazoprevir/elbasvir; PTV/r/OBV+DSV: paritaprevir/ritonavir/ombitasvir+dasabuvir; RBV: ribavirina; SMV: simeprevir; SOF: sofosbuvir; SOF/LDV: sofosbuvir/ledipasvir; SOF/VEL: sofosbuvir/velpatasvir.
En los pacientes no cirróticos las combinaciones terapéuticas que requieren RBV se recogen en la tabla 2. En los pacientes con cirrosis compensada los regímenes que contienen RBV se recogen en la tabla 3.
Pacientes infectados por el genotipo 1aEn los estudios fase 3 de la combinación terapéutica PTV/r/OBV+DSV se objetivó que entre los pacientes no cirróticos con genotipo 1a naive, la tasa de fracaso virológico fue mayor en el grupo sin RBV (7,8% vs. 2,0%) y que con la adición de RBV, la tasa de RVS aumentó al 97%11. En los pacientes cirróticos con infección por genotipo 1a y respondedores nulos a un tratamiento previo, el régimen de PTV/r/OBV+DSV más RBV durante 24 semanas, consigue tasas de RVS superiores a las 12 semanas de tratamiento (94,2% vs. 88,6%)12. Para aumentar la RVS en pacientes cirróticos respondedores nulos a un tratamiento previo, si se utiliza esta combinación terapéutica, se requiere, además de añadir RBV, aumentar la duración del tratamiento a 24 semanas.
En los estudios fase 3 de la combinación de GZR/EBR en pacientes no cirróticos y en el análisis integrado post-hoc de los estudios fase 2 y fase 313-16, la tasa de RVS fue similar en los pacientes tratados con o sin RBV, con la excepción de los pacientes con infección por el genotipo 1a con RAS basales en las posiciones 28, 30, 31 y 93 de la región NS5A en los que prolongar el tratamiento a 16 semanas añadiendo RBV mejoró la RVS16. En cuanto a la combinación de GZR/EBR en pacientes con cirrosis sucede lo mismo. Por ello, si no se realizan pruebas de resistencia a NS5A, los pacientes naive y los tratados previamente infectados por el subtipo 1a con cirrosis compensada con un nivel de ARN del VHC>800.000UI/ml (5,9log10UI/ml) deben recibir la combinación de GZR y EBR durante 16 semanas con RBV. En estos pacientes, la adición de RBV y aumentar la duración del tratamiento a 16 semanas impide el efecto negativo de las RAS basales a NS5A sobre la RVS.
En el análisis de los datos agrupados de los pacientes que recibieron la combinación de SOF/LDV en ensayos clínicos fases 2 y 3 se observó que la presencia de RAS basales que confieren resistencia de alto nivel al LDV (aumento de > 100 veces en EC50 en el sistema de replicón: M28A/G/T, Q30E/G/H/K/R, L31M/V, P32L/S, H58D y/o Y93C/H/N/S) se asoció con una tasa menor de RVS en pacientes infectados por genotipo 1a sin cirrosis con fracaso a un tratamiento previo tratados durante 12 semanas sin RBV17,18. La adición de RBV impidió el efecto negativo de las RAS basales a NS5A sobre la RVS. Estos resultados obtenidos de los ensayos clínicos se han reproducido en el mundo real en diferentes estudios de diversos continentes. El análisis integrado de los pacientes genotipo 1 con cirrosis tratados con la combinación de dosis fija de SOF/LDV, con o sin RBV, incluidos en diferentes estudios fases 2 y 3, demostró que ni la duración del tratamiento ni la RBV tenían un impacto en la RVS en pacientes sin tratamiento previo pero, en los pacientes con fracaso a un tratamiento previo, SOF/LDV con RBV durante 12 semanas parece ser la opción más costo-efectiva19. Esto también es sugerido por los resultados del estudio SIRIUS, que comparó SOF/LDV con RBV durante 12 semanas con SOF/LDV durante 24 semanas en pacientes con infección por VHC genotipo 1 y cirrosis que no habían logrado RVS después de un tratamiento previo con un régimen con inhibidores de proteasa de primera generación20.
La eficacia de SOF más DCV durante 12 o 24 semanas con o sin RBV se ha evaluado en una cohorte grande de vida real incluyendo pacientes con cirrosis genotipo 121, y aunque este estudio no fue controlado y la elección del tratamiento se realizó a discreción del médico tratante, se puede concluir que la adición de RBV podría permitir acortar la duración del tratamiento a 12 semanas en esta población.
Pacientes infectados por genotipo 4Con la combinación de PTV/r/OBV, la ausencia de RBV se asoció con una tasa de RVS más baja (91%). El fracaso se relacionó principalmente con razones virológicas, lo que sugiere que el uso de RBV aumenta la probabilidad de alcanzar RVS en esta población22.
Con la combinación de EBR/GZR entre los pacientes previamente tratados, en un ensayo aleatorizado de 12 o 16 semanas del régimen con o sin RBV, las tasas de RVS fueron inferiores al 95% en todos los grupos excepto en los pacientes que recibieron 16 semanas del régimen con RBV23.
En los pacientes sin cirrosis o con cirrosis compensada y fracaso a un tratamiento previo tratados con la combinación de SOF/LDV, SOF más DCV y SOF más SMV también se aconseja añadir RBV para aumentar la probabilidad de alcanzar RVS.
Pacientes infectados por genotipos 5 o 6En los pacientes infectados por los genotipos 5 o 6 con un fracaso a un tratamiento previo, independientemente de si son cirróticos o no, la adición de RBV a SOF/LDV o SOF más DCV también aumenta la RVS.
Pacientes difíciles de curar que requieren ribavirinaLa duración del tratamiento o el uso de RBV siguen siendo herramientas útiles en aquellos pacientes difíciles de curar como los pacientes infectados por el genotipo 3, los pacientes con cirrosis descompensada y en aquellos que no han logrado una RVS después de un tratamiento con AAD.
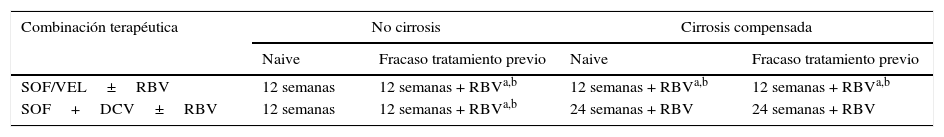
Pacientes infectados por el genotipo 3Con las combinaciones terapéuticas actuales, los pacientes infectados por genotipo 3 presentan menor RVS y mayor tasa de recaídas. Las opciones de tratamiento recomendadas por las guías4,5 en estos pacientes se muestran en la tabla 4. Los pacientes con genotipo 3 sin cirrosis pueden ser tratados con SOF más DCV durante 12 semanas sin RBV. Pero, SOF más DCV 12 semanas es subóptimo en pacientes cirróticos. Por ello, el uso de RBV parece ser obligatorio para el tratamiento de los pacientes con cirrosis genotipo 3 que son tratados durante 12 semanas con SOF y DCV. En el estudio ALLY-3 de la combinación SOF más DCV durante 12 semanas en pacientes infectados por genotipo 3, la presencia de cirrosis se asoció con una marcada reducción de la RVS (58% a 69%)24. La adición de RBV al régimen durante 12 o 16 semanas en pacientes con enfermedad hepática avanzada aumentó la RVS al 86% en los pacientes cirróticos en el estudio ALLY-3+25. Actualmente no hay estudios que comparen la eficacia de SOF más DCV con RBV 12 semanas frente a SOF más DCV con o sin RBV durante 24 semanas, por lo que quedan por establecer los regímenes óptimos que combinan SOF más DCV y la necesidad de RBV en pacientes con genotipo 3 con cirrosis. Además, las tasas de RVS observadas en pacientes con RAS basales a NS5A en los brazos que contenían RBV eran más altas que las observadas en los brazos libres de RBV. Si no se realizan pruebas de resistencia a NS5A, los pacientes con infección por el VHC genotipo 3 sin cirrosis y con fracaso de un tratamiento previo deben tratarse con la combinación de SOF y DCV durante 12 semanas con RBV. Si se realizan pruebas de resistencia a NS5A, los pacientes con fracaso a un tratamiento previo sin cirrosis con la RAS Y93H a NS5A deben ser tratados con la combinación de SOF y DCV durante 12 semanas con RBV. Los pacientes sin la RAS Y93H a NS5A Y93H deben recibir la combinación de SOF y DCV durante 12 semanas sin RBV5.
Opciones de tratamiento recomendadas en pacientes infectados por genotipo 3 sin y con cirrosis
| Combinación terapéutica | No cirrosis | Cirrosis compensada | ||
|---|---|---|---|---|
| Naive | Fracaso tratamiento previo | Naive | Fracaso tratamiento previo | |
| SOF/VEL±RBV | 12 semanas | 12 semanas + RBVa,b | 12 semanas + RBVa,b | 12 semanas + RBVa,b |
| SOF+DCV±RBV | 12 semanas | 12 semanas + RBVa,b | 24 semanas + RBV | 24 semanas + RBV |
DCV: daclatasvir; RBV: ribavirina; SOF: sofosbuvir; SOF/VEL: sofosbuvir/velpatasvir.
En el estudio fase 3, ASTRAL-3, que evaluó la combinación de SOF/VEL también se observaron tasas de RVS más bajas en los pacientes con cirrosis, en los pacientes con fracaso a un tratamiento previo y en los pacientes con presencia de RAS basales a NS5A, particularmente en la posición 93. En pacientes cirróticos naive, SOF/VEL alcanzó tasas de RVS del 93%, mientras que en los pretratados la RVS fue del 89%26. La tasa de RVS fue del 97% en los pacientes sin RAS a NS5A basales, frente al 88% en aquellos con RAS a NS5A basales (presentes en el 16% de los casos). Por tanto, se puede contemplar la adición de RBV en los pacientes infectados por genotipo 3 no cirróticos con fracaso a un tratamiento previo y en pacientes con cirrosis compensada tanto naive como con fracaso a un tratamiento previo.
Pacientes con cirrosis descompensadaLas opciones de tratamiento también permanecen limitadas en pacientes con enfermedad hepática descompensada y además los efectos adversos graves son mayores en los pacientes con cirrosis descompensada (10 a 52%) que en las otras poblaciones de pacientes con VHC (<10%). En estos pacientes siempre que sea posible se recomienda la utilización de RBV. De hecho, se han incluido relativamente pocos pacientes con enfermedad hepática descompensada en los ensayos con AAD. Además, no se recomienda el uso de inhibidores de la proteasa en pacientes con Score Child-Pugh B y están contraindicados en pacientes con cirrosis descompensada con Score Child-Pugh C, debido a las alteraciones del metabolismo que ocurren en estos pacientes que pueden provocar toxicidad. Los inhibidores de la proteasa tampoco deben utilizarse en pacientes con cirrosis compensada con antecedentes de descompensación previa, ya que se han reportado casos de descompensación durante el tratamiento. Así, el tratamiento de los pacientes con cirrosis descompensada debe basarse en la combinación de SOF y un inhibidor de la NS5A, como LDV, DCV o VEL, añadiendo RBV siempre que sea posible (tabla 5).
Recomendaciones en pacientes con cirrosis descompensada
| Siempre que sea posible se recomienda la utilización de ribavirina (RBV). La dosificación se realizará en función de los niveles basales de hemoglobina, aclaramiento de creatinina, edad y comorbilidades |
| En pacientes con cirrosis descompensada (Score Child-Pugh B y C), no se recomiendan las pautas basadas en inhibidores de proteasa (sofosbuvir+simeprevir, paritaprevir/r+ombitasvir ±dasabuvir, grazoprevir/elbasvir) |
| El tratamiento de los pacientes con cirrosis descompensada debe basarse en la combinación de sofosbuvir y un inhibidor NS5A, como ledipasvir, daclatasvir o velpatasvir, añadiendo RBV siempre que sea posible |
| Se necesitan datos adicionales en pacientes con enfermedad hepática más avanzada (Child-Pugh C) |
| Los efectos adversos graves son mayores en los pacientes con cirrosis descompensada que en otras poblaciones de pacientes con VHC |
La RVS en 20 pacientes cirróticos genotipo 1, con Score Child-Pugh B fue solo del 65% con SOF/LDV durante 12 semanas27. En otro estudio, SOF/LDV con RBV durante 12 semanas se comparó con SOF/LDV con RBV durante 24 semanas en pacientes cirróticos con Scores Child-Pugh B y C genotipo 1. Las tasas de RVS oscilaron entre el 83-94%, sin diferencias con las tasas obtenidas en aquellos tratados durante 24 semanas28. Recientemente, los datos de una cohorte no controlada con cirrosis descompensada de vida real han demostrado un ligero aumento de la eficacia de este régimen administrado durante 12 semanas en el grupo que recibe RBV en comparación con el grupo sin RBV, lo cual sugiere que es aconsejable el uso de RBV en pacientes con genotipo 1 con cirrosis descompensada29. En resumen, los pacientes con cirrosis descompensada tratados con SOF/LDV deben recibir tratamiento 24 semanas y el uso de RBV permite acortar el tratamiento a 12 semanas en esta población de pacientes.
El régimen de SOF más DCV se ha evaluado en pacientes con genotipo 1 con cirrosis descompensada incluidos en un ensayo clínico fase 3 de un solo brazo. La dosis inicial de RBV fue de 600mg diarios y posteriormente se aumentaba hasta 1.000mg diarios según el nivel de hemoglobina y la función renal. La tasa de RVS total fue del 82% y no fue igual de eficaz entre los pacientes con Child-Pugh A o B (>90%) y aquellos con Child-Pugh C (<60%), sugiriendo que SOF más DCV y RBV durante 12 semanas podría ser un régimen óptimo para el genotipo 1 en pacientes con cirrosis descompensada Child-Pugh A o B30. La combinación de SOF y DCV con o sin RBV (5 pacientes) se ha administrado durante 12 semanas en pacientes con genotipo 1 y cirrosis descompensada en una cohorte no controlada de vida real (45 pacientes). Las tasas de RVS fueron del 82 y 60%, en pacientes con y sin RBV, respectivamente31. El pequeño número de pacientes y la elección del tratamiento realizado por el médico tratante no permiten apoyar fuertemente el uso de RBV en estos pacientes. En resumen, la combinación de SOF más DCV y RBV durante 12 semanas puede recomendarse en pacientes con genotipo 1 con cirrosis compensada o descompensada Child-Pugh B. Se necesitan datos adicionales en pacientes con enfermedad hepática más avanzada (Child-Pugh C).
El estudio fase 3 ASTRAL-4 ha evaluado la eficacia de SOF/VEL con o sin RBV 12 semanas o SOF/VEL 24 semanas en pacientes genotipos 1-6 con cirrosis descompensada (sólo Child-Pugh B). Al igual que en otros estudios con otras combinaciones de AAD, los pacientes infectados por el genotipo 3 del VHC presentaron tasas más bajas de RVS que los pacientes infectados por otros genotipos del VHC. El SOF/VEL con RBV durante 12 semanas fue más eficaz que el SOF/VEL solo durante 12 o 24 semanas; sin embargo, la RBV se asoció con más interrupciones del tratamiento debido a efectos adversos. La tasa de RVS de los pacientes cirróticos descompensados infectados por el genotipo 3 que recibieron SOF/VEL más RBV fue del 85%, mientras que solo fue del 50% en los pacientes con genotipo 3 que recibieron SOF/VEL sin RBV32, lo que sugiere que la contribución de la RBV puede ser particularmente importante en los pacientes infectados por el genotipo 3 del VHC. Por lo tanto, siempre que sea posible se recomienda la utilización de RBV en pacientes con genotipo 3 y cirrosis descompensada.
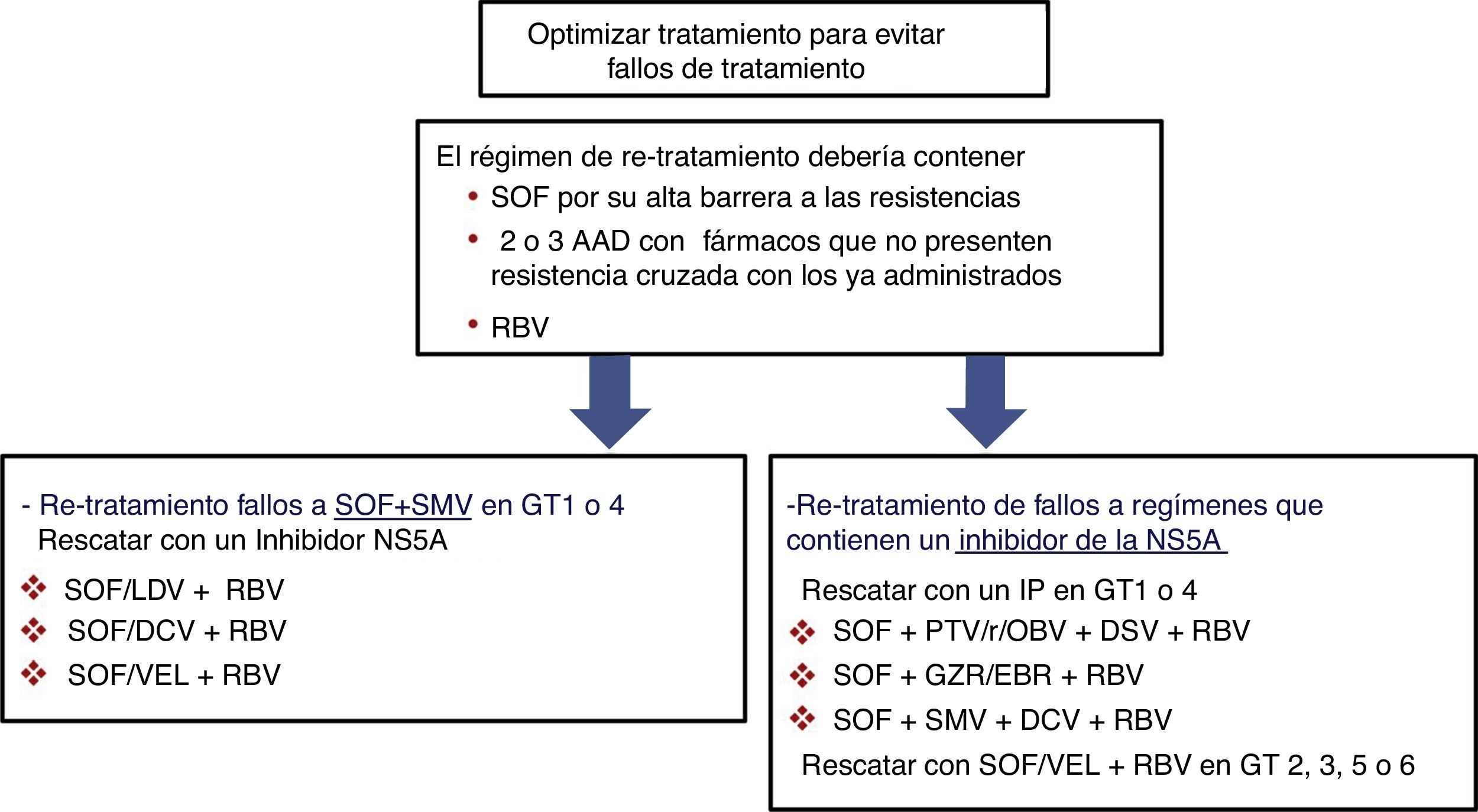
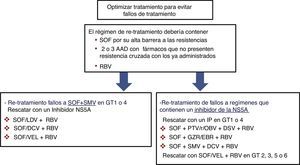
Pacientes con fallo a un tratamiento previo con antivirales de acción directaEn los pacientes que no han logrado una RVS después de un tratamiento con AAD se seleccionan RAS que se ha demostrado que confieren una susceptibilidad reducida a la clase de fármaco correspondiente en vitro. Estas RAS y un número de sustituciones alternativas en las mismas posiciones pueden estar presentes al inicio del nuevo tratamiento en pacientes previamente expuestos a AAD. Por ello, las guías recomiendan utilizar las pruebas de resistencia para guiar el cambio de tratamiento4,5. Como se puede observar en la figura 1, si no se dispone de una prueba de resistencias, las estrategias de retratamiento han de incluir necesariamente esquemas con fármacos que no presenten resistencia cruzada, incluyendo RBV y prolongando el tratamiento a 24 semanas, sobre todo en pacientes con fibrosis F3 o cirrosis. Además, para el retratamiento de los fallos a AAD se aconseja usar regímenes basados en SOF porque el SOF tiene una barrera alta a la resistencia. Las variantes resistentes al VHC son excepcionales después del tratamiento con SOF, y en caso de que aparezcan, estas desaparecen rápidamente después de finalizar el tratamiento33,34. En estos pacientes, la RBV permite optimizar la probabilidad de obtener RVS.
Opciones de re-tratamiento recomendadas en pacientes con fracaso a AAD si no se dispone de test de resistencias. La duración del tratamiento debería ser de 12 o 24 semanas (24 semanas recomendado en pacientes con fibrosis F3 o cirrosis).
AAD: antivirales de acción directa; DCV: daclatasvir; GT: genotipo; GZR/EBR: grazoprevir/elbasvir; IP: inhibidor de la proteasa; PTV/r/OBV+DSV: paritaprevir/ritonavir/ombitasvir+dasabuvir; RBV: ribavirina; SMV: simeprevir; SOF: sofosbuvir; SOF/LDV: sofosbuvir/ledipasvir; SOF/VEL: sofosbuvir/velpatasvir.
La RBV (1-beta-D-ribofuranosil-1,2,4-triazol-3-carboxamida) es un análogo sintético de guanosina con actividad antiviral que fue sintetizado originalmente en la década de 1970 y ha mostrado ser activo contra muchos virus ADN y ARN. La RBV en monoterapia no es eficaz en el tratamiento de la hepatitis C crónica, pero, la RBV en combinación con Peg-IFN es eficaz para esta enfermedad.
No se conoce por completo el efecto antiviral de la RBV. La RBV parece inhibir selectivamente la síntesis del ADN y del ARN virales en células huésped infectadas y aumentar la respuesta inmune mediada por citoquinas contra los virus. La RBV se fosforila intracelularmente a mono-, di- y trifosfatos. Una vez fosforilada, la RBV altera el metabolismo celular de las purinas mediante la inhibición de la inosina monofosfato deshidrogenasa (IMPDH), lo que conduce a una disminución del trifosfato de guanosina (GTP) que es esencial para la transcripción viral y la replicación de los virus ARN. El resultado de esta acción de la RBV es la inhibición del ARN viral y de la síntesis de proteínas, interfiriendo con la capacidad del virus para propagarse a otras células. En concentraciones más altas a la requerida para inhibir la síntesis de ARN viral, la RBV muestra cierta citotoxicidad para las células huésped. La RBV también aumenta la producción de citoquinas antivirales, tales como la interleucina-2, el factor de necrosis tumoral alfa y el interferón-gamma, por las células T CD4 y CD8.
No parece que la RBV sea un inhibidor potente de la ARN polimerasa, ya que solo produce una disminución leve de la carga viral (<0,5log) y no aumenta la pendiente de la primera fase de reducción del ARN del VHC. Sus efectos se relacionan con la aceleración de la segunda fase, dependiente de la disminución viral inducida por RBV en pacientes en los que la producción de virus está bloqueada de manera eficiente por las combinaciones de fármacos libres de IFN, a través de mecanismos aún no conocidos35,36.
Se ha demostrado que la RBV ejerce un efecto antiviral significativo, moderado y transitorio en una proporción significativa de pacientes que reciben monoterapia con RBV35,37-39. Por otra parte, durante la monoterapia con RBV se ha demostrado una disminución de la alanina transaminasa (ALT), que es independiente del efecto antiviral de la RBV36-39. Se han propuesto una serie de mecanismos como una inhibición directa de la ARN polimerasa viral. Sin embargo, el modesto efecto antiviral de la monoterapia con RBV in vivo, hace improbable esta hipótesis. Se ha sugerido también que la actividad antiviral de la RBV se relaciona con un agotamiento de las reservas intracelulares de GTP causada por la inhibición de la enzima IMPDH por la RBV. Sin embargo, otros inhibidores potentes específicos de la IMPDH, usados solos o en combinación con RBV o IFN, no ejercen un efecto significativo sobre la replicación del VHC en pacientes con infección por VHC, lo que sugiere que la inhibición de la IMPDH no influye en la actividad antiviral de la RBV40. Por último, la RBV actuaría como un mutágeno del VHC al incorporarse dentro de los nuevos genomas sintetizados, dando lugar a mutaciones en el genoma viral y originando un «error catastrófico» de la replicación (mutaciones suicidas). El resultado final es que los viriones infecciosos van desapareciendo, y se evita que el virus ataque a los hepatocitos sanos. Un estudio reciente ha analizado las mutaciones inducidas por la RBV utilizando la secuenciación profunda y se ha observado que la RBV ejerce un efecto mutagénico sobre el VHC induciendo las transiciones de nucleótidos, lo que sugiere que este efecto podría ser un factor relevante que explique la actividad antiviral de la RBV37. Pero la mutagénesis inducida por la RBV no explica la respuesta bioquímica. Por último, la hipótesis de que la RBV puede actuar como un potenciador de la señalización del IFN por el aumento de la inducción de los genes estimulados por IFN no se ha demostrado in vivo39. En resumen, la disociación entre las respuestas antivirales y bioquímicas a la RBV sugiere que la RBV puede actuar a través de diferentes mecanismos, un efecto antiviral directo parcialmente explicado por propiedades mutagénicas y un efecto bioquímico indirecto a través de un mecanismo desconocido.
Efectos adversos de la ribavirinaAunque la RBV parece tener menos toxicidad en ausencia de Peg-IFN, la RBV es teratogénica y está asociada con anemia hemolítica y a otros efectos indeseables, como astenia, prurito, molestias gastrointestinales, insomnio, cefalea, etc. Por lo tanto, el poder prescindir de la RBV comporta una serie de ventajas como disminución de los efectos indeseables y mejoría en la calidad de vida.
Aquí es importante destacar que a pesar de sus efectos adversos, a lo largo de los múltiples ensayos con AAD se puede observar que aunque la RBV se asocia con un aumento de la anemia, la fatiga y el insomnio, las tasas de acontecimientos adversos graves y la interrupción del tratamiento son similares en los pacientes tratados con o sin ella.
Utilización de la ribavirina: relación riesgo-beneficioLa decisión de añadir RBV debe ser individualizada para cada paciente de acuerdo con la relación riesgo-beneficio: ligero aumento de la eficacia y menor duración del tratamiento frente a peor perfil de seguridad y calidad de vida, debido principalmente a la anemia. La gran mayoría de los pacientes son tratados en exceso mediante la adición de RBV porque no es posible seleccionar, basándonos en factores basales, los pacientes que necesitan RBV. La gravedad de la enfermedad hepática podría desempeñar un papel, ya que se ha sugerido que existe una relación entre el valor de FibroScan y la eficacia del tratamiento41. Otro parámetro podría ser la presencia de RAS basales a la NS5A. Se ha demostrado que en pacientes cirróticos que recibieron un régimen basado en SOF/LDV, las tasas de RVS observadas en pacientes con RAS a NS5A basales en los brazos que contenían RBV eran más altas que las observadas en los brazos libres de RBV (pacientes con RAS a NS5A), pero similares a las informadas en pacientes sin RAS basales a NS5A tratados sin RBV42. Desafortunadamente, debido a las dificultades de acceso a las pruebas de resistencia éstas no se recomiendan en todos los pacientes cirróticos. Una forma de mejorar la relación riesgo-beneficio podría ser definir mejor la dosis óptima de RBV en combinación con AAD. La dosis de RBV basada en el peso está relacionada con la estrategia de tratamiento con Peg-IFN y RBV. Un régimen que contenga SOF o 2 o 3-AAD con dosis bajas de RBV (600 o 800mg diarios) puede mejorar la tasa de RVS en comparación con el régimen libre de RBV mientras se minimiza la incidencia de toxicidad asociada con la dosis de RBV basada en el peso. Esta opción debería ser evaluada en diferentes poblaciones, pero la llegada inminente de AAD de segunda generación administrados sin RBV no permite realizar ensayos clínicos con RBV a dosis bajas. En la práctica, se recomienda iniciar el tratamiento con la dosis basada en el peso (1.000 o 1.200mg en pacientes <75kg o ≥75kg, respectivamente) y adaptar la dosis según el nivel de hemoglobina y la función renal. Por último, el uso de RBV es problemático en poblaciones diversas, como en los pacientes en hemodiálisis, pacientes con cirrosis descompensada o pacientes antes o después del trasplante. En este contexto, es necesaria una dosificación individualizada de RBV, como una dosis inicial de RBV de 600mg diarios y posteriormente ir aumentando hasta 1.000mg diarios según el nivel de hemoglobina y la función renal. Una mejor comprensión del mecanismo de acción podría permitir el uso selectivo de RBV en la era de los AAD.
ConclusionesLa terapia combinada con RBV mejoró notablemente la respuesta al Peg-IFN mediante la prevención de la recaída7. Además, la RBV ha sido un componente importante del tratamiento basado en Peg-IFN con inhibidores de proteasa de primera generación, previniendo la recaída8. La experiencia en el tratamiento con AAD ha permitido acortar el tratamiento y eliminar la RBV en la mayoría de los pacientes. Sin embargo, la duración del tratamiento o el uso de RBV siguen siendo herramientas útiles en aquellos pacientes difíciles de curar, como los pacientes infectados por el genotipo 3, los pacientes con cirrosis descompensada y los pacientes que no han logrado una RVS después de un tratamiento con AAD. De todas formas, próximamente saldrán nuevas combinaciones de medicamentos que obviarán el uso de la RBV incluso en poblaciones difíciles de tratar y que de seguro harán que la RBV tenga un papel totalmente secundario en el tratamiento antiviral de la hepatitis C.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.