La encefalopatía hepática (EH) es una complicación grave y frecuente de la cirrosis hepática.
Además de corregir los factores precipitantes, los tratamientos más utilizados y con los que existe mayor experiencia son los disacáridos no absorbibles y la rifaximina. Muchas de las recomendaciones se basan en la práctica clínica con escasos estudios controlados y aleatorizados.
Actualmente, la rifaximina se debería iniciar durante un episodio de EH, si tras 24-48 horas con tratamiento con disacáridos no absorbibles no presenta mejoría clínica. En la EH recurrente es aconsejable añadir rifaximina si, el paciente estando en tratamiento con disacáridos no absorbibles, presenta clínica. Por el momento, no se recomienda el tratamiento habitual de la EH mínima con rifaximina.
La rifaximina ha demostrado que es eficaz en el tratamiento agudo de la EH así como en la prevención de recidivas.
Hepatic encephalopathy (HE) is a frequent and serious complication of liver cirrhosis.
In addition to correction of the precipitating factors, the most commonly used treatments are non-absorbable disaccharides and rifaximin. Many of the recommendations are based on current clinical practice and there are few randomized controlled trials.
Currently, rifaximin should be initiated during an episode of EH if, after 24-48 hours of non-absorbable disaccharide therapy, there is no clinical improvement. In recurrent EH, it is advisable to add rifaximin in patients under non-absorbable disaccharide therapy who develop a new episode. Currently, standard treatment with rifaximin for minimal EH is not recommended.
Rifaximin is effective in the acute treatment of overt encephalopathy and in preventing recurrence.
La encefalopatía hepática (EH) es una complicación grave y frecuente de la insuficiencia hepática. Ocurre en el 30-45% de los pacientes con cirrosis hepática (CH)1 y entre el 10 y el 50% de los pacientes con una derivación portosistémica percutánea intrahepática (DPPI)2.
La EH se caracteriza por un amplio espectro de alteraciones neuropsiquiátricas y motoras que pueden producir desde una leve alteración cognitiva y de la función motora hasta el coma y la muerte3,4. Es una de las manifestaciones más invalidantes de la enfermedad hepática y afecta de manera muy importante la calidad de vida de los pacientes y de sus cuidadores. Asimismo, conlleva una utilización de recursos mayor que otras manifestaciones de la CH2,5.
La aparición de EH es un indicador de mal pronóstico, y se ha evidenciado que es un factor predictor independiente de mortalidad; la probabilidad de supervivencia libre de trasplante tras el primer episodio de EH aguda al año y al tercer año es de aproximadamente el 50 y el 25%, respectivamente1,5.
La patogénesis subyacente de la EH es desconocida. Se han postulado varios factores tales como mercaptanos, ácidos grasos de cadena corta, ácido gamma-aminobutírico, endorfinas, glutamato, agonistas endógenos benzodiacepínicos, triptófano, deficiencia de zinc y el depósito de manganeso en los ganglios de la base6, aunque el factor clave más conocido y descrito desde hace años es el incremento del amonio plasmático5,7,8. El amonio atraviesa la barrera hematoencefálica y entra en el sistema nervioso central produciendo edema astrocitario que afecta de forma directa a los neurotransmisores excitatorios e inhibitorios. Sin embargo, en los pacientes con cirrosis se ha evidenciado que no hay una correlación directa entre los niveles de amonio plasmático y el grado de EH, pero sí con la concentración de amonio cerebral9. De hecho, niveles altos de amonio por sí solos no aportan nada al diagnóstico ni valor pronóstico en pacientes con cirrosis y EH. No obstante, en caso de niveles normales de amonio en un paciente con EH clínica, se ha de cuestionar este diagnóstico2.
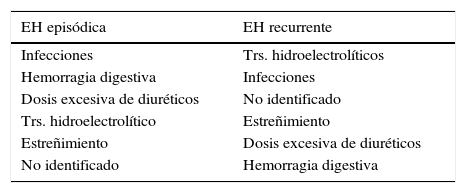
Tratamiento de la encefalopatía hepáticaRespecto al manejo de la EH, en primer lugar siempre hay que buscar posibles factores precipitantes (tabla 1). El hecho de tratar y controlar el factor precipitante es de suma importancia, pues en cerca del 90% de los pacientes esta se resuelve tratando dicho factor.
Posibles factores desencadenantes de encefalopatía hepática clínica según las guías internacionales2:
| EH episódica | EH recurrente |
|---|---|
| Infecciones | Trs. hidroelectrolíticos |
| Hemorragia digestiva | Infecciones |
| Dosis excesiva de diuréticos | No identificado |
| Trs. hidroelectrolítico | Estreñimiento |
| Estreñimiento | Dosis excesiva de diuréticos |
| No identificado | Hemorragia digestiva |
Ordenado según la frecuencia en orden descendente.
Tras detectar y, si es posible, corregir el desencadenante, se debe realizar tratamiento de la EH. Se han propuesto muchos tratamientos, si bien hay pocos estudios controlados y aleatorizados, por lo que actualmente muchas de las recomendaciones se basan en la práctica clínica2.
Los tratamientos más frecuentemente utilizados y con más experiencia son los disacáridos no absorbibles y los antibióticos orales no absorbibles o poco absorbibles, como la rifaximina. Sin embargo, se han descrito otras terapias, como los aminoácidos de cadena ramificada, probióticos y la L-ornitin-aspartato, entre otros.
La elección del tratamiento con disacáridos no absorbibles es por un doble motivo. Por un lado tiene un efecto catártico y, por otro lado, este tipo de laxante produce una acidificación del medio, generando un ambiente hostil para las bacterias productoras de ureasa (implicadas en la producción de amonio intestinal), por lo que se reduce la síntesis de amonio y, por tanto, su absorción. Las dosis habitualmente utilizadas son entre 30-60mg/día. A estas dosis es un fármaco seguro, generalmente bien tolerado y efectivo tanto en el tratamiento como en la prevención de la EH, incluyendo la EH mínima10. En ocasiones, dosis altas pueden producir efectos secundarios como deshidratación e hiponatremia, que son factores que pueden precipitar o empeorar la sintomatología.
A pesar de que la lactulosa y el lactitol son ampliamente utilizados en la práctica clínica y en muchas guías actuales continúan estando recomendados2, hay un metaanálisis del año 2004 donde no demuestra su efectividad de acuerdo con los criterios de medicina basada en la evidencia11.
Los antibióticos orales como el metronidazol, la neomicina y la rifaximina suponen otra estrategia para disminuir la cantidad de amonio producido por las bacterias entéricas. No obstante, tanto el metronidazol como la neomicina utilizadas de forma continua pueden tener efectos secundarios. Con los aminoglucósidos (neomicina y paramomicina), pese a su mínima absorción, se han reportado casos de ototoxicidad y nefrotoxicidad.
La rifaximina es un antibiótico que fue sintetizado en Italia en 198212 y derivado de la rifamicina, de escasa absorción intestinal y cuya acción es bacteriostática. En los últimos años este fármaco ha ido adquiriendo una mayor relevancia para el tratamiento de la EH, convirtiéndose en el antibiótico de elección dada la buena tolerancia (escasos efectos adversos) y eficacia.
Se han realizado varios estudios comparando la rifaximina con placebo, con otros antibióticos y con laxantes disacáridos no absorbibles13. En estos estudios se ha demostrado que la rifaximina es igual o superior a los diferentes fármacos comparados con buena tolerancia. También se han realizado estudios a más largo plazo, como tratamiento de mantenimiento comparado con disacáridos no absorbibles o con neomicina. Recientemente se ha publicado un estudio en el que se administra tratamiento de mantenimiento con rifaximina vs. placebo con uso libre de disacáridos no absorbibles durante 2años de seguimiento. En él se evidencia una tasa de recurrencia de la EH menor en los pacientes tratados con rifaximina de manera crónica, sin objetivar mayores efectos secundarios14. Además, en un metaanálisis de este año que compara la eficacia y la seguridad de los distintos tratamientos para la EH se evidencia que la rifaximina es el fármaco que consigue una mayor reducción de los niveles de amonio plasmáticos15.
Base racional para la utilización de rifaximinaLa rifaximina es un antibiótico con un amplio espectro de actividad contra bacterias, tanto grampositivas como gramnegativas, y sobre todo contra bacterias entéricas anaerobias16. Se une a la subunidad b de la ARN polimerasa dependiente del ADN e impide la síntesis del ARN.
La escasa absorción intestinal permite una concentración muy alta en el tracto gastrointestinal y, por tanto, una modificación de la flora bacteriana intestinal con niveles en sangre inferiores al 1% tras la administración oral, por lo que la rifaximina es segura en los pacientes sanos. Sin embargo, la CH altera la farmacocinética de este fármaco con un incremento marcado de la absorción sistémica de este comparado con los controles. Parece que existe una relación directa con el grado de insuficiencia hepática17,18.
Los pacientes cirróticos presentan una microbiota intestinal alterada que podría influir en la capacidad cognitiva19. La administración de antibióticos en la EH se basa en alterar la flora bacteriana y conseguir una reducción de la endotoxemia mediante una disminución de la producción y la absorción de neurotoxinas derivadas del intestino. Al disminuir los niveles de amonio y endotoxemia podría producirse un impacto positivo sobre los episodios de EH aguda y crónica20,21.
La administración de rifaximina a largo plazo parece tener un mínimo efecto sobre la flora intestinal normal, detectándose, cuando se utiliza a dosis altas, una disminución inicial de Enterococcus, Escherichia coli, Lactobacillus spp., Bacteroides spp., Bifidobacterium spp. y Clostridium perfringens, que regresan a sus concentraciones habituales tras una o 2semanas12 de su retirada22. En un estudio con 211 pacientes que recibieron rifaximina durante más de 6meses no se describió ninguna infección por Clostridium difficile23; sin embargo, se ha descrito algún caso de infección por esta bacteria en pacientes de riesgo tratados con rifaximina durante 6meses24. Finalmente, Candida albicans, implicada en algunos casos de diarrea asociada a tratamiento antibiótico, ha sido aislada en muestras fecales en un 20% de los pacientes en tratamiento con 1.200mg/día de rifaximina12.
Las resistencias a la rifaximina son muy infrecuentes25. Se ha observado que tras pocos días de retirar el tratamiento con rifaximina desaparece la resistencia de las bacterias (5días), pero no hay estudios a largo plazo18. Se cree que la selección de mutantes resistentes de bacterias, tanto gramnegativas como grampositivas, en el tracto gastrointestinal es bajo en condiciones anaeróbicas, pero no se puede descartar totalmente12.
Tolerancia y efectos secundariosLa rifaximina tiene mínimos efectos secundarios. Se han descrito cefalea, flatulencias, dolor abdominal, estreñimiento, náuseas y vómitos. Estos efectos secundarios son menores a los que acontecen con los disacáridos no absorbibles e iguales a los que se presentan cuando se compara con placebo13.
En los estudios realizados con rifaximina con dosis de 550mg cada 12h durante 6meses24 y más de 2,5años26 mostraron que el antibiótico fue generalmente bien tolerado en todos los pacientes incluidos.
La marcada reducción de la población de E.coli fecal a largo plazo podría empeorar las pruebas de coagulación, dado que estas bacterias juegan un papel en la producción de vitaminaK18.
De manera similar a la rifabutina, la rifampicina y la rifapentina, la alergia a la rifaximina también es posible; se han reportado casos de urticaria cutánea y un caso de edema angioneurótico18.
Finalmente, no se han reportado interacciones medicamentosas, por lo que se considera un fármaco muy seguro. Sin embargo, in vitro la rifaximina induce la enzima CYP3A4, aunque parece que no ocurre in vivo por su escasa biodisponibilidad oral, si bien se ha publicado algún caso de inducción de esta enzima en algún paciente tratado con rifaximina que presentaba sobrecrecimiento bacteriano intestinal27. Esta interacción interfiere con la actividad de la warfarina. Dado que los pacientes con cirrosis tienen mayor absorción de rifaximina respecto a los controles, se ha de tener en cuenta para posibles interacciones18.
Rifaximina, ¿cuándo administrarla?Rifaximina en el tratamiento de episodios de encefalopatía hepáticaEn un episodio de EH, el tratamiento más importante es corregir/tratar el factor precipitante, por lo que es muy importante investigar el posible desencadenante.
Además, se puede realizar tratamiento de la EH con disacáridos no absorbibles y/o rifaximina, dado que la gravedad puede ser desde leve (grado1) a grave (grado4 o coma) según la clasificación de West-Haven2.
De los estudios de que se dispone para el tratamiento de la EH aguda, mencionar uno prospectivo, controlado y doble ciego, con 120 pacientes con EH que se aleatorizaron a recibir lactulosa junto a 1.200mg de rifaximina vs. lactulosa y placebo28. Muchos de estos pacientes se diagnosticaron de EH grado2 a 4 por criterios de West Haven. Los pacientes incluidos presentaban de media un Child-Turcotte-Pugh de 9,7 puntos y un MELD de 24,6 puntos y una EH mayoritariamente grado3 (33,3%) y 4 (48,3%). Todos los pacientes recibieron lactulosa y rifaximina o placebo por sonda nasogástrica y fueron monitorizados. El estudio confirmó que el grupo de rifaximina presentó una menor mortalidad y menor estancia media hospitalaria respecto a los pacientes que recibieron lactulosa junto a placebo. En este último grupo los fallecimientos fueron debidos a sepsis, por lo que añadir rifaximina en el tratamiento de un episodio de EH grave es más efectivo que la administración única de disacáridos no absorbibles.
Existen otros estudios aleatorizados en los que se valora el papel de la rifaximina, mostrándose esta más efectiva que los disacáridos no absorbibles y con una eficacia equivalente o mayor que la obtenida con otros antibióticos utilizados en pacientes con encefalopatía de leve a grave17,29-32.
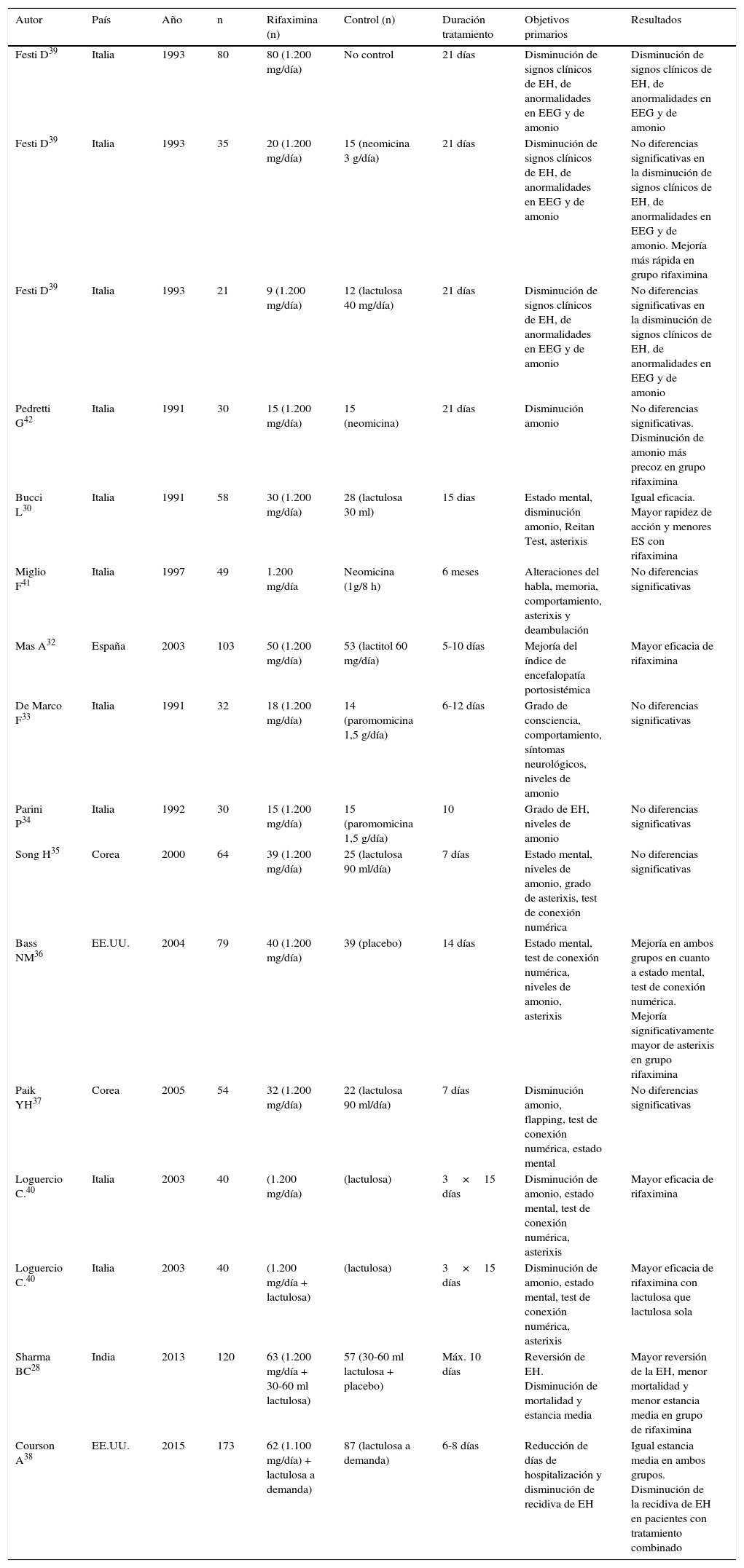
Muchos de los estudios publicados en los últimos años son favorables al uso de la rifaximina, tanto en episodios agudos de EH28,30,32-42 como en la prevención de la recurrencia14,24,26,31,43-48 y en la EH mínima25,39,50-55; la mayoría de ellos asociados al uso libre de disacáridos no absorbibles. Finalmente, se han publicado varios artículos de revisión o metaanálisis que indican que la rifaximina es, como mínimo, tan efectiva como los disacáridos no absorbibles, y esta es mejor tolerada56,57. Sin embargo, estadísticamente no se ha objetivado que sea superior; por ello todavía no se aconseja en las guías internacionales su uso en monoterapia para el tratamiento y la prevención de episodios de EH recurrente, pero se considera una terapia efectiva como tratamiento coadyuvante a los disacáridos no absorbibles2,56 (tablas 2-4).
Rifaximina en el tratamiento de episodios de encefalopatía hepática (EH)
| Autor | País | Año | n | Rifaximina (n) | Control (n) | Duración tratamiento | Objetivos primarios | Resultados |
|---|---|---|---|---|---|---|---|---|
| Festi D39 | Italia | 1993 | 80 | 80 (1.200 mg/día) | No control | 21 días | Disminución de signos clínicos de EH, de anormalidades en EEG y de amonio | Disminución de signos clínicos de EH, de anormalidades en EEG y de amonio |
| Festi D39 | Italia | 1993 | 35 | 20 (1.200 mg/día) | 15 (neomicina 3 g/día) | 21 días | Disminución de signos clínicos de EH, de anormalidades en EEG y de amonio | No diferencias significativas en la disminución de signos clínicos de EH, de anormalidades en EEG y de amonio. Mejoría más rápida en grupo rifaximina |
| Festi D39 | Italia | 1993 | 21 | 9 (1.200 mg/día) | 12 (lactulosa 40 mg/día) | 21 días | Disminución de signos clínicos de EH, de anormalidades en EEG y de amonio | No diferencias significativas en la disminución de signos clínicos de EH, de anormalidades en EEG y de amonio |
| Pedretti G42 | Italia | 1991 | 30 | 15 (1.200 mg/día) | 15 (neomicina) | 21 días | Disminución amonio | No diferencias significativas. Disminución de amonio más precoz en grupo rifaximina |
| Bucci L30 | Italia | 1991 | 58 | 30 (1.200 mg/día) | 28 (lactulosa 30 ml) | 15 dias | Estado mental, disminución amonio, Reitan Test, asterixis | Igual eficacia. Mayor rapidez de acción y menores ES con rifaximina |
| Miglio F41 | Italia | 1997 | 49 | 1.200 mg/día | Neomicina (1g/8 h) | 6 meses | Alteraciones del habla, memoria, comportamiento, asterixis y deambulación | No diferencias significativas |
| Mas A32 | España | 2003 | 103 | 50 (1.200 mg/día) | 53 (lactitol 60 mg/día) | 5-10 días | Mejoría del índice de encefalopatía portosistémica | Mayor eficacia de rifaximina |
| De Marco F33 | Italia | 1991 | 32 | 18 (1.200 mg/día) | 14 (paromomicina 1,5 g/día) | 6-12 días | Grado de consciencia, comportamiento, síntomas neurológicos, niveles de amonio | No diferencias significativas |
| Parini P34 | Italia | 1992 | 30 | 15 (1.200 mg/día) | 15 (paromomicina 1,5 g/día) | 10 | Grado de EH, niveles de amonio | No diferencias significativas |
| Song H35 | Corea | 2000 | 64 | 39 (1.200 mg/día) | 25 (lactulosa 90 ml/día) | 7 días | Estado mental, niveles de amonio, grado de asterixis, test de conexión numérica | No diferencias significativas |
| Bass NM36 | EE.UU. | 2004 | 79 | 40 (1.200 mg/día) | 39 (placebo) | 14 días | Estado mental, test de conexión numérica, niveles de amonio, asterixis | Mejoría en ambos grupos en cuanto a estado mental, test de conexión numérica. Mejoría significativamente mayor de asterixis en grupo rifaximina |
| Paik YH37 | Corea | 2005 | 54 | 32 (1.200 mg/día) | 22 (lactulosa 90 ml/día) | 7 días | Disminución amonio, flapping, test de conexión numérica, estado mental | No diferencias significativas |
| Loguercio C.40 | Italia | 2003 | 40 | (1.200 mg/día) | (lactulosa) | 3×15 días | Disminución de amonio, estado mental, test de conexión numérica, asterixis | Mayor eficacia de rifaximina |
| Loguercio C.40 | Italia | 2003 | 40 | (1.200 mg/día + lactulosa) | (lactulosa) | 3×15 días | Disminución de amonio, estado mental, test de conexión numérica, asterixis | Mayor eficacia de rifaximina con lactulosa que lactulosa sola |
| Sharma BC28 | India | 2013 | 120 | 63 (1.200 mg/día + 30-60 ml lactulosa) | 57 (30-60 ml lactulosa + placebo) | Máx. 10 días | Reversión de EH. Disminución de mortalidad y estancia media | Mayor reversión de la EH, menor mortalidad y menor estancia media en grupo de rifaximina |
| Courson A38 | EE.UU. | 2015 | 173 | 62 (1.100 mg/día) + lactulosa a demanda) | 87 (lactulosa a demanda) | 6-8 días | Reducción de días de hospitalización y disminución de recidiva de EH | Igual estancia media en ambos grupos. Disminución de la recidiva de EH en pacientes con tratamiento combinado |
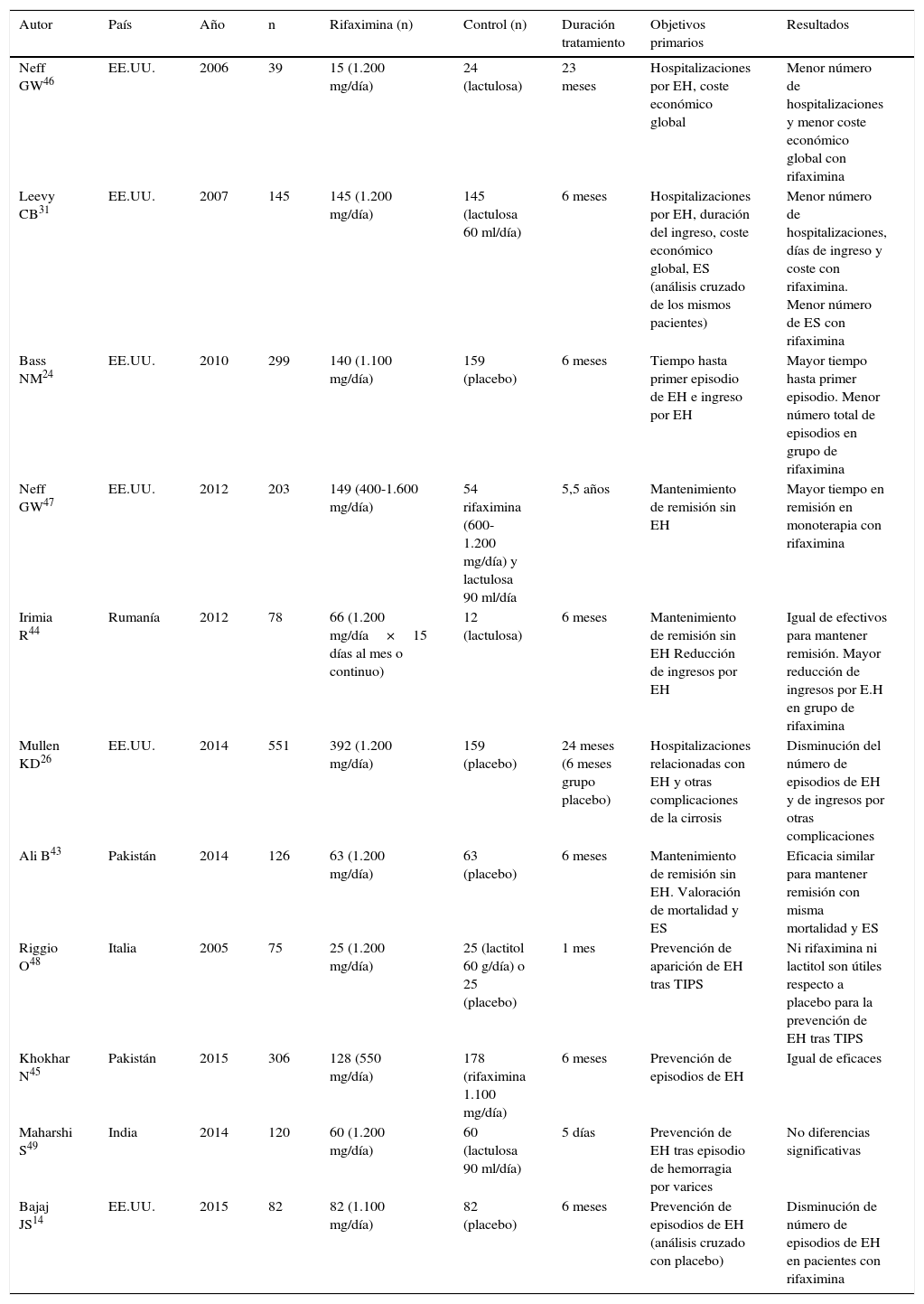
Rifaximina en la prevención de recurrencia de encefalopatía hepática (EH)
| Autor | País | Año | n | Rifaximina (n) | Control (n) | Duración tratamiento | Objetivos primarios | Resultados |
|---|---|---|---|---|---|---|---|---|
| Neff GW46 | EE.UU. | 2006 | 39 | 15 (1.200 mg/día) | 24 (lactulosa) | 23 meses | Hospitalizaciones por EH, coste económico global | Menor número de hospitalizaciones y menor coste económico global con rifaximina |
| Leevy CB31 | EE.UU. | 2007 | 145 | 145 (1.200 mg/día) | 145 (lactulosa 60 ml/día) | 6 meses | Hospitalizaciones por EH, duración del ingreso, coste económico global, ES (análisis cruzado de los mismos pacientes) | Menor número de hospitalizaciones, días de ingreso y coste con rifaximina. Menor número de ES con rifaximina |
| Bass NM24 | EE.UU. | 2010 | 299 | 140 (1.100 mg/día) | 159 (placebo) | 6 meses | Tiempo hasta primer episodio de EH e ingreso por EH | Mayor tiempo hasta primer episodio. Menor número total de episodios en grupo de rifaximina |
| Neff GW47 | EE.UU. | 2012 | 203 | 149 (400-1.600 mg/día) | 54 rifaximina (600-1.200 mg/día) y lactulosa 90 ml/día | 5,5 años | Mantenimiento de remisión sin EH | Mayor tiempo en remisión en monoterapia con rifaximina |
| Irimia R44 | Rumanía | 2012 | 78 | 66 (1.200 mg/día×15 días al mes o continuo) | 12 (lactulosa) | 6 meses | Mantenimiento de remisión sin EH Reducción de ingresos por EH | Igual de efectivos para mantener remisión. Mayor reducción de ingresos por E.H en grupo de rifaximina |
| Mullen KD26 | EE.UU. | 2014 | 551 | 392 (1.200 mg/día) | 159 (placebo) | 24 meses (6 meses grupo placebo) | Hospitalizaciones relacionadas con EH y otras complicaciones de la cirrosis | Disminución del número de episodios de EH y de ingresos por otras complicaciones |
| Ali B43 | Pakistán | 2014 | 126 | 63 (1.200 mg/día) | 63 (placebo) | 6 meses | Mantenimiento de remisión sin EH. Valoración de mortalidad y ES | Eficacia similar para mantener remisión con misma mortalidad y ES |
| Riggio O48 | Italia | 2005 | 75 | 25 (1.200 mg/día) | 25 (lactitol 60 g/día) o 25 (placebo) | 1 mes | Prevención de aparición de EH tras TIPS | Ni rifaximina ni lactitol son útiles respecto a placebo para la prevención de EH tras TIPS |
| Khokhar N45 | Pakistán | 2015 | 306 | 128 (550 mg/día) | 178 (rifaximina 1.100 mg/día) | 6 meses | Prevención de episodios de EH | Igual de eficaces |
| Maharshi S49 | India | 2014 | 120 | 60 (1.200 mg/día) | 60 (lactulosa 90 ml/día) | 5 días | Prevención de EH tras episodio de hemorragia por varices | No diferencias significativas |
| Bajaj JS14 | EE.UU. | 2015 | 82 | 82 (1.100 mg/día) | 82 (placebo) | 6 meses | Prevención de episodios de EH (análisis cruzado con placebo) | Disminución de número de episodios de EH en pacientes con rifaximina |
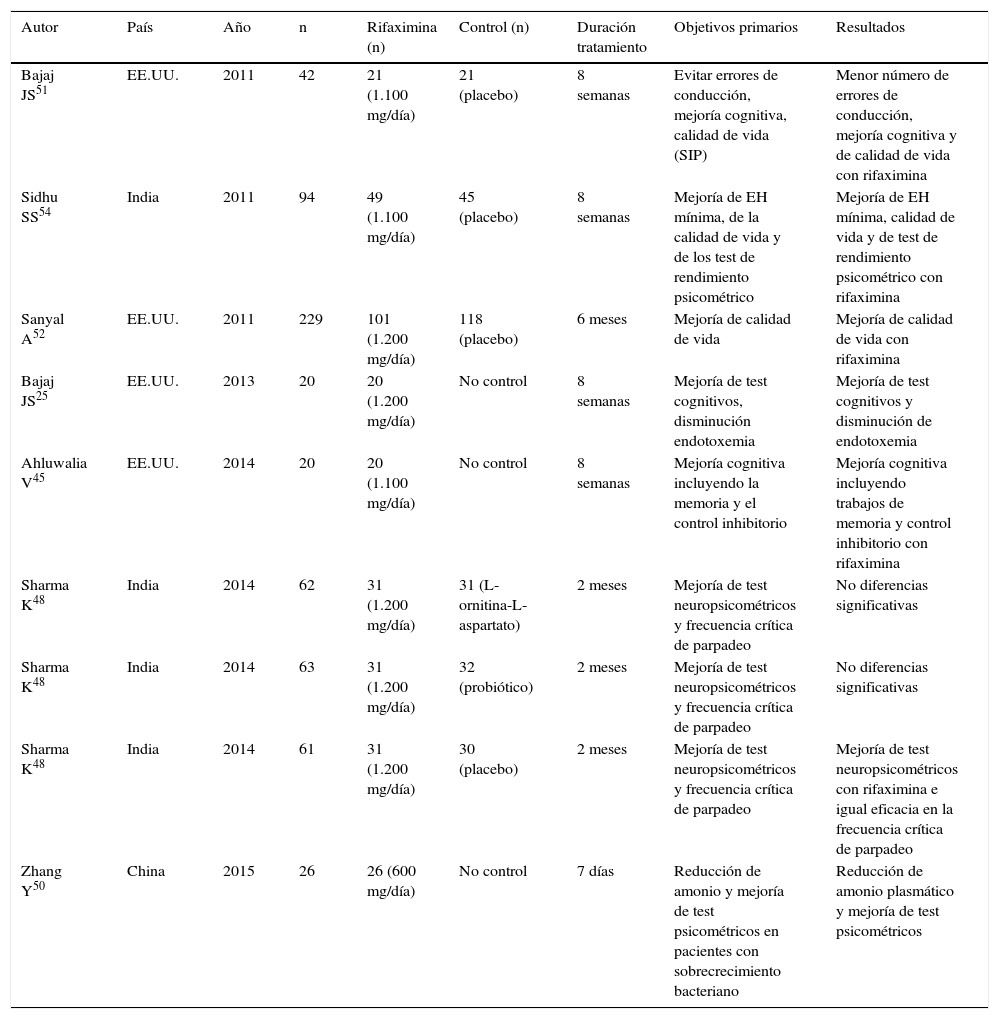
Rifaximina en la encefalopatía hepática (EH) mínima
| Autor | País | Año | n | Rifaximina (n) | Control (n) | Duración tratamiento | Objetivos primarios | Resultados |
|---|---|---|---|---|---|---|---|---|
| Bajaj JS51 | EE.UU. | 2011 | 42 | 21 (1.100 mg/día) | 21 (placebo) | 8 semanas | Evitar errores de conducción, mejoría cognitiva, calidad de vida (SIP) | Menor número de errores de conducción, mejoría cognitiva y de calidad de vida con rifaximina |
| Sidhu SS54 | India | 2011 | 94 | 49 (1.100 mg/día) | 45 (placebo) | 8 semanas | Mejoría de EH mínima, de la calidad de vida y de los test de rendimiento psicométrico | Mejoría de EH mínima, calidad de vida y de test de rendimiento psicométrico con rifaximina |
| Sanyal A52 | EE.UU. | 2011 | 229 | 101 (1.200 mg/día) | 118 (placebo) | 6 meses | Mejoría de calidad de vida | Mejoría de calidad de vida con rifaximina |
| Bajaj JS25 | EE.UU. | 2013 | 20 | 20 (1.200 mg/día) | No control | 8 semanas | Mejoría de test cognitivos, disminución endotoxemia | Mejoría de test cognitivos y disminución de endotoxemia |
| Ahluwalia V45 | EE.UU. | 2014 | 20 | 20 (1.100 mg/día) | No control | 8 semanas | Mejoría cognitiva incluyendo la memoria y el control inhibitorio | Mejoría cognitiva incluyendo trabajos de memoria y control inhibitorio con rifaximina |
| Sharma K48 | India | 2014 | 62 | 31 (1.200 mg/día) | 31 (L-ornitina-L-aspartato) | 2 meses | Mejoría de test neuropsicométricos y frecuencia crítica de parpadeo | No diferencias significativas |
| Sharma K48 | India | 2014 | 63 | 31 (1.200 mg/día) | 32 (probiótico) | 2 meses | Mejoría de test neuropsicométricos y frecuencia crítica de parpadeo | No diferencias significativas |
| Sharma K48 | India | 2014 | 61 | 31 (1.200 mg/día) | 30 (placebo) | 2 meses | Mejoría de test neuropsicométricos y frecuencia crítica de parpadeo | Mejoría de test neuropsicométricos con rifaximina e igual eficacia en la frecuencia crítica de parpadeo |
| Zhang Y50 | China | 2015 | 26 | 26 (600 mg/día) | No control | 7 días | Reducción de amonio y mejoría de test psicométricos en pacientes con sobrecrecimiento bacteriano | Reducción de amonio plasmático y mejoría de test psicométricos |
La recomendación actual para el tratamiento de un episodio de EH sería la lactulosa o lactitol de elección, y añadir rifaximina en aquellos pacientes que no presenten respuesta a los disacáridos no absorbibles a las 24-48h2, además de corregir posibles factores desencadenantes (tabla 5).
Recomendaciones actuales de tratamiento
| Episodio agudo | • Corregir factores precipitantes • Tratamiento con disacáridos no absorbibles • Iniciar rifaximina si no mejora a las 48-72 h del inicio de tratamiento con lactulosa/lactitiol • Si el paciente previamente ya estaba con este tratamiento, iniciar rifaximina desde su ingreso |
| EH recurrente | • La prevención tras un primer episodio de EH es administrar laxantes disacáridos no absorbibles • Si estando con tratamiento con lactulosa/lactitol presenta nuevo episodio, añadir rifaximina (dosis inicial 1.200 mg/día) |
| EH Mínima | • No se recomienda tratamiento actualmente |
| Colocación DPPI | • No se recomienda profilaxis de rutina |
DPPI: derivación portosistémica percutánea intrahepática.
La EH recurrente se define como más de 2 episodios de EH en un año4.
Uno de los estudios pivotales de este fármaco se realizó en pacientes con EH recurrente24. Es un estudio aleatorizado, doble ciego y controlado con placebo durante 6meses en pacientes con CH con uso libre de disacáridos no absorbibles. En él se evidencia que la rifaximina redujo el riesgo de recurrencias de EH (22,1% vs. 45,9% en el grupo placebo) y de las hospitalizaciones relacionadas con esta descompensación, siendo un 13,6% en el grupo tratado con rifaximina frente a un 22,6% en el grupo placebo. Esta mejoría clínica también favoreció una mejor calidad de vida con un perfil de efectos secundarios comparable a placebo. Respecto al uso de disacáridos no absorbibles, prácticamente todos los pacientes, tanto en el grupo de rifaximina como en el grupo placebo, recibieron lactulosa (91,4% frente a 91,2%, respectivamente). Ahora bien, los pacientes en la práctica clínica habitualmente requieren tratamientos a más largo plazo (más allá de 6meses). Tal y como se ha descrito anteriormente, hasta ahora no había ningún estudio que valorase la administración de rifaximina de manera continuada. Recientemente se ha publicado un estudio que valora la administración de rifaximina durante una media de 24meses. En este estudio no solo se evidencia la seguridad de la administración de este fármaco (escasos efectos adversos) sino también su eficacia, valorada por el número de episodios de EH y la menor tasa de reingreso tanto por EH como por otras causas. Aunque no se mencionan los otros motivos de hospitalización (fuera de la EH), los autores postulan que el hecho de dar rifaximina y reducir la endotoxemia podría tener un papel en el descenso de las citoquinas tales como IL-6, TNF-α y óxido nítrico58, lo que conllevaría una mejor evolución clínica.
Para valorar la reproducibilidad y, por tanto, la fiabilidad de los resultados de los estudios previos, se valoró la eficacia de la administración de rifaximina en aquellos pacientes que en el estudio de rifaximina vs. placebo durante 6meses habían sido tratados con placebo. Los resultados evidenciaron que estos pacientes, al cambiar de placebo a rifaximina, presentaban un efecto protector contra la recurrencia de los episodios de EH en más del 65%14.
Una situación singular es la EH en pacientes portadores de derivación portosistémica percutánea intrahepática (DPPI). Habitualmente se utiliza el tratamiento estándar para prevenir episodios de EH tras la colocación de la derivación. No obstante, un estudio demostró que ni la administración de lactulosa ni la de rifaximina prevenían los episodios de EH post-DPPI mejor que placebo48. Desde que se realiza una mejor selección de pacientes candidatos a DPPI se ha reducido la incidencia de EH graves tras la derivación. Si esta ocurre, una opción que se ha de plantear es la reducción del diámetro del shunt, pues puede revertir la EH59.
Así pues, en la EH recurrente las recomendaciones actuales serían tras un primer episodio de EH administrar lactulosa como profilaxis de un nuevo episodio. Si, estando con este tratamiento, presenta clínica de EH es aconsejable añadir rifaximina (dosis inicial de 1.200mg/día, que se puede disminuir a 800mg/día). La profilaxis rutinaria de la EH con lactulosa o rifaximina no se recomienda tras la colocación de una DPPI2.
Rifaximina en la encefalopatía hepática mínimaLa EH mínima es aquella que condiciona un déficit neurológico o cognitivo leve y que precisa tests neuropsicológicos avanzados para detectarlos. Los estudios con rifaximina y lactulosa también han demostrado eficacia en este tipo de encefalopatía y, por lo tanto, en la calidad de vida de los pacientes52,54. Un estudio controlado aleatorizado demostró que la administración de rifaximina en pacientes con EH mejoraba de forma significativa la capacidad de conducción en un simulador cuando se comparaba con placebo51. En detalle, a las 8 semanas de iniciado el estudio los pacientes tratados con rifaximina mostraron una mejoría significativamente mayor que los que recibieron placebo en evitar los errores de conducción (76% vs. 31%, p=0,013), velocidad (81% vs. 33%, p=0,005) y giros ilegales (62% vs. 19%, p=0,01). Además, se observó una significativa mejoría tanto en el rendimiento cognitivo (91% vs. 61%, p=0,01) como en la calidad de vida (p=0,04) en los pacientes tratados con rifaximina en comparación con los controles.
Dada la variedad de métodos utilizados para definir la EH mínima, los objetivos y la corta duración de los estudios, de momento no se recomienda un tratamiento rutinario en la EH mínima.
Estudio económico sobre el uso de rifaximinaLos análisis farmacoeconómicos son siempre complejos y difíciles de evaluar, con muchas limitaciones, y además el resultado obtenido puede no ser válido en otras regiones geográficas por diferencias en el sistema sanitario, la práctica médica60 y el coste del fármaco (variaciones de un país a otro).
Una manera pragmática de abordar el tema es incluir el coste de los fármacos como un ahorro si se evitan resultados negativos, como por ejemplo la reducción de las tasas de hospitalización13. En un estudio retrospectivo con 39 pacientes se evidenció que el coste por persona y año era menor en los pacientes si recibían tratamiento con rifaximina que si recibían lactulosa46. Se ha publicado un estudio evaluando diferentes estrategias para valorar la opción más coste-eficaz en el tratamiento de la EH. Los brazos fueron: 1)no tratamiento para la EH; 2)lactulosa en monoterapia; 3)lactitol en monoterapia; 4)neomicina en monoterapia; 5)rifaximina en monoterapia, y 6)lactulosa y rifaximina de rescate si hay intolerancia o no respuesta al tratamiento. En él se demostró que la monoterapia con rifaximina no era coste-efectiva basándose en el precio. En cambio, la monoterapia con lactulosa y el tratamiento de rescate con rifaximina (administración de ambos conjuntamente) en los pacientes que no respondieron inicialmente a lactulosa se confirmó como coste-eficaz61.
Pese a que el precio de la rifaximina es mucho mayor que el de la lactulosa o el lactitol, existe evidencia que apoya el uso de rifaximina para prevenir nuevos ingresos por encefalopatía u otras complicaciones de la cirrosis. El uso de rifaximina podría suponer un ahorro en el coste sanitario de los pacientes61. Recientemente se ha publicado un análisis de coste-efectividad calculado en base al sistema sanitario de Reino Unido y utilizando un modelo de Markov; se estimó que el uso de rifaximina era coste-efectivo comparado con el tratamiento estándar a los 5años, a los 10años e incluso en caso de tratamiento de por vida60.
En los casos de EH mínima, donde las hospitalizaciones son escasas y la terapia tiene que ser potencialmente prolongada, no parece que sea coste-efectiva.
Adherencia al tratamientoDos estudios han reportado una alta adherencia al tratamiento, entre el 84 y el 92%24,51. Esta tasa se considera muy alta con relación a la descrita en algunos estudios con la utilización de lactulosa (adherencia del 54%)62. En un estudio retrospectivo en el que los pacientes recibieron rifaximina y lactulosa durante 6meses se definió «cumplimiento» como la adherencia al tratamiento de al menos el 75% de la medicación. Los resultados mostraron que el 92% de los pacientes en el grupo de rifaximina y el 31% de los pacientes en el grupo de lactulosa fueron cumplidores del tratamiento31. Los factores que podrían intervenir en una menor adherencia al tratamiento podrían ser el menor nivel de alerta, confusión, la falta de soporte social, así como una dosificación compleja63.
ConclusionesRifaximina ha demostrado que es eficaz en el tratamiento agudo de la EH así como en su prevención. Tiene una mejor tolerancia que los disacáridos no absorbibles. La rifaximina es más eficaz reduciendo los niveles de amonio en sangre, lo que conlleva un menor número y duración de las hospitalizaciones y un mayor ahorro en gastos derivados de un ingreso hospitalario. El tratamiento con disacáridos no absorbibles de base y el tratamiento de rescate con rifaximina en aquellos pacientes que no responden inicialmente a lactulosa/lactitol se han confirmado como coste-eficaces, aunque todavía quedan algunos aspectos por dilucidar. Respecto al uso de rifaximina en el tratamiento de la EH mínima, no existe una clara evidencia que lo soporte.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.