La recurrencia de la infección por Clostridium difficile (ICD) es frecuente y a menudo difícil de controlar. El trasplante de microbiota fecal (TMF) es una opción terapéutica avalada en estos casos, aunque se desconoce su aplicabilidad y efectividad en nuestro medio.
ObjetivosAnalizar los aspectos técnicos, seguridad y efectividad del primer programa consolidado de TMF en España.
MétodosEstudio retrospectivo descriptivo de todos los pacientes con ICD recurrente tratados mediante TMF por colonoscopia en un hospital de tercer nivel tras la implantación de un protocolo multidisciplinar entre marzo de 2015 y septiembre 2016.
ResultadosSe realizaron 13 TMF en 12 pacientes (11/12; 91,7% mujeres) con una mediana de edad de 84,6 años (rango: 38,2-98,2). En todos los casos la indicación fue la recurrencia de la ICD. Los pacientes habían presentado una mediana de 3 episodios previos de ICD (rango: 2-6) y en todos había fracasado el tratamiento con fidaxomicina. Todos los procedimientos se realizaron mediante colonoscopia. La efectividad con una sesión de TMF fue del 91,7% (11/12; IC 95%: 64,6-98,5%). En la paciente no respondedora se realizó un segundo TMF a los 17 días con desaparición de la sintomatología. No se registraron efectos adversos secundarios al procedimiento endoscópico ni al TMF tras una mediana de seguimiento de 6,5 meses (rango: 1-16 meses). Dos pacientes fallecieron durante el seguimiento por causas no relacionadas con el TMF.
ConclusionesEl TMF por colonoscopia es una alternativa terapéutica efectiva y segura en la recurrencia de la ICD. Se trata de un procedimiento sencillo que debería implementarse en más centros en nuestro entorno.
Recurrent Clostridium difficile infection (CDI) is common and often difficult to manage. Faecal microbiota transplant (FMT) is an effective therapeutic tool in these cases, although its applicability and effectiveness in Spain is currently unknown.
AimTo analyse the technical aspects, safety and effectiveness of the first consolidated FMT programme in Spain.
MethodsRetrospective descriptive study of all patients with recurrent CDI treated with FMT performed by colonoscopy in a tertiary centre after the implementation of a multidisciplinary protocol between March 2015 and September 2016.
ResultsA total of 13 FMT were performed in 12 patients (11/12; 91.7% women) with a median age of 84.6 years (range: 38.2-98.2). Recurrence of CDI was the indication for FMT in all cases. Patients had suffered a median of 3 previous episodes of CDI (range: 2-6) and all had failed treatment with fidaxomicin. All procedures were performed by colonoscopy. Effectiveness with one session of FMT was 91.7% (11/12; 95% CI: 64.6 to 98.5%). In the non-responder patient, a second FMT was performed 17 days after the first procedure, with disappearance of symptoms. No side effects related to the endoscopic procedure or the FMT were recorded after a median follow-up of 6.5 months (range: 1-16 months). Two patients died during follow-up due to causes unrelated to FMT.
ConclusionFMT by colonoscopy is an effective and safe therapeutic alternative in recurrent CDI. It is a simple procedure that should be implemented in more centres in Spain.
Clostridium difficile (CD) es la primera causa de diarrea nosocomial en el mundo occidental y se asocia a una elevada morbimortalidad y consumo de recursos sanitarios1. El tratamiento clásico se basa en la retirada del antibiótico desencadenante y el empleo de metronidazol, vancomicina o, más recientemente, fidaxomicina. A pesar de ello, un número significativo de pacientes no responden al tratamiento inicial o sufren una recurrencia (2-38%) en las primeras 8 semanas2.
En el año 1958 Eiseman et al. publicaron una serie de 4 casos de enterocolitis seudomembranosa tratados exitosamente con enemas de material fecal3. Este abordaje de la enfermedad, conceptualmente desafiante con la visión vigente en aquella época de la microbiota como un elemento nocivo, cayó en el olvido de la comunidad científica durante más de medio siglo. No ha sido hasta la última década, y especialmente durante el último lustro, cuando el trasplante de microbiota fecal (TMF) se ha posicionado como una de las terapias con mayor interés teórico y práctico en el ámbito de la Gastroenterología, los procesos autoinmunes y las enfermedades metabólicas. Las guías de práctica clínica ya incluyen esta modalidad terapéutica como una alternativa en casos de recurrencias múltiples de infección por CD (ICD) y se dispone de ensayos clínicos sobre su eficacia en enfermedad inflamatoria intestinal4–6. En el año 2013, ante la aparición de los primeros ensayos de TMF en la ICD, diseñamos un programa multidisciplinar (Servicio de Gastroenterología y Hepatología, Servicio de Microbiología y Servicio de Enfermedades Infecciosas) en nuestro centro. Hasta la fecha, no existen datos que evalúen los resultados del TMF en nuestro país. El objetivo de este trabajo es analizar la efectividad y seguridad del TMF tras la implantación de este programa.
Material y métodosDiseño y población del estudioEstudio descriptivo retrospectivo en el que se presentan todos los casos de TMF realizados para el tratamiento de la ICD recurrente en el Hospital Universitario Ramón y Cajal de Madrid (España) entre marzo de 2015 y septiembre de 2016. El éxito del TMF se ha definido como la ausencia de diarrea (3 o más deposiciones al día) en las 8 semanas posteriores al procedimiento.
Recogida de datosSe recogieron de la historia clínica y de la base de datos electrónica de la Unidad de Endoscopias (Endobase, Olympus®) variables demográficas, clínicas, analíticas, microbiológicas y endoscópicas mediante un cuaderno de recogida de datos específicamente diseñado con 48 ítems. El seguimiento de los pacientes se ha completado mediante entrevista telefónica y mediante el sistema de información sanitaria Horus que permite visualizar las consultas y sus motivos en atención primaria.
Descripción del protocolo del trasplante de microbiota fecalIndicación del trasplante de microbiota fecal (receptor)El Servicio de Enfermedades Infecciosas es el principal responsable del manejo clínico de los pacientes con ICD, y el que habitualmente establece la indicación de TMF. Puesto que fidaxomicina se emplea en los pacientes con elevado riesgo de recurrencia o recurrencias múltiples, se considera candidato potencial a TMF a cualquier paciente que reciba este fármaco (tabla 1). Si el paciente acepta este tratamiento se le remite a la Consulta de Gastroenterología para la selección del donante. En el caso de recurrencia de la ICD confirmada microbiológicamente tras el tratamiento con fidaxomicina el paciente es tratado con vancomicina y se programa la colonoscopia para el TMF, suspendiendo la vancomicina 2 días antes.
Criterios de selección y datos a recoger del receptor de TMF
| Datos a recoger en la historia clínica | Criterios de inclusión |
| Enfermedad actual por CD: número de deposiciones diarias, otros síntomas, criterios de gravedad clínicos y analíticos | Firma del consentimiento informado por parte del paciente o de su representante legal |
| Episodios previos de enfermedad por CD: número, tratamiento recibido y gravedad de los mismos | Edad superior a 18 años |
| Constantes vitales: tensión arterial, frecuencia cardiaca, temperatura axilar, frecuencia respiratoria, saturación de oxígeno | Segunda recidiva (tercer episodio) de la enfermedad por CD tras tratamiento adecuado de los episodios previos |
| Peso, talla e IMC | Criterios de exclusión |
| Antecedentes médicos, incluyendo hábitos tóxicos, hábitos sexuales y conductas de riesgo para la transmisión de infecciones | Pacientes en tratamiento inmunosupresor: corticoesteroides a altas dosis, inhibidores de la calcineurina, fármacos biológicos, quimioterapia con recuento de neutrófilos<500 |
| Antecedentes quirúrgicos | Cirrosis hepática descompensada, VIH en estadio C, trasplante de progenitores hematopoyéticos y otras causas de inmunodeficiencia grave |
| Antecedentes vacunales | Pacientes terminales (expectativa de vida<2 meses) |
| Alergias a medicamentos y alimentos | |
| Viajes recientes: país, región (rural o urbana), tiempo de estancia, dieta, actividades, etc. | |
| Embarazos, transfusiones, trasplantes u otras situaciones con riesgo de aloinmunización | |
| Tratamiento médico habitual y el esporádico en los últimos 3 meses (especialmente IBP y antibióticos) | |
| Antecedentes familiares relevantes | |
| Dieta habitual | |
| Exploración física completa |
CD: Clostridium difficile; IBP: inhibidores de la bomba de protones; IMC: índice de masa corporal; TMF: trasplante de microbiota fecal; VIH: virus de la inmunodeficiencia humana.
El Servicio de Gastroenterología y Hepatología es el responsable del estudio ambulatorio de los potenciales donantes (tabla 2). En primer lugar se le entrega el consentimiento informado y, tras su firma, se procede a realizar una anamnesis general, exploración clínica y un cuestionario específicamente diseñado (tabla 3). Si tras esta evaluación inicial no existe una contraindicación se obtienen muestras de sangre y heces (tabla 4). El estudio predonación se considera válido durante un periodo de 3 meses desde la primera visita. Se instruye al donante que, si cambia su situación clínica o epidemiológica de forma relevante hasta el día del procedimiento, avise al médico responsable del TMF y lo ponga en su conocimiento. En la mañana del procedimiento, el donante debe aportar en el laboratorio de Microbiología una deposición completa lo más reciente posible. Es preferible que el TMF se realice en las primeras 6h desde la defecación, no siendo recomendable la utilización de muestras de más de 24h7. Se debe interrogar al donante en ese momento si en los días previos ha presentado algún síntoma de infección (fiebre, diarrea, vómitos, dolor abdominal), si ha consumido en los últimos 5 días alimentos a los que el receptor sea alérgico (conocido o sospechado) o si ha tomado recientemente algún fármaco que pueda influir en la composición de la microbiota (fundamentalmente antibióticos); en cuyo caso la donación no sería válida y el procedimiento debería suspenderse.
Criterios de inclusión y de exclusión del donante
| Criterios de exclusión | Criterios de inclusión |
|---|---|
| Incapacidad legal para otorgar el consentimiento informado | Firma del consentimiento informado |
| Enfermedades infecciosas potencialmente transmisibles | Edad de 18 a 65 años |
| Trabajadores sanitarios | IMC entre 18 y 35kg/m2 |
| Contactos o conductas de riesgo en los últimos 12 meses | Buen estado general de salud (ECOG 0) |
| Tatuajes o piercing en los últimos 6 meses | |
| Viaje en el último año a países con enfermedades diarreicas endémicas o con alto riesgo de diarrea del viajero (según OMS) | |
| Uso de antibióticos, IBP o fármacos inmunosupresores en los últimos 3 meses | |
| Consumidor de más de 28UBE semanales | |
| Consumo de drogas ilícitas | |
| Diarrea aguda o crónica | |
| Estreñimiento (criterios Roma III) | |
| Cirugía mayor en el aparato digestivo, excluyendo apendicectomía | |
| Proceso oncológico activo o historia de cáncer en los últimos 10 años | |
| Enfermedad inflamatoria intestinal | |
| SII o dispepsia funcional (criterios Roma III) | |
| Hepatopatía o enfermedad renal crónicas | |
| Enfermedades autoinmunes y sistémicas | |
| Síndrome metabólico (criterios ATP III) | |
| Enfermedad neuropsiquiátrica | |
| Enfermedad vascular significativa |
ATP: Adult Treatment Panel; ECOG: Eastern Cooperative Oncology Group; IBP: inhibidores de la bomba de protones; IMC: índice de masa corporal; OMS: Organización Mundial de la Salud; SII: síndrome del intestino irritable; UBE: unidades de bebida estándar.
Cuestionario para la selección de donantes
| Como usted sabe, puede que sea seleccionado para actuar como donante en un trasplante de microbiota fecal. Es de vital importancia que conteste con veracidad y sinceridad a las preguntas que se le van a formular a continuación |
| ¿Padece o ha padecido alguna enfermedad importante (del corazón, pulmones, riñones, hígado, neurológica, del tubo digestivo, etc.)? ¿Y en la infancia? ¿Ha recibido adecuadamente todas las vacunas del calendario vacunal? |
| ¿Está en seguimiento por algún médico especialista por algún problema de salud o ha estado ingresado en un hospital alguna vez? |
| ¿Ha sido vacunado recientemente contra la poliomielitis o ha recibido recientemente cualquier otra vacuna que se administre por vía oral? |
| ¿Ha recibido cualquier otro tipo de vacuna recientemente? |
| ¿Le han operado de algo alguna vez? |
| ¿Es alérgico a algún medicamento o alimento? |
| ¿Ha tomado en los últimos 3 meses algún antibiótico u otro medicamento para tratar infecciones? |
| ¿Ha tomado en los últimos 3 meses algún medicamento inmunosupresor como los corticoesteroides? |
| ¿Ha tomado en los últimos 3 meses algún medicamento supresor del ácido gástrico («protector de estómago») como el omeprazol? |
| Por favor, indique los medicamentos que toma de forma habitual y los que ha tomado de forma esporádica recientemente |
| ¿Ha recibido alguna vez alguna transfusión de sangre o de productos derivados de la sangre? |
| ¿Ha recibido alguna vez algún injerto de tejidos, órganos o médula ósea? |
| ¿Ha recibido algún injerto de piel o hueso? |
| ¿Ha recibido alguna vez un injerto de duramadre (meninge que cubre el cerebro)? |
| ¿Ha estado en contacto con la sangre de otra persona o se ha pinchado con algún material cortante o punzante que pudiera estar contaminado con la sangre o fluidos de otra persona? |
| ¿Ha tenido contacto sexual con alguna persona con VIH o sida? |
| ¿Ha tenido contacto sexual con alguna persona que reciba dinero o drogas como pago por el sexo? |
| Ha tenido contacto sexual con alguien que tenga hemofilia o haya utilizado concentrados de los factores de la coagulación? |
| ¿Ha tenido contacto sexual con personas con hepatitis? |
| ¿Ha tenido múltiples parejas sexuales durante los últimos meses? |
| ¿Ha tenido contacto sexual con alguien que haya recibido tratamiento para la sífilis o la gonorrea? |
| ¿Vive con una persona que tenga VIH/sida o hepatitis? |
| ¿Alguna vez ha practicado sexo por dinero, drogas u otros objetos? |
| ¿Consume o ha consumido alguna droga ilícita por vía intravenosa, inhalada, esnifada o por cualquier otra vía? |
| ¿Bebe alcohol de forma habitual? ¿Fuma? ¿Cuánto? |
| Si es mujer, ¿existen posibilidades de que esté embarazada? |
| ¿Se ha hecho algún tatuaje, piercing, acupuntura o cualquier otro procedimiento donde se utilicen agujas en la piel? ¿Cuándo y dónde? |
| ¿Ha utilizado agujas para inyectarse drogas, esteroides o cualquier otra sustancia ilícita o no prescrita por su médico? |
| ¿Ha estado fuera de España en los 3 últimos años? Comente con su médico los viajes y las actividades que realizó. |
| Entre 1980 y 1996 ¿Estuvo durante más de 3 meses en el Reino Unido? |
| ¿Alguna vez ha padecido malaria, enfermedad de Chagas o babesiosis? (son parásitos que afectan a la sangre) |
| ¿Alguno de sus parientes padece la enfermedad de Creutzfeldt-Jackob (¿enfermedad de las «vacas locas»? |
VIH: virus de la inmunodeficiencia humana.
Estudios realizados al donante
| Estudios en sangre | Estudios en heces |
|---|---|
| Hemograma | Estudio de larvas y huevos de parásitos en heces (3 muestras) |
| Bioquímica: iones, función renal, perfil hepático, urea, calcio, magnesio, fósforo, lípidos en plasma y TSH | Coprocultivo |
| Inmunoglobulinas séricas | Antígeno de Giardia lamblia |
| Estudio de hemostasia | GDH y toxinas A y B de CD |
| Serología viral: VIH, VHB, VHC, VHA, VHE, HTLV 1 y 2, sífilis, CMVa y VEBa | Tinción de Kinyoun |
| Detección por PCR de ácidos nucleicos: VIH y VHB |
CD: Clostridium difficile; CMV: citomegalovirus; GDH: glutamato deshidrogenasa; HTLV: virus linfotropo de células T humanas; PCR: reacción en cadena de la polimerasa; TSH: hormona estimulante de la tiroides; VEB: virus de Epstein-Barr; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VHE: virus de la hepatitis E; VIH: virus de la inmunodeficiencia humana.
El procesamiento y análisis de las heces de donante y receptor es llevado a cabo por el Servicio de Microbiología. Las muestras deben ser manejadas siempre en el laboratorio, bajo una campana de flujo laminar y con equipos de protección individual por contacto (nivel 2 de bioseguridad) que incluyan delantal, guantes, mascarilla y protector ocular. Para la obtención de la solución de microbiota se solubilizan 100g de material fecal con 500ml de suero salino fisiológico (ClNa 0,9%) con una batidora destinada exclusivamente para el TMF. Una vez obtenida la solución homogénea se centrifuga para depositar la fibra y las partes insolubles, y se recoge el sobrenadante en 10 jeringuillas de 50ml de cono estrecho aptas para el colonoscopio. El procesamiento de la muestra debe coordinarse con la Unidad de Endoscopias, para comenzar la preparación unos 30min antes de la colonoscopia y evitar que la muestra se quede mucho tiempo sin refrigeración, ya que una vez preparadas se conservan a temperatura ambiente para evitar la hipotermia durante la instilación.
Procedimiento endoscópicoLa preparación para la colonoscopia se realiza con solución evacuante de polietilenglicol 4l, con dosis fraccionada, comenzando la tarde previa al TMF. En los pacientes que presenten un peor estado general o comorbilidad significativa se contempla la posibilidad de utilizar soluciones de preparación de menor volumen o realizar la preparación en régimen de hospitalización.
Durante la colonoscopia, todo el personal implicado está equipado con medidas de protección por contacto. Los procedimientos se realizan con sedación como norma general (bien por un anestesiólogo, bien por un endoscopista, en función de las características del paciente). La colonoscopia se realiza con mínima insuflación a la entrada, al llegar al ciego se obtienen 2 biopsias de ciego para estudio microbiológico. Una vez alcanzado el ciego, se procede a iniciar la instilación del TMF a través del canal de trabajo del colonoscopio siguiendo el siguiente esquema en retirada: 350ml de solución fecal en el colon derecho, 100ml en el colon transverso y los 50ml restantes en el colon izquierdo. Durante la extracción del endoscopio se debe evitar la aspiración para evitar la retirada del material trasplantado.
Una vez finalizado el procedimiento y una vez recuperado el paciente de la sedación, se le administran 2mg de loperamida por vía oral y se le instruye para que intente retener la solución administrada la mayor cantidad de tiempo posible (idealmente durante al menos 4-6h). Posteriormente debe guardar reposo en cama durante 24h pudiendo reanudar una dieta ajustada a su situación clínica, sin otras restricciones, a las 6h del procedimiento.
Análisis estadísticoEl análisis estadístico se ha llevado a cabo con el programa Stata versión 14.0 (StataCorp®, Texas, EE. UU.). Los datos cuantitativos se presentan utilizando la mediana como medida de tendencia central y el rango como medida de dispersión debido a la marcada asimetría de las distribuciones. Los datos cualitativos se presentan en forma de frecuencias absolutas y relativas. El éxito clínico se ha definido como una variable dicotómica y su intervalo de confianza al 95% se ha estimado con el método de Wilson. No se han realizado pruebas de significación ni estimación del tamaño muestral por el diseño del estudio.
Aspectos éticosAnte la falta de regulación nacional o europea para este procedimiento, y una vez consultados el Comité de Ensayos Clínicos y el Comité Ético Asistencial local, además de la Organización Nacional de Trasplantes, se dio comienzo al programa con una autorización específica de la dirección del centro. El estudio ha sido aprobado por el Comité de Ética e Investigación Clínica (CEIC) del Hospital Ramón y Cajal. Todos los donantes y receptores firmaron el consentimiento informado para la realización del procedimiento.
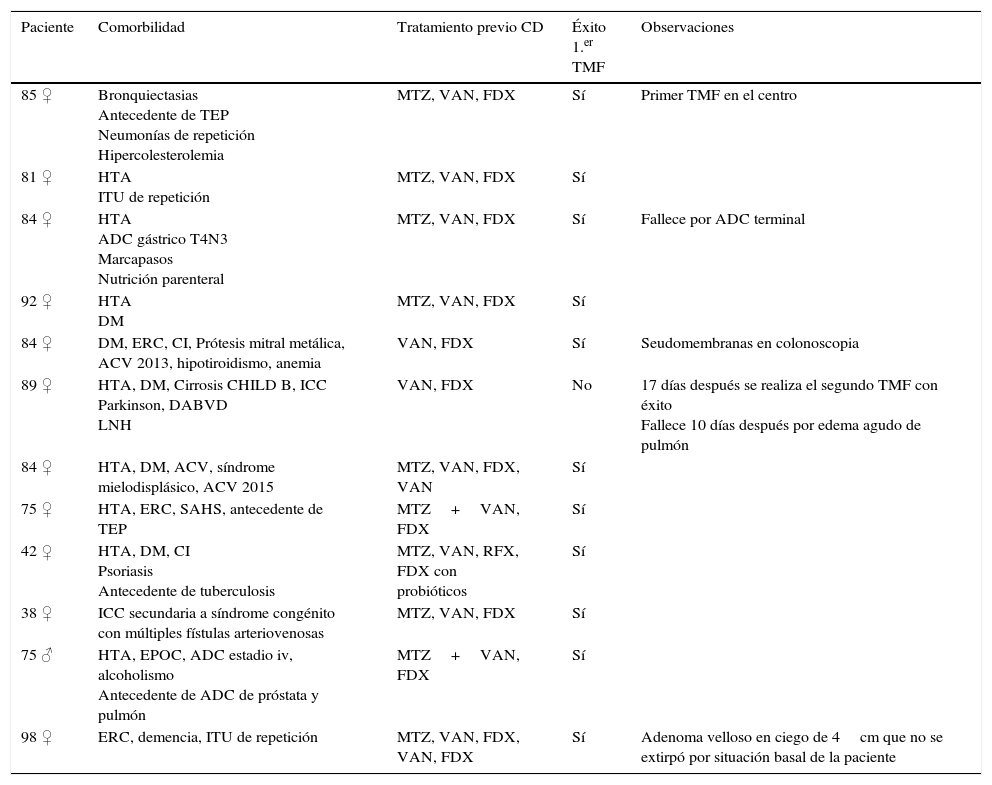
ResultadosSe estudiaron un total de 16 donantes con una mediana de un donante (rango: 0-2) por cada receptor; en 11 (84,6%) casos el donante estaba emparentado. Se realizaron un total de 13 TMF a 12 pacientes con una mediana de edad de 84,6 años (rango: 38,2-98,2), 11 (91,7%) de ellos mujeres (tabla 5). Una paciente hinduista rechazó el TMF por motivos religiosos. Cuatro pacientes no pertenecían a nuestra institución y fueron referidos a nuestro centro para el procedimiento. La indicación en todos los casos fue la recurrencia múltiple de la ICD. Ningún paciente recibía inmunosupresores. Todos los pacientes habían recibido previamente fidaxomicina. La mediana de episodios previos al TMF fue de 3 (rango: 2-6) con una mediana de 68,5 días (rango: 24-306) entre el inicio del primer episodio de ICD y el primer TMF. Veinticuatro horas antes del TMF la mediana de deposiciones al día era de 3,5 (rango: 2-12), en 2 sujetos las heces eran sanguinolentas, 7 presentaban dolor abdominal y 2 náuseas. Todos los procedimientos se realizaron mediante colonoscopia lográndose intubar el ciego en 9 (69,2%), alcanzar el colon ascendente proximal en 3 pacientes y en un caso únicamente se accedió hasta el sigma. Se utilizaron 500ml de solución fecal filtrada en todos los casos; instilando 350ml en ciego y colon derecho, 100ml en transverso y 50ml en colon descendente en 12 TMF; en uno se inyectó toda la solución en sigma y recto. En 5 TMF la sedación fue realizada por el endoscopista, en 7 por un anestesiólogo y un paciente no recibió sedación. Once de los sujetos fueron preparados con 4l de solución evacuante de polietilenglicol, una paciente recibió solo 2l de polietilenglicol por su comorbilidad de base (insuficiencia cardiaca crónica y cirrosis hepática). Como hallazgos incidentales durante la endoscopia se objetivaron: divertículos no complicados en 3 pacientes (25%), eritema y edema en 2 (16,6%), seudomembranas en uno, un adenoma de aspecto velloso en ciego de 4cm y un pólipo pediculado de 1cm en recto.
Características de los pacientes
| Paciente | Comorbilidad | Tratamiento previo CD | Éxito 1.er TMF | Observaciones |
|---|---|---|---|---|
| 85 ♀ | Bronquiectasias Antecedente de TEP Neumonías de repetición Hipercolesterolemia | MTZ, VAN, FDX | Sí | Primer TMF en el centro |
| 81 ♀ | HTA ITU de repetición | MTZ, VAN, FDX | Sí | |
| 84 ♀ | HTA ADC gástrico T4N3 Marcapasos Nutrición parenteral | MTZ, VAN, FDX | Sí | Fallece por ADC terminal |
| 92 ♀ | HTA DM | MTZ, VAN, FDX | Sí | |
| 84 ♀ | DM, ERC, CI, Prótesis mitral metálica, ACV 2013, hipotiroidismo, anemia | VAN, FDX | Sí | Seudomembranas en colonoscopia |
| 89 ♀ | HTA, DM, Cirrosis CHILD B, ICC Parkinson, DABVD LNH | VAN, FDX | No | 17 días después se realiza el segundo TMF con éxito Fallece 10 días después por edema agudo de pulmón |
| 84 ♀ | HTA, DM, ACV, síndrome mielodisplásico, ACV 2015 | MTZ, VAN, FDX, VAN | Sí | |
| 75 ♀ | HTA, ERC, SAHS, antecedente de TEP | MTZ+VAN, FDX | Sí | |
| 42 ♀ | HTA, DM, CI Psoriasis Antecedente de tuberculosis | MTZ, VAN, RFX, FDX con probióticos | Sí | |
| 38 ♀ | ICC secundaria a síndrome congénito con múltiples fístulas arteriovenosas | MTZ, VAN, FDX | Sí | |
| 75 ♂ | HTA, EPOC, ADC estadio iv, alcoholismo Antecedente de ADC de próstata y pulmón | MTZ+VAN, FDX | Sí | |
| 98 ♀ | ERC, demencia, ITU de repetición | MTZ, VAN, FDX, VAN, FDX | Sí | Adenoma velloso en ciego de 4cm que no se extirpó por situación basal de la paciente |
ACV: accidente cerebrovascular; ADC: adenocarcinoma; CD: Clostridium difficile; CI: cardiopatía isquémica; DABVD: dependiente para las actividades básicas de la vida diaria; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FDX: fidaxomicina; HTA: hipertensión arterial; ICC: insuficiencia cardiaca congestiva; ITU: infecciones del tracto urinario; LNH: linfoma no hodgkiniano; MTZ: metronidazol; RFX: rifaximina; SAHS: síndrome de apneas-hipoapneas del sueño;, TEP: tromboembolismo pulmonar; TMF: trasplante de microbiota fecal; VAN: vancomicina.
Se realizaron en régimen de hospitalización 12/13 (92,3%) TMF con una mediana de hospitalización post-TMF de 2,5 días (rango: 0-8), ningún paciente precisó traslado a la Unidad de Cuidados Intensivos. A las 48h del TMF la sintomatología de todos los sujetos había remitido con una mediana de una deposición diaria (rango:0-2). La efectividad con una sesión de TMF fue del 91,7% (11/12; IC 95%: 64,6-98,5%). En la paciente no respondedora, en la que únicamente se alcanzó el sigma en la colonoscopia, se llevó a cabo un segundo TMF con heces de la misma donante a los 17 días con desaparición de los síntomas. No se registraron efectos adversos secundarios al procedimiento endoscópico ni al TMF tras una mediana de seguimiento de 6,5 meses (rango: 1-16 meses). Dos pacientes fallecieron durante el seguimiento por causas no relacionadas con el TMF (adenocarcinoma gástrico terminal y edema agudo de pulmón). Una paciente procedente de otra comunidad autónoma presentó una diarrea leve tras la toma de antibióticos a los 3 meses del TMF que fue tratada por sus médicos con vancomicina. Durante el seguimiento posterior no ha vuelto a presentar diarrea.
DiscusiónEstudios recientes demuestran que la recurrencia de la ICD se asocia a elevados costes, reingresos hospitalarios e incluso mayor mortalidad8,9. Aunque fidaxomicina es superior a los tratamientos clásicos algunos pacientes presentan recurrencias, especialmente cuando se emplea en pacientes con recurrencias múltiples10. El TMF constituye una alternativa excelente en esta situación, sin embargo, actualmente no existen datos publicados de su efectividad en nuestro país.
El primer eslabón del TMF es el donante de microbiota; aún existe mucha controversia sobre cuál es el cribado más eficiente y qué grado de parentesco debe guardar con el receptor. En nuestro protocolo los criterios de inclusión y exclusión se basan principalmente en la revisión de Bakken et al. (tablas 2 y 3); si bien son bastante restrictivos, consideramos que esta actitud se justifica por el riesgo de transmisión de patógenos y la disponibilidad ilimitada de donantes7. En nuestro estudio, 11 de 13 TMF se realizaron con donantes emparentados. Estos tienen la ventaja de una mayor accesibilidad y de compartir factores de riesgo ambientales, lo cual podría minimizar el riesgo de transmisión de infecciones7. No obstante, un metaanálisis que incluyó a 273 pacientes no observó diferencias estadísticamente significativas en la tasa de resolución clínica entre donantes anónimos y relacionados con el receptor11.
En todos nuestros pacientes se utilizaron heces frescas por ser el método de elección cuando se diseñó el protocolo, pero se ha demostrado que se pueden almacenar congeladas a −80°C hasta 6 meses sin pérdida de viabilidad12. De hecho, recientemente Lee et al. han publicado un ensayo clínico con 219 pacientes en el que encontraron que el rendimiento del material fecal congelado es no inferior al de muestras frescas13. Las heces congeladas permiten reducir el coste dado que se puede realizar más de un trasplante con el mismo donante. Además, facilita el TMF en pacientes sin familia o sin donantes accesibles o adecuados. Respecto al volumen de heces, se administraron 500ml de solución de microbiota en todos los pacientes. Esta decisión se basó en la revisión sistemática de Gough et al. donde la tasa de resolución de ICD se asoció de forma directamente proporcional al volumen infundido (97% con>500ml frente al 80% si<200ml)14. Además, esta revisión encontró que la recurrencia fue 4 veces más frecuente cuando el peso de las heces era<50g; motivo por el cual en nuestro protocolo se utilizaron 100g14.
Los enemas fueron inicialmente empleados hasta que en 1991 se incorporó la vía duodenal y posteriormente en el año 2000 la colonoscopia, que se ha convertido en la más utilizada en la actualidad6,15,16. A pesar de que a día de hoy la ruta óptima no está claramente establecida dado que no se dispone de estudios comparativos específicamente diseñados para este fin, la colonoscopia nos parece la mejor opción por haber mostrado un mayor éxito terapéutico frente a la vía alta en varias revisiones sistemáticas (89-92% versus 76-82%), así como por una teórica mejor aceptación por parte del paciente11,14. Asimismo, la colonoscopia permite instilar la solución en todo el colon e incluso en íleon terminal, a diferencia de los enemas que únicamente alcanzan el ángulo esplénico por lo que hipotéticamente podrían ser menos eficaces. La colonoscopia ofrece además la posibilidad de visualizar la mucosa colónica y de esta forma valorar la gravedad de la enfermedad, obtener muestras histológicas y valorar la presencia de enfermedad concomitante. En nuestra serie, la mucosa presentaba un aspecto normal en todos los pacientes excepto en 3 (23%) en los que se evidenciaron hallazgos relacionados con la ICD; además se detectaron 2 lesiones preneoplásicas, hallazgos similares a lo descrito en series previas17,18.
Es importante resaltar que cuando se opta por la colonoscopia se deben extremar las precauciones durante el procedimiento utilizando mínima insuflación y no forzando el paso por ángulos difíciles, lo que explica la baja tasa de intubación cecal en nuestra serie. En cuanto a la necesidad de preparación previa a la colonoscopia, el uso de soluciones evacuantes parece reducir la densidad de bacterias de CD e incluso de sus esporas, por lo que los expertos recomiendan su uso el día previo a la realización del TMF independientemente de la vía de administración empleada19.
Los receptores del TMF para la ICD suelen ser pacientes frágiles, de edad avanzada y con múltiples comorbilidades, características que reunían la mayoría de los pacientes tratados en nuestro centro (tabla 5)16,20. No se realizó ningún TMF en pacientes que recibieran inmunosupresores por ser un criterio de exclusión en el protocolo inicial. No obstante, es probable que deba modificarse este criterio ya que diversos grupos de trabajo han comunicado resultados favorables sin un incremento del riesgo de eventos infecciosos21,22.
Con relación a la definición de recurrencia y curación de la infección, existe una gran heterogeneidad en los distintos estudios, lo que explica parte de la variabilidad en las tasas de éxito publicadas. La mayoría de los trabajos basan la definición de curación en criterios exclusivamente clínicos (desaparición de la diarrea) con intervalos que van desde una semana hasta 6 meses16. En el presente estudio hemos definido curación como la ausencia de diarrea en las primeras 8 semanas post-TMF, en consonancia con las recomendaciones del Colegio Americano de Gastroenterología (ACG) y la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID)2,6. El éxito clínico con un procedimiento fue del 91,7% (IC 95%: 64,6-98,5%), siendo necesario un segundo TMF en un caso por recurrencia de la infección tras el primer TMF. Estos resultados positivos son concordantes con los obtenidos en ensayos clínicos y estudios no controlados16,18,23.
Actualmente, no existe suficiente evidencia para determinar el número o la frecuencia de infusiones necesarias. En la revisión sistemática de 2016 de Chapman et al. el número de TMF por paciente osciló entre 1 y 10, siendo la causa más frecuente de repetición del procedimiento la recurrencia de la infección16. En otra revisión sistemática con 801 casos de TMF con diversas indicaciones, el 83,3% de los pacientes recibieron una única instilación15.
En nuestro estudio solo un procedimiento se realizó ambulatoriamente por la fragilidad de los sujetos tratados. En un futuro, si las indicaciones de TMF se amplían o si se prioriza su uso en la escala terapéutica de la ICD, es esperable que una parte importante de los procedimientos se puedan realizar de forma ambulatoria.
En términos generales, los efectos adversos del TMF son escasos, leves y transitorios. El sesgo de publicación, el carácter retrospectivo de muchas de las series y la escasez de datos a largo plazo obligan a interpretar con cautela la información disponible. A pesar del estricto cribado de los donantes, existe el riesgo potencial de trasmisión de patógenos; de hecho, se han notificado 2 casos de gastroenteritis aguda por Norovirus post-TMF24. En los primeros días los efectos adversos más habituales son el dolor abdominal, náuseas, vómitos, sensación de hinchazón, diarrea y flatulencia. Otros efectos secundarios descritos son el estreñimiento, vómitos, prurito, parestesias, clínica catarral, cefalea, aparición de ampollas en la lengua y fiebre pasajera25. En nuestra serie no se han registrado efectos adversos a corto ni medio plazo, aunque es posible que síntomas menores (náuseas, malestar abdominal, etc.) hayan pasado desapercibidos por su carácter retrospectivo. Dos pacientes fallecieron durante el seguimiento, una por un adenocarcinoma gástrico terminal y otra por un cuadro de edema agudo de pulmón 10 días después del segundo TMF. Aunque se podría hipotetizar sobre una posible asociación entre la preparación de la colonoscopia y este último fallecimiento, consideramos que esta opción es muy poco probable ya que la paciente fue dada de alta 5 días después de la colonoscopia encontrándose estable desde el punto de vista cardiorrespiratorio, se utilizó una preparación de bajo volumen y en sus antecedentes figuraban múltiples ingresos por descompensaciones de su insuficiencia cardiaca crónica (tabla 5). Hasta el momento, con más de 1.000 casos publicados en la literatura, no existe ningún fallecimiento con una relación causal directa con el TMF.
Desde el punto de vista económico, merece la pena resaltar que la puesta en marcha del TMF en el centro no supuso a priori un aumento del gasto para el sistema, utilizándose recursos humanos y materiales ya disponibles para la actividad asistencial habitual y que se encuentran al alcance de cualquier hospital de tercer nivel. De hecho, existen varios estudios que avalan su eficiencia26,27.
Las principales limitaciones de este trabajo son su pequeño tamaño muestral, la heterogeneidad de los sujetos incluidos y la recogida retrospectiva de la información. Aun así, consideramos que es válido como prueba de concepto de la aplicabilidad y efectividad del TMF en nuestro entorno.
Los principales retos futuros del TMF son la estandarización y simplificación de sus pasos, verificar si es posible aislar las subpoblaciones de microbiota que realmente tienen poder terapéutico, mejorar el conocimiento de sus efectos a largo plazo, conocer su efectividad en casos refractarios de ICD y definir su verdadera utilidad en otras enfermedades. Actualmente están en marcha ensayos clínicos en enfermedad inflamatoria intestinal, encefalopatía hepática, colangitis esclerosante primaria, pancreatitis aguda, síndrome del intestino irritable, estreñimiento, esteatohepatitis no alcohólica, síndrome metabólico, erradicación de bacterias multirresistentes en portadores rectales, VIH y epilepsia28,29.
ConclusionesLos resultados obtenidos en nuestro centro proporcionan una prueba más de la efectividad y seguridad del TMF por colonoscopia en la ICD recurrente. Se trata de un procedimiento sencillo, avalado por la evidencia científica y cuya realización es factible en nuestro medio mediante un trabajo que requiere de un equipo interdisciplinar. Su uso, más allá del valor como herramienta de investigación que pueda tener, responde a una necesidad asistencial actual y creciente. En consecuencia, consideramos que debería promoverse su implementación en otros centros de tercer nivel para facilitar su accesibilidad, permitir la centralización de las tareas y favorecer la conformación regional de bancos de microbiota que contribuirían a optimizar el procedimiento.
Conflicto de interesesNinguno.