El cáncer colorrectal constituye un problema de salud importante. Se ha demostrado una mejoría de la supervivencia mediante la realización de colonoscopias de cribado y la extirpación de sus lesiones precursoras, los pólipos. Sin embargo, la colonoscopia no es infalible y se han propuesto múltiples estrategias dirigidas a mejorar la calidad de la misma. En esta revisión se describen los sistemas endoscópicos de que disponemos para mejorar la detección y caracterización de los pólipos, las diferentes clasificaciones utilizadas para la predicción histológica y las indicaciones actuales de las técnicas de diagnóstico endoscópico avanzado.
Colorectal cancer is a major health problem. An improvement to its survival has been demonstrated by performing colonoscopy screenings and removing its precursor lesions: polyps. However, colonoscopy is not infallible and multiple strategies have been proposed aimed at improving the quality thereof. This report describes the endoscopic systems available to improve the detection and characterization of polyps, the different classifications for histological prediction and the current indications of advanced endoscopic diagnostic techniques.
La realización de colonoscopias de cribado de cáncer colorrectal (CCR) y la extirpación de pólipos ha demostrado una mejoría de la supervivencia de este cáncer1. Sin embargo, la consecuencia directa de la implantación de los programas de cribado ha sido el aumento exponencial del número de colonoscopias y la saturación de las Unidades de Endoscopia y Anatomía Patológica.
Debido al bajo riesgo de histología avanzada o invasiva de la mayoría de los pólipos resecados en la práctica diaria, se ha postulado que muchos no necesitan evaluación patológica (estrategia de «resecar y descartar»)2. Además, evitar las polipectomías innecesarias de pólipos hiperplásicos podría representar un importante ahorro de costes (estrategia de «dejar in situ»)3,4. Estas estrategias se basan en una predicción de histología in vivo.
Por otro lado, a pesar de que la colonoscopia es la mejor técnica disponible, esta no es infalible ya que hasta un 21% de los pólipos pueden pasar desapercibidos5, especialmente los pequeños y/o planos y los ocultos en los pliegues del colon.
Por estas razones, existen múltiples estrategias dirigidas a mejorar la calidad de la colonoscopia para optimizar la detección de las lesiones y caracterización de las mismas. Estas incluyen soluciones de limpieza mejor toleradas, mejoras en los endoscopios, dispositivos para aumentar la visualización de la mucosa, y el empleo de sistemas computacionales de soporte6. En esta revisión se describen los sistemas endoscópicos que han sido propuestos para mejorar la detección y la predicción histológica de los pólipos colorrectales, las diferentes clasificaciones utilizadas para la predicción histológica y las indicaciones actuales de las técnicas de diagnóstico endoscópico avanzado.
Nuevos endoscopios, dispositivos y sistemas de imagenColonoscopios con mayor ángulo de visiónUna de las causas potenciales de fallo de detección de pólipos es el ángulo de visión relativamente estrecho del colonoscopio estándar (140-170°). Actualmente existen 3 modelos con mayor ángulo de visión, aunque solo uno de ellos ha demostrado una tasa de detección de adenomas (TDA) superior a la colonoscopia convencional, con el inconveniente de un mayor tiempo de retirada7–10 (tabla 1).
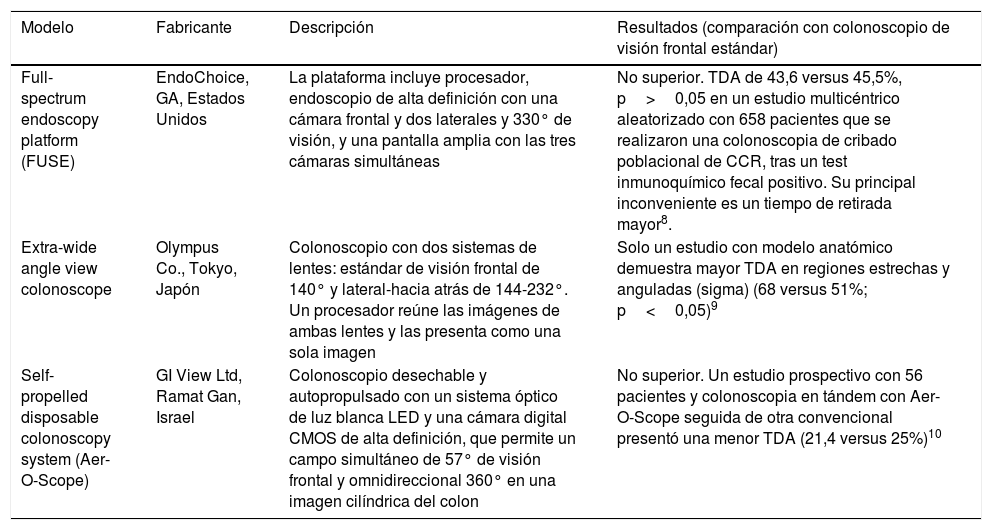
Modelos de colonoscopios con mayor ángulo de visión
| Modelo | Fabricante | Descripción | Resultados (comparación con colonoscopio de visión frontal estándar) |
|---|---|---|---|
| Full-spectrum endoscopy platform (FUSE) | EndoChoice, GA, Estados Unidos | La plataforma incluye procesador, endoscopio de alta definición con una cámara frontal y dos laterales y 330° de visión, y una pantalla amplia con las tres cámaras simultáneas | No superior. TDA de 43,6 versus 45,5%, p>0,05 en un estudio multicéntrico aleatorizado con 658 pacientes que se realizaron una colonoscopia de cribado poblacional de CCR, tras un test inmunoquímico fecal positivo. Su principal inconveniente es un tiempo de retirada mayor8. |
| Extra-wide angle view colonoscope | Olympus Co., Tokyo, Japón | Colonoscopio con dos sistemas de lentes: estándar de visión frontal de 140° y lateral-hacia atrás de 144-232°. Un procesador reúne las imágenes de ambas lentes y las presenta como una sola imagen | Solo un estudio con modelo anatómico demuestra mayor TDA en regiones estrechas y anguladas (sigma) (68 versus 51%; p<0,05)9 |
| Self-propelled disposable colonoscopy system (Aer-O-Scope) | GI View Ltd, Ramat Gan, Israel | Colonoscopio desechable y autopropulsado con un sistema óptico de luz blanca LED y una cámara digital CMOS de alta definición, que permite un campo simultáneo de 57° de visión frontal y omnidireccional 360° en una imagen cilíndrica del colon | No superior. Un estudio prospectivo con 56 pacientes y colonoscopia en tándem con Aer-O-Scope seguida de otra convencional presentó una menor TDA (21,4 versus 25%)10 |
TDA: tasa de detección de adenomas.
Se han diseñado diversos dispositivos que se acoplan al endoscopio con el objetivo principal de aumentar la tasa de detección de lesiones. Sin embargo, con algunos de ellos solo se han realizado estudios de viabilidad y los resultados de los que disponemos son limitados. En la tabla 2 se describen los principales modelos disponibles y un resumen de los resultados6,7,11–15. Recientemente, se ha publicado un metaanálisis con Endocuff que incluye 12 ensayos clínicos y 8.376 pacientes. La TDA fue significativamente mayor en el grupo que utilizó Endocuff respecto a la colonoscopia estándar (41,3 versus 34,2%; riesgo relativo [RR]=1,20, intervalo de confianza [IC] del 95% 1,06-1,36; p=0,003), siendo más relevante en endoscopistas con baja-moderada TDA (<35%): RR 1,51, IC del 95% 1,35-1,69; p<0,001)16. Recientemente se ha publicado un estudio aleatorizado español con 711 pacientes que compara Endocuff con capuchón y no encuentra diferencias entre ellos en la TDA (50,4% vs. 50,6%)17.
Dispositivos complementarios al endoscopio para optimizar la detección de lesiones
| Tecnología/ Referencia | Fabricante | Funcionamiento | Aplicación clínica | Limitaciones | Impacto en TDA |
|---|---|---|---|---|---|
| Third-Eye Retroscope (TER)* | Avantis Medical Systems, Inc, Sunnyvale, CA. Estados Unidos | Dispositivo de imagen auxiliar a través del canal de trabajo para obtener imagen en retroversión durante la retirada | Mejora la visualización del lado proximal de los pliegues | Reduce la capacidad de absorción al 50%, calidad de imagen pobre, requiere retirarlo para pasar accesorios por el canal de trabajo | Aumento |
| Third-Eye Panoramic* | Avantis Medical Systems, Inc, Sunnyvale, CA, Estados Unidos | Capuchón con dos LED y dos cámaras laterales conectado a través de un catéter que recorre el endoscopio hasta un procesador externo conectado al monitor | Mayor campo de visión (> 300°) mediante tres imágenes parcialmente superpuestas | Dificultad de intubación de la válvula ileocecal | Desconocido (estudio único de viabilidad) |
| Endocuff™, Endocuff-Vision™** | Arc Medical Design, Leeds, Reino Unido | Manguito flexible de 2cm con 1-2 filas de púas flexibles en la punta del colonoscopio | Mejora la visualización del lado proximal de los pliegues | Puede causar laceración de la mucosa, salida durante el procedimiento | Mejoría, sobre todo lesiones pequeñas y endoscopistas con TDA baja-moderada |
| Capuchón** | Varios | Adaptador de plástico que se coloca en el extremo distal del endoscopio para dar estabilidad | Aplana los pliegues del colon y mejora la exposición mucosa en retirada | Reduce el campo de visión, la interposición de material fecal puede dificultar la visión | Aumenta la detección de pólipos pero sin beneficio en la tasa de detección de adenomas |
| EndoRings** | EndoAid Ltd, Caesarea, Israel | Anillos suaves, flexibles y circulares de silicona en la punta del colonoscopio | Mejora la visualización del lado proximal de los pliegues y aumenta la estabilidad | Puede impedir la inserción | Modesta mejoría, datos limitados |
| G-EYE** | SMART Medical Systems Ltd, Ra’ anana, Israel | Visión frontal de alta definición con un balón en el extremo distal reutilizable y reprocesable | Globo parcialmente inflado que rectifica los pliegues, reduce el deslizamiento y centra la óptica visual en retirada | Nada descrito | Aumento |
Los equipos de videoendoscopia utilizan luz blanca que es reflejada en los tejidos y recuperada por un Charge-Coupled Device en el extremo del endoscopio. Esta luz blanca cubre prácticamente todo el espectro de la luz visible, es decir desde los 400nm a los 700nm. La endoscopia de alta definición tiene más líneas de barrido y píxeles horizontales que los sistemas convencionales (> 850.000 píxeles en lugar de los 367.000 convencionales) lo que permite observar las estructuras con más detalle. Además, la magnificación permite la ampliación de la imagen hasta x150 veces18.
El estudio del patrón de criptas mediante la clasificación de Kudo se realiza con endoscopia de alta definición, cromoendoscopia (con azul de metileno, índigo carmín o violeta cristal) y magnificación19 y ha sido validada en numerosos estudios. Un metaanálisis que incluyó 20 estudios con un total de 5.111 lesiones colorrectales en 3.418 pacientes obtuvo una sensibilidad del 89% y una especificidad del 85,7% para la diferenciación de lesiones neoplásicas y no neoplásicas con magnificación. El subgrupo de cromoendoscopia con magnificación obtuvo aún mejores resultados (sensibilidad 92,7% y especificidad 87,3%)20. Además, existe una buena concordancia inter- e intraobservador en endoscopistas expertos en la predicción histológica mediante la clasificación de Kudo, con unos valores kappa medios de 0,776 y 0,862, respectivamente21.
En Europa los endoscopios con magnificación son poco habituales. Un estudio prospectivo que asignó aleatoriamente a 660 pacientes para realizarse una colonoscopia con o sin magnificación obtuvo una exactitud diagnóstica del 92% (372/405) en el grupo que utilizó magnificación y fue significativamente mayor respecto el grupo de colonoscopia sin magnificación (68%, 278/407) para la diferenciación de lesiones neoplásicas/no neoplásicas ≤ 10mm22.
Por otra parte, el grado de experiencia también influye en los resultados y los endoscopistas inexpertos tienden a confundir las lesiones neoplásicas pequeñas (≤5mm) con lesiones no neoplásicas y, contrariamente, las lesiones no neoplásicas grandes (>5mm) son erróneamente etiquetadas como neoplásicas22,23.
En cuanto a la detección de lesiones, un reciente metaanálisis que incluye 40 estudios y compara diferentes modalidades endoscópicas, la cromoendoscopia obtuvo mejores resultados en la detección de adenomas que la luz blanca, tanto estándar (OR 1,53; IC del 95% 1,22-1,93) como de alta definición (OR 1,30; IC del 95% 1,06-1,60). No obstante, los autores concluyen que se requieren estudios adicionales para confirmar estos hallazgos24.
Narrow band imagingEl sistema Narrow Band Imaging (NBI) de Olympus (tabla 3)25 utiliza un sistema de filtros que estrecha la longitud de onda de la luz emitida. El equipo filtra las bandas correspondientes a la luz azul y verde (415nm y 540nm) y descarta la roja (650nm). La luz azul, que es de longitud de onda corta, penetra muy poco en la pared del órgano y es fuertemente absorbida por la hemoglobina de la red capilar cercana a la superficie de la mucosa que tiene un pico de absorción de 415nm. La luz verde penetra más y reproduce las imágenes de los vasos en mayor profundidad. Estas características realzan la vascularización de los pólipos y permiten una mejor visualización de los mismos.
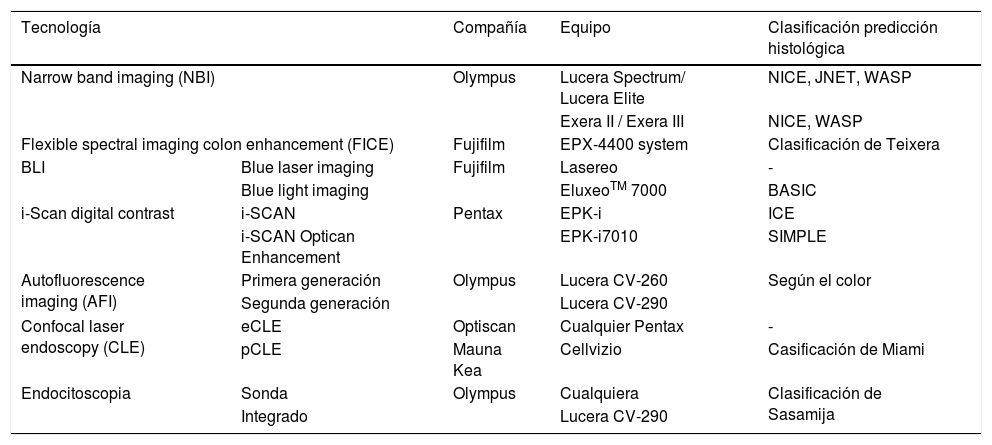
Tecnologías de imagen endoscópica avanzada: equipos y clasificaciones específicas para predicción de diagnóstico histológico
| Tecnología | Compañía | Equipo | Clasificación predicción histológica | |
|---|---|---|---|---|
| Narrow band imaging (NBI) | Olympus | Lucera Spectrum/ Lucera Elite | NICE, JNET, WASP | |
| Exera II / Exera III | NICE, WASP | |||
| Flexible spectral imaging colon enhancement (FICE) | Fujifilm | EPX-4400 system | Clasificación de Teixera | |
| BLI | Blue laser imaging | Fujifilm | Lasereo | - |
| Blue light imaging | EluxeoTM 7000 | BASIC | ||
| i-Scan digital contrast | i-SCAN | Pentax | EPK-i | ICE |
| i-SCAN Optican Enhancement | EPK-i7010 | SIMPLE | ||
| Autofluorescence imaging (AFI) | Primera generación | Olympus | Lucera CV-260 | Según el color |
| Segunda generación | Lucera CV-290 | |||
| Confocal laser endoscopy (CLE) | eCLE | Optiscan | Cualquier Pentax | - |
| pCLE | Mauna Kea | Cellvizio | Casificación de Miami | |
| Endocitoscopia | Sonda | Olympus | Cualquiera | Clasificación de Sasamija |
| Integrado | Lucera CV-290 | |||
Adaptada de la revisión de East et al.25.
Atkinson et al. han publicado recientemente un metaanálisis con 11 ensayos clínicos que incluyen un total de 4.491 individuos y 6.636 pólipos y la TDA es superior con NBI que con luz blanca de alta definición (45,2% vs. 42,3%; p=0,04), siendo esta mejoría más marcada cuando la preparación es mejor26.
Clasificación de Narrow Band Imaging International Colorectal EndoscopicTanto el color de la lesión como el grosor del vaso son estimaciones subjetivas. Esto ha llevado al desarrollo de la clasificación «NBI International Colorectal Endoscopic» (NICE), basada en el color, la vascularización y el patrón de superficie27. Una ventaja clave de esta clasificación es que puede aplicarse con colonoscopios con o sin magnificación óptica. Además, este sistema de clasificación ha sido validado consiguiendo un 89% de exactitud diagnóstica, 98% de sensibilidad y 95% de valor predictivo negativo para descartar el diagnóstico de adenoma en pólipos pequeños con una confianza alta en el 75%28.
Un ensayo clínico multicéntrico con 421 pólipos colorrectales pequeños que comparó NBI mediante la clasificación NICE y luz blanca de alta definición en el diagnóstico óptico (neoplásico versus no neoplásico) no obtuvo diferencias significativas relativas a la exactitud diagnóstica, sensibilidad ni tampoco al valor predictivo negativo (VPN) (73,7%, 82,4% y 75,5%, en el grupo de NBI y 79,2%, 79,8%, y 73,4%, en el grupo de luz blanca)29. No obstante, la exactitud diagnóstica de NBI en este estudio es más baja de lo reportado en la literatura, por lo que los resultados deberían interpretarse con precaución.
Clasificación japonesa con Narrow Band ImagingUna clasificación posterior a la NICE es la «Japanese NBI Expert Team» (JNET)30 que subdivide las lesiones NICE 2 en tipo 2A (adenomas de bajo grado), y tipo 2B (adenomas de alto grado incluyendo el cáncer que infiltra superficialmente la submucosa). Sin embargo, la clasificación JNET tiene mayor complejidad por la necesidad de magnificación que puede restringir su adopción por todos los endoscopistas.
Clasificación Workgroup serrAted polypS and PolyposisLos pólipos serrados sésiles no están considerados en la clasificación NICE. En cambio, la clasificación Workgroup serrAted polypS and Polyposis (WASP) combina la clasificación NICE y cuatro características de los pólipos serrados sésiles: superficie en forma de nube, borde mal definido, forma irregular y puntos negros dentro de las criptas. La presencia de al menos dos características es suficiente para diagnosticar una lesión serrada sésil. Durante la fase de validación, el diagnóstico óptico realizado con alta confianza mostró una exactitud diagnóstica del 84% y un VPN del 91% para las lesiones diminutas neoplásicas31.
Flexible spectral imaging color enhancementFlexible spectral imaging color enhancement o Fujinon Intelligent Chromo Endoscopy (FICE) se trata de una tecnología de posprocesado de mejora de la imagen vascular y de la superficie mediante espectroscopia. La espectroscopia consiste en la interacción entre la radiación electromagnética (luz) y la materia (superficie tisular), con absorción o emisión de energía radiante. A diferencia del NBI, que utiliza filtros físicos de luz óptica, FICE selecciona determinadas longitudes de onda a partir de datos digitalizados. El sistema es flexible dado que tiene diez ajustes de filtro digital preestablecidos con capacidad de programar más. Por ejemplo, el filtro 2 resalta las lesiones con vasos superficiales mientras que el filtro 4 es útil para visualizar el patrón de criptas glandulares de la superficie mucosa.
Teixeira et al. describieron en 2009 una clasificación basada en magnificación y patrones de microvascularización en la que se tiene en cuenta el grosor y la disposición en relación a las glándulas de los vasos con una exactitud diagnóstica del 98% para diferenciar pólipos de colon neoplásicos de no neoplásicos32 (fig. 1A). Además, la concordancia interobservador es muy buena (0,80) así como intraobservador (0,73-0,88)33.
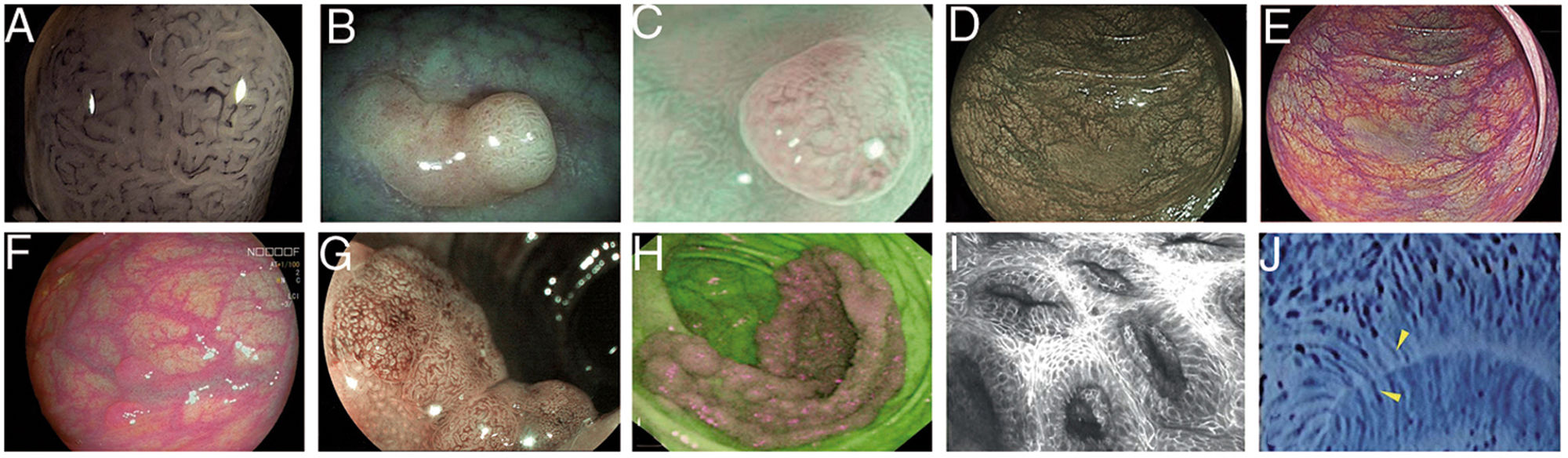
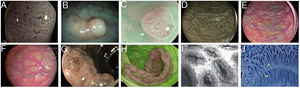
Imágenes de pólipos con diversas tecnologías endoscópicas. A) Adenoma con displasia de alto grado que corresponde a la categoría IV de la clasificación de Teixeira para Flexible spectral imaging color enhancement (FICE). Pueden observarse numerosos vasos largos y espiriformes, algunos más gruesos y con dilataciones dispersas. B) Imagen de i-SCAN (modo 3, demarcación) de un pólipo no adenomatoso de colon que presenta un color pálido similar a la mucosa circundante. C) Modo 3 de i-SCAN Optical enhancement (OE) de un diminuto adenoma de colon, que ofrece una mejora óptica de la caracterización vascular. Caso representativo de pólipo serrado sésil en modo Blue Laser Imaging Bright (BLI-Bright) D) y modo Linked Color Imaging (LCI) E). F) También con LCI, dos adenomas con displasia de bajo grado diminutos plano-elevados (París IIa) de colon sigmoide. G) Imagen en modo Blue Light Imaging (BLI) de adenoma de colon plano-elevado de 10mm con displasia de bajo grado (cortesía de H. Uchima). H) Imagen de un pólipo adenomatoso de extensión lateral granular (LST-G) de 5cm en ciego; con autofluorescencia (AFI) la lesión aparace de color púrpura, que contrasta con la mucosa normal de alrededor que es de color verde. I) Pólipo hiperplásico visualizado mediante endomicroscopía láser confocal (iCLE) en el que las criptas presentan aberturas regulares con una capa homogénea de células epiteliales. J) Ejemplo de pólipo de colon con displasia de alto grado y visión mediante endocitoscopia con magnificación 450x; las glándulas tienen forma irregular con núcleos grandes y distorsionados (categoría 2).
Por otra parte, un estudio que aplicó la clasificación NICE (desarrollada para NBI) a vídeos de pólipos grabados utilizando FICE para diferenciar adenomas de pólipos hiperplásicos mostró una exactitud diagnóstica de solo el 77%, con una modesta concordancia interobservador e intraobservador (0,51 y 0,40, respectivamente). Esto sugiere que los sistemas de clasificación pueden no ser intercambiables entre modalidades de imágenes avanzadas34.
Contrast digital i-SCANi-SCAN es otra tecnología digital de contraste basada en el posprocesamiento de la imagen capturada. Este sistema consta de tres características de mejora: mejora de la superficie; mejora de contraste, donde las áreas más oscuras (deprimidas) se ven de color más azulado; y mejora de tono, un tipo de imagen digital con algunas similitudes a FICE, ya que la imagen de luz blanca se divide en sus componentes rojo, verde y azul. Cada componente puede ser modificado de forma independiente, y posteriormente recombinar los tres colores para de este modo construir una nueva imagen digital35 (fig. 1B).
Los sistemas de clasificación i-SCAN para pólipos también se han desarrollado utilizando patrones de criptas y características de microvascularización. Bouwens et al.36 desarrollaron un sistema simple denominado ICE (i-SCAN Classification for Endoscopic diagnosis) basado en las clasificaciones Kudo y NICE, donde el color, el patrón de la superficie epitelial y el patrón vascular se evaluaron de forma independiente. La sensibilidad, especificidad y exactitud diagnóstica para el diagnóstico de los adenomas fueron del 79, 86 y 81%, respectivamente. De los diagnósticos, el 81% fueron hechos con alta confianza y estos fueron asociados con una exactitud diagnóstica significativamente mayor en comparación con los diagnósticos restantes.
Un metaanálisis que incluyó 925 pacientes y 2.312 pólipos obtuvo una sensibilidad y especificidad de aproximadamente el 90% para diferenciar pólipos neoplásicos/no neoplásicos tras valoración con i-SCAN37.
i-SCAN Optical Enhancementi-SCAN Optical enhancement (OE) es una versión posterior de i-SCAN que añade un preprocesado mediante filtros ópticos que limitan el espectro de la luz, manteniendo también el posprocesado, es decir, una combinación de cromoendoscopia óptica y digital. La tecnología OE tiene como objetivo lograr una transmisión global más alta conectando los picos del espectro de absorción de la hemoglobina (415, 540 y 570nm), creando así un espectro de longitud de onda continua. Es similar a NBI ya que se reduce la luz roja aumentando la azul y verde para resaltar la morfología del patrón vascular. En cambio, la imagen se visualiza más brillante que NBI. El uso de filtros ópticos también permite una mejor observación de los patrones microsuperficiales en la superficie de la mucosa y la vascularización38 (fig. 1C).
Recientemente se ha publicado la clasificaciónSimplified Identification Method for Polyp Labeling during Endoscopy (SIMPLE) de diminutos y pequeños pólipos colorrectales mediante el uso de i-SCAN OE. Con esta clasificación se obtuvo una exactitud diagnóstica por expertos del 83% antes y 94% después del entrenamiento (p=0,002). La sensibilidad, especificidad, valor predicitivo positivo (VPP) y VPN después de la capacitación fue del 97, 88, 95 y 91%, respectivamente. La concordancia interobservador de diagnóstico de pólipos mejoró de 0,46 a 0,66 antes y después de la formación. También se demostró que esta clasificación es aplicable con NBI sin magnificación, con exactitudes diagnósticas comparables postentrenamiento (0,69 versus 0,71 en clasificación NICE y SIMPLE, respectivamente; p=0,40)38.
Blue Laser ImagingLa utilidad de la mayoría de las tecnologías de espectro reducido puede quedar limitada por un campo de visión oscuro. La imagen de Blue Laser Imaging (BLI) puede superar esta limitación combinando dos fuentes de luz láser de longitudes de onda de 410nm y 450nm. El láser de 450nm actúa sobre el fósforo, induciendo luz fluorescente que es equivalente a una fuente de luz de xenón. El otro láser proporciona mejoría de la información de la superficie mucosa y vascularización mediante la aplicación de un espectro de longitud de onda limitada de 410nm de luz azul, de manera similar a NBI.
El sistema BLI utiliza cuatro modos (BLI, BLI-bright, White light o WLI y Linked color imaging o LCI) que se pueden seleccionar por el endoscopista mediante un botón del bloque de mandos del colonoscopio. Cada modo tiene un efecto diferente sobre el contraste y es más adecuado para inspeccionar imágenes cercanas, para la detección o para reconocer mejor el patrón mucoso o microvascular39,40 (fig. 1D y E).
Un estudio que combinó la metodología LCI con láser y la clasificación NICE obtuvo buenos resultados para la predicción de lesiones neoplásicas tipo 2 y 3: sensibilidad 96,5%, especificidad 83,8%, VPP 90,2%, y VPN 93,9%41.
Blue Light ImagingRecientemente está disponible en Europa el sistema Blue Light Imaging (BLI) y Linked Color Imaging (LCI) con tecnología de 4 LED (4-LED Multi Light tecnology)42 (fig. 1F y 1G).
La clasificación BLIAdenoma Serrated International Classification (BASIC) es específica para la caracterización de pólipos colorrectales con BLI e incluye características de superficie, patrón de criptas y vascularización. La concordancia interobservador mejora si se utiliza magnificación43.
AutofluorescenciaAlgunas moléculas como el colágeno, las flavinas y la nicotinamida adenina dinucleótido fosfato, son fluoróforas, es decir, emiten fluorescencia tras ser excitadas con luz de onda corta. Las imágenes de autofluorescencia (AFI) se obtienen en tiempo real y su señal se ve alterada por cambios en el grosor de la mucosa, en el flujo sanguíneo de la mucosa, y en los fluoróforos endógenos tisulares. El tejido grueso con un flujo sanguíneo aumentado como el de los adenomas atenúa ambas señales de excitación y autofluorescencia25.
Las diferencias en la emisión de fluorescencia entre tejidos neoplásicos y no neoplásicos son detectadas por un sensor adicional de imagen CCD equipado con un filtro que corta la luz de excitación azul. El videoprocesador combina la señal de autofluorescencia con la reflectancia mucosa de la luz verde utilizada para la iluminación para producir un falso color de imagen que puede ser púrpura, violeta o verde. Así, una lesión displásica se destacaría como una lesión púrpura en un fondo verde correspondiente a la mucosa normal44 (fig. 1H).
Los inconvenientes de esta técnica son que la resolución de la imagen es incluso más baja que con luz blanca de definición estándar, puede haber lesiones de color ambiguo y las lesiones inflamatorias o isquémicas también pueden ser violetas (falsos positivos)25.
Para el diagnóstico óptico en el colon, se ha desarrollado un sistema de clasificación: si la lesión de interés es de color púrpura indica tejido neoplásico; si es verde, indica que no es neoplásico; y si es violeta (intermedio), debe utilizarse NBI para su discriminación45.
En un estudio retrospectivo con el sistema AFI de primera generación, la sensibilidad, especificidad, VPP y VPN para diferenciación de lesión neoplásica fueron del 98,8% 86,4%, 96,4% y 95,0%, respectivamente46. En un estudio prospectivo fue respectivamente del 94,7%, 88,9%, 95,9% y 85,2%47. Finalmente, en un estudio retrospectivo con el sistema AFI de segunda generación los resultados fueron los siguientes, respectivamente: 94,2%, 91,8%, 92,5% y 93,8%48.
Endomicroscopía láser confocalLa endomicroscopía láser confocal (CLE) se desarrolló para visualizar imágenes de células y subcelulares de hasta 250 micrómetros por debajo de la superficie mucosa. Como los sistemas de iluminación y detección están en el mismo plano focal, se denomina «confocal». Sucesivos puntos en una región se escanean para construir una imagen rastreada digital. La imagen creada es una sección óptica que representa un plano focal dentro de la zona examinada y aparece en tonos de grises. A diferencia de las tecnologías anteriores, CLE requiere el uso de contraste. Los más utilizados son la fluoresceína administrada por vía intravenosa, y acriflavina y violeta cristal, que son aplicados tópicamente.
Existen dos sistemas basados en CLE. El sistema endoscope-CLE (eCLE) está integrado en el extremo distal del endoscopio y el sistema probe-CLE (pCLE) consiste en una minisonda flexible que puede ser introducida a través del canal de trabajo de un endoscopio estándar. eCLE permite una resolución más alta, mayor campo de visión y profundidad de la imagen, a expensas de planos dinámicos de imagen, a diferencia del pCLE que utiliza planos fijos y de profundidad de imagen variable.
La clasificación de Mainz fue el primer sistema de clasificación para pólipos de colon con el método integrated-CLE (iCLE) (primer sistema integrado en el endoscopio, no disponible actualmente comercialmente) que diferencia epitelio normal, regenerativo y displásico25,49 (fig. 1I). Tiene una elevada exactitud diagnóstica y concordancia inter- e intraobservador en un estudio con tres observadores (0,68-0,84)50.
La clasificación de Miami fue propuesta en 2009 para el sistema pCLE51. Un estudio de validación de estos criterios para el diagnóstico histológico de pólipos de colon (hiperplásicos versus adenomas tubulares) obtuvo una exactitud diagnóstica del 84,9% que ascendió a 91% si la predicción se realizó con alta confianza. El acuerdo interobservador fue k=0,7352.
EndocitoscopiaLa endocitoscopia se basa en el principio de microscopía de luz de contacto y permite la visualización, en tiempo real, de la estructura celular de la capa epitelial superficial en un plano paralelo a la superficie de la mucosa. La tecnología usa una lente como objetivo de enfoque fijo y alta potencia, que proyecta imágenes muy amplificadas de zonas menores de 0,5mm de diámetro. Hay dos tipos de prototipo: integrado en el endoscopio, o un dispositivo que se inserta a través del canal de trabajo de un endoscopio terapéutico (canal ≥ 3,7mm). Requiere contacto con la mucosa, aplicación de mucolítico previo, con frecuencia el uso de capuchón para estabilizar la imagen y la utilización de un contraste absortivo como el azul de metileno al 0,5-1% o el violeta cristal. El diagnóstico endocitoscópico se basa en la valoración de varias características citológicas y de arquitectura como la densidad, el tamaño, la disposición de las células, el tamaño y forma de los nucléolos, la relación núcleo-citoplasma y el patrón de tinción53,54 (fig. 1J).
Sasamija et al. propusieron una clasificación de lesiones colorrectales mediante endocitoscopia que fue validada posteriormente por Rotondano et al., con un VPP de 100%, 93,1%, 90,1%, y 100% para lesiones no neoplásicas, displasia de bajo grado, displasia de alto grado y cáncer invasivo, respectivamente54,55.
Indicaciones actuales de las técnicas endoscópicas de diagnóstico avanzadoEl objetivo de todas las tecnologías descritas en el apartado anterior es mejorar la visualización de la mucosa con realce de las estructuras y el detalle microvascular. En manos expertas pueden mejorar el rendimiento diagnóstico, pero en la práctica habitual no se ha demostrado sistemáticamente su superioridad frente a la luz blanca de alta definición. Por este motivo, las guías actuales no recomiendan su utilización de forma sistemática.
Respecto a la detección de pólipos esporádicos en individuos con riesgo medio, se ha publicado un resumen de 6 metaanálisis (rango 5-14 estudios, 1.199-5.074 pacientes) que consideran NBI, FICE, i-SCAN y AFI, y no muestran un beneficio significativo para la detección de adenomas o pólipos para cualquier modalidad56. La Guía de la European Society of Gastrointestinal Endoscopy (ESGE) no apoya el uso clínico de NBI, FICE o i-SCAN para mejorar la detección de pólipos. Solo recomienda realizar pancromoendoscopia convencional con colorantes y endoscopios de alta definición en pacientes con síndrome de Lynch, síndrome de poliposis serrada y detección de displasia en la colitis ulcerosa de larga evolución57.
Un metaanálisis que incluye un total de 91 estudios y que analizan la capacidad de caracterizar pólipos como adenomatosos o hiperplásicos, utilizando NBI, FICE, i-SCAN, AFI o CLE, concluye que todas estas técnicas excepto AFI (sensibilidad 87%, especificidad 66%) podrían ser utilizadas por endoscopistas debidamente capacitados para hacer el diagnóstico óptico58. En consecuencia, la ESGE apoya el uso clínico de NBI, FICE e
i-SCAN para el diagnóstico óptico de pólipos diminutos (≤5mm) por expertos57, mientras que la AmericanSociety of Gastrointestinal Endoscopy (ASGE) solo apoya el uso de NBI59.
En la tabla 4 se detalla la utilidad que han demostrado las diferentes técnicas en la detección y caracterización de pólipos25.
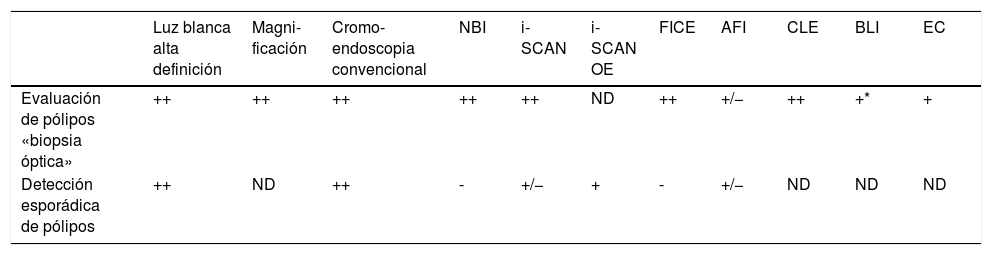
Utilidad de las técnicas de detección y diagnóstico óptico en la práctica clínica
| Luz blanca alta definición | Magni-ficación | Cromo-endoscopia convencional | NBI | i-SCAN | i-SCAN OE | FICE | AFI | CLE | BLI | EC | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Evaluación de pólipos «biopsia óptica» | ++ | ++ | ++ | ++ | ++ | ND | ++ | +/− | ++ | +* | + |
| Detección esporádica de pólipos | ++ | ND | ++ | - | +/− | + | - | +/− | ND | ND | ND |
Adaptada de la revisión de East et al.25. La utilidad clínica representa la evidencia y el impacto clínico: ++ muy útil; + útil; +/− indeterminado; - no beneficio adicional; ND no disponible.
En los últimos años, el avance de la tecnología ha permitido el desarrollo de la imagen endoscópica avanzada y de nuevos endoscopios y dispositivos que permiten mejorar la detección y caracterización de los pólipos colorrectales. Sin embargo, estas técnicas no están disponibles de forma universal, son dependientes del fabricante de endoscopios y requieren un entrenamiento específico por lo que las guías actuales no contemplan el uso de muchas de ellas de forma sistemática. La incorporación de la inteligencia artificial podría constituir una buena alternativa en un futuro próximo.
En base a los resultados publicados, en la práctica clínica actual se recomienda el uso de cromoendoscopia convencional en pacientes con síndrome de poliposis serrada y síndrome de Lynch para mejorar la detección de pólipos colorrectales. En cambio, para mejorar la caracterización de los pólipos es útil la tecnología de NBI y, probablemente, también FICE e i-SCAN (recomendadas ambas por la ESGE, pero no por la ASGE). No obstante, teniendo en cuenta la extensa oferta de nuevas tecnologías, debería utilizarse la mejor herramienta disponible en cada centro. Existen además otras técnicas al alcance de todos los endoscopistas que pueden aumentar la detección de lesiones con endoscopios estándar como son la retroflexión en colon derecho, la doble inspección en colon derecho, la colonoscopia asistida con agua, así como la cromoendoscopia con colorantes.
Conflicto de interesesMaría Pellisé ha sido consultora de Norgine Iberia desde 2012 hasta 2017. Recibió honorarios por realizar conferencias de Norgine Iberia, Casen Recordati y Olympus España en los últimos 5 años. Gloria Fernández-Esparrach ha recibido honorarios por organizar cursos de Norgine Iberia y Olympus España en los últimos dos años y ha sido consultora de CDx Diagnostics.
Este trabajo fue apoyado por el Gobierno de España a través de los proyectos financiados iVENDIS (DPI2015-65286-R) e HISINVIA (PI17/00894), por la Fundación de la Sociedad Española de Endoscopia Digestiva (FSEED), por la Secretaria d’Universitats i Recerca de la Generalitat de Catalunya (2014-SGR-1470, 2014-SGR-135, SGR-2017-1669 y SGR-2017-653), y por el programa CERCA de la Generalitat de Catalunya.