El fallo hepático agudo (FHA) es una entidad rara de instauración rápida y alta mortalidad que se caracteriza por coagulopatía con INR>1,5 y cualquier grado de encefalopatía en un paciente sin enfermedad hepática previa1. Algunas de las causas más frecuentes son la toxicidad por fármacos como el acetaminofén, las hepatitis víricas, la hepatitis autoinmune, la enfermedad de Wilson y la hepatitis isquémica1,2. Aunque la diseminación hematógena de los tumores sólidos afecta frecuentemente al hígado, el FHA por infiltración neoplásica es muy infrecuente, existiendo pocos casos descritos en la literatura. En un estudio realizado en el Reino Unido durante 18 años (1978-1995) esta situación se documentó solo en el 0,44% de los pacientes, siendo las neoplasias de origen hematológico la causa más frecuente3. En otro estudio multicéntrico americano más reciente, realizado por el Acute Liver Failure Study Group donde revisaron 1.910 pacientes con FHA desde 1998 a 2012 identificaron solamente 27 pacientes (1,4%) con FHA secundario a una infiltración tumoral4.
El parénquima hepático es sustituido por células neoplásicas que se propagan por vía sinusoidal, produciendo isquemia hepatocelular y liberando citoquinas proinflamatorias. El aumento de la AST, la LDH y la hepatomegalia apoyan esta hipótesis; el fallo hepático fulminante desencadena un fracaso multiorgánico con alta mortalidad (60-80%)5. El diagnóstico de confirmación se realiza mediante biopsia hepática y en la mayoría de los casos se realiza postmortem3,6-9.
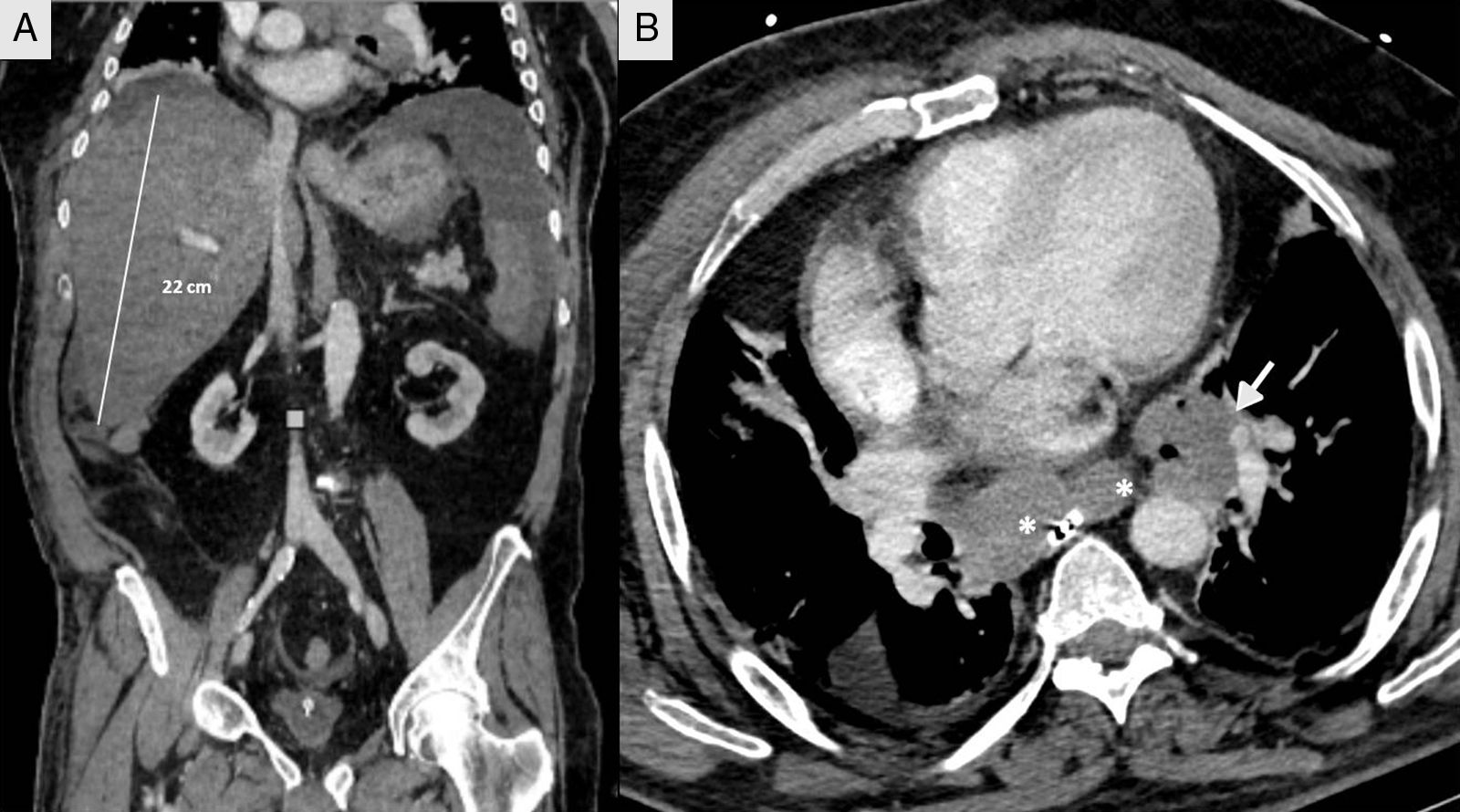
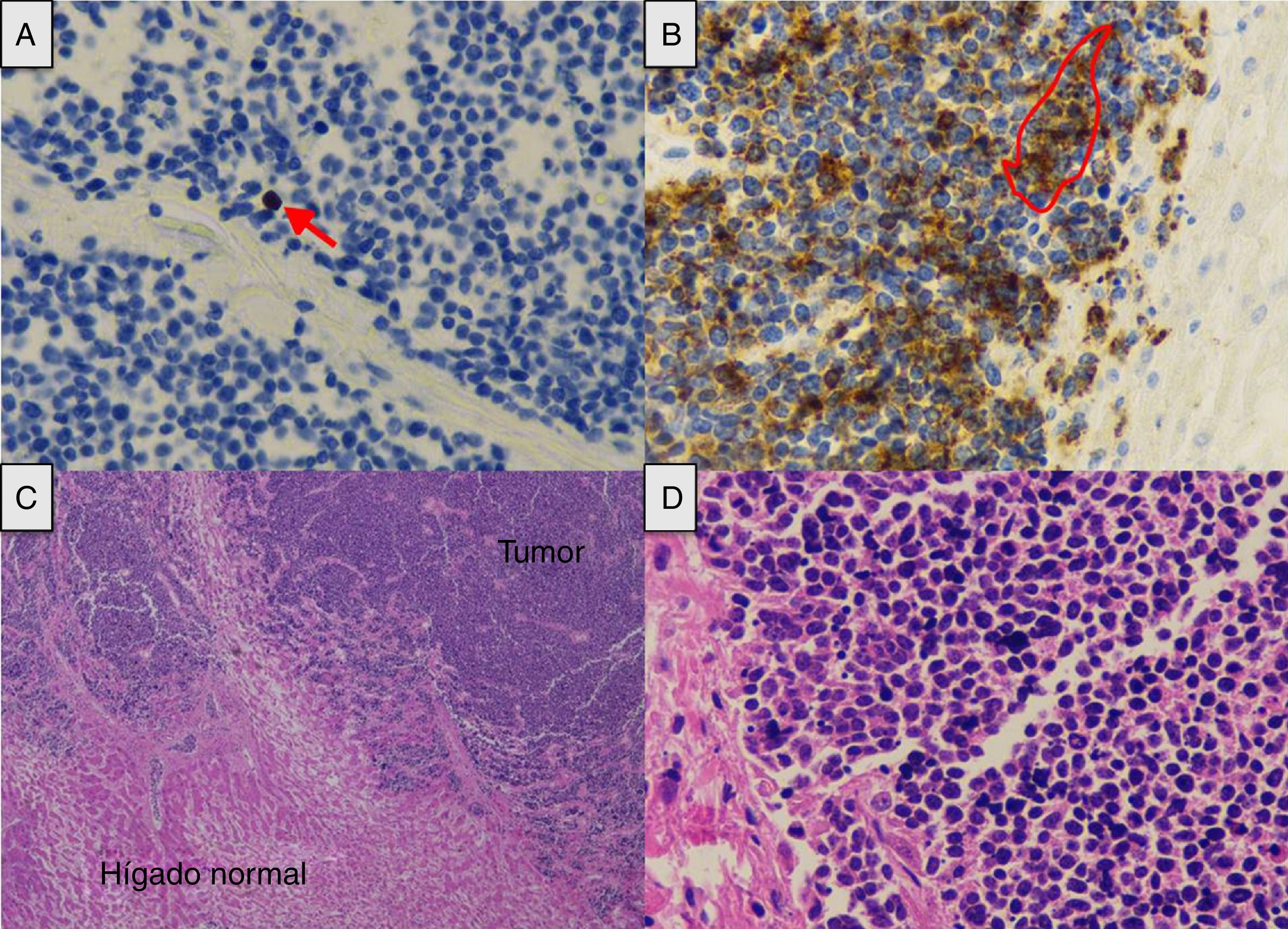
Presentamos el caso de un varón de 66 años, pastor de ovejas, exfumador de 40 paquetes/año, bebedor moderado, bronquítico crónico con CPAP domiciliaria e hipertrigliceridemia. Presenta un cuadro catarral de 10 días de evolución, sin fiebre, tratado con levofloxacino y prednisona, con distensión abdominal, meteorismo y oliguria. No refería consumo de drogas ilícitas ni otros hepatotóxicos. No sintomatología general, pérdida de peso ni historia familiar de enfermedad hepática. A su ingreso se realiza TC tóraco-abdominal que muestra una llamativa hepatomegalia con un eje anteroposterior en el corte axial de 30cm y 22cm en el corte coronal, sin identificar lesiones focales con vía biliar normal y grandes bloques adenopáticos mediastínicos subcarinales (fig. 1). Ingresa en el servicio de medicina interna inicialmente con la siguiente analítica: glucemia 104mg/dl, creatinina 1,13mg/dl, urea 67mg/dl, sodio 142mmol/l, potasio 4mmol/l, AST 266U/l, ALT 457U/l, FA 174U/l, GGT 1.033U/l, bilirrubina total 2,5mg/dl, amilasa 87U/l, hemograma normal, coagulación TP 79%, INR 1,17, fibrinógeno derivado 550mg/dl, gasometría arterial pH 7,45, pCO2 35mmHg, pO2 71mmHg, bicarbonato 24,5mM/l y EB +1,6mM/l, presentando mala evolución clínica con fallo hepático (AST 4.791U/l, ALT 2.301U/l, FA 286U/l, GGT 739U/l, bilirrubina total 12,2mg/dl, LDH 5.470U/l, amonio 106mmol/l, coagulopatía con TP 28% e INR 2,79), fracaso renal agudo oligoanúrico (creatinina 3,8mg/dl, urea 105mg/dl), amilasa 165U/l, lipasa 185U/l, CK 1.866U/l, potasio 7mmol/l, glucemia 34mg/dl y acidosis metabólica con pH 7, lactato 13mmol/l y EB −20mM/l. Dada la mala evolución ingresa en la unidad de cuidados intensivos (UCI) precisando intubación orotraqueal y conexión a ventilación mecánica por insuficiencia respiratoria aguda, inestabilidad hemodinámica y deterioro neurológico en relación con encefalopatía metabólica. En la exploración destacaba un abdomen muy distendido, timpánico y doloroso a la palpación de forma difusa. Serología viral para hepatitis A, B, C y E negativa. Citomegalovirus, sífilis, virus Epstein-Barr y virus de herpes simple negativo. Serología de Leptospira negativo. Anticuerpo monoclonal CA-72.4 y antígeno asociado a células escamosas negativos. Estudios de autoinmunidad negativos (factor reumatoide, ANA, AMA, ANCA y anti-músculo liso). Hemocultivos y cultivo de orina negativo. Leucocitos 19.300 sin neutrofilia llamativa y procalcitonina 4,47ng/ml. Evolución fulminante a shock distributivo refractario al tratamiento habitual de sostén incluyendo fármacos vasopresores, corticoides a dosis altas, técnicas de reemplazo renal continuo y tratamiento de forma empírica con meropenem. El paciente falleció a las 12h de su ingreso en la UCI. Se realizó necropsia y en el estudio anatomopatológico se confirmó la proliferación en el hígado de nidos tumorales de distribución anárquica que englobaban y destruían espacios portales y venas centrales, ensanchando los sinusoides, atrapando los hepatocitos y sustituyéndolos por fibrosis (fig. 2). No se identifican masas, ni obstrucciones de las estructuras vasculares infra o suprahepáticas. Hilio sin alteraciones. Conglomerados adenopáticos mediastínicos de aspecto tumoral, subcarinal de 6×4cm, paratraqueales bilaterales de 8×3cm y paraaórtica sobre cara anterior del cayado de 4×3cm. No existe compresión de circulación venosa a este nivel. También se observó el crecimiento del mismo tipo de células en los ganglios mediastínicos y paraaórticos. El estudio inmunohistoquímico (fig. 2) resultó positivo para cromogranina, CD 56, PGP 9.5 y focalmente con intensidad débil para CK 7, concluyendo que se trataba de un carcinoma neuroendocrino de célula grande grado 2 de 3 de la OMS (2 mitosis en 10 CGA y Ki-67 del 5%), con infiltración hepática masiva y adenopatías mediastínicas sin identificar la lesión primaria.
A) Índice de proliferación neoplásica (flecha) (Ki-67 ×40). B) La célula tumoral expresa cromogranina en su citoplasma como marcador de diferenciación neuroendocrina (contorno) (cromogranina ×40). C) Extensa infiltración tumoral (hematoxilina-eosina ×2). D) La distribución nuclear de la cromatina es similar a la referida como «en sal y pimienta» (hematoxilina-eosina ×40).
Las neoplasias neuroendocrinas constituyen un grupo muy heterogéneo de tumores que producen hormonas y pueden surgir en cualquier órgano. Dentro de estas neoplasias, los carcinomas neuroendocrinos son tumores pobremente diferenciados con alto índice de proliferación y un comportamiento muy agresivo que suelen tener metástasis en el momento del diagnóstico. El porcentaje de los que comienzan con tumor primario desconocido es del 13%9 y su localización más frecuente es el tracto gastrointestinal. El índice Ki-67 los clasifica desde el punto de vista histológico, siendo el grado 2 aquellos con un índice Ki-67 entre el 3-20%. Otros indicadores de mal pronóstico son los niveles altos de cromogranina A (CGA) y el índice mitótico10.
Este caso clínico nos recuerda, que el FHA con fracaso multiorgánico por infiltración tumoral es una posibilidad que, aunque infrecuente, debe ser tenida en cuenta. En este caso ni la historia clínica ni las pruebas de imagen orientaron el diagnóstico que solamente pudo ser confirmado en el estudio necrópsico.
Al Servicio de Anatomía Patológica del Hospital Universitario Central de Asturias, doctora María Aurora Astudillo y doctor Guillermo Eduardo Mendoza.
Al Servicio de Radiología del Hospital Universitario Central de Asturias, doctora Alicia Mesa.