La aspergilosis invasiva (AI) es causada por la inhalación de conidias del moho Aspergillus spp., el cual tiene como hábitat el suelo. Ha sido descrita en pacientes con trasplante de médula ósea y neutropenia grave (<500 neutrófilos/mm3). Los pacientes que ingresan a la unidad de cuidado intensivo (UCI) también pueden ser susceptibles a la AI, con otros factores de riesgo tales como: enfermedad pulmonar obstructiva crónica (EPOC), cirrosis hepática, enfermedades autoinmunes en manejo inmunosupresor y trasplante de órgano sólido, en donde la mortalidad puede llegar al 80%.
Se describe el caso de un hombre de 56 años con antecedente de tabaquismo, sin confirmación espirométrica de EPOC, que presentó AI pulmonar durante su estancia en UCI. El diagnóstico fue confirmado por histopatología de úlcera en carina, cultivo de aspirado traqueal y galactomanan en lavado broncoalveolar.
Voriconazol fue su tratamiento, con buena respuesta clínica.
Invasive aspergilosis (IA) is caused by Aspergillum particles inhalation such as mildew and yeast. They live in the soil as a natural habitat. This infection has been described in patients with a bone marrow transplant and serious neutropenia (<500 mm3). Inward patients of intensive care unit (ICU) can be also susceptible to them, and even more with risk factors associated such as chronic obstructive pulmonary disease (COPD), liver cirrhosis, autoimmune diseases with inmunosupressor therapy and solid organ transplantation, where mortality can reach 80% of cases.
A case of IA in a man of 56 years old is described. He had smoking history without previous spirometric assessment. The patient developed IA during stay at the intensive care unit. Aspergillus septate hiphae were observed in the biopsy at the carina's ulcer. Galactomannan assay was positive in bronchioalvelar fluid.
The patient had good clinical response to treatment with Voriconazole.
La aspergillosis invasiva (AI) es una enfermedad grave que afecta usualmente a pacientes inmunosuprimidos.
Es causada por la inhalación de las conidias del moho Aspergillus spp., el cual tiene como hábitat el suelo1. Son muchas las especies de este moho; sin embargo, pocas han sido reportadas como patógenas para el hombre.
Aspergillus fumigatus es el causante de la mayor parte de las infecciones2.
La AI tiene una alta morbimortalidad y ha sido ampliamente descrita en pacientes con neoplasias hematológicas que han requerido trasplante de médula ósea y padecían neutropenia grave (<500 neutrófilos/mm3). El órgano más afectado por la AI es el pulmón, lo cual es comprensible por el modo de transmisión; otros órganos comprometidos en orden de importancia son riñón, corazón, tracto gastrointestinal, hígado y bazo3. Las manifestaciones de la AI dependen del sistema inmune y del inóculo del moho. En los pacientes neutropénicos se puede encontrar una invasión extensa por hifas al tejido pulmonar, causando aspergilosis invasiva pulmonar (AIP) que ocasiona infarto y trombosis vascular, con posterior diseminación extrapulmonar. Clínicamente se caracteriza por persistencia de la fiebre a pesar del manejo antibiótico de amplio espectro, dolor pleurítico y hemoptisis4.
Los pacientes que ingresan a la unidad de cuidado intensivo (UCI) pueden ser susceptibles a la AI, con otros factores de riesgo diferentes al cáncer hematológico como son: enfermedad pulmonar obstructiva crónica (EPOC), cirrosis hepática, enfermedades autoinmunes en manejo inmunosupresor y trasplante de órgano sólido, en donde la mortalidad ha sido de un 80%5,6. Los pacientes en la UCI sufren cambios estructurales en la vía aérea y en el aclaramiento mucociliar al estar en ventilación mecánica, lo cual favorece la colonización por Aspergillus spp. La colonización por este hongo es un factor de mortalidad en esta población7.
En los pacientes con EPOC se ha encontrado que el humo del cigarrillo y las infecciones pulmonares frecuentes alteran el movimiento ciliar, facilitando la adherencia de las conidias del Aspergillus spp. al epitelio de la vía aérea. Las altas dosis de esteroides inhalados son otro factor de riesgo asociado. La AI en este grupo de pacientes se puede presentar como una neumonía o una exacerbación de la EPOC, que no se resuelve ante el manejo antibiótico usual. En la fibrobroncoscopia se observan signos de traqueobronquitis con eritema, ulceración y nódulos en el árbol respiratorio. La mortalidad en este grupo de pacientes puede llegar hasta un 95%8,9. La aspergilosis traqueobronquial se presenta en un 8-10% de los casos y se reconocen 2 formas de presentación: la traqueobronquitis pseudomembranosa (más común en neutropénicos) y la forma ulcerosa, frecuente en receptores de trasplante pulmonar10.
Dentro de las herramientas diagnósticas se cuenta con la detección del antígeno galactomanano, cuya positividad sérica se considera cuando el índice es mayor de 0,7, en una sola medición, o mayor de 0,5 en 2 mediciones; su valor predictivo depende del contexto clínico del paciente. Así: en pacientes neutropénicos tiene una sensibilidad del 85% y una especificidad del 95%, en pacientes con neoplasias hematológicas la sensibilidad es del 70%, en pacientes con trasplante de médula ósea es del 80%, pero es baja en el caso de trasplante de órgano sólido (25-50%). En pacientes de UCI, que ingresan por EPOC y AIP, 2 determinaciones positivas en suero dan una sensibilidad del 47,1% y una especificidad del 93,5%; la variación en el rendimiento de esta prueba se argumenta bajo el concepto de que, en ausencia de neutropenia, hay depuración adecuada del antígeno11. La cuantificación del galactomanano en el lavado broncoalveolar se ha convertido en una prueba de gran utilidad en pacientes de UCI. Meersseman et al. encontraron una sensibilidad de 88% y una especificidad de 87%, en 110 pacientes críticos, empleando un valor de corte de 0,5 del galactomanano en el lavado broncoalveolar12.
Descripción del casoHombre de 56 años, con antecedente de hipertensión arterial, úlcera péptica, y tabaquismo. Consultó por dolor abdominal y vómito. Ingresa en estado de choque, con abdomen agudo. Durante la cirugía se encontró úlcera péptica perforada en cara posterior de la segunda porción del duodeno, con peritonitis de 4 cuadrantes; se realizó drenaje de peritonitis y rafia duodenal, con posterior traslado a la UCI, en donde se dio ventilación mecánica, catecolaminas y hemodiálisis. Luego se complicó por la aparición de fístula duodenal, por lo que es llevado en 3 ocasiones más a lavado de cavidad abdominal. En los cultivos de líquido peritoneal, creció Candida albicans resistente a azoles y Klebsiella pneumoniae, con perfil betalactamasa de espectro extendido (BLEE+). Se inició meropenem con caspofungina. Su evolución fue hacia la mejoría clínica, con descenso de los reactantes de fase aguda y retiro de la terapia dialítica y del soporte vasopresor.
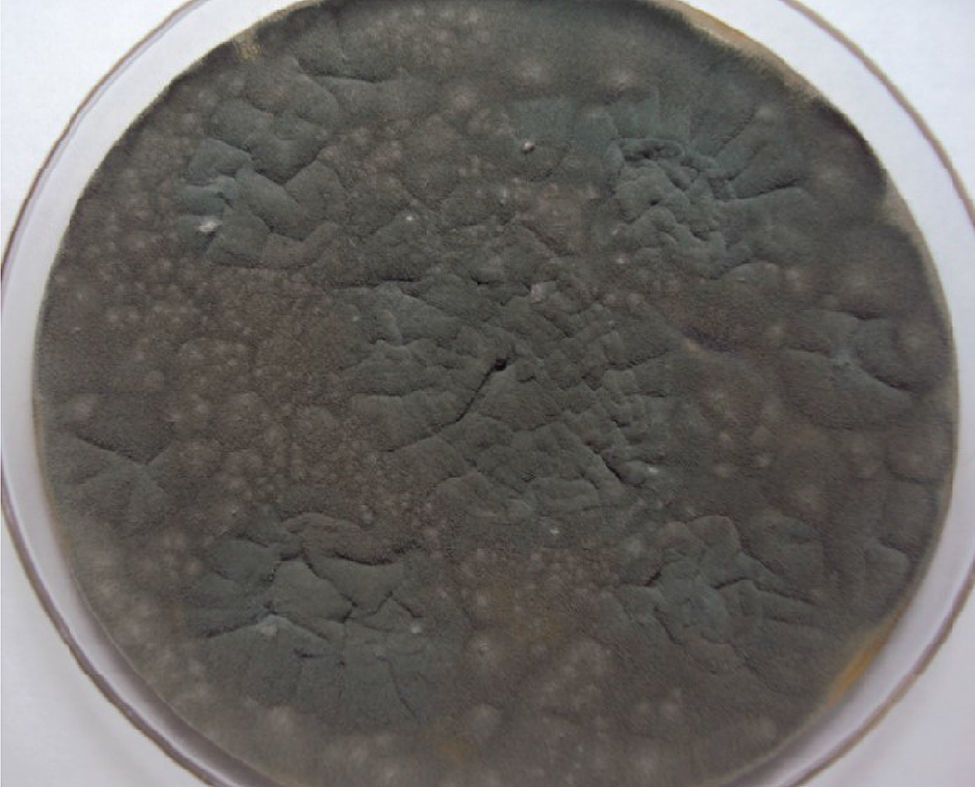
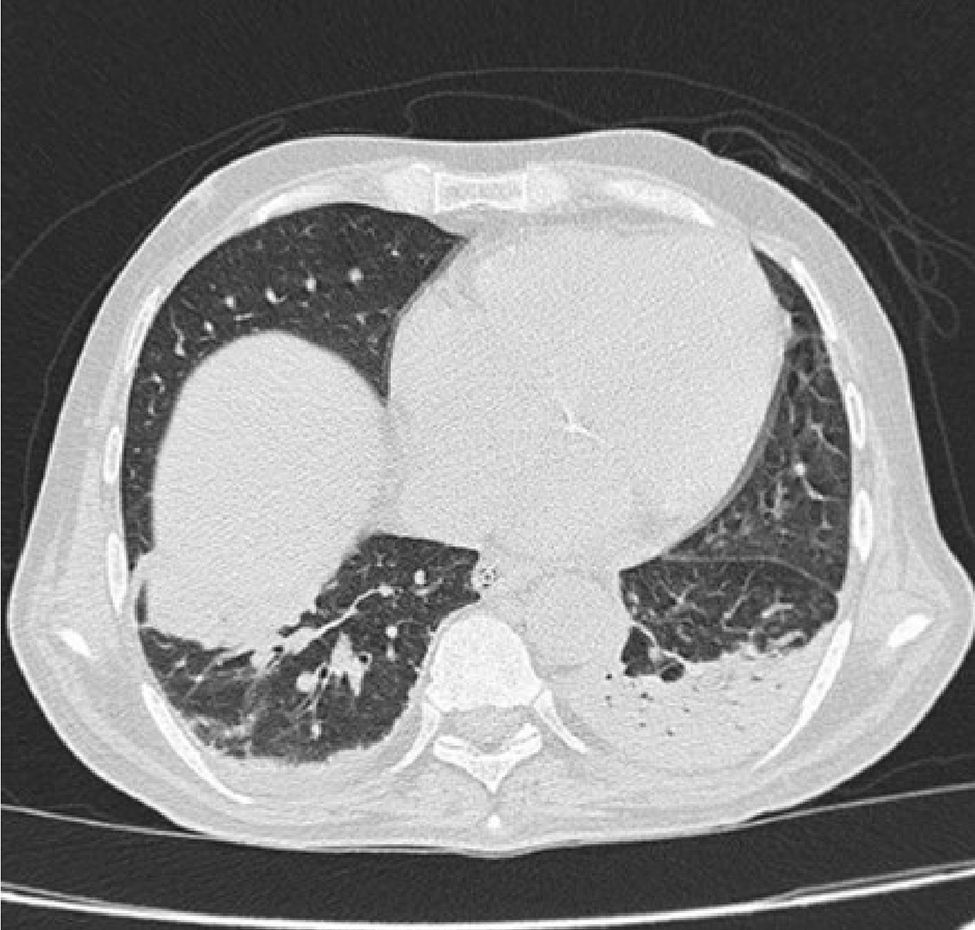
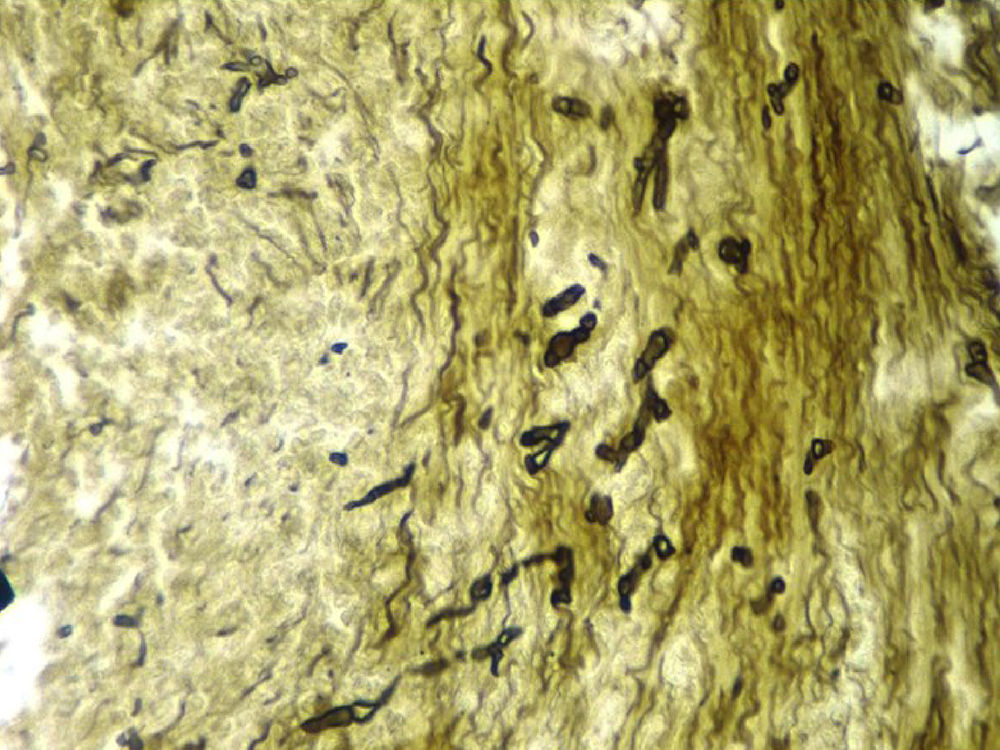
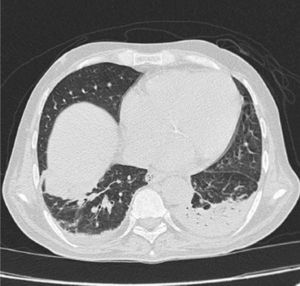
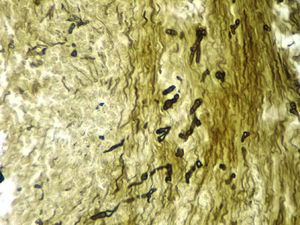
A los 20 días de estancia en UCI, presentó episodio de hemoptisis masiva, con fiebre y aumento de la respuesta inflamatoria. Los hemocultivos para aerobios fueron negativos, la tomografía axial computarizada (TAC) de abdomen no evidenció colecciones, la TAC de senos paranasales descartó sinusitis. Se tomó aspirado traqueal ante la sospecha de neumonía asociada a la ventilación mecánica, que documentó la presencia de Aspergillus fumigatus (fig. 1). La TAC de alta resolución de tórax reportó atelectasia basal izquierda, derrame pleural bilateral, engrosamiento liso de los septos con signos de hipertensión pulmonar y sin evidencia de signo de halo ni de semiluna (fig. 2). Es valorado por el servicio de Neumología quien realizó una fibrobroncoscopia con LBA, evidenciando la presencia de una úlcera en carina, que era la causa de la hemoptisis; se tomó biopsia de esta úlcera que reportó la presencia de esporas e hifas septadas, ramificadas en ángulo agudo, compatibles con Aspergillus spp. (fig. 3). Adicionalmente se realizó galactomanano sérico que fue negativo y galactomanano en el LBA que fue positivo (3,45 OD).
Con el cultivo de aspirado traqueal, biopsia de la úlcera en carina y galactomanano en LBA se consideró el diagnóstico de AIP por Aspergillus fumigatus y se inició manejo con voriconazol, con una evolución clínica favorable, que permitió el traslado a salas de Medicina Interna y posteriormente, el egreso.
DiscusiónLa AIP se presenta con disnea, tos y fiebre en pacientes con EPOC, que han sido expuestos a antibióticos y esteroides inhalados y sistémicos. La AIP puede ser una causa de ingreso a UCI, requiriendo ventilación mecánica en un 36% de los casos, con una mortalidad del 54%6. Bulpa et al.8 definieron AIP probada en pacientes con EPOC, cuando hay una lesión en tracto respiratorio con un tiempo inferior a 3 meses, en la cual se puede demostrar la presencia de hifas compatibles con Aspergillus spp., acompañada de un cultivo positivo de una muestra de tracto respiratorio inferior y el galactomanano positivo. El galactomanano en LBA ha demostrado tener una mayor sensibilidad que la realizada en suero (87 y 65%, respectivamente) con una especificidad igual a la del suero, cuando el valor de corte es 1,0 (95%)11.
Ante la dificultad para lograr establecer el diagnóstico de AIP en pacientes de UCI, Vanderwoude et al.13 crearon un algoritmo de diagnóstico clínico que debe tener los siguientes 3 criterios: cultivo de tracto respiratorio positivo para Aspergillus spp., signos y síntomas compatibles y hallazgos radiológicos sugestivos, con un cuarto criterio que puede ser los factores de riesgo o la presencia de Aspergillus spp. en un cultivo de LBA (tabla 1). Este algoritmo ha sido validado recientemente en un estudio multicéntrico, que incluyó a 524 pacientes con aislamiento de Aspergillus spp. en el aspirado endotraqueal14, de los cuales a 115 pacientes se les obtuvieron datos histopatológicos, que fueron considerados como la prueba diagnóstica. El algoritmo tenía una especificidad del 61%, una sensibilidad del 92%, un valor predictivo positivo del 61% y negativo del 92%. Este algoritmo diagnostica en un 32% de más los casos de aspergilosis, al ser comparado con los criterios de la Organización Europea para la Investigación y tratamiento del cáncer (EORCT/MSG).
Algoritmo clínico para aspergilosis en UCI
| 1. Cultivo de tracto respiratorio positivo para Aspergillus spp. |
| 2. Signos y síntomas compatibles (uno de los siguientes) |
| Fiebre refractaria de mínimo 3 días y con terapia antibiótica adecuada |
| Recrudescencia de la fiebre después de un período de defervescencia de mínimo 48 h sin cambio de antibióticos y ninguna otra causa aparente |
| Dolor torácico pleurítico |
| Frote pleural |
| Disnea |
| Hemoptisis |
| Empeoramiento de la insuficiencia respiratoria a pesar de tener manejo antibiótico y soporte ventilatorio adecuados |
| 3. Radiografía o TAC de tórax anormal |
| 4. Otros 4a o 4b: |
| 4a: Factores de riesgo del huésped (una de las siguientes condiciones) |
| Neutropenia (conteo absoluto de neutrófilos <500/mm3) antes de la admisión a UCI |
| Enfermedad hematooncológica tratada con agentes citotóxicos |
| Tratamiento con esteroides (prednisolona >20 mg/día o su equivalente) |
| Inmunodeficiencia congénita |
| 4b: Cultivo semicuantitativo de LBA positivo para Aspergillus spp. (+ o ++) sin crecimiento bacteriano ni evidencia de hifas en la citología |
La primera línea de tratamiento es el voriconazol, con una mortalidad menor que la anfotericina B15. Sin embargo, el voriconazol tiene múltiples interacciones medicamentosas que restringen su uso en pacientes con enfermedad hepática, debido al mayor riesgo de hepatotoxicidad. La insuficiencia renal (tasa de depuración de creatinina estimada <50mL/min) contraindica la utilización de la forma intravenosa por la acumulación de la ciclodextrina de sodio (vehículo de este azol), que puede acumularse a pesar de la hemodiálisis y causar neurotoxicidad. En estos casos debe emplearse anfotericina liposomal, que es tan efectiva como la anfotericina deoxicolato, pero con menos efectos secundarios16.
En conclusión, la AIP es una enfermedad que no es exclusiva de los pacientes con neoplasias hematológicas y neutropénicos. Existen otros factores de riesgo como son la EPOC, cirrosis hepática, uso de esteroides y sida.
Se requiere un alto índice de sospecha en pacientes en UCI y emplear las herramientas diagnósticas para confirmar de una forma oportuna su diagnóstico. El retraso en el manejo adecuado se asocia con alta mortalidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.