A pesar del conocimiento actual de la fisiopatología de la sepsis, esta enfermedad sigue siendo una de las principales causas de muerte a nivel mundial. Alrededor del 40% de los pacientes admitidos a la unidades de cuidado intensivo desarrollan esta enfermedad, y del 20 al 50% de los pacientes sépticos mueren por complicaciones asociadas. La investigación actual busca comprender mejor los mecanismos celulares y moleculares de esta enfermedad, y extrapolar estos hallazgos en aplicaciones clínicas que mejoren el pronóstico de estos pacientes. Actualmente, se cree que un hospedero susceptible desarrolla una respuesta inflamatoria sistémica (SIRS) en respuesta a un patógeno; sin embargo, algunos individuos progresan hacia un estado de inmunoparálisis denominado síndrome de respuesta antiinflamatoria compensatoria (CARS), asociado a infecciones secundarias. El objetivo de esta revisión es resaltar las principales características de la fisiopatología de la sepsis, destacando las implicaciones clínicas de la investigación básica, desde una perspectiva inmunológica.
Despite our current understanding of sepsis pathophysiology, this disease is still a leading cause of death worldwide. Forty percent of patients admitted to intensive care units develop this illness, and 20 to 50% of septic patients die due to its associated complications. Current research aims to improve our understanding of the cellular and molecular mechanisms of this disease and translate these findings into clinical applications that provide a better prognosis for these patients. Currently, it is believed that a susceptible host develops a systemic inflammatory response syndrome (SIRS) after an encounter with a pathogen; however, some individuals progress to a state of immunoparalysis known as compensatory anti-inflammatory response syndrome (CARS), which has been associated with secondary infections. The purpose of the present review is to highlight the main features of sepsis pathophysiology and to highlight the clinical implications of basic research from an immunological perspective.
En 1972, Lewis Thomas introdujo el concepto de que la respuesta del sistema inmune frente a los microorganismos durante una infección puede ser tan fuerte que se convierta en nociva para nosotros mismos1. Posteriormente, Roger Bone acuñó el término síndrome de respuesta inflamatoria sistémica (SIRS) para describir a aquellos pacientes que presentaban evidencia clínica de este fenómeno proinflamatorio2. La introducción de este paradigma propició la realización de varios ensayos clínicos con el fin de evaluar la eficacia de diversos agentes que pudieran disminuir los efectos adversos de la respuesta inflamatoria; sin embargo, ninguno produjo los resultados esperados3. Actualmente, se considera que la sepsis consiste en un estado de inflamación exacerbado que se desarrolla en respuesta a un patógeno. Algunos individuos, buscando regular el sistema, progresan hacia un estado de inmunoparálisis conocido como síndrome de respuesta antiinflamatoria compensatoria (CARS) que parece volverlos susceptibles al desarrollo de infecciones secundarias e incluso a un mayor riesgo de muerte3. A pesar de los avances en el entendimiento de la fisiopatología de la sepsis, esta enfermedad continúa siendo un gran problema de salud mundial con una mortalidad que va del 20 al 50%, dependiendo de la gravedad del cuadro clínico4. Recientemente, un estudio multicéntrico realizado en nuestro país encontró que la mortalidad al día 28 en los pacientes con sepsis, sepsis grave, y choque séptico es de 7,3, 21,9 y 45,6%, respectivamente5. A continuación, se hará una descripción de los eventos inmunológicos asociados con el desarrollo de esta dolencia, así como los posibles blancos terapéuticos objeto de inmunomodulación.
Síndrome de respuesta inflamatoria sistémicaEl término SIRS fue propuesto en 1991 para describir un proceso inflamatorio que se encuentra asociado al menos con 2 de las siguientes manifestaciones clínicas: a) temperatura corporal>38°C o<36°C; b) frecuencia cardíaca>90 latidos por minuto; c) frecuencia respiratoria>20 respiraciones por minuto o evidencia de hiperventilación con una PaCO2<32mmHg y d) recuento de leucocitos en sangre periférica>12.000/mm3 o<4.000/mm3, o con presencia de neutrófilos inmaduros (bandas)>10%6. Cuando el SIRS es el resultado de un proceso infeccioso se denomina sepsis6. La conferencia de consenso del 2001 evaluó esta propuesta de definiciones y, aunque no encontró evidencia suficiente que permita un cambio sustancial en las mismas, destaca que los criterios del SIRS no son muy sensibles ni específicos y propone ampliar la lista de manifestaciones que pueden reflejar un proceso infeccioso con respuesta generalizada del individuo6.
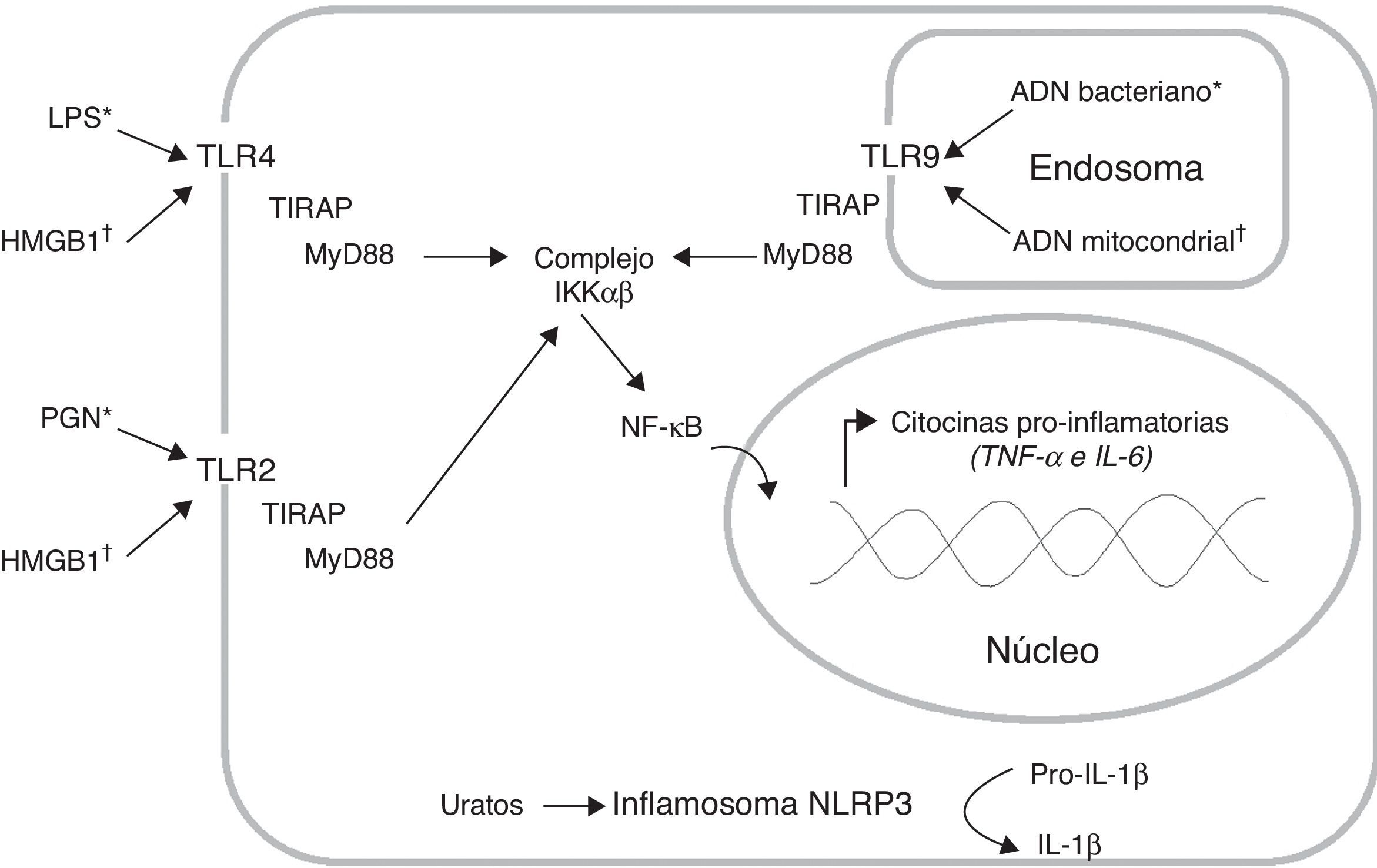
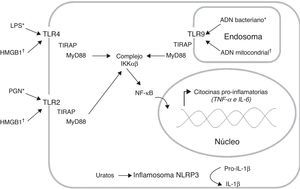
Inducción y amplificación de la respuesta inflamatoriaLas células del sistema inmune innato, como los monocitos/macrófagos y las células dendríticas (CD), expresan receptores de reconocimiento de patrones (PRR) que reconocen estructuras muy conservadas de los microorganismos invasores denominadas patrones moleculares asociados a patógenos (PAMP), y también reconocen y se unen a moléculas endógenas denominadas patrones moleculares asociados a daño (DAMP)7. Entre los PRR encontramos los receptores tipo toll (TLR), los cuales presentan una localización celular específica y reconocen determinados PAMP7. La interacción entre los TLR y sus respectivos ligandos activa vías de señalización que inducen la respuesta inflamatoria (fig. 1). Este proceso requiere de múltiples moléculas adaptadoras intracelulares tales como TIRAP y MyD88, las cuales se asocian al dominio citoplasmático de la proteína TLR e inducen la disociación del complejo IKKαβ para liberar el factor de transcripción NF-κB; este factor se transloca al núcleo e induce la transcripción de los genes que codifican citocinas proinflamatorias7. Y se ha demostrado que los pacientes sépticos presentan niveles elevados de citocinas proinflamatorias3.
Producción de citocinas pro-inflamatorias a través de la activación de distintos receptores de reconocimiento de patrones (PRR). Los receptores tipo toll (TLR) reconocen tanto patrones moleculares asociados a patógenos (PAMP*) como patrones moleculares asociados a daño (DAMP†). La interacción ligando receptor induce el reclutamiento de las moléculas adaptadoras TIRAP y MyD88, lo cual activa la vía de señalización que permite la disociación del complejo IKKαβ para liberar el factor de transcripción NF-kB; este factor se transloca al núcleo e induce la transcripción de los genes que codifican citocinas pro-inflamatorias. Adicionalmente, el inflamosoma NLRP3 puede reconocer los cristales de ácido úrico, lo cual induce la conversión de la Pro-IL-1β (forma inactiva) en IL-1β (forma activa). Lipopolisacárido (LPS), peptidoglicano (PGN).
Las bacterias gramnegativas han sido los microorganismos asociados con mayor frecuencia a la sepsis; sin embargo, la frecuencia de los gérmenes grampositivos relacionados con esta enfermedad ha aumentado en los últimos años5. En Colombia, ambos grupos de microorganismos se encuentran asociados tanto a las infecciones adquiridas en la comunidad como a las intrahospitalarias5. El lipopolisacárido (LPS) es el componente mayoritario de la pared celular de las bacterias gramnegativas, mientras que el peptidoglicano (PGN) es el principal componente de la pared celular de las bacterias grampositivas; estos PAMP son reconocidos a través del TLR4 y del TLR2 respectivamente7 (fig. 1). Adicionalmente, el ADN bacteriano es reconocido por el TLR9 presente en los endolisosomas debido a que contiene secuencias CpG7 (fig. 1). El reconocimiento inicial de los patógenos puede ser llevado a cabo, entre otros, por los macrófagos y mastocitos residentes en los tejidos, los cuales liberan diversos mediadores inflamatorios tales como quimiocinas, citocinas, aminas vasoactivas, eicosanoides y productos de cascadas proteolíticas8. Cabe destacar que las citocinas proinflamatorias TNF-α, IL-1β, e IL-6 inducen la respuesta de fase aguda, así como la activación del endotelio y de otros leucocitos8.
El daño causado a los tejidos por todos esos mediadores inflamatorios liberados induce, a su vez, la liberación de moléculas endógenas que también pueden activar el sistema inmune9. La proteína HMGB1 es una proteína no histona que modifica el plegamiento del ADN; esta puede ser liberada pasivamente al medio extracelular por células necróticas o de manera activa por los monocitos y los macrófagos activados9. En el 2005, se reportó que la concentración plasmática de la HMGB1 de los pacientes con sepsis grave y choque séptico se mantiene elevada hasta por una semana después del ingreso al servicio hospitalario10. Sin embargo, un estudio multicéntrico realizado en Europa encontró que la cinética de las concentraciones plasmáticas de la HMGB1 en los pacientes sépticos puede variar, dependiendo de la fuente primaria del sitio de infección11. La HMGB1 induce la activación del TLR2 y del TLR412 (fig. 1), promoviendo aún más la producción de citocinas proinflamatorias en monocitos13. Además, se ha demostrado que la HMGB1 induce un patrón distintivo en la expresión génica y la activación de los neutrófilos de pacientes sépticos14. Nuestro grupo estudió la utilidad diagnóstica15 y pronóstica16 de esta proteína, con resultados negativos en ambos casos.
Otros factores endógenos que pudieran contribuir al estado inflamatorio exacerbado son los DAMP mitocondriales; se ha demostrado que estas moléculas son reconocidas a través de receptores presentes en los neutrófilos e inducen su activación, migración y degranulación tanto in vivo como in vitro17. Adicionalmente, se ha demostrado que los cristales de urato monosódico (producto de degradación de las purinas) inducen la producción de IL-1β a través del inflamosoma NLRP3 (fig. 1) y que además actúan en sinergia con el LPS para activar el TLR4, promoviendo aún más la producción de IL-1β18.
Susceptibilidad genética al desarrollo de un estado proinflamatorioDesde las investigaciones iniciales se reportó el aumento de citocinas proinflamatorias en pacientes con sepsis, especialmente en aquellos individuos que morían a causa de esta enfermedad3. Los polimorfismos presentes en los promotores de los genes que codifican para las citocinas pudieran determinar las concentraciones plasmáticas de estas proteínas durante la respuesta a una infección3. De hecho, se han descrito diferentes variantes alélicas del gen que codifica para el TNF-α, entre ellas un polimorfismo de un solo nucleótido (SNP) en la posición -308 ubicada en la región del promotor que da origen a las variantes TNF1 (G/G) y TNF2 (G/A o A/A)19; el alelo TNF2 se presenta en baja frecuencia en la población y se ha asociado con una mayor producción de TNF-α20. Diversos estudios han encontrado una asociación entre este polimorfismo y la susceptibilidad a desarrollar sepsis21; sin embargo, también se han reportado resultados contradictorios22. Recientemente, una revisión sistemática seguida de un metaanálisis encontró que el alelo TNF2 está asociado al desarrollo de sepsis; sin embargo, no encontró asociación alguna entre esta variante y la mortalidad observada en este grupo de pacientes23.
También se han descrito polimorfismos en el gen que codifica la IL-1β; entre ellos el SNP-511 (C>T) que se ubica en la región promotora del gen y determina el nivel de expresión de la proteína24. Aunque se ha encontrado asociación entre este polimorfismo y el riesgo de desarrollar sepsis25, se requieren cohortes con un mayor número de individuos que permitan corroborar la participación de esta variante biológica en la fisiopatología de la enfermedad. Adicionalmente, se ha estudiado el polimorfismo -174 (G/C) ubicado en el promotor del gen que codifica para la IL-6 en el contexto de la sepsis26; sin embargo, los hallazgos recopilados hasta la fecha han sido contradictorios27.
Síndrome de respuesta antiinflamatoria compensatoriaEl paradigma de la inflamación exacerbada no logra explicar completamente los eventos observados en los pacientes con sepsis3; de hecho, durante este proceso también se liberan moléculas antiinflamatorias que buscan regular la respuesta inmune2, y en algunos casos se puede llegar a desarrollar un CARS2. El CARS se ha asociado con cambios en el sistema inmune (tabla 1), entre los que se destacan la alteración en la expresión del HLA-DR en monocitos (mHLA-DR), la apoptosis en linfocitos y el aumento de las citocinas reguladoras, los cuales parecieran influir en el desarrollo de infecciones secundarias y la muerte del paciente28. Sin embargo, los hallazgos asociados a CARS han sido principalmente descritos en cohortes aisladas, por lo que ha sido difícil hacer una caracterización completa de este proceso que permita proponer blancos terapéuticos susceptibles de inmunomodulación.
Principales características inmunológicas del síndrome de respuesta antiinflamatoria compensatoria (CARS), su asociación con el desenlace clínico, su posible uso como biomarcador y el posible agente inmunomodulador requerido como terapia
| Característica | Asociación (referencias) | Posible biomarcador | Posible agente inmunomodulador (referencias) |
|---|---|---|---|
| Disminución en la expresión del HLA-DR en monocitos | Mortalidad (35) Infección secundaria (29) | ΔmHLA-DR | G-CSF GM-CSF (40) |
| Apoptosis en linfocitos | Mortalidad (41) Infección secundaria (41) | % de linfocitos de sangre periférica en apoptosis | IL-7 e IL-15 (27) |
| Predominio de la respuesta Th2 sobre Th1 | Mortalidad (46) | - | Anti-IL-10 (27) |
Los monocitos son células del sistema inmune que se originan a partir de precursores mieloides presentes en la médula ósea, los cuales entran a la circulación y días después migran a los tejidos para diferenciarse en macrófagos29. Adicionalmente, se ha demostrado que esta población celular puede diferenciarse a CD mieloides tanto in vitro como in vivo29. Los monocitos expresan en forma constitutiva la molécula HLA-DR en su superficie y se ha determinado que en individuos sanos el porcentaje de monocitos que la expresan es>90%30; sin embargo, su expresión puede estar disminuida de manera parcial o total en pacientes con sepsis31. Este proceso se ha asociado a defectos en la producción de citocinas proinflamatorias y en la presentación antigénica a los linfocitos T, alterando el desarrollo de una respuesta adaptativa adecuada30. Un estudio realizado en Finlandia analizó el mHLA-DR en 61 pacientes con sepsis, admitidos a 2 unidades de cuidados intensivos de un hospital local, y encontró que el porcentaje de monocitos que expresaban HLA-DR de los individuos que fallecieron era significativamente menor al momento del ingreso con respecto a los sobrevivientes32. Hallazgos similares fueron encontrados en un estudio realizado en Grecia que incluyó una cohorte de 35 pacientes con diagnóstico de sepsis grave33. En contraste, un estudio realizado en 93 pacientes en choque séptico no encontró diferencias estadísticamente significativas en el porcentaje de monocitos que expresaban mHLA-DR entre sobrevivientes y no sobrevivientes34. Así mismo, una cohorte que incluyó a 35 pacientes con sepsis grave en Taiwán reportó resultados similares35. Teniendo en cuenta la disparidad de estos hallazgos, algunos estudios han analizado las variaciones en la expresión del mHLA-DR en el tiempo. Monneret et al. estudiaron su expresión durante los días 1-2 y 3-4 en pacientes con choque séptico y encontraron que el porcentaje de monocitos que expresan HLA-DR era significativamente mayor en los sobrevivientes con respecto a los no sobrevivientes en los días 3-434. Un estudio prospectivo realizado en China midió el mHLA-DR durante los días 0, 3, y 7 en un grupo de 79 pacientes adultos con diagnóstico de sepsis grave; los investigadores analizaron los cambios en el valor medido los días 3 y 7 con respecto al día 0 (ΔmHLA-DR3 y ΔmHLA-DR7) y encontraron que los pacientes con un ΔmHLA-DR3 ≤ 4,8% presentaban mayor mortalidad que aquellos con un ΔmHLA-DR3>4,8% (71,4 vs. 2.0%; OR 125; IC 95%: 13,93-1.121,67); de manera similar, los pacientes con un ΔmHLA-DR7 ≤ 9% tenían mayor mortalidad que aquellos con un ΔmHLA-DR7>9% (52,9 vs. 2,0%; OR 54,00; IC 95%: 5,99-486,08), lo cual sugiere que el cambio del mHLA-DR puede predecir de manera confiable la probabilidad de supervivencia en los pacientes con sepsis grave36. Finalmente, cabe resaltar que niveles disminuidos de mHLA-DR también se han relacionado con el desarrollo de infecciones secundarias en pacientes con sepsis30.
La evidencia recopilada hasta el momento ha permitido proponer que el mHLA-DR debería ser empleado en el monitoreo del paciente en estado crítico30, no solo en adultos sino también en niños, ya que el mHLA-DR también parece predecir de manera temprana el pronóstico de los pacientes con sepsis neonatal37. Sin embargo, es indispensable realizar una caracterización muy completa de las alteraciones del mHLA-DR en los pacientes sépticos antes de emplear este posible biomarcador de manera rutinaria. Esto es porque se ha observado que la expresión de esta molécula puede ser modulada de manera diferencial de acuerdo al tipo de infección subyacente, el patógeno implicado y la severidad de la enfermedad38. Adicionalmente, se ha observado que individuos con niveles elevados de IL-10 presentan una correlación inversa con el porcentaje de monocitos que expresan HLA-DR39; de hecho, se ha demostrado que la IL-10 regula negativamente la expresión del HLA-DR en los monocitos clásicos CD14Alt°CD16−40. Con base en todos estos estudios, se propuso que a los pacientes con sepsis que presenten disminución significativa del mHLA-DR se les debe administrar el factor estimulante de colonia de granulocitos (G-CSF) o el factor estimulante de colonia de granulocito-macrófago (GM-CSF) como inmunomoduladores; sin embargo, un metaanálisis que analizó 12 ensayos clínicos aleatorios (RCT) con 2.380 pacientes no encontró evidencia suficiente que soporte el uso rutinario de estas sustancias en el tratamiento de los pacientes con esta enfermedad41.
Apoptosis de linfocitosLa apoptosis es un tipo de muerte celular que morfológicamente se caracteriza por la contracción celular y la compactación y fragmentación del núcleo42. Este fenómeno puede ocurrir mediante la interacción de un ligando que interactúa con un receptor ubicado en la membrana plasmática de la célula (apoptosis extrínseca), por ejemplo la interacción del TNF-α con su receptor; o por el predominio de las proteínas proapoptóticas (BIM, PUMA u otras proteínas tipo BH3) sobre las antiapoptóticas (BCL2 y BCL-XL) debido a daño endógeno, lo cual induce la liberación del citocromo C por parte de la mitocondria y la activación de las caspasas efectoras (apoptosis intrínseca)42. Durante este proceso, las células en apoptosis liberan mediadores lipídicos los cuales atraen macrófagos, pero al mismo tiempo pueden inhibir la liberación de las citocinas proinflamatorias TNF-α e IL-12 y aumentar la liberación de factores inmunosupresores como la IL-1043. Adicionalmente, las células en apoptosis expresan el fosfolípido fosfatidilserina en la cara externa de la membrana plasmática, lo cual conlleva su reconocimiento por fagocitos a través de diferentes receptores como los tipo TAM (TYRO3, AXL y MER)43. Se ha demostrado que la activación de estos receptores inhibe la producción de citocinas proinflamatorias inducida por la señalización mediada por los TLR en células presentadoras de antígenos (CPA)43.
Se ha observado que los pacientes con sepsis presentan evidencia de apoptosis masiva de linfocitos, tanto en sangre periférica como en tejido linfoide42. Esta muerte es inducida tanto por la vía extrínseca como por la intrínseca en los linfocitos T44. La linfopenia resultante se asocia claramente con la mortalidad, puesto que la destrucción masiva de las células del sistema inmune impide una respuesta efectiva contra el insulto primario y además favorece la aparición de infecciones secundarias42. La apoptosis se ha observado en diversas poblaciones de linfocitos T como LT CD4+, LT CD8+, y en CPA HLA-DR+ presentes en el bazo de individuos con sepsis grave45. Además, la secreción de TNF-α, IFN-γ, IL-6 e IL-10 por los esplenocitos de estos pacientes es menos del 10%, comparada con la secreción en controles no infectados; este patrón de citocinas es independiente de la edad, del tiempo que dure la enfermedad, del uso de corticoesteroides y del estado nutricional45. Con base en estas evidencias, se ha propuesto el uso de las citocinas IL-7 e IL-15 para limitar la extensión de la apoptosis en pacientes con sepsis; además, la IL-15 también podría ayuda a restaurar la función efectora de los linfocitos28.
Predominio de la respuesta tipo Th2 sobre Th1Los linfocitos T CD4+ «ayudadores» representan una población celular heterogénea que se puede clasificar de acuerdo con el perfil de citocinas producidas luego de ser estimulados46. Durante las fases tempranas de la presentación antigénica, las CD activadas producen IL-12 que induce la polarización de los linfocitos T hacia un perfil Th1, caracterizado por la producción de citocinas proinflamatorias tales como el IFN-γ y el TNF-α; sin embargo, este fenómeno es transitorio y estas mismas células propician la respuesta tipo Th2, en la que predominan las citocinas reguladoras como la IL-4 e IL-1046. Algunos individuos con sepsis presentan niveles plasmáticos elevados tanto de citocinas proinflamatorias como de citocinas antiinflamatorias; sin embargo, el predominio de IL-10 sobre TNF-α es considerado un indicador de mal pronóstico47. Aunque la IL-10 puede ser producida por linfocitos T polarizados hacia la respuesta tipo Th2, esta citocina reguladora también puede ser secretada por monocitos, macrófagos, CD mieloides, neutrófilos y células T reguladoras48. Se ha demostrado que la producción de IL-10 por parte de las células T puede ser modulada positivamente a través de la IL-6 y el TGF-β49, mientras que en los macrófagos la producción de IL-10 se modula positivamente mediante la proteína C reactiva50. Adicionalmente, una mayor produción de IL-10 pudiera estar relacionada con la presencia de polimorfismos presentes en la región promotora del gen que codifica para esta citocina51. Una de las principales funciones de la IL-10 es regular la respuesta inmune frente a los patógenos; esta actividad biológica se ejerce mediante la inhibición en la producción de las citocinas proinflamatorias TNF-α, IL-6, IL-12 e IL-1β y la regulación negativa de la expresión del complejo mayor de compatibilidad clase ii en monocitos activados por LPS48. La IL-10 también inhibe la expresión de moléculas coestimuladoras como CD80 y de la molécula de adhesión ICAM-1 en monocitos/macrófagos; además, inhibe tanto la generación de CD derivadas de monocitos, como la maduración de las CD estimuladas con LPS, alterando de esta manera la presentación antigénica y, por ende, la proliferación y activación de las células T48. Teniendo en cuenta estos hallazgos se ha propuesto el uso de anti-IL-10 como posible agente inmunomodulador en los pacientes con sepsis que presenten niveles muy elevados de esta citocina reguladora28.
ConclusionesLa fisiopatología de la sepsis es un proceso complejo que involucra diversos elementos del sistema inmune, los cuales participan durante las diferentes etapas de la historia natural de la enfermedad. Entre ellas encontramos el reconocimiento inicial de los microorganismos a través de receptores presentes en las CPA, la amplificación de la respuesta inflamatoria por el reconocimiento de moléculas endógenas asociadas a daño, la producción de citocinas pro- y antiinflamatorias, la modulación en la expresión de mHLA-DR, y la apoptosis masiva de los linfocitos T. Aunque es muy probable que el genotipo del individuo contribuya a la susceptibilidad de padecer esta enfermedad, es el balance adecuado de los diferentes componentes lo que debe permitir alcanzar la regulación «estéril», sin causar un daño colateral excesivo. A pesar de estos avances, aún falta entender mejor la manera en la que cada uno de estos elementos contribuye al desarrollo de esta dolencia; además, es indispensable caracterizar los biomarcadores que permitan identificar claramente cuáles individuos se encuentran en fase proinflamatoria y cuáles presenten características de inmunosupresión inducida por sepsis. Cuando esto suceda, se podrá introducir la inmunomodulación como una herramienta terapéutica efectiva que permita disminuir tanto la mortalidad como la comorbilidad en los pacientes con sepsis.
FinanciaciónFinanciado por Estrategia de Sostenibilidad 2013-2014 del Grupo Inmunovirología y del Grupo Académico de Epidemiología Clínica de la Universidad de Antioquia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.