Las infecciones por micobacterias no tuberculosas (MNT) se describen en los últimos años con mayor frecuencia, especialmente en pacientes con inmunosupresión y en pacientes tratados por procedimientos estéticos. Las MNT incluyen especies del género Mycobacterium, diferentes del complejo Mycobacterium tuberculosis y Mycobacterium leprae.
ObjetivoDescribir las características demográficas y clínicas de pacientes hospitalizados con infecciones por MNT.
MetodologíaEstudio descriptivo retrospectivo.
ResultadosDe 187 pacientes con infección por micobacterias documentadas por cultivo, 17 (9,1%) tuvieron infección por MNT. Edad promedio de 38,4±19,2 años. El 58,82% fueron hombres. Las principales comorbilidades fueron VIH/sida (41,17%), diabetes mellitus (23,53%), enfermedad renal crónica (17,64%), terapia inmunosupresora (17,64%) y neoplasias (17,64%). En los coinfectados con VIH el recuento de CD4 fue <50 en 85,71%. Las especies más frecuentes fueron complejo M. avium (CMA) 35,29%, M. abscessus (17,65%) y M. chelonae (11,76%). Las formas de infección fueron: diseminada (35,29%), pulmonar (23,53%), piel y tejidos blandos (17,64%) y gastrointestinal (11,76%). Estancia promedio de 22,1 días; un 23,53% requirió atención en UCI. La mortalidad general fue 23,53%.
ConclusiónLas infecciones por MNT causan una serie de condiciones patológicas, los pacientes inmunocomprometidos son la población de mayor riesgo y las formas diseminada y pulmonar, las más frecuentes. La sospecha temprana así como la toma de muestras adecuadas y el uso de métodos diagnósticos apropiados son indispensables para su diagnóstico oportuno y tratamiento adecuado.
Nontuberculous mycobacteria (NTM) infections has been described more frequently in recent years, especially in immunosuppression conditions and after cosmetic surgical procedures. The NTM include species of the genus Mycobacterium, other than Mycobacterium tuberculosis complex and Mycobacterium leprae.
ObjectiveTo describe the demographic and clinical characteristics of Colombian in-patients with NTM infections.
MethodologyA retrospective descriptive study.
ResultsIn 187 patients with culture- confirmed mycobacterial infection, 17 (9,1%) had NTM. The mean age was 38,4±19,2 and 58,82% were men. Major comorbidities were: HIV/AIDS (41,1%), diabetes mellitus (23,5%), chronic renal disease (17,6%), immunosuppressive therapy (17,6%) and neoplasms (17,6%). In patients co-infected with HIV, CD4 count was <50 in 85,7%. The most frequent species were M. avium complex (MAC) in 35,2%, M. abscessus in 17,6% and M. chelonae in 11,7%. Infections were disseminated (35,2%), pulmonary (23,5%), skin and soft tissue (17,6%) and in gastrointestinal system (11,7%). The average hospital stay was 22,1 days and 23,5% required intensive care unit. Overall mortality was 23,5%.
ConclusionMNT infections cause a number of pathological conditions, being more frequent in immunocompromised patients. The disseminated and pulmonary forms were the most common. Early clinical suspicion and appropriate samples and diagnostic assays, are crucial for early diagnosis and treatment.
Colombia es un país donde la tasa de incidencia de tuberculosis (TB) se ha mantenido en los últimos años alrededor de 25/100.000 habitantes, con tendencia de incremento en las formas extrapulmonares y en la incidencia de TB en menores de 15 años1. Las infecciones por micobacterias no tuberculosas (MNT) usualmente generan compromiso de los siguientes órganos y sistemas: piel y tejidos blandos, tracto respiratorio, tejido linfoide, osteoarticular, gastrointestinal y las formas diseminadas. Este tipo de infecciones se describen en los últimos años con mayor frecuencia, especialmente en pacientes con inmunosupresión ya sea por infección por virus de la inmunodeficiencia humana (VIH) o por otras causas, y también asociadas a procedimientos estéticos. No es claro si existe realmente un incremento en la incidencia de infecciones por MNT, o si estamos ante la presencia de mejores técnicas de diagnóstico microbiológico o en una búsqueda más activa de infecciones por micobacterias2–5.
El concepto MNT se utiliza para distinguir las especies de micobacterias que no pertenecen al complejo Mycobacterium tuberculosis ni son Mycobacterium leprae. Las enfermedades causadas por MNT se conocen como micobacteriosis para diferenciarlas de la tuberculosis causada por todos los miembros del Complejo Mycobacterium tuberculosis incluido Mycobacterium bovis y la lepra causada por Mycobacterium leprae6.
La clasificación del género MNT establecida por Runyon en 1959, con base en sus características fenotípicas (crecimiento y pigmentación), nos permite agrupar y clasificar las especies de importancia clínica (tabla 1), sin embargo en esta no se incluyen todas las especies identificadas a posteriori7,8.
Clasificación de micobacterias no tuberculosas según características fenotípicas
| Grupo | Características fenotípicas | Especies |
| Grupo I | FotocromógenasProducen pigmento amarillo en presencia de luz | M. kansasiiM. marinum |
| Grupo II | EscotocromógenasProducen pigmento amarillo a naranja en presencia de oscuridad | M. scrofulaceumM. gordonae |
| Grupo III | No fotocromógenosNo producen pigmento | Complejo M. aviumComplejo M. terraeM. ulceransM. xenopiM. simiaeM. malmoenseM. szulgaiM. asiaticum |
| Grupo IV | Crecimiento rápido, crecen en menos de una semana | M. fortuitumM. chelonaeM. abscessus |
Fuente: Ruyon.
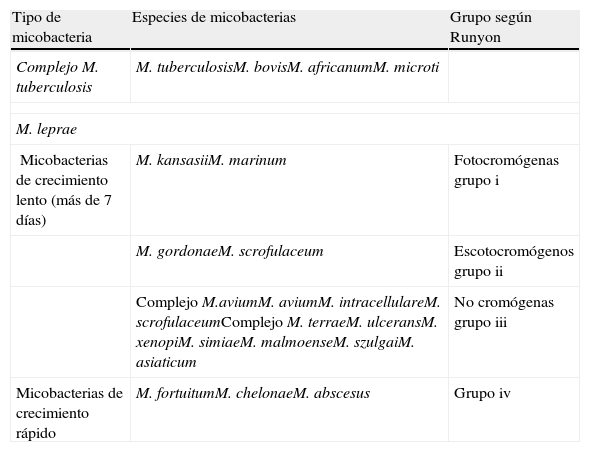
Actualmente se establecen relaciones entre las características genotípicas y fenotípicas, que han permitido la creación de árboles filogenéticos que agrupan la mayoría de las micobacterias. En la tabla 2 podemos observar las especies de micobacterias que se ha demostrado que causan enfermedad en humanos.
Clasificación de micobacterias que causan infección en humanos
| Tipo de micobacteria | Especies de micobacterias | Grupo según Runyon |
| Complejo M. tuberculosis | M. tuberculosisM. bovisM. africanumM. microti | |
| M. leprae | ||
| Micobacterias de crecimiento lento (más de 7 días) | M. kansasiiM. marinum | Fotocromógenas grupo i |
| M. gordonaeM. scrofulaceum | Escotocromógenos grupo ii | |
| Complejo M.aviumM. aviumM. intracellulareM. scrofulaceumComplejo M. terraeM. ulceransM. xenopiM. simiaeM. malmoenseM. szulgaiM. asiaticum | No cromógenas grupo iii | |
| Micobacterias de crecimiento rápido | M. fortuitumM. chelonaeM. abscesus | Grupo iv |
Las MNT son organismos ambientales, encontrados en aguas, polvos, suelos, animales y alimentos y, por tal motivo, no fueron consideradas patógenas inicialmente y su hallazgo era interpretado como colonización o, en algunos casos, como contaminación de los cultivos. El relativo lento crecimiento comparado con otras bacterias y la presencia de ácidos micólicos en su pared hacen que estas especies sean resistentes a los tratamientos de aguas con cloro9–11.
Normalmente las especies de MNT no son patógenos obligados y generalmente no causan enfermedad, sin embargo cuando hay detrimento del sistema inmune del huésped o hay rotura de las barreras de piel o mucosas, estos gérmenes pueden conllevar enfermedades potencialmente fatales6,12,13. La importancia de las infecciones por MNT está en relación con el mejor entendimiento de su cuadro clínico, sus mecanismos patogénicos, el desarrollo de métodos diagnósticos y las características del huésped a los que nos vemos enfrentados en los últimos años, especialmente cuando su sistema inmune está alterado.
El mecanismo patogénico exacto no es conocido, pero por la formación de granulomas y la presencia de formas diseminadas, se considera que su patogenia pudiese ser similar a TB. La infección pulmonar es adquirida a través de inhalación de aerosoles provenientes de suelos o aguas contaminadas y, a partir del compromiso pulmonar inicial, puede dar lugar a las formas diseminadas. La ingestión de alimentos o aguas contaminadas es otra forma de adquirir la enfermedad y posteriormente por diseminación hematógena generar formas diseminadas. La rotura de barreras cutáneas y de mucosas predispone a infecciones usualmente localizadas, situación que especialmente vemos en infecciones asociadas a trauma y a procedimientos estéticos8,13,14.
No se conoce realmente, cuando la enfermedad está presente, si esta se produjo por reactivación, reinfección o infección exógena primaria.
El compromiso o infección pulmonar por MNT usualmente está asociado a inmunosupresión y a defectos estructurales pulmonares previos. No es fácil establecer el diagnóstico de compromiso pulmonar por MNT: se requiere, además del cuadro clínico sugestivo, determinar el compromiso radiológico y el aislamiento microbiológico. Los criterios definidos por la Sociedad Americana del Tórax y la Sociedad Americana de enfermedades infecciosas (ATS/IDSA) deben ser aplicados en el diagnóstico de la enfermedad pulmonar por MNT. Sin embargo, están en mora de ser revisados, ya que ante la dificultad del diagnóstico microbiológico, el desarrollo de las pruebas de biología molecular ha ganado espacio y se consolidan como métodos diagnósticos y deberán ser incluidas en los criterios de diagnóstico de enfermedad de MNT15 (tabla 3).
Criterios ATS/IDSA para establecer diagnóstico de infecciones por MNT a nivel pulmonar
| Criterios clínicos, radiográficos y microbiológicos ATS/IDSA | |
| Criterios clínicos | Síntomas respiratorios compatiblesExclusión apropiada de otras enfermedades especialmente tuberculosis y micosis |
| Más | |
| Criterios radiográficos | Radiografía del tórax con evidencia de lesiones nodulares o lesiones cavitariasOTomografía del tórax de alta resolución (TACAR) que muestre bronquiectasias multifocales con múltiples nódulos pequeños |
| Más | |
| Criterios microbiológicos | Resultado de cultivo positivo de al menos 2 muestras separadas de esputo. (Si los resultados de las muestras de esputo inicial no son diagnósticos se debe considerar repetir muestras para tinciones y cultivos)OResultado positivo de cultivo de cepillado o lavado bronquialOCaracterísticas histopatológicas de biopsia transbronquial u otro tipo de biopsia pulmonar (inflamación crónica granulomatosa o tinción positiva) y cultivo positivo para MNT; o biopsia con características histopatológicas y uno o más cultivos positivos para MNT de muestras de esputo, cepillado o lavado bronquial |
| Se debe consultar con expertos cuando se obtienen cultivos positivos, ya que estos pueden ser debidos a contaminación ambiental | |
| En los pacientes en quienes se sospeche enfermedad pulmonar por MNT, pero que no cumplan los criterios diagnósticos, se debe realizar seguimiento clínico y microbiológico hasta que el diagnóstico quede firmemente establecido o excluido | |
| Hacer el diagnóstico de enfermedad pulmonar por MNT no implica, per se, la necesidad de iniciar tratamiento. Esta es una decisión basada en la evaluación de los beneficios y riesgos potenciales del tratamiento, en cada caso, de manera individual y particular | |
ATS: American Thoracic Society; IDSA: Infectious Diseases Society of America; MNT: micobacterias no tuberculosas.
Las MNT se consideran de poca contagiosidad y no se ha demostrado transmisión por aerosoles, lo cual tiene implicaciones epidemiológicas, pues no requeriría aislamiento por aerosoles, ni tampoco estudios epidemiológicos a sus contactos8,14.
Las infecciones de piel y tejidos blandos están relacionadas siempre con inoculación directa de la MNT a través de traumas, heridas quirúrgicas y con inyecciones, especialmente en procedimientos estéticos, sin embargo también se describen casos de compromiso cutáneo asociado a inmunosupresión, como es el caso de pacientes trasplantados, donde las formas cutáneas también pueden ser la expresión de formas diseminadas. Las manifestaciones cutáneas son variadas: patrón esporotricoide (diseminación linfocutánea), foliculitis recurrente, forunculosis recurrente, nódulos-abscesos subcutáneos que se fistulizan, úlceras y las formas crónicas con fibrosis, fístulas y deformidades retractiles del sitio afectado. En Colombia y en el mundo se han descrito brotes epidémicos asociados a procedimientos estéticos y en pacientes inmunosuprimidos, generando deformidades muchas veces irreparables5,13–18.
La mayoría de las MNT patógenas pueden causar infecciones de piel y tejidos blandos, siendo las más frecuentes las de crecimiento rápido (M. fortuitum, M. chelone y M. abscesus), pero también son frecuentes por M. marinum y por micobacterias de crecimiento lento como M. ulcerans que ocasiona la enfermedad de Buruli descrita en 1937 en Australia y en 1942 en África tropical, enfermedad que se ha considerada como una de las más frecuentes producidas por micobacterias después de tuberculosis y lepra.
El diagnóstico de infección de piel y tejidos blandos por MNT se establece por cultivo, pero la sospecha clínica con base en una anamnesis que haga énfasis en factores de riesgo, las manifestaciones clínicas, el bajo rendimiento de tinciones directas y la negatividad de estudios microbiológicos habituales, apoyados también por hallazgos histopatológicos en biopsias, llevan a establecer el diagnóstico5,13–19.
Horsburg en 1996 realizó una revisión de infecciones de relevancia clínica causadas por MNT y la mayoría de los casos quedaron agrupados en 4 síndromes clínicos: enfermedad pulmonar, compromiso ganglionar, compromiso de piel y tejidos blandos y la forma diseminada. Esta última, especialmente en huésped inmunosuprimido6. Sin embargo, además de los síndromes clínicos descritos, también hay compromiso de tracto gastrointestinal y compromiso osteoarticular20.
Dentro de las MNT, el complejo Mycobacterium avium (CMA) es la especie que causa enfermedad pulmonar con mayor frecuencia21; pero el compromiso pulmonar también se puede observar en M. kansasii, M. malmoense, M. abscessus y M. xenopi22.
En el trabajo realizado por Crespo en Cali (Colombia) para identificar la prevalencia de micobacterias en pacientes con VIH, encontró que la prevalencia de MNT fue del 5%, pero en esa población estudiada solo en el 1% se consideró que MNT fue causante de enfermedad. Las especies de MNT aisladas fueron M. gordonae (2%), M. sulgai (1%), M. fortuitum (1%) y M. avium (1%)23.
Murcia-Aranguren, en Bogotá, encontró que en 3 centros que atienden población de VIH/sida, de 286 pacientes incluidos con infección VIH estudiados para detectar oportunistas, solo 16 (5,6%) fueron positivos para cualquier especie de micobacteria; M. avium fue aislado en 13 (4,54%), M. tuberculosis en 4 (1,4%) y en 2 (0,7%) pacientes se aisló en forma simultánea M. tuberculosis y M. avium17.
En nuestro país, hay algunas series descritas de compromiso cutáneo por MNT; estas, en la mayoría de los casos, asociadas a procedimientos estéticos de mesoterapia, pero también existen formas cutáneas ocasionadas por inoculación directa en programas de desensibilización en pacientes alérgicos, así como manifestación de enfermedad diseminada o compromiso cutáneo asociado a inmunosupresión en pacientes trasplantados y oncológicos. La mayoría de estos casos son ocasionados por MNT de crecimiento rápido y se caracterizan por lesiones nodulares dolorosas, úlceras o fístulas. Las especies más frecuentemente aisladas en estas series fueron M. chelonea, M abscessus y M. fortiutum14,15,24. Sin embargo las formas esporotricoides que simulan carcinomas escamocelulares también han sido descritas en pacientes con inmunosupresión de base, como diabetes mellitus19.
En contraste con M. tuberculosis, cuyo reporte es obligatorio a nivel mundial, las infecciones por MNT no se reportan sistemáticamente, por lo que se carece de datos precisos acerca de su verdadera incidencia y prevalencia. Sin embargo en los países de alta prevalencia de TB, se describen cada días más casos de infecciones por MNT y esto ha generado interés por su descripción, con el fin de identificar sus características clínicas, factores de riesgo, comorbilidad y ubicación geográfica, así como de optimizar los métodos de detección e implementación de pruebas de biología molecular. El complejo M. avium es la MNT predominante en la mayoría de países, seguida de M. gordonae y M. xenopi. Importantes diferencias han sido observadas en la incidencia, prevalencia y ubicación geográfica de M. xenopi, M. kansasii y micobacterias de crecimiento rápido25–29.
El objetivo de este estudio es describir las características epidemiológicas, clínicas y microbiológicas de los pacientes con infecciones por MNT y aportar datos para la epidemiología colombiana y el entendimiento de las infecciones por MNT.
MetodologíaTipo de estudioEstudio observacional descriptivo retrospectivo.
PoblaciónPacientes hospitalizados con aislamiento microbiológico de MNT y confirmación de la especie por cultivo, atendidos en el Hospital Pablo Tobón Uribe (HPTU), centro de alta complejidad de atención, Medellín, Antioquia, Colombia, entre el 1 de enero de 2004 y el 31 de diciembre de 2010.
Se excluyeron aquellos pacientes que no tenían en la historia clínica la información de las variables demográficas, clínicas, durante la hospitalización en la cual se realizó el aislamiento.
Recolección de datosLos pacientes con aislamiento microbiológico de MNT se identificaron en la base de datos del grupo de microbiología del Hospital Pablo Tobón Uribe. Se evaluó la historia clínica de cada uno de ellos para identificar las variables (demográficas, clínicas, microbiológicas y desenlaces).
El método utilizado para el aislamiento microbiológico de las MNT durante los años 2004 a 2008 fue el medio de cultivo sólido Ogawa Kudoh y desde el 2009 se utiliza adicionalmente el método automatizado BD BACTEC™ MGIT™, equipo de Becton Dickinson.
Análisis estadísticoLas variables cuantitativas se expresaron como media y rango. Las variables cualitativas como frecuencias absolutas y relativas. Se utilizó el programa SPSS 13.0.
Fuentes de financiaciónLos investigadores no recibieron dinero de ninguna institución, el Hospital Pablo Tobón Uribe ofreció al grupo investigador todo el apoyo logístico necesario para llevar a cabo la recolección de datos y elaboración del artículo de investigación.
El protocolo de investigación fue aprobado por el Comité de Investigaciones y Ética en Investigaciones del Hospital Pablo Tobón Uribe.
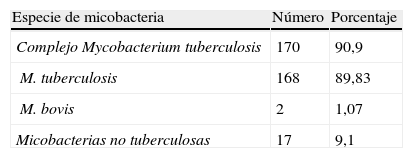
ResultadosDe 204 pacientes con infección por micobacterias, 187 fueron documentadas por cultivo; de estas, el 91,9% fueron M. tuberculosis y el 9,1%, MNT (tabla 4).
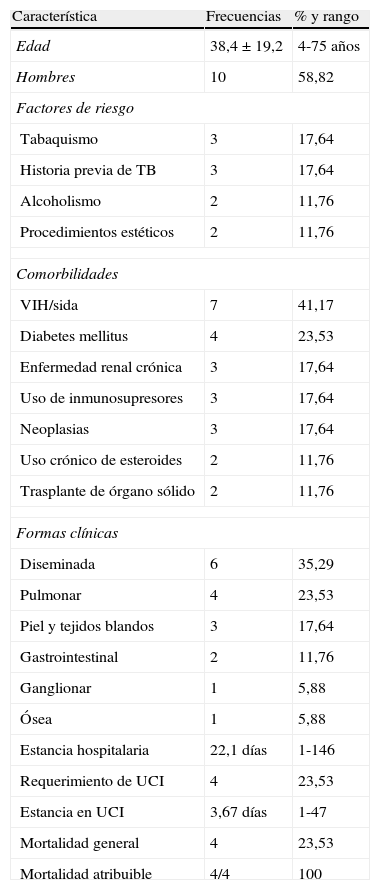
La edad promedio de los pacientes con infección por MNT fue 38,4±19,2 años (rango 4 a 75), 10 (58,82%) fueron hombres. Se identificaron como factores de riesgo tabaquismo e historia previa de tuberculosis en 17,64%, alcoholismo y procedimiento estéticos en 11,76%. Al ingreso, la fiebre fue el síntoma predominante en 82,53%, seguida de síntomas respiratorios 23,53% y manifestaciones cutáneas 17,64%. Las principales comorbilidades fueron VIH/sida 50,0% y diabetes mellitus 23,54%, seguidas por enfermedad renal crónica, neoplasias y uso crónico de esteroides con 17,64% cada una. Trasplante de órgano y uso crónico de esteroides fueron las otras 2 comorbilidades en el 11, 76% respectivamente (tabla 5).
Características generales de los pacientes con aislamiento de MNT en el HPTU entre 2004 y 2010 (n=17)
| Característica | Frecuencias | % y rango |
| Edad | 38,4±19,2 | 4-75 años |
| Hombres | 10 | 58,82 |
| Factores de riesgo | ||
| Tabaquismo | 3 | 17,64 |
| Historia previa de TB | 3 | 17,64 |
| Alcoholismo | 2 | 11,76 |
| Procedimientos estéticos | 2 | 11,76 |
| Comorbilidades | ||
| VIH/sida | 7 | 41,17 |
| Diabetes mellitus | 4 | 23,53 |
| Enfermedad renal crónica | 3 | 17,64 |
| Uso de inmunosupresores | 3 | 17,64 |
| Neoplasias | 3 | 17,64 |
| Uso crónico de esteroides | 2 | 11,76 |
| Trasplante de órgano sólido | 2 | 11,76 |
| Formas clínicas | ||
| Diseminada | 6 | 35,29 |
| Pulmonar | 4 | 23,53 |
| Piel y tejidos blandos | 3 | 17,64 |
| Gastrointestinal | 2 | 11,76 |
| Ganglionar | 1 | 5,88 |
| Ósea | 1 | 5,88 |
| Estancia hospitalaria | 22,1 días | 1-146 |
| Requerimiento de UCI | 4 | 23,53 |
| Estancia en UCI | 3,67 días | 1-47 |
| Mortalidad general | 4 | 23,53 |
| Mortalidad atribuible | 4/4 | 100 |
HPTU: Hospital Pablo Tobón Uribe; MNT: micobacterias no tuberculosas; TB: tuberculosis; VIH/sida: virus de inmunodeficiencia humana/síndrome de inmunodeficiencia adquirido; UCI: unidad de cuidado intensivo.
En los pacientes con infección VIH/sida el 85,6% (6/7) tuvieron recuento de CD4 menor de 50: El recuento promedio en estos pacientes fue de 25±20 cel/ml y la carga viral promedio de 83,344±40,796 copias/ml, todos ellos sin tratamiento antirretroviral o en falla inmunovirológica.
Las presentaciones clínicas extrapulmonares fueron el 76,4% y de estas en orden de frecuencia: infección diseminada 35,29%, piel y tejidos blandos 17,64%, gastrointestinal 17,64%, ganglionar 5,88% y compromiso óseo 5,88%.
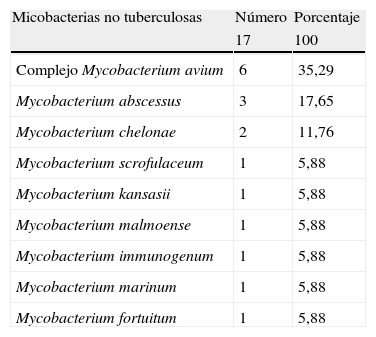
Las especies de MNT aisladas con mayor frecuencia fueron: CMA (35,29%), M. abscessus (17,65%), M. chelonae (11,76%) (tabla 6).
Especies de micobacterias no tuberculosas aisladas
| Micobacterias no tuberculosas | Número | Porcentaje |
| 17 | 100 | |
| Complejo Mycobacterium avium | 6 | 35,29 |
| Mycobacterium abscessus | 3 | 17,65 |
| Mycobacterium chelonae | 2 | 11,76 |
| Mycobacterium scrofulaceum | 1 | 5,88 |
| Mycobacterium kansasii | 1 | 5,88 |
| Mycobacterium malmoense | 1 | 5,88 |
| Mycobacterium immunogenum | 1 | 5,88 |
| Mycobacterium marinum | 1 | 5,88 |
| Mycobacterium fortuitum | 1 | 5,88 |
Las formas diseminadas 6/17 (35,29%) ocurrieron en 4 pacientes con inmunosupresión por VIH y en 2 trasplantados renales. Fueron ocasionadas por CMA en 4 casos (23,52%), M. abscessus en 1 (5,88%) y por M. malmoense en 1 (5,88%).
El compromiso pulmonar estuvo presente en 4 pacientes (23,53%) y fueron ocasionados por M. chelonae, M. scrofulaceum, M. abscessus y M. kansasii. Los patrones de compromiso pulmonar observados fueron infiltrados fibronodulares, bronquiectasias y distribución miliar. No se observaron lesiones cavitarias.
Las formas cutáneas 3/17 (17,64%) fueron ocasionadas por M. fortuitum, M. marinum y M. immunogenum; estas se caracterizaron por lesiones nodulares, fístulas y úlceras, 2 de ellas asociadas a procedimientos quirúrgicos.
El compromiso de tracto gastrointestinal ocurrió en 2 pacientes y fue ocasionado por CAM y M. abscessus. Tuvimos un caso de compromiso óseo por M. chelonae y un caso de compromiso ganglionar por CAM.
En los pacientes con infección VIH/sida, 6 casos fueron ocasionados por CAM y uno por M. malmoense.
La estancia hospitalaria promedio fue de 22,1 días (rango 1 a 146 días). De los pacientes hospitalizados el 23,53% requirió atención en UCI con una estancia promedio de 3,67 días (rango 1 a 47 días). La mortalidad general fue del 23,53% y, en todos los casos, la mortalidad ocurrió en pacientes atendidos en UCI y fue atribuida a infección diseminada.
DiscusiónLas infecciones por MNT se describen cada vez con mayor frecuencia en países de alta prevalencia de tuberculosis, relacionados cada vez más con la búsqueda activa por parte del clínico y también por avances tecnológicos en diagnóstico microbiológico y de biología molecular3,4,7,8,13,14,20,23,25–31.
Es una entidad que se debe tener en cuenta en pacientes inmunosuprimidos y, como lo muestra nuestra población, la inmunosupresión es un factor determinante en la forma de presentación clínica5,13,18,19,30. Las causas de inmunosupresión descritas como factores de riesgo en otros estudios son infección VIH/sida, uso de inmunosupresores, medicamentos antifactor de necrosis tumoral (anti-TNF) y enfermedades que depriman el sistema inmune.
Los estudios y descripciones realizados en Colombia identifican como los principales factores de riesgo la inmunosupresión por VIH, la diabetes mellitus, el haberse realizado procedimientos quirúrgicos estéticos o mesoterapia y la escarificación cutánea para desensibilización de alérgenos14,15,17,19,24,29.
En nuestra serie, las principales comorbilidades identificadas fueron VIH/sida, diabetes mellitus, uso de terapias inmunosupresoras, enfermedad renal crónica, neoplasias y trasplante de órgano. Todas ellas generan inmunosupresión de tipo celular y exponen a los pacientes a una serie de infecciones que tiene como uno de sus principales mecanismos de defensa la función celular T y, dentro de estas, las infecciones por micobacterias. También se describen como factores de riesgo para infección por MNT, tabaquismo y lesiones estructurales toracopulmonares como fibrosis quística, bronquiectasias y deformidad de la pared torácica. En nuestros pacientes documentamos como factores de riesgo tabaquismo, alcoholismo y procedimientos estéticos. Adicionalmente en el 17,64%, se identificó el antecedente de haber sufrido de tuberculosis pulmonar. Este último antecedente no ha sido establecido como factor de riesgo, pero es llamativo en nuestra serie, dado que la gran mayoría de los pacientes tienen inmunosupresión de base y es posible que este diagnóstico de tuberculosis solo se haya realizado por tinciones para bacilos ácido alcohol resistentes y no por cultivo, lo cual nos haría pensar en la posibilidad de un mal diagnóstico previo.
Las infecciones por MNT usualmente causan en el paciente inmunocomprometido enfermedad extrapulmonar y diseminada, como se corroboró en nuestra serie. Si bien CMA es unos de las principales causas de enfermedad diseminada, tuvimos 2 casos de infección diseminada causada por M. abscessus y M. malmoense, causas infrecuentes, pero también descritas5,6,8,21,22,31.
La infección pulmonar por MNT se caracteriza usualmente por compromiso difuso, con infiltrados reticulares, alveolares, nodulares y de aspecto miliar. Se describen 4 patrones de compromiso pulmonar: enfermedad cavitaria, bronquiectasias, fibronodular y neumonitis de hipersensibilidad6,8,20,21,31. En nuestros pacientes no se evidenció enfermedad cavitaria y tampoco había historia de lesiones estructurales previas y es llamativo, además, que el compromiso pulmonar fuese causado por MNT infrecuentes en enfermedad pulmonar y no por CMA, especie que generalmente es descrita como el principal agente etiológico de compromiso pulmonar en micobacteriosis5,8,20,25,26,31.
Las formas cutáneas son similares a las descritas en otras series, siendo el compromiso nodular y abscesos subcutáneos los más frecuentes. Los 3 pacientes tuvieron como factor de riesgo cirugías y estado de inmunosupresión13–16,19,24.
En pacientes inmunosuprimidos por infección VIH/sida, el conteo de CD4 es un factor predisponente para infecciones por MNT y, especialmente, de formas diseminadas cuando el conteo es menor de 50. En nuestra población 6 de los 7 pacientes (85,71%) con infección por VIH tenían CD4<50, con un promedio de 25±20 cel/ml, asociado esto a carga viral elevada, por carencia de terapia antirretroviral y falla inmunovirológica. En 6 casos el agente etiológico fue CMA y en uno M. malmoense. Hallazgos similares a los descritos en series de otros países. Es indispensable en nuestra población implementar la profilaxis con macrólidos, especialmente en la población más susceptible con recuento de CD4 ≤ 50, para evitar morbimortalidad asociada; conducta olvidada o no tenida en cuenta por el concepto erróneo de que en nuestra población la prevalencia de MNT es baja5,6,8,17,23,28,31.
A pesar de ser un número reducido de pacientes y de ser solo pacientes hospitalizados, nuestro grupo aporta datos sobre el comportamiento epidemiológico de las infecciones por MNT, especialmente en pacientes con inmunosupresión. Esto nos obliga en nuestras instituciones a tener en cuenta los factores de riesgo y comorbilidades asociados a las infecciones por MNT, a pensar en ellas dentro de los diagnósticos diferenciales y a implementar profilaxis para las mismas cuando estas estén indicadas, situaciones que no son norma en nuestra práctica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses ni recibieron dinero de ninguna institución. El Hospital Pablo Tobón Uribe ofreció al grupo investigador todo el apoyo logístico necesario para llevar a cabo la recolección de datos y elaboración del artículo de investigación. El protocolo de investigación fue aprobado por el Comité de Investigaciones y Ética en Investigaciones del Hospital Pablo Tobón Uribe.