El citomegalovirus es una de las principales causas de infección y enfermedad en receptores de trasplante renal, con un notorio impacto en términos de morbilidad, mortalidad y costos. Sin embargo, no existe en Colombia una práctica clínica estandarizada entre los centros de trasplante, por lo cual, es de suma importancia disponer de guías con el fin de orientar la estratificación, el diagnóstico de laboratorio, el tratamiento y la prevención de la infección y enfermedad por citomegalovirus en pacientes adultos con trasplante renal. A través de la metodología ADAPTE para la evaluación de calidad y transculturización de guías de práctica clínica a nuestro medio, un grupo multidisciplinario realizó una revisión sistemática de la literatura: se seleccionaron las guías internacionales, las cuales fueron evaluadas con el instrumento AGREE II en términos de calidad. Con la guía base seleccionada se buscó la evidencia existente para contestar a las preguntas, de acuerdo con el método de desarrollo de recomendaciones GRADE. Se realizaron recomendaciones para la estratificación, el diagnóstico, el tratamiento y la prevención de la infección y enfermedad por citomegalovirus en pacientes adultos con trasplante renal en Colombia.
Cytomegalovirus is a primary cause of infection and illness in patients who have had renal transplantation, with a significant impact on morbidity, mortality and economic costs. However, there is no standardized clinical practice in transplant centers in Colombia, and it is important to have guidelines to stratify, diagnose, treat and prevent cytomegalovirus infection and disease. Through ADAPTE's methodology for the quality evaluation and adaptation of clinical practice guidelines in our setting, a multidisciplinary group carried out a systematic review of the medical literature, selecting international guidelines that were evaluated with the AGREE-II instrument in terms of quality. With each selected guideline, an evidence table was constructed and the GRADE strategy was performed to develop recommendations. Recommendations related to stratification, laboratory diagnosis, treatment and prevention of infections and disease caused by cytomegalovirus in adult transplant patients were developed.
El trasplante renal es sin duda el tratamiento de elección para pacientes con enfermedad renal crónica en fases avanzadas1; sin embargo, el uso de inmunosupresión crónica con el objetivo de evitar el rechazo e impactar en la sobrevida del injerto y del paciente es un factor determinante en el riesgo de infección. La infección por citomegalovirus (CMV) es una de las complicaciones más frecuentes en receptores de trasplante renal, con un notorio impacto en términos de morbilidad, mortalidad y costos2–4. El CMV se distribuye ampliamente en la población general, con una prevalencia del 50-90%, que es mayor en los países en desarrollo y en las regiones con bajo nivel socioeconómico5. El riesgo de CMV está determinado por condiciones del huésped como edad, comorbilidades y características genéticas; sin embargo, los 2 factores de riesgo más relevantes son el estado serológico (la incidencia de enfermedad es mayor en grupos de alto riesgo: donante [D+], receptor [R−])6 y, en segunda instancia, el estado global de inmunosupresión7. El cuadro clínico varía de viremia asintomática autolimitada a síndrome o enfermedad invasiva tisular que compromete la vida. La infección viral, caracterizada por CMV ADN-emia (circulación de ADN viral) en sangre o plasma en ausencia de síntomas ocurre en cerca del 50% de receptores seropositivos y hasta en el 70% de receptores de alto riesgo (D+/R−), quienes desarrollan una infección primaria luego del trasplante8,9. Por su parte, el síndrome viral (carga viral positiva, fiebre, malestar, leucopenia o trombocitopenia) o enfermedad invasiva tisular ocurre entre el 15 y el 20% de los receptores seronegativos y en el 5-10% de los receptores de riesgo intermedio (R+)10. Las estrategias de prevención incluyen la terapia presuntiva, en la cual el tratamiento antiviral se inicia luego de detectar una carga viral significativa, o la profilaxis universal, usualmente utilizada en pacientes de alto riesgo. Sin embargo, cada aproximación tiene ventajas y desventajas en términos de eficacia, costos y efectos secundarios11. En Colombia, hay información limitada sobre la carga de la enfermedad por CMV en receptores de trasplante en general y con trasplante renal en particular12; sin embargo, se ha confirmado la alta frecuencia de infección por CMV y del compromiso tisular gastrointestinal. Teniendo en cuenta el impacto previsible de CMV en los receptores de trasplante en Colombia, se hace necesaria la generación de una guía de práctica clínica que oriente las decisiones de los clínicos con el fin de disminuir la morbimortalidad asociada y facilitar la toma de decisiones.
En este documento de consenso se encuentran una serie de recomendaciones basadas en la evidencia y adaptadas a la realidad colombiana, fruto del trabajo cooperativo de la Asociación Colombiana de Infectología, la Asociación Colombiana de Nefrología e Hipertensión Arterial y el Instituto Nacional de Salud. El consenso propone la implementación de estas recomendaciones en los grupos de trasplante del país, así como su adopción por todas aquellas instituciones, nefrólogos y otros especialistas que realicen procesos de seguimiento a pacientes trasplantados con el fin de lograr un mejoramiento en los estándares de calidad, y propone indicadores de evaluación en aras de evaluar el impacto de la intervención.
Objetivos del consensoGenerar una guía para la estratificación, diagnóstico, tratamiento y prevención de la infección por CMV en pacientes adultos con trasplante renal adaptada a la realidad colombiana mediante un proceso de transculturización, utilizando la metodología ADAPTE. El propósito es generar mediante un proceso sistemático una serie de recomendaciones con la mayor validez, claridad y aplicabilidad posible, y poner a disposición de los lectores la síntesis de la evidencia científica para orientar sus decisiones, con el ánimo de estandarizar y reducir la variabilidad de la práctica clínica.
Otros objetivos secundarios de la reunión de consenso fueron el de contribuir a disminuir la variación en la práctica clínica en este grupo de pacientes; el de contribuir al mejoramiento de la tecnología disponible en nuestro medio, asegurando un uso racional y adecuado de las diversas pruebas diagnósticas; el de definir los medicamentos y su dosificación correcta tanto en el tratamiento como en la prevención, contribuyendo a mejorar los desenlaces en los pacientes, así como a disminuir el riesgo potencial de resistencia.
Aspectos clínicos abordados por la guíaLos aspectos clínicos abordados por la guía incluyen la estratificación del riesgo de infección/reactivación, diagnóstico de laboratorio e histopatológico, el tratamiento farmacológico y las estrategias de prevención.
Pacientes objetivoLos pacientes diana de este consenso son adultos (mayores de 18 años) con trasplante renal de cualquier tipo. Se excluye de estas recomendaciones a la población en edad pediátrica (menores de 18 años) y otros tipos de trasplante de órgano sólido.
UsuariosLas recomendaciones están dirigidas al equipo de la salud que atiende directamente a los pacientes con trasplante renal, que incluye a médicos generales, especialistas en medicina interna, nefrología, infectología, cirugía de trasplante, patólogos, profesionales en microbiología, bacteriología, laboratorio clínico y enfermería; de igual manera, incluye a aquellos que toman decisiones en salud a nivel colectivo e individual, en instancias asistenciales, administrativas y financieras, tanto en el medio hospitalario como en los sistemas de aseguramiento, pagadores del gasto en salud y en las instituciones oficiales que generan políticas de salud.
MetodologíaPara la realización de la guía se utilizó la metodología propuesta por la colaboración ADAPTE, la cual es una aproximación sistemática para la adopción o modificación de una o varias guías generadas en un entorno cultural y organizacional específico, para ser aplicado en un contexto diferente: es una alternativa racional al desarrollo de guías de novo. El objetivo general de la adaptación es aprovechar las ventajas de las guías de práctica clínica existentes, con el fin de incrementar la eficiente producción y uso de guías de alta calidad, y de garantizar que las recomendaciones finales abordan aspectos de salud específicos y relevantes para el contexto en el cual se van a implementar y que se adaptan a las necesidades, prioridades, legislación, política y recursos particulares de un área o región.
El proceso de adaptación se basa en los siguientes principios básicos:
- •
El uso de principios basados en la evidencia ampliamente aceptados para el desarrollo de guías de práctica clínica.
- •
Desarrollo de métodos fiables para garantizar la calidad y la validez de la recomendación adaptada.
- •
El uso de un enfoque participativo en la aceptación y la apropiación de las recomendaciones.
- •
La consideración explícita de contexto para garantizar la relevancia para la práctica.
- •
Información transparente para promover la confianza en las recomendaciones de la guía adaptada.
- •
El uso de un formato flexible para dar cabida a las necesidades y circunstancias específicas.
Para tal fin se siguieron 24 procesos resumidos en 3 fases:
- 1)
La fase de preparación, que implica la conformación del grupo desarrollador y los aspectos integrales del proceso.
- 2)
La fase de adaptación incluye desde la selección del tema hasta la identificación de las preguntas clínicas específicas, búsqueda y evaluación de las guías, la selección de la guías apropiadas, evaluación de las guías en términos de calidad, vigencia, contenido, consistencia y aplicabilidad y preparación del documento.
- 3)
La fase de finalización incluye la revisión externa de la guía adaptada, con retroalimentación de los diferentes grupos involucrados y consultas a los elaboradores de las guías utilizadas en el proceso de adaptación.
La preparación del grupo del desarrollo de la guía (GDG) consistió en 3 representantes clínicos, 2 especialistas en infectología y uno en nefrología con experiencia en la elaboración de guías de práctica clínica, además de un experto metodológico. Durante esta fase se establecieron los términos generales de referencia, viabilidad del proceso de adaptación de acuerdo con la información disponible, metodología a utilizar, identificación de necesidades y recursos, así como la elaboración del protocolo y la planeación integral del proceso. El GDG fue el encargado de la formulación de las preguntas PICO, de realizar las revisiones sistemáticas de la literatura, de seleccionar las guías de práctica clínica, de hacer la evaluación del conjunto de la evidencia, y de coordinar y dirigir las sesiones de generación de recomendaciones. Finalmente, el GDG coordinó la generación de las versiones preliminares de la guía, así como en su lectura y aprobación.
Tanto los miembros del GDG como los demás participantes realizaron una declaración de intereses sobre temas relacionados o no con la condición de la guía. Esta declaración fue realizada específicamente en el inicio de las actividades de la elaboración de la guía y en las reuniones de consenso para la formulación de las recomendaciones.
Determinación de preguntas clavesDe acuerdo con las definiciones establecidas, se elaboraron las preguntas claves que la guía clínica intenta responder, teniendo en cuenta la población de interés, las características de la enfermedad, los procesos diagnósticos, los tipos de terapia, las estrategias de prevención, los profesionales a los cuales la guía clínica está dirigida, los desenlaces esperados, incluyendo aquellos relacionados con los pacientes, con la organización o con aspectos de salud pública, así como el ámbito y contexto en el cual la guía clínica será implementada. La versión final de las preguntas en esta guía fueron:
- 1
¿Cómo se estratifica el riesgo de infección/reactivación por CMV en pacientes adultos con trasplante renal?
- 2
¿Cómo se hace el diagnóstico de infección y enfermedad por CMV en pacientes adultos con trasplante renal?
- 3
¿Cuál es el tratamiento de enfermedad por CMV en pacientes adultos con trasplante renal?
- 4
¿Cómo se previene la infección/enfermedad por CMV en pacientes adultos con trasplante renal?
Para realizar la búsqueda bibliográfica se tuvo la colaboración de un experto metodológico, utilizando diversas fuentes, de acuerdo con una estrategia diseñada específicamente. En una primera etapa las búsquedas fueron restringidas a guías de práctica clínica. Los criterios de inclusión fueron adultos, trasplante renal e infección por CMV. Los términos de búsqueda usados fueron «cytomegalovirus infection», «cytomegalovirus», «renal transplantation», «kidney transplantation», «organ transplantation», «prophylaxis», «prevention», «diagnosis», «treatment», «therapy», «antiviral agents», «vaccination» y «practica guidelines», seleccionados del diccionario de terminología MeSH. No se usaron filtros en las búsquedas de guías de práctica clínica y se establecieron límites de idioma (español, portugués, inglés) y se restringió la búsqueda a los últimos 5 años. Se obtuvieron 20 referencias que fueron evaluadas por el GDG, que identificó 4 guías que fueron evaluadas13–16. Al obtener los textos completos, una guía (guía internacional) tenía una publicación de 2010 y una actualización en 2013, por lo que solo se evaluó esta última16.
Evaluación de las guías clínicas seleccionadasSe evaluó la calidad metodológica de las 4 guías utilizando el instrumento Appraisal of Guidelines for Research and Evaluation II (AGREE II)17. Este instrumento evalúa la calidad, el rigor metodológico, la transparencia con la que se desarrolla una guía y la validez predictiva de la guía, dado que tiene un alto grado de concordancia con la evaluación individual de la calidad de la evidencia sobre las que están sustentadas las recomendaciones. Adicionalmente se evaluó la vigencia de la guías, así como los períodos cubiertos por la estrategia de búsqueda de la bibliografía con el fin de garantizar la inclusión de la evidencia más actualizada. Se evaluó el contenido, identificando si las recomendaciones estaban debidamente sustentadas en evidencia y existía coherencia con sus respectivos niveles. Se analizó la consistencia teniendo en cuenta: 1) La estrategia de búsqueda y de selección de la evidencia que apoyan las recomendaciones. 2) La consistencia entre la evidencia seleccionada y cómo los desarrolladores resumieron e interpretaron dicha evidencia. 3) La consistencia entre la interpretación de la evidencia y las recomendaciones. Finalmente, se analizó la aceptabilidad y validez de las recomendaciones, teniendo en cuenta el contexto cultural, el sistema de salud vigente, recursos y características de la población.
Cada guía fue evaluada por 2 expertos clínicos y uno metodológico. Una vez obtenidas las matrices de recomendaciones y los aspectos de aplicabilidad de las guías de práctica clínica, se seleccionó para adaptación la guía Adapted international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Posteriormente se procedió a clasificar las respuestas que da la guía a las preguntas planteadas y, finalmente, a evaluar la calidad de la evidencia que sustenta cada recomendación a través del sistema Grading of Recommendations Assessment, Development and Evaluation (GRADE). A pesar de que la guía seleccionada ya tenía incluida la evaluación por el sistema GRADE, el GDG revisó nuevamente el grado de recomendación con base en las fuentes originales de la evidencia. Para esto, se empleó el software GRADE pro, que califica la evidencia dependiendo de la metodología del artículo (ensayo clínico o estudio observacional) y otros factores de calidad de la evidencia. GRADE tiene en cuenta 4 criterios para determinar la calidad o dirección y la fuerza de las recomendaciones: a) el balance entre los beneficios y riesgos e inconvenientes; b) la confianza en la magnitud de las estimaciones del efecto de la intervención en los desenlaces importantes (calidad global de la evidencia); c) los valores y preferencias de los pacientes y d) el uso de recursos y costos. Cada recomendación fue categorizada de acuerdo con la calidad de la evidencia o nivel de evidencia, indica hasta qué punto la confianza en la estimación de un efecto es adecuada para estar a favor o en contra de una recomendación y la fuerza de una recomendación como el grado en que podemos estar seguros de que los efectos deseables de una recomendación son mayores que los efectos indeseables (tabla 1). Se elaboró a partir del documento de recomendaciones una tabla de evidencia que contiene la información que soporta cada una de las recomendaciones para cada una de las preguntas formuladas.
Categorías de fuerza y dirección de la recomendación
| Fuerza y dirección de la recomendación | Definición |
|---|---|
| Recomendación fuerte a favor | Los beneficios de la intervención superan claramente los efectos indeseables |
| Recomendación débil a favor | Los efectos indeseables superan claramente los beneficios de la intervención |
| Recomendación débil en contra | Los beneficios de la intervención probablemente superan los efectos indeseables |
| Recomendación fuerte en contra | Los efectos indeseables de la intervención probablemente superan los beneficios |
En un segundo momento, y con base en los resultados de las preguntas seleccionadas y recomendaciones seleccionadas mediante la metodología GRADE, se desarrolló un consenso Delphi en tiempo real18. Para ello se constituyó un grupo de consenso conformado por expertos profesionales de la salud: especialistas en infectología, nefrología, bacteriología, microbiología con experiencia en biología molecular. Los participantes en el consenso son parte de la Asociación Colombiana de Infectología (ACIN-Capítulo Central), de la Asociación Colombiana de Nefrología e Hipertensión Arterial (Asocolnef), del Instituto Nacional de Salud (INS), así como de diversas instituciones y universidades y se encuentran desarrollando actividades asistenciales con programas o pacientes de trasplante renal.
El GDG formuló las preguntas que fueron puestas a consideración del grupo de expertos como la base de las recomendaciones. Conforme a las indicaciones de RAND/UCLA, se utilizó una escala ordinal de 9 categorías para calificar cada una de las recomendaciones formuladas. Teniendo en cuenta esto, cada una de las preguntas propuestas se calificó como recomendada (apropiada), contraindicada (inapropiada) o dentro de un nivel de incertidumbre, de acuerdo con el valor de la mediana de las respuestas de los expertos. Además, se presentó la información del grado de acuerdo (consenso) con los resultados de los rangos de respuesta a cada una de las preguntas. Esta calificación fue basada en el método descriptivo propuesto por Sánchez et al.19. Finalmente, si después de 3 rondas no existió consenso, se determinó la recomendación de acuerdo con el resultado de la última ronda. Al final, se enunciaron las recomendaciones según los resultados del consenso.
Proceso para difundir y actualizar la guíaDebido al interés en el tema y a la necesidad de recomendaciones que favorezcan la adopción de buenas prácticas clínicas y un alto nivel de calidad en el ejercicio asistencial en la atención de pacientes con trasplante renal, se publica el presente documento en la revista Infectio (Asociación Colombiana de Infectología) y se realizarán publicaciones duplicadas en la revista de la Asociación de Nefrología. Así mismo, será pública en los sitios web de cada una de las sociedades participantes.
La participación de miembros de diferentes ramas de la medicina y de sociedades científicas en sus diferentes niveles permitió al grupo desarrollador observar las posibles barreras tanto de organización como de la aplicación de las recomendaciones que este consenso pudiera presentar. Se propone actualizar la presente guía en un plazo de 3 años.
Definiciones clínicasLas definiciones clínicas se determinaron de acuerdo con las recomendaciones internacionales15,16,20,21, teniendo en cuenta las siguientes categorías:
- •
Infección por CMV: presencia de replicación de CMV independientemente de los síntomas, documentada por la carga viral.
- •
Enfermedad por CMV: infección por CMV acompañada por síntomas y signos clínicos. Incluyendo:
- ∘
Síndrome CMV: manifestado por fiebre mayor de 38,8°C por al menos 2 días, asociado a malestar general, leucopenia, trombocitopenia, linfocitos atípicos y elevación de aminotransferasas.
- ∘
Enfermedad invasiva por CMV: manifestada por compromiso orgánico: colitis, neumonitis, hepatitis, nefritis, miocarditis, pancreatitis o retinitis, entre otros. La enfermedad debe ser corroborada por biopsia20.
- ∘
Se recomienda estratificar el riesgo de infección o reactivación en trasplante renal realizando serología IgG (IgG CMV) antes del trasplante tanto en el donante como en el receptor. Si la serología pretrasplante del receptor es negativa, se debe repetir al momento del trasplante (fuerte, baja).
En adultos, una prueba serológica no conclusiva en el donante debe ser asumida como positiva; una prueba no conclusiva en el receptor debe interpretarse asignándolo al grupo de riesgo apropiado más alto para tomar decisiones en el período postrasplante (moderada, baja).
El estado serológico para CMV del donante y del receptor (referido en adelante como D/R) es el principal predictor de riesgo de infección o reactivación. Por tanto, es imperativo usar una prueba con alta sensibilidad y especificidad para su categorización. Los grupos de riesgo podrán definirse como riesgo alto D+/R−, riesgo intermedio D−/R+ y D+/R+, riesgo bajo D−/R−. Como se anotó previamente, en estudios prospectivos se ha identificado el riesgo de reactivación a partir de estas categorías22. A los 3 meses, los pacientes con riesgo alto tuvieron una tasa de reactivación cercana al 90%, mientras que los grupos de riesgo intermedio (R+) tuvieron tasas entre 40 y 50% de reactivación, mientras que ninguno de los pacientes en el grupo de bajo riesgo reactivó. El estudio de Weber et al.23 comparó sensibilidad y especificidad de 3 pruebas por ELISA para detección de anticuerpos anti-CMV (Elisa IgG recombinante; Elisa IgG+IgM; Elisa anticuerpos comparativos) en 442 muestras de sangre (incluyendo muestras de pacientes con infección primaria, muestras de donantes de sangre seleccionados seropositivos y seronegativos y muestras rutinarias) y encontró que la seroconversión IgG se detecta con la prueba de ELISA IgG CMV tan temprano como la IgM en los pacientes que tenían infección y que las pruebas alternativas fueron menos sensibles detectando seroconversión más tardía, con diferencia entre 1 a 3 muestras posteriores. El estudio de Lazzarotto et al.24 evaluó 101 muestras de suero obtenidas de mujeres embarazadas para buscar la presencia de IgM específica de CMV en quienes habían tenido resultados discordantes entre 2 pruebas de detección; se usaron 9 kits comerciales basados en técnica de Elisa y 2 pruebas por Western Blotting y se encontró alta frecuencia de resultados falsos positivos con la prueba IgM CMV. El estudio de Weber et al.25 no encontró diferencia estadísticamente significativa en el rendimiento de las pruebas para determinar IgG CMV al comparar las pruebas que usan antígenos recombinantes y las que usan como sustrato virus lisado. El estudio de Seed et al.26 comparó el rendimiento diagnóstico de una prueba por Elisa para detección de anticuerpos totales anti-CMV con una prueba por inmunoanálisis enzimático para detección de IgG anti-CMV y encontró para esta última prueba una especificidad del 99,3% con sensibilidad cercana al 100%: esta es una prueba útil en la tamización de riesgo de donantes. Adicionalmente al estado serológico CMV, existen otros factores de riesgo de infección que deberán considerarse adicionalmente, como el estado global de inmunosupresión determinado por el tipo de terapia, dosis, duración y momento de utilización, particularmente los medicamentos agotadores de linfocitos T, tanto como terapia de inducción como tratamiento contra el rechazo, así como factores del huésped como edad, comorbilidades o neutropenia27.
¿Cómo se hace el diagnóstico de infección y enfermedad por citomegalovirus en pacientes adultos con trasplante renal?- •
Se recomienda de preferencia medir la carga viral mediante pruebas moleculares para el diagnóstico de infección por CMV (detección de ADN viral), con base en la cual se podrán tomar decisiones respecto al inicio de terapia anticipada y se podrá monitorizar la respuesta a la terapia (fuerte, moderada).
- •
No se recomienda medir antigenemia (Ag-pp65-CMV) como una alternativa para el diagnóstico de infección, dados los avances disponibles de la tecnología en nuestro medio (moderada, moderada).
- •
Se recomienda que las pruebas diagnósticas se realicen siempre en un mismo tipo de muestra (plasma o sangre total) en cada sitio de atención (fuerte, moderada).
- •
En la medida en que las plataformas y técnicas estén disponibles, se recomienda que, al realizar carga viral mediante pruebas cuantitativas de CMV, tanto en las pruebas comerciales como en las desarrolladas en cada laboratorio, estas sean calibradas y demuestren colinealidad con el estándar internacional de la Organización Mundial de la Salud y los resultados sean reportados en UI/ml (débil, moderada).
- •
En pacientes con carga viral por encima del límite de detección y por debajo del límite de cuantificación, se recomienda hacer la correlación clínica y un seguimiento apropiado por el grupo de trasplante y repetir las pruebas en una semana (fuerte, débil).
- •
Se recomienda realizar estudio histológico con inmunohistoquímica específica para CMV para el diagnóstico de enfermedad invasiva tisular (fuerte, moderada).
- •
En la medida en que esté disponible, se recomienda que el examen histopatológico del tejido tomado incluya rutinariamente inmunotinción o hibridación in situ para CMV, con el objetivo de aumentar la sensibilidad en el diagnóstico de enfermedad invasiva tisular (fuerte, moderada).
- •
El cultivo de virus CMV en sangre u orina tiene un papel muy limitado para el diagnóstico de enfermedad, por lo cual no se recomienda como método diagnóstico de enfermedad invasiva tisular (enfermedad de órgano final) (fuerte, moderada).
- •
No hay recomendación acerca del uso de carga viral en muestras tisulares para el diagnóstico de enfermedad por CMV.
- •
Se recomienda que los resultados de la carga viral para el diagnóstico de infección o enfermedad por CMV estén disponibles en un máximo de 72 h (buena práctica clínica).
Existen varias pruebas de detección de infección por CMV que son útiles tanto en el diagnóstico como en el seguimiento, las cuales se pueden agrupar básicamente en 2 grupos: técnicas de detección de antígenos precoces del virus en leucocitos periféricos con anticuerpos monoclonales (pruebas de antigenemia) y métodos de detección en tiempo real de fragmentos de ADN vírico (técnicas de amplificación de ácidos nucleicos tanto cualitativas como cuantitativas).
Los métodos en tiempo real para cuantificación de ácidos nucleicos son el estándar de diagnóstico, puesto que tienen una mayor sensibilidad y especificidad, un intervalo lineal más amplio, detección de ADN viral de forma temprana (mayor sensibilidad de la técnica), mayor rendimiento y menor riesgo de contaminación. Como limitantes requiere equipos y reactivos costosos28–34. La prueba de antigenemia pp65 CMV es una prueba semicuantitativa que muestra correlación entre el número de células con tinción positiva y el desarrollo de enfermedad por CMV, aunque la enfermedad invasiva tisular puede ocurrir con recuentos celulares de tinción positiva bajos o negativos. Esta prueba tiene ventajas en algunos escenarios, puesto que no requiere de equipos costosos y el ensayo es una prueba relativamente fácil de realizar. Los problemas están relacionados con la falta de estandarización, incluyendo la interpretación subjetiva de los resultados. Es poco probable que se logre una mejor estandarización de la prueba porque la mayoría de los laboratorios usan métodos moleculares. El rendimiento de la prueba disminuye cuando el recuento absoluto de neutrófilos es menor que 1.000/mm3. La realización de la prueba requiere un procesamiento manual grande, lo que hace que sea susceptible de variaciones entre laboratorios, y la muestra de sangre tiene estabilidad limitada y debería ser procesada dentro de las siguientes 6 a 8 h de recolectadas para evitar que disminuya la sensibilidad35–39.
Para realizar pruebas diagnósticas para CMV, las muestras de plasma y sangre total son útiles con algunas diferencias significativas en los valores de carga viral y en la cinética viral; el ADN-CMV generalmente se detecta más temprano y en mayores cantidades en sangre total comparado con plasma; se debe usar un mismo tipo de muestra cuando se hace monitoreo (seguimiento) a los pacientes40–45.
Al no existir homogenización y estandarización de las diferentes pruebas existentes, ni de las desarrolladas en cada laboratorio ni de las pruebas disponibles comercialmente, cada centro de trasplante y su laboratorio deberán seleccionar y utilizar siempre la misma prueba en el diagnóstico y monitoreo, así como definir el punto de corte umbral para considerarla positiva e indicar tratamiento46–48. A pesar de la pobre correlación interinstitucional de los resultados de las pruebas cuantitativas de amplificación de ácidos nucleicos de CMV (QNAT), estudios recientes muestran adecuada reproducibilidad en los valores de carga viral entre múltiples laboratorios cuando se calibra la prueba empleada con el estándar de referencia desarrollado por la Organización Mundial de la Salud, proveniente del Instituto Nacional de Estándares y Controles Biológicos del Reino Unido46.
El diagnóstico definitivo de enfermedad invasiva tisular se basa en la detección de CMV en las muestras tisulares, con excepción en enfermedad de sistema nervioso central y retinitis. El diagnóstico histológico se basa en la identificación de cuerpos de inclusión o antígenos virales en la biopsia mediante inmunohistoquímica49–52. Los cultivos par CMV (vía células Shell o rutinarios) son técnicamente difíciles de realizar, con tiempos muy prolongados para obtener resultados; por lo tanto, su papel es muy limitado en el diagnóstico de enfermedad invasiva tisular53, sin embargo, su procesamiento debe ser rutinario en biopsias de tracto gastrointestinal, dados los retos para el diagnóstico de enfermedad a este nivel por el bajo rendimiento de las pruebas de carga viral, ya que puede cursar con niveles muy bajos de carga viral que no superen el umbral de positividad de la prueba seleccionada51,52,54. Los resultados de cultivo o de QNAT en muestras tisulares pueden ser difíciles de interpretar, particularmente en el contexto de viremia activa, puesto que pueden reflejar tanto diseminación (vertimiento) como enfermedad activa de órgano. Sin embargo, si la inmunohistoquímica tisular es positiva y la dinamia en sangre es negativa, un cultivo tisular positivo o QNAT en tejido pueden soportar el diagnóstico de enfermedad invasiva tisular55,56. El compromiso de sistema nervioso central en receptores de trasplante de órgano sólido es extremadamente raro; en ausencia de estudios clínicos extensos, la presencia de ADN-CMV en LCR probablemente represente enfermedad por CMV y requiera tratamiento. El diagnóstico de retinitis se basa en el examen oftalmológico; la carga viral en sangre, plasma u otros test de laboratorio son raramente útiles como predictores de retinitis por CMV, aunque pueden estar positivos antes y al momento del diagnóstico. La carga viral positiva en líquido vítreo puede ser útil en guiar el diagnóstico de retinitis. Sin embargo, no es claro el papel que puedan jugar las pruebas moleculares en plasma o sangre con relación al diagnóstico de la enfermedad invasiva por CMV. Hasta tanto estudios clínicos no validen su utilidad, se considera que estas no se deben realizar de rutina.
Las pruebas moleculares son fundamentales para la toma de decisiones clínicas. El grupo de consenso consideró que es recomendable disponer de los resultados en un tiempo apropiado para realizar dicha toma de decisiones y no poner en peligro al paciente. El retraso en el diagnóstico puede asociarse potencialmente con progresión de la enfermedad y mayor morbilidad y, potencialmente, con mortalidad. Aunque no existen estudios clínicos que validen el tiempo de respuesta de laboratorio, se consideró que un tiempo inferior a 72 h es apropiado para una respuesta oportuna en el contexto del paciente trasplantado.
¿Cuál es el tratamiento de enfermedad por citomegalovirus en pacientes adultos con trasplante renal?- •
Para el tratamiento de la enfermedad por CMV no severa, se recomienda valganciclovir 900mg cada 12 h o ganciclovir intravenoso 5mg/kg cada 12 h como manejo de primera línea en adultos. Valganciclovir y ganciclovir deben ser ajustados según la función renal (fuerte, moderada).
- •
Se recomienda el uso de ganciclovir parenteral en los casos de enfermedad que amenace la vida, en condiciones donde esté comprometida la biodisponibilidad oral o cuando no exista adecuada adherencia al tratamiento (fuerte, baja).
- •
Se puede hacer conversión entre los 2 medicamentos recomendados en tratamiento (ganciclovir intravenoso a valganciclovir) sin interrumpir la dosificación (fuerte, débil).
- •
No se recomienda usar ganciclovir oral, aciclovir ni valaciclovir en el tratamiento de enfermedad por CMV (fuerte, moderada).
- •
Se recomienda continuar el tratamiento con ganciclovir intravenoso o con valganciclovir hasta que se logre demostrar la erradicación viral con 2 pruebas de carga viral negativas después de un mínimo de 2 semanas de tratamiento (fuerte, moderada).
- •
Se recomienda realizar carga viral de CMV semanalmente durante la fase de tratamiento para monitorizar la respuesta (fuerte, moderada).
- •
Se recomienda prolongar la duración del tratamiento cuando existen factores de alto riesgo de recaída o reinfección, como son: resultado seronegativo IgG CMV al comienzo de la viremia, tener alta carga viral inicial, tener una alta inmunosupresión, cursar con enfermedad invasiva tisular gastrointestinal (moderada, moderada).
- •
La carga viral en plasma o en sangre total no refleja el estado de enfermedad compartimentalizada, particularmente en sitios santuario como sistema nervioso central y humor vítreo; por tanto, en este grupo de pacientes se recomienda continuar el tratamiento hasta la resolución clínica completa (moderada, baja).
- •
En casos de alto riesgo se puede utilizar profilaxis secundaria con valganciclovir 900mg una vez al día (dosis ajustada a la función renal si se requiere) durante 1 a 3 meses: está indicada la mayor duración en la población de alto riesgo de recurrencia; sin embargo, es poca la evidencia disponible para generar una recomendación (moderada, baja).
- •
Se puede realizar monitoreo periódico de carga viral durante la profilaxis secundaria sin conocerse el tiempo correcto de intervalo para el monitoreo: está posiblemente indicado realizarlo más frecuentemente en los grupos de más alto riesgo acumulado (débil, baja).
- •
Se recomienda monitorizar frecuentemente la función renal durante el tratamiento y realizar los ajustes en la dosis del fármaco antiviral (fuerte, moderada).
- •
Se recomienda evitar reducir las dosis de valganciclovir o ganciclovir por efectos colaterales como leucopenia, dado el riesgo de su exposición del virus al fármaco con riesgo de inducción de resistencia. Se deben evaluar otras causas potenciales de leucopenia y manejarlas, si es posible, con reducción o modificación de las terapias inmunosupresoras, mielosupresivas o con profilaxis antibiótica. La adición de factor estimulante de colonias podría también ser considerada antes de reducir o suspender la terapia antiviral (moderada, baja).
- •
Se recomienda considerar reducir la dosis o modificar el esquema de inmunosupresión en pacientes con enfermedad severa por CMV, pacientes no respondedores y pacientes con alta carga viral (fuerte, baja).
- •
En caso de recurrencia de enfermedad por CMV después de un período libre de tratamiento, las mismas opciones de tratamiento del primer episodio de enfermedad son aplicables. Se debe realizar una evaluación general del estado global de inmunosupresión y se deberá ajustar cuando sea necesario (fuerte, moderada).
- •
No se recomienda el uso de inmunoglobulina intravenosa o inmunoglobulina hiperinmune anti-CMV en pacientes con trasplante renal (fuerte, baja).
Para el tratamiento de infección/enfermedad por CMV en trasplante renal, los medicamentos recomendados son valganciclovir y ganciclovir intravenoso basados principalmente en los datos del estudio VICTOR57 y en la equivalencia de las concentraciones plasmáticas obtenidas con valganciclovir. La posibilidad de administrar la terapia vía oral tiene ventajas como la disminución de la estancia hospitalaria y la disminución del riesgo de infección de sitios de acceso venoso; sin embargo, tiene limitaciones en condiciones que disminuyan la biodisponibilidad oral como en enfermedad intestinal, condición clínica que amenace la vida o en situación de alto riesgo de no adherencia farmacológica.
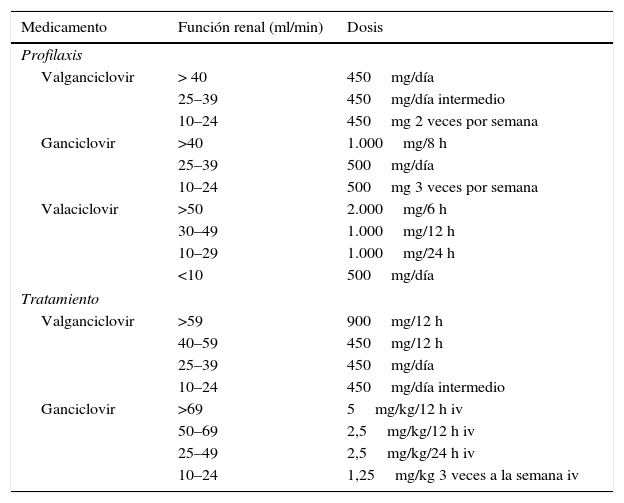
El estudio VICTOR es un ensayo clínico metacéntrico que aleatorizó a pacientes receptores de trasplante de órgano sólido con enfermedad por CMV a ser tratados con valganciclovir oral o con ganciclovir intravenoso, haciendo seguimiento con medición de carga viral en los días 0, 3, 7, 10, 14, 17, 21, 28, 42 y 49 y que demostró no inferioridad de valganciclovir oral frente a ganciclovir intravenoso en desenlaces de erradicación de viremia, actividad clínica de la enfermedad, tiempo para que la viremia baje a menos del límite de detección, cinética de carga viral, seguridad y tolerabilidad del tratamiento. Estudios posteriores han propuesto desenlaces similares58,59. Independiente de si se usa valganciclovir o ganciclovir intravenoso, es importante que se administre la dosis apropiada del medicamento en la medida en que la dosificación inadecuada puede resultar en falta de efectividad clínica y en riesgo de desarrollar resistencia antiviral. La dosis del medicamento seleccionado debe ser ajustada según la función renal; algunos estudios proponen que sería mejor ajustar usando la ecuación de Cockcroft Gault comparada con la ecuación de MDRD, dado que podría llevar a sudorificación60–62 (tabla 2).
Medicamentos de uso oral para la prevención y el tratamiento de la infección o enfermedad por CMV y las dosis recomendadas de acuerdo con la función renal
| Medicamento | Función renal (ml/min) | Dosis |
|---|---|---|
| Profilaxis | ||
| Valganciclovir | > 40 | 450mg/día |
| 25–39 | 450mg/día intermedio | |
| 10–24 | 450mg 2 veces por semana | |
| Ganciclovir | >40 | 1.000mg/8 h |
| 25–39 | 500mg/día | |
| 10–24 | 500mg 3 veces por semana | |
| Valaciclovir | >50 | 2.000mg/6 h |
| 30–49 | 1.000mg/12 h | |
| 10–29 | 1.000mg/24 h | |
| <10 | 500mg/día | |
| Tratamiento | ||
| Valganciclovir | >59 | 900mg/12 h |
| 40–59 | 450mg/12 h | |
| 25–39 | 450mg/día | |
| 10–24 | 450mg/día intermedio | |
| Ganciclovir | >69 | 5mg/kg/12 h iv |
| 50–69 | 2,5mg/kg/12 h iv | |
| 25–49 | 2,5mg/kg/24 h iv | |
| 10–24 | 1,25mg/kg 3 veces a la semana iv | |
iv: intravenoso.
La duración recomendada del tratamiento se determina a partir del monitoreo frecuente de carga viral y posiblemente de los factores de riesgo de recurrencia de enfermedad que podrían indicar la necesidad de prolongar el tiempo de tratamiento para garantizar la erradicación viral. El monitoreo propuesto es semanal, hasta evidenciar erradicación viral mediante 2 pruebas consecutivas negativas con un tiempo mínimo de tratamiento de 2 semanas y así determinar la duración óptima de la terapia antiviral29,57,59,63–65. Los factores de riesgo de recurrencia de infección por CMV que se han identificado son la falla en la erradicación de la carga viral al día 21 (OR 3,9 para recurrencia clínica, OR 5,6 para recurrencia virológica)59, carga viral inicial alta y viremia persistentemente detectable posterior a la culminación del tratamiento63, terapia altamente inmunosupresora que prolonga el tiempo de erradicación viral64, cursar con enfermedad de órgano final o invasiva tisular65, principalmente enfermedad invasiva gastrointestinal66, presentar rechazo de aloinjerto67, inicio con compromiso multiorgánico y donante cadavérico68,69. En presencia de enfermedad compartimentalizada de sistema nervioso central y de humor vítreo, la duración óptima del tratamiento es difícil de establecer y probablemente deba continuarse el tratamiento hasta tener resolución clínica total66.
En general, se debe evitar reducir la dosis de valganciclovir o ganciclovir por efectos colaterales como leucopenia, dado el riesgo de subexposición del virus al fármaco, con el subsecuente riesgo de inducción de resistencia. Podría optarse por disminuir las dosis de las terapias inmunosupresoras, mielosupresivas u optar por profilaxis antibiótica; como alternativa estaría el uso de factor estimulante de colonias, sin mucha evidencia que apoye una recomendación64,70.
En el año 2005 se publicó una serie de casos de 5 pacientes consecutivos llevados a trasplante de corazón que tuvieron rechazo y luego recaída de enfermedad por CMV, en la que todos los pacientes habían sido tratados con ganciclovir intravenoso y, adicionalmente, se les suministró inmunoglobulina hiperinmune CMV a 3 de los pacientes cada 21 días con la meta de mantener niveles séricos normales de IgG, con resultados que señalan que la adición de inmunoglobulina intravenosa a la terapia antiviral podría mejorar los desenlaces en pacientes con hipogammaglobulinemia y enfermedad por CMV71. En un estudio prospectivo se realizó medición de inmunoglobulinas IgG, IgA, IgM y factores del complemento (C3, C4, factor B) en muestras de sangre periférica obtenidas pretrasplante cardíaco, al día 7 y día 30 postrasplante, y se encontró que el monitoreo temprano de los niveles de inmunoglobulinas puede ayudar a identificar el riesgo de desarrollar infección en trasplante cardíaco72. Sin embargo, no hay evidencia que apoye su uso en trasplante renal.
¿Cómo se previene la infección/enfermedad por citomegalovirus en pacientes adultos con trasplante renal?- •
En consideración a la alta prevalencia de infección por CMV en pacientes con trasplante renal se recomienda utilizar profilaxis o terapia anticipada para la prevención de enfermedad por CMV, excepto en pacientes de bajo riesgo (D−R−) (fuerte, alta).
- •
Se recomienda utilizar profilaxis en el grupo de alto riesgo (D+/R−) como estrategia de prevención de enfermedad por CMV (fuerte, alta).
- •
Se recomienda utilizar profilaxis en pacientes con riesgo intermedio (R+) y factores de riesgo adicionales como terapia con anticuerpos antilinfocito (fuerte, débil).
- •
Se recomienda utilizar profilaxis en pacientes con inmunosupresión potente (rituximab, bortezomib, eculizumab) y aquellos con VIH (débil, débil).
- •
Al optar por profilaxis en el grupo de alto riesgo por serología (D+/R−), es preferible mantener profilaxis por 6 meses (moderada, alta).
- •
Cuando se usa la estrategia de profilaxis en receptores con serología positiva R+ (independiente de D+ o D−), se recomienda utilizar por un período de 3 meses (fuerte, alta-moderada).
- •
El riesgo de infección y enfermedad por CMV es bajo en trasplante renal D−/R− y no se recomienda el uso rutinario de profilaxis en esta situación. Se recomienda el uso de hemoderivados que han tenido un proceso de reducción de leucocitos y seronegativos para CMV (fuerte, moderada).
- •
Para profilaxis de infección por CMV en trasplante renal se recomienda el uso de valganciclovir, gangiclovir o altas dosis de valaciclovir (moderada, alta).
- •
No se recomienda el uso de aciclovir por ser inferior a ganciclovir en prevención de infección por CMV (fuerte, alta).
- •
Cuando se usa una estrategia de terapia anticipada, se recomienda que cada centro desarrolle y valide su protocolo local. Dado que esta estrategia se basa en el monitoreo de laboratorio, es importante que se seleccione un valor umbral adecuado suficientemente bajo (para disminuir la probabilidad de progresión a enfermedad clínica y de inducción de resistencia antiviral) para cada prueba específica que sea usada (débil, moderada).
- •
Para que la terapia anticipada sea óptima y efectiva, hay fuerte consenso en la realización de monitoría estricta con carga viral cada semana por 3-4 meses después del trasplante. Durante el período de monitoreo se debe usar el mismo tipo de técnica y muestra (plasma o sangre total) (fuerte, moderada).
- •
Se recomienda que, una vez se alcanza el umbral positivo definido, se inicie tan pronto como sea posible la terapia antiviral con dosis de tratamiento (no dosis profiláctica), utilizando valganciclovir o ganciclovir intravenoso y que se continúe la terapia hasta tener 2 pruebas negativas; se recomienda el monitoreo semanal de carga viral mientras está en terapia anticipada (fuerte, alta).
- •
En el caso de receptores de alto riesgo de infección por CMV que presenten rechazo de injerto que requiera manejo con anticuerpos antilinfocito, se debe reiniciar la estrategia de prevención previamente usada, bien sea profilaxis o terapia anticipada, por 1 a 3 meses (moderada, moderada).
- •
Se recomienda profilaxis antiviral secundaria por 2 a 4 semanas después del tratamiento anticipado. Alternativamente, una vez se ha culminado el tratamiento, el monitoreo semanal puede ser reiniciado como originalmente estaba planeado (3-4 meses postrasplante) (moderada, baja).
- •
Se recomienda considerar en pacientes de alto riesgo la implementación de una aproximación híbrida (profilaxis seguida de terapia anticipada), dado el riesgo de enfermedad tardía por CMV (moderada, baja).
- •
Se recomienda utilizar en profilaxis una dosis de 900mg día en pacientes de alto riesgo y una dosis de 450mg día en pacientes de riesgo intermedio. Se debe realizar el ajuste de la dosis según la función renal (fuerte, baja).
- •
No se recomienda el uso de dosis de valganciclovir menores a 450mg día en pacientes con función renal normal (fuerte, baja).
Las estrategias de prevención de CMV han disminuido significativamente la incidencia de enfermedad por CMV y han disminuido los efectos indirectos adversos de la infección73. Las 2 estrategias principales de prevención son la profilaxis universal y la terapia anticipada. La profilaxis universal incluye la administración de medicamentos antivirales a todos los pacientes o a un subgrupo de «pacientes en riesgo», los cuales se inician en el período inmediato postrasplante y se continúan por un límite variable de tiempo entre 3 y 6 meses. La terapia anticipada consiste en hacer monitoreo de laboratorio en intervalos regulares para detectar de forma temprana replicación y, una vez la replicación viral alcanza un umbral determinado, se inicia terapia antiviral idealmente antes del desarrollo de síntomas para disminuir la progresión a enfermedad clínica. Algunos autores recomiendan iniciar tratamiento con cualquier nivel de carga viral detectable basados en que la cinética viral es impredecible y puede incrementarse muy rápidamente, incluso con tiempos de doblaje de 1,5 días en grupos de alto riesgo serológico D−/R+, lo que llevaría a tasas altas de enfermedad CMV si no se inicia la terapia oportunamente22,74.
La decisión de optar por una u otra estrategia deberá tomarse en cada centro de trasplante de acuerdo con la capacidad logística de ejecutar el monitoreo estricto y poder iniciar rápidamente los tratamientos requeridos. Los datos disponibles son conflictivos en demostrar diferencias en eficacia entre las estrategias preventivas. El estudio de Kouri et al.11 comparó los resultados y costos de dar profilaxis por 100 días vs. terapia anticipada por 21 días con valganciclovir en adultos receptores de trasplante renal en estado serológico de riesgo D+/R−, D+/R+, D−/R+, mostrando que ambas estrategias son efectivas en prevenir la infección sintomática por CMV (se presentó en 5% en ambos grupos), sin diferencias en eventos colaterales ni eventos adversos. No hubo diferencias globales en los costos, aunque sí diferencias individuales (en profilaxis depende del costo del medicamento; en terapia anticipada, del costo de la prueba empleada para detección de carga viral). En el año 2008 se publicó un estudio clínico aleatorizado abierto realizado en un solo centro que aleatorizó, a pacientes receptores de trasplante renal de alto e intermedio riesgo serológico para infección por CMV75, a recibir profilaxis por 3 meses con valaciclovir vs. terapia anticipada con valganciclovir por un tiempo mínimo de 14 días, iniciando antes una primera prueba de carga viral positiva; en los desenlaces mostró que la terapia anticipada con valganciclovir y la profilaxis con valaciclovir parecen ser igualmente efectivas en prevenir enfermedad por CMV en trasplante renal. Sin embargo, mostró aparente mayor incidencia de rechazo agudo de injerto probado por biopsia a los 12 meses de seguimiento con la terapia anticipada, que podría atribuirse a efecto derivado de la replicación viral no detectada y a la persistencia de virus dentro del injerto, que podría estimular la respuesta aloinmune. Sin embargo, un estudio posterior por Spinner et al. compara retrospectivamente el uso de profilaxis vs. terapia anticipada con valganciclovir y encuentra un desenlace primario compuesto de ausencia de rechazo agudo, pérdida del injerto y muerte, muy similar en ambos grupos (83 profilaxis vs. 81% en terapia anticipada en el seguimiento a largo plazo: 4 años)76. Resultados similares a este último estudio tuvo el análisis post hoc que hizo Reischig en el año 2010 del ensayo clínico presentado 2 años antes, donde se analizaron las biopsias renales realizadas durante los 12 meses de seguimiento postrasplante buscando presencia de CMV mediante PCR en tiempo real y tinciones de inmunohistoquímica y encontraron tasas comparables de infección intrainjerto CMV relativamente bajas en pacientes manejados con valganciclovir como terapia anticipada y valaciclovir como profilaxis77.
Algunos datos observacionales permiten considerar la posibilidad de optar por profilaxis en pacientes de alto o moderado riesgo serológico que tengan factores de riesgo adicionales como infección por VIH o VHC, terapia altamente inmunosupresora78–80.
Los medicamentos a usar en profilaxis de infección por CMV en trasplante renal son valganciclovir, ganciclovir oral o valaciclovir. En un estudio se comparó la seguridad y eficacia de valaciclovir a dosis altas (2 g 4 veces al día) vs. ganciclovir oral (1g 3 veces al día) por 90 días en profilaxis de infección por CMV en trasplante renal, y se encontraron resultados similares de forma global entre valaciclovir y ganciclovir oral en efectividad y seguridad, sin diferencias respecto a detección de ADN-emia CMV, infecciones diferentes a CMV, episodios de rechazo agudo, niveles de creatinina sérica a 3 y 6 meses postrasplante81. Este mismo estudio plantea dejar la decisión de cuál medicamento usar al balance de criterios adicionales como costo (el estudio encontró posible sobrecosto del 20% en el grupo valaciclovir) y posibilidad de desarrollo de resistencia antiviral. Otro estudio clínico aleatorizado que compara valaciclovir vs. ganciclovir oral con dosificación estándar de valaciclovir 2 g/día y ganciclovir oral 3g/día mostró a ambos medicamentos como igualmente efectivos en la prevención de enfermedad por CMV después del trasplante renal y mostró ambos esquemas como costoefectivos82, aunque mostró posible menor incidencia de enfermedad tardía y de rechazo agudo de injerto en el grupo valaciclovir. Paya et al.83 publicaron un ensayo clínico controlado doble ciego, aleatorizado, multicéntrico con inclusión de receptores de trasplante de órgano sólido de alto riesgo serológico D+/R−, con aleatorización a esquemas de profilaxis con valganciclovir vs. ganciclovir oral con seguimiento de eficacia y seguridad hasta los 12 meses postrasplante, sin encontrar diferencias significativas: la incidencia de enfermedad CMV a los 6 meses en 12 y 15% con valganciclovir y ganciclovir oral, respectivamente; la incidencia de enfermedad tardía a 12 meses fue 17,2 y 18,4%, respectivamente; la incidencia de neutropenia con valganciclovir fue mayor que con ganciclovir (8,2 vs. 3,2%) sin modificar el perfil de seguridad global de los medicamentos. En el año 2000 se publica un estudio clínico controlado multicéntrico que compara ganciclovir oral con aciclovir oral en profilaxis de infección por CMV en 155 receptores de órgano sólido D+/R− estratificando la aleatorización de los receptores de trasplante renal en donante cadavérico y donante vivo; todos los receptores recibieron ganciclovir intravenoso por 5-10 días y luego fueron aleatorizados a recibir aciclovir oral vs. ganciclovir oral por 12 semanas adicionales. Los resultados muestran que ganciclovir oral se asoció con disminución significativa en la incidencia de enfermedad sintomática o viremia, comparado con el grupo que recibió aciclovir (32 vs. 50%), con diferencias también significativas en términos de enfermedad tisular invasiva, tiempo transcurrido al inicio de enfermedad a favor del grupo ganciclovir84.
En cuanto a la decisión de cuánto tiempo mantener la profilaxis, 2 ensayos clínicos aleatorizados y una cohorte retrospectiva apoyan las recomendaciones de mantener profilaxis por 6 meses en grupo de alto riesgo, 3 meses en riesgo intermedio y contemporizar entre 3-6 meses cuando hay factores de riesgo adicionales85–87. El ensayo clínico de Humar et al.85 es un estudio multicéntrico, aleatorizado, doble ciego que incluyó a 326 pacientes receptores de trasplante renal de alto riesgo serológico D+/R− y los aleatorizó a esquemas de profilaxis de 200 vs. 100 días con valganciclovir en igual dosis/día, encontrando diferencias significativas en incidencia de enfermedad por CMV confirmada en el período de 12 meses postrasplante (16 vs. 36.8%) con comportamiento similar en detección de viremia CMV (35 vs. 50%). No hubo diferencia entre los 2 grupos en rechazo agudo de injerto probado por biopsia ni en la tasa de eventos adversos. El estudio de Witzke et al.86 incluyó a 296 receptores de trasplante renal con estado serológico de riesgo intermedio por R+ independiente del estado D+ o D−; el estudio aleatorizó en 2 grupos a recibir profilaxis con valganciclovir por 100 días vs. terapia anticipada con valganciclovir por un tiempo mínimo de 14 días, seguida de profilaxis secundaria. El resultado final muestra reducción de las tasas de infección (11 vs. 38,7%) y enfermedad por CMV (4,4 vs. 19,2%) en el grupo de profilaxis vs. grupo de terapia anticipada, respectivamente.
Cuando se opta por terapia anticipada, cada centro deberá validar su propio protocolo de monitoría incluyendo el tipo de prueba diagnóstica a usar, los umbrales de corte para definir positiva la prueba, la frecuencia de realización. Son varios los estudios retrospectivos que muestran cómo se modifican los resultados en reducción de probabilidad de episodios de enfermedad por CMV vs. riesgo de falla farmacológica cuando se siguen protocolos estrictos de terapia anticipada74,88–90. Los esquemas farmacológicos para terapia anticipada siguen las mismas consideraciones que el tratamiento pleno de la enfermedad por CMV. Sin embargo, algunos estudios no aleatorizados señalan que en pacientes con trasplante renal se pueden utilizar dosis bajas de valganciclovir sin que estos resultados afecten la efectividad del medicamento91,92.
Algunos estudios de terapia anticipada han incluido profilaxis antiviral secundaria por 2-4 semanas de culminar el tratamiento anticipado o alternativamente reasumir un protocolo de monitoreo semanal sin tener suficiente evidencia para generar una recomendación específica93–95. No hay estudios que permitan dirimir la decisión de si se modifica o no el esquema de prevención en pacientes que reciben inmunosupresión con inhibidores mTOR como sirolimus y everolimus que aparentemente pudieran tener menores tasas de infección por CMV96. Sin embargo, Andrassy et al. realizaron un metaanálisis y una revisión sistemática con el fin de evaluar si era prescindible el uso de profilaxis en receptores con trasplante quienes recibían terapia inmunosupresora basada en inhibidores de mTOR. En el primer metaanálisis, comparando inhibidores de calcineurina (CNI) vs. inhibidores de mTOR, se incluyeron 8 estudios prospectivos aleatorizados y 2 estudios de centro único, todos realizados en receptores de trasplante renal, la mayoría en terapia de novo o temprana dentro del primer mes, que recibían terapia de inducción con anticuerpos mono- o policlonales, evidenciando mayor incidencia de eventos significativos relacionados con CMV en los pacientes que la recibían (RR=2,27; IC 95%: 1,72-3,01). En el segundo metaanálisis, comparando la combinación de mTOR-I+CNI con un tratamiento basado en CNI, se incluyeron 12 estudios aleatorizados y 3 de centro único, 9 de ellos en receptores de trasplante renal, y evidenció que los pacientes tratados con CNI solamente tenían 2,45 veces más riesgo de eventos relacionados con CMV (RR=2,45; IC 95%: 1,76-3,41; p<0,0001). Se considera que el tratamiento con inhibidores de mTOR solo o en combinación con CNI reduce la incidencia de CMV en trasplante de órganos sólidos, pero la heterogeneidad de la evidencia no es suficiente para modificar la estrategia de prevención en pacientes con trasplante renal97.
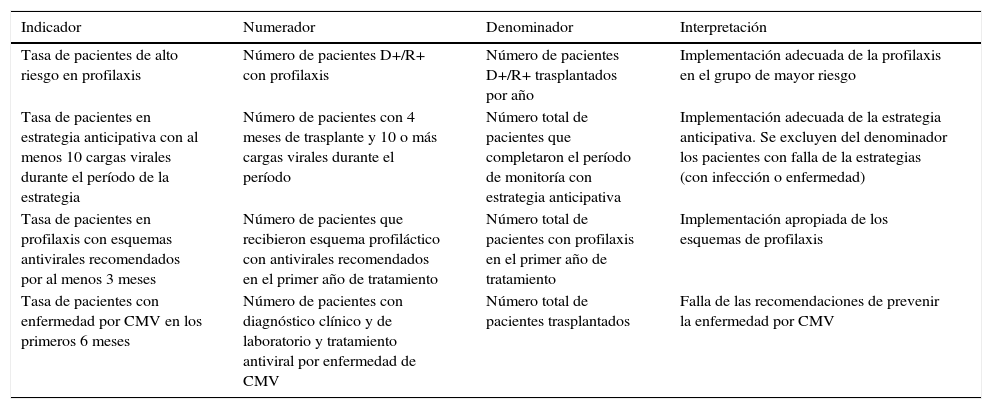
Implementación, aplicabilidad e indicadores de gestiónSe propone la implementación inmediata de las recomendaciones de consenso en los grupos participantes, así como su diseminación a otros grupos del país a través de congresos, reuniones académicas y otras estrategias educativas. Sin embargo, para tener mayor impacto en su implementación se propone que sea incluida en los procesos de auditoría médica, y que los indicadores se articulen con los que usualmente son llevados por los programas de trasplante y, de ser posible, se incluyan en la cuenta de alto costo. En la tabla 3 se resumen los indicadores propuestos para evaluar la implementación de las recomendaciones de la guía.
Indicadores de gestión de la aplicación del consenso
| Indicador | Numerador | Denominador | Interpretación |
|---|---|---|---|
| Tasa de pacientes de alto riesgo en profilaxis | Número de pacientes D+/R+ con profilaxis | Número de pacientes D+/R+ trasplantados por año | Implementación adecuada de la profilaxis en el grupo de mayor riesgo |
| Tasa de pacientes en estrategia anticipativa con al menos 10 cargas virales durante el período de la estrategia | Número de pacientes con 4 meses de trasplante y 10 o más cargas virales durante el período | Número total de pacientes que completaron el período de monitoría con estrategia anticipativa | Implementación adecuada de la estrategia anticipativa. Se excluyen del denominador los pacientes con falla de la estrategias (con infección o enfermedad) |
| Tasa de pacientes en profilaxis con esquemas antivirales recomendados por al menos 3 meses | Número de pacientes que recibieron esquema profiláctico con antivirales recomendados en el primer año de tratamiento | Número total de pacientes con profilaxis en el primer año de tratamiento | Implementación apropiada de los esquemas de profilaxis |
| Tasa de pacientes con enfermedad por CMV en los primeros 6 meses | Número de pacientes con diagnóstico clínico y de laboratorio y tratamiento antiviral por enfermedad de CMV | Número total de pacientes trasplantados | Falla de las recomendaciones de prevenir la enfermedad por CMV |
Para la identificación de las barreras y los facilitadores de implementación, se recolectó información relevante en el consenso de expertos que se llevó a cabo para la generación de las recomendaciones de práctica clínica. En cada una de las recomendaciones generadas, se identificaron las posibles barreras y facilitadores de su implementación así como los puntos críticos de la gestión del sistema de salud (barreras externas) que fueron resumidas en la tabla 4. Las barreras y facilitadores de implementación de la pregunta 4 está incluidas en las preguntas anteriores.
Barreras y facilitadores de implementación de la guía de práctica clínica
| Recomendación | Barreras | Facilitadores |
|---|---|---|
| • Se recomienda estratificar el riesgo de infección o reactivación en trasplante renal haciendo realizando serología IgG (IgG CMV) antes del trasplante tanto en el donante como en el receptor. Si la serología pretrasplante del receptor es negativa, se debe repetir al momento del trasplante | Inequidad en el acceso a servicios de salud | Socialización de las recomendaciones, Inclusión de las pruebas diagnósticas en los modelos de atención |
| Se recomienda de preferencia medir carga viral mediante pruebas cuantitativas para el diagnóstico de infección CMV, con base en la cual se podrán tomar decisiones respecto al inicio de terapia anticipada y se podrá monitorizar la respuesta a la terapia | Falta de tecnologías necesarias para realizar las pruebas necesarias para la identificación de pacientes con infección por CMV. Recurso humano y tecnológico, concentrado y reducido | Programa de atención integral que faciliten la obtención oportunas de las pruebas. Inclusión de la pruebas de carga viral cuantitativas en los programas de atención de los pacientes de trasplantes |
| • Para el tratamiento de la enfermedad por CMV no severa, se recomienda valganciclovir 900mg cada 12 h o ganciclovir intravenoso 5mg/kg cada 12 h como manejo de primera línea en adultos. Valganciclovir y ganciclovir deben ser ajustados de acuerdo con la función renal | Disponibilidad de medicamento, limitación de acceso a medicamentos antivirales, costo de medicamentos antivirales, intermediación de la prestación de los servicios de salud, recurso humano concentrado y reducido, sistema fragmentado de prestación por aseguramiento. No todos los medicamentos recomendados se encuentran actualmente en el plan de obligatorios de salud | Regulación de los precios de los medicamentos, cobertura universal en salud. Inclusión de los antivirales dentro del plan obligatorio de salud, específicamente, valganciclovir |
Finalmente, dado que existe una limitada información de costos sobre las recomendaciones de la guía en nuestro país, se propone que se haga una evaluación económica acerca de las recomendaciones de diagnóstico, tratamiento y prevención.
FinanciaciónEl presente consenso fue financiado a través de la Asociación Colombiana de Infectología, Capítulo Central, mediante una donación irrestricta de Laboratorios Roche.
Conflicto de interesesLas visiones e intereses del agente financiador no han influido las recomendaciones finales. Todos los participantes del consenso realizaron y firmaron una declaración de conflicto de interés.
Los siguientes participantes declararon no tener ningún conflicto de interés: YA, IA, JCC, JAC, FOG, PG, LM, MFR, AR, FR, RT, LGU, NY.
Con Roche: CM.
El grupo elaborador de la guía agradece el apoyo de Sonia Guerrero y Yehimi Ibarra de la Asociación Colombiana de Infectología, Capítulo Central, por la colaboración en los temas administrativos.