Describir factores de riesgo asociados a infección o colonización por Acinetobacter baumannii resistente a carbapenémicos en adultos hospitalizados en unidades de cuidado intensivo (UCI) de 13 instituciones de Bogotá.
Materiales y métodosEstudio prospectivo de casos y controles. El diagnóstico de estos fue infección o colonización, con aislamientos de A. baumannii resistente a carbapenémicos y los controles de pacientes con aislamientos de A. baumannii sensibles a carbapenémico. Se incluyó a 165 personas y se hizo un aislamiento por paciente. A aquellos que presentaban A. baumannii resistente a carbapenémicos se les evaluó la sensibilidad y a todos los que presentaron A. baumannii (resistente o sensible a carbapenémicos) se les realizó detección de carbapenemasas por PCR y electroforesis en gel de campo pulsado.
ResultadosDel total de aislamientos, 30 fueron A. baumannii sensible a carbapenémicos y 135 a A. baumannii resistente a carbapenémicos (83,7% fueron multirresistentes y 99% sensibles a polimixina). Todos los A. baumannii fueron positivos para OXA-51. De los A. baumannii resistentes a carbapenémicos, 129 fueron positivos para OXA-23, uno para OXA-72 y los restantes únicamente para OXA-51. Por electroforesis en gel de campo pulsado se determinaron 46 genotipos (12 clones y 34 perfiles únicos); el más grande fue Ab22 (n=89). Del total de aislamientos, 117 correspondieron a infección y 48 a colonización. En el análisis multivariado, los factores relacionados con ABRC fueron: hospitalización previa (OR 11,9; IC 95%: 1,59-89), exposición a carbapenémicos por más de 3 días (OR 10,36; IC 95%: 1,73–61,95) y presencia de infección o colonización por genotipo Ab22 (OR 449; IC 95%: 25-798).
DiscusiónA. baumannii es de difícil tratamiento y erradicación del entorno hospitalario. Las medidas de prevención de infección cruzada y uso prudente de antibióticos son fundamentales para prevenir la infección por gérmenes multirresistentes en hospitales. Se identificaron 3 factores de riesgo, 2 potencialmente asociados a infección cruzada, hospitalización previa y un clon predominante, y otro relacionado con uso aumentado de carbapenémicos.
ConclusiónSe identificaron 3 factores de riesgo, 2 potencialmente asociados a infección cruzada, hospitalización previa y un clon predominante, y otro relacionado con uso aumentado de carbapenémicos por más de 3 días.
To describe the risk factors for colonisation or infection by carbapenem-resistant Acinetobacter baumannii in adults hospitalised in the ICU of 13 hospitals of Bogota.
Materials and methodsA prospective, case control study. The case group was defined as having infection with carbapenem-resistant A. baumannii and the control group was defined as having infection with carbapenem-sensitive A. baumannii. We included 165 patients, one isolate per patient. Sensitivity was assessed in carbapenem-resistant A. baumannii and carbapenemase detection by PCR and pulsed field gel electrophoresis was performed on all patients.
ResultsThirty isolates were carbapenem-sensitive A. baumannii and 135 were carbapenem-resistant A. baumannii (83.7% were multiresistant and 99% were sensitive to polymyxin). All isolates were positive to OXA-51. Of the carbapenem-resistant A .baumannii, 129 were positive to OXA 23, one to OXA-72 and the rest were positive to OXA-51. Using PFGE, 46 genotypes were identified, and the most common was Ab22 (n=89). A total of 117 isolates were classified as infection and 48 as colonisation. Multivariate analysis determined the risk factors for carbapenem resistant A. baumannii to be: Previous hospitalisation (OR 11.9, 95% CI: 1.59 to 89), exposure to carbapenems for more than 3 days (OR 10.36, 95% CI: 1.73 to 61.95) and the presence of infection or colonisation by the Ab22 genotype (OR 449, 95% CI: 25 to 798).
DiscussionA. baumannii is difficult to treat and eradicate from the hospital environment. This study identified 3 risk factors, 2 potentially associated with cross-infection (previous hospitalisation and the presence of a predominant clone) and the third was related to the use of carbapenems for more than 3 days.
ConclusionThis study identified 3 risk factors, 2 potentially associated to cross-infection (previous hospitalisation and the presence of a predominant clone) and the third was related to the use of carbapenems for more than 3 days.
Acinetobacter baumannii es un patógeno hospitalario, relacionado ampliamente con infecciones asociadas a la atención en salud (IAAS)1, que afecta con predilección a pacientes críticamente enfermos1–3, de muy difícil control por su capacidad para sobrevivir en condiciones ambientales extremas y posibilidad de transmisión cruzada y aérea2,4. Adicionalmente A. baumannii se ha diseminado rápidamente en el ambiente hospitalario por su capacidad de adquirir resistencia a múltiples antibióticos, en particular a los carbapenémicos, cuya resistencia es mediada por carbapenemasas, principalmente de clase D (oxacilinasas) y, con menos frecuencia, de clase B o metalobetalactamasas (MBL)2–3, así como a desinfectantes en relación con bombas de expulsión tipo amv A5. El riesgo de mortalidad entre los pacientes que se infectan por este agente1,2 es muy alto: en un metaanálisis reciente se describe un 33%, con un rango de 8 a 40% y riesgo incrementado de mortalidad de 2,49 de los pacientes infectados por A. baumannii resistentes a carbapenémicos1 (ABRC).
En Bogotá, la resistencia a A. baumannii en Unidades de Cuidado Intensivo (UCI) fue ≥50% para imipenem y >55% para meropenem, entre los años 2005 y 20076. A. baumannii es epidémico y puede pasar a ser endémico7; el mayor riesgo se observa en las UCI, donde la mortalidad atribuible está entre el 20 y el 65%8. En un estudio de Colombia, se observó que la resistencia en esta población se asoció con incremento de un 60% en los costos de hospitalización9. En Latinoamérica, la información es escasa; por ello, es difícil ponderar el impacto de diferentes factores de riesgo en el desarrollo de resistencia. El propósito de este estudio es describir los factores de riesgo asociados a infección o colonización por ABRC, en adultos hospitalizados en UCI de 13 instituciones de Bogotá.
MetodologíaTipo de estudio y poblaciónEstudio multicéntrico y prospectivo de casos y controles, en pacientes adultos hospitalizados en UCI de 13 instituciones de Bogotá (H1 a H13, nombradas aleatoriamente) y protocolo con previa aprobación del Comité de Ética. El criterio de inclusión fue que los pacientes tuvieran más de 18 años y que estuvieran hospitalizados en UCI con cultivo de AB. Como el objetivo fue establecer los factores de riesgo para infección o colonización por ABRC, solo se trabajó con pacientes diagnosticados con infección o colonización con aislamiento de este. Para confirmarlo, se realizó una prueba de referencia. Se incluyó a los pacientes que, con el primer aislamiento, presentaran A. baumannii sensible a carbapenémicos (ABSC). Se excluyó a pacientes con aislamiento concomitante de microorganismos diferentes.
El estudio se realizó entre abril de 2005 y el mismo mes de 2006. No fueron incluidos pacientes con aislamientos de ABRC o ABSR identificados antes del inicio del estudio. El emparejamiento se realizó a partir de pacientes hospitalizados en UCI por más de 48 h y hasta 7 días después de su traslado al hogar, al momento de la toma de la muestra con la que se identificó un aislamiento de AB. Se diseñó con error alfa inferior a 5% y beta inferior a 20%, hipótesis de no asociación de factores de riesgo para aislamientos de AB, diferencia de exposición entre casos y controles de 20% y pérdidas de 10%, con relación caso-control 1:1. En total, se tuvieron en cuenta 134 casos10.
Recolección y manejo de la informaciónVariables analizadas: género, edad, estancia hospitalaria, diagnósticos de ingreso a UCI, origen de la muestra, foco de infección, presencia y duración de dispositivos invasivos, enfermedad quirúrgica, antibióticos previos al cultivo, duración de tratamiento y dosis, puntaje APACHE II al ingreso a UCI, gravedad de sepsis —según criterios de Bone11— y presencia de enfermedades médicas asociadas. Se conformó un comité de expertos encargados de aplicar a cada caso criterios de IAAS según CDC11 y de definir el aislamiento como infectante o colonizante, y si el inicio antimicrobiano empírico fue apropiado, según diagnóstico infeccioso y perfil de sensibilidad.
Caracterización fenotípicaSe analizó un aislamiento por paciente. La identificación se realizó con API20NE (bioMérieux). En los aislamientos de ABRC, se evaluó sensibilidad antimicrobiana por concentración mínima inhibitoria (CMI) a través de E-Test (AB biodisk) para aztreonam, amikacina, ceftazidima, ceftriaxona, cefepima, ciprofloxacina, imipenem, meropenem, piperacilina-tazobactam, ampicilina-sulbactam, cefoperazona-sulbactam y colistina. El procedimiento y la interpretación de resultados se realizó de acuerdo con las instrucciones del fabricante. La presencia de carbapenemasas MBL se determinó por E-test usando la tira imipenem/imipenem+EDTA (IP/IPI). Los aislamientos con resultado de CMI IP/IPI ≥8 fueron considerados positivos. La multirresistencia se definió como resistencia a 3 o más clases de antibióticos.
Detección de genes codificantes de carbapenemasasEl ADN de los aislamientos se obtuvo por lisis celular a partir de colonias bacterianas frescas de un cultivo en agar BHI, suspendidas en 100 uL de agua destilada estéril y llevadas a calentamiento hasta ebullición por 10 min. La detección de genes codificantes de carbapenemasas se realizó a través de reacción en cadena de la polimerasa (PCR). Para genes codificantes de carbapenemasas oxacilinasas se usó un ensayo de PCR múltiple convencional para blaOXA-23, blaOXA-24, blaOXA-51 y blaOXA-5812 (tabla 1) y para carbapenemasas MBL se usó PCR simple convencional para los genes blaVIM y blaIMP13 (tabla 1). Se utilizaron mezclas de reacción que contenían: solución tampón de PCR 1X, 3mM de MgSO4 (PCR múltiplex de OXAs) y 2mM de MgSO4 (PCR simple), 0,2mM de dNTPs, 0,5μM de cada iniciador excepto para blaIMP para el cual se utilizó 1μM, y 1 U/μL de Taq AccuPrime (Invitrogen®) para la PCR múltiplex y 0,5 U/μL de Taq para la PCR simple. Las condiciones de amplificación usadas se estandarizaron en el laboratorio y fueron desnaturalización inicial de 95°C por 5 min, 35 ciclos de 95°C por 45 s, anillamiento de 53°C para blaIMP y 56°C para blaVIM y la PCR múltiplex de OXAs por un minuto, 72°C por un minuto y una extensión final a 72°C por 7 min. Las reacciones de PCR se realizaron en el termociclador iCycler® de Bio-Rad. Los productos de amplificación se visualizaron en geles de agarosa al 1,2%, teñidos con bromuro de etidio (0,5μg/mL).
Secuencia de iniciadores utilizados en los ensayos de PCR
| Nombre | Secuencia | Tamaño del producto | Referencia |
|---|---|---|---|
| OXA-23-like F | 5′ GAT CGG ATT GGA GAA CCAGA 3′ | 501pb | 12 |
| OXA-23-like R | 5′ ATT TCT GAC CGC ATT TCC AT 3′ | ||
| OXA-24- like F | 5′GGT TAG TTG GCC CCC TTA AA 3′ | 246bp | |
| OXA-24- like R | 5′ AGT TGA GCG AAA AGG GGA TT 3′ | ||
| OXA-51- like F | 5′ TAA TGC TTT GAT CGG CCT TG 3′ | 353bp | |
| OXA-51- like R | 5′ TGG ATT GCA CTT CAT CTT GG 3′ | ||
| OXA-58- like F | 5′ AAG TAT TGG GGC TTG TGC TG 3′ | 599pb | |
| OXA-58- like R | 5′ CCC CTCTGCGCTCTACATAC 3′ | ||
| IMPgen-F1 | 5′ GAATAG(A/G)(A/G)TGGCTTAA(C/T)TCTC 3′ | 188pb | 13 |
| IMPgen-R1 | 5′ CCAAAC(C/T)ACTA(G/C)GTTATC 3′ | ||
| VIMgen-F2 | 5′ GTTTGGTCGCATATCGCAAC 3′ | 382pb | |
| VIMgen-R2 | 5′ AATGCGCAGCACCAGGATAG 3′ |
Los productos de amplificación obtenidos fueron purificados con el estuche comercial PureLink PCR (Invitrogen®) y enviados a secuenciación en ambas cadenas con los iniciadores descritos (tabla 1). Las amplímeros fueron secuenciados en el equipo MegaBace DNA Analysis System (Amersham®) (servicio de secuenciación BioMol Ltda). Las secuencias de nucleótidos obtenidas se editaron con el software Molecular Evolutionary Genetics Analysis (MEGA version 4.0) y la identidad de las secuencias se evaluó comparándolas con las secuencias de ADN almacenadas en las bases de datos del GenBank disponibles en el sitio web BLASTN (https://blast.ncbi.nlm.nih.gov/Blast.cgi).
Electroforesis en gel de campo pulsadoLa tipificación se realizó con electroforesis en gel de campo pulsado (EGCP), el ADN fue digerido con la enzima de restricción ApaI (Promega®) y separado en el equipo CHEFDRIII (BioRad®), usando las condiciones previamente descritas por Seifert et al.14. Los patrones electroforéticos se analizaron con el software Fingerprinting II (Bio-Rad®). El coeficiente de DICE se usó para calcular las similitudes de los patrones, y para la construcción del dendrograma se usó el algoritmo Unweight Pair-Group Meted with Arithmetic Averages (UPGMA), con una tolerancia de 1,5% y una optimización de 1%. Los aislamientos con similitud ≥85% fueron considerados del mismo genotipo (relacionados clonalmente).
Análisis estadísticoSe realizó estadística descriptiva, análisis bivariado de diferencia de proporciones (X2), prueba de Fisher y rangos logarítmicos, según la necesidad. Se hizo un análisis multivariado de regresión logística. Para el modelo de regresión, se estableció como variable de desenlace la resistencia a carbapenémicos, definida según resultado de E-test a imipenem y meropenem. Las variables de predicción serán incluidas a partir de los resultados del análisis bivariado, con probabilidad de azar inferior a 20% (según recomendación de Kleinbaun).
Para controlar la confusión, se incluyeron dentro del modelo variables sin significación estadística, que, sin embargo, han sido reconocidas como fuente de confusión en diferentes publicaciones. El resultado final del análisis de regresión logística fue validado por 2 métodos diferentes: el de residuos de Shoenfeld y la prueba de bondad de ajuste. Se usó el programa STATA 8.0 (licenciado a la Universidad Nacional de Colombia).
ResultadosIncidencia de infección o colonizaciónEl 1,47% de los pacientes en UCI se infectaron por AB. Un total de 115 correspondieron a IAAS, 2 a infección extrainstitucional y 48 a colonización, distribuidos así: 34 de 153 resultaron ser resistentes y 14 de 30, sensibles. Una institución presentó la mayor frecuencia de aislamientos, con 16%, y otra no presentó ningún aislamiento. La resistencia fue superior al 60% en la mayoría de las instituciones; una tercera institución no presentó resistencia en sus aislamientos (tabla 1). Se concluyó, a partir del seguimiento al AB, que este se presenta en brotes temporales y recurrentes.
Se identificaron desde 3 aislamientos, en una institución, hasta 52, en otra, con reconocimiento de 3 brotes y manifestaciones de endemicidad. Cerca del 75% de los pacientes habían estado hospitalizados 90 días antes. Las principales causas de ingreso a UCI fueron el compromiso del sistema nervioso central (17%) y enfermedades abdominales (15%). Un total de 41 pacientes presentaron enfermedades concomitantes, como diabetes mellitus (12%) y enfermedad pulmonar crónica (11%). Además, el 90% tuvo ventilación mecánica.
Los antibióticos más utilizados previamente en UCI fueron: cefepima 400 DDD, piperacilina-tazobactam 299 DDD, meropenem 227 DDD, ceftriaxona 217 DDD e imipenem 178 DDD. La estancia hospitalaria fue 35 días (IC 95%: 31–40) y los pacientes estuvieron hospitalizados en UCI cerca de 9 días (IC 95%: 7,3–11). Los aislamientos fueron recuperados principalmente de sangre (22,1%; n=37) y tracto respiratorio (18,5%; n=31) (tabla 2). La mediana de edad fue 51 años (IC 95%; 47–58), con APACHE entre 15 y 16; 131 pacientes estuvieron previamente hospitalizados en otros servicios antes del aislamiento de AB.
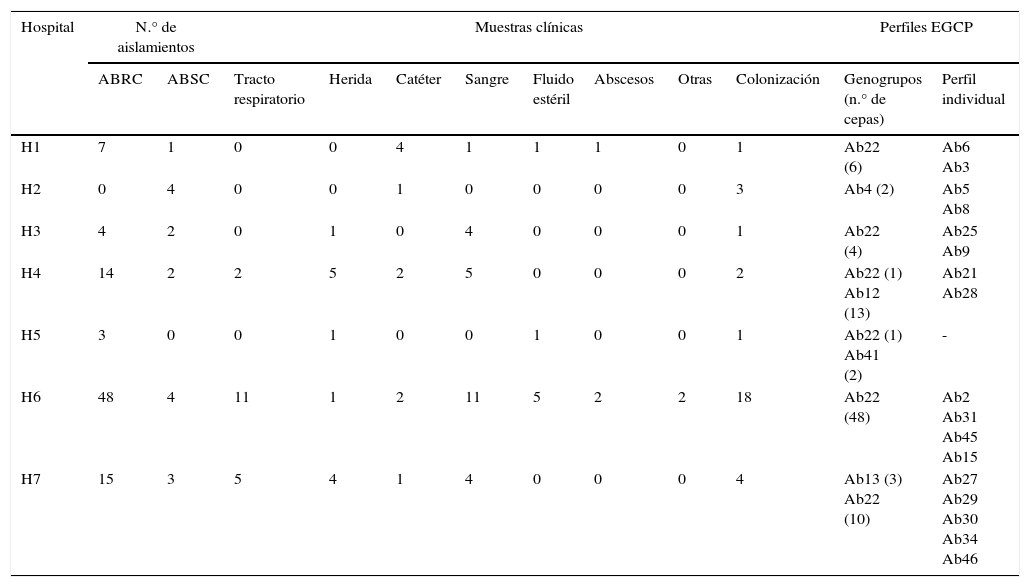
Datos clínicos y perfiles de EGCP de los aislamientos de A. baumannii analizados
| Hospital | N.° de aislamientos | Muestras clínicas | Perfiles EGCP | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ABRC | ABSC | Tracto respiratorio | Herida | Catéter | Sangre | Fluido estéril | Abscesos | Otras | Colonización | Genogrupos (n.° de cepas) | Perfil individual | |
| H1 | 7 | 1 | 0 | 0 | 4 | 1 | 1 | 1 | 0 | 1 | Ab22 (6) | Ab6 Ab3 |
| H2 | 0 | 4 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 3 | Ab4 (2) | Ab5 Ab8 |
| H3 | 4 | 2 | 0 | 1 | 0 | 4 | 0 | 0 | 0 | 1 | Ab22 (4) | Ab25 Ab9 |
| H4 | 14 | 2 | 2 | 5 | 2 | 5 | 0 | 0 | 0 | 2 | Ab22 (1) Ab12 (13) | Ab21 Ab28 |
| H5 | 3 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | Ab22 (1) Ab41 (2) | - |
| H6 | 48 | 4 | 11 | 1 | 2 | 11 | 5 | 2 | 2 | 18 | Ab22 (48) | Ab2 Ab31 Ab45 Ab15 |
| H7 | 15 | 3 | 5 | 4 | 1 | 4 | 0 | 0 | 0 | 4 | Ab13 (3) Ab22 (10) | Ab27 Ab29 Ab30 Ab34 Ab46 |
| Hospital | N.° de aislamientos | Muestras clínicas | Perfiles EGCP | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ABRC | ABSC | Tracto respiratorio | Herida | Catéter | Sangre | Fluido estéril | Abscesos | Otras | Colonización | Genogrupos (n.° de cepas) | Perfil individual | |
| H8 | 16 | 5 | 7 | 2 | 2 | 3 | 0 | 0 | 2 | 5 | Ab7 (2) Ab16 (4) Ab17 (3) Ab22 (3) Ab44 (3) | Ab33 Ab35 Ab37 Ab38 Ab39 Ab42 |
| H9 | 10 | 2 | 4 | 0 | 1 | 5 | 0 | 0 | 0 | 2 | Ab22 (2) Ab23 (2) Ab24 (6) | Ab43 Ab10 |
| H10 | 4 | 2 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 2 | Ab22 (3) Ab40 (2) | Ab18 |
| H11 | 6 | 2 | 0 | 0 | 0 | 0 | 3 | 1 | 1 | 3 | Ab22 (6) | Ab1 Ab26 |
| H12 | 5 | 2 | 1 | 0 | 0 | 1 | 0 | 0 | 1 | 4 | Ab22 (2) | Ab11 Ab19 Ab20 Ab32 Ab36 |
| H13 | 3 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | Ab22 (3) | Ab14 |
ABRC: Acinetobacter baumannii resistente a carbapenémicos; ABSC: Acinetobacter baumannii sensible a carbapenémicos; EGCP: electroforesis en gel de campo pulsado.
El uso de antibióticos en las diferentes instituciones no se sigue comúnmente por servicios. Se encontró una alta frecuencia de uso de carbapenémicos en las instituciones 7, 8 y 9; el más usado es meropenem. De los antibióticos evaluados, el más utilizado es cefepime, seguido de piperacilina, tazobactam y ceftriaxona (4a).
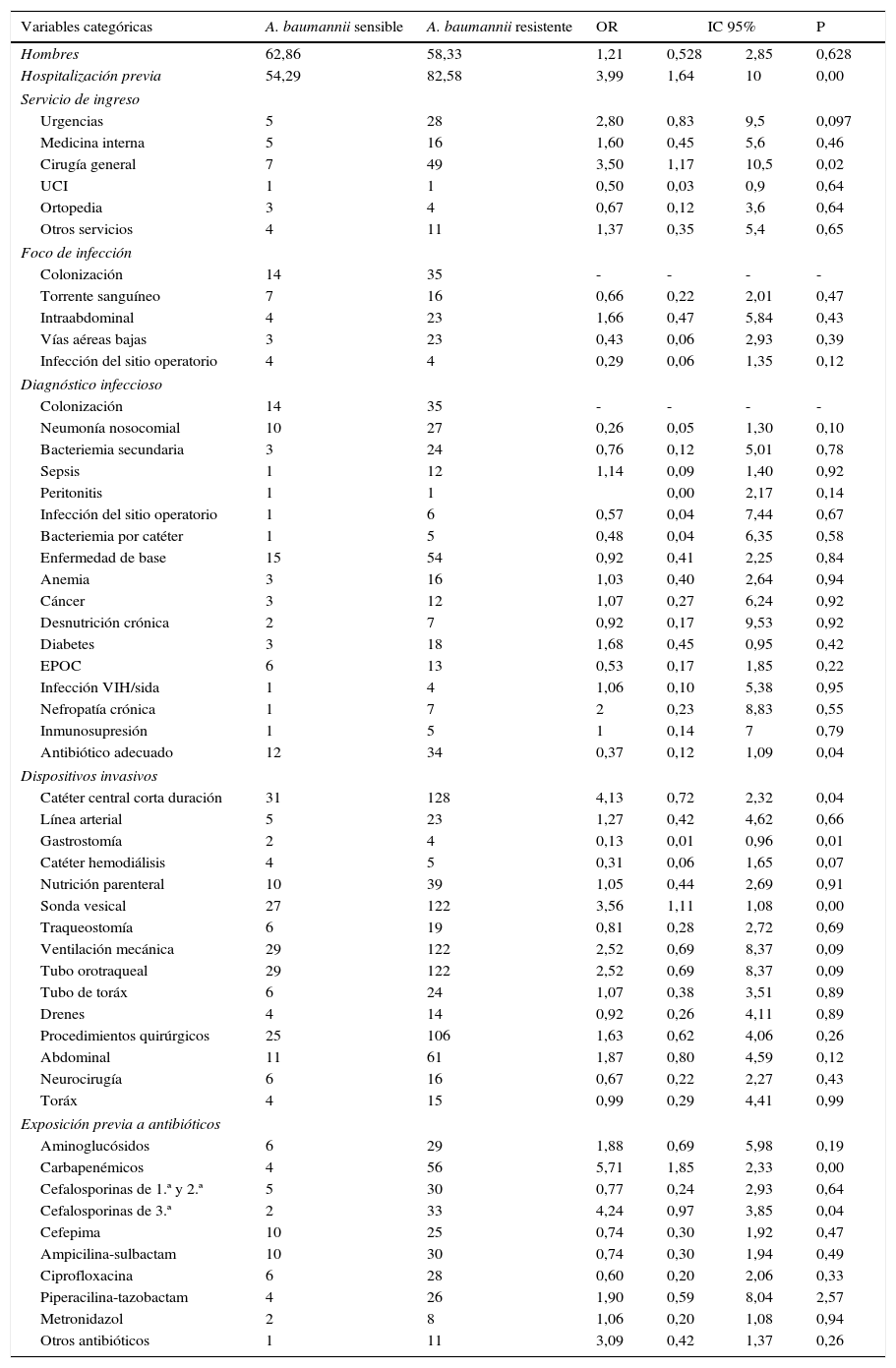
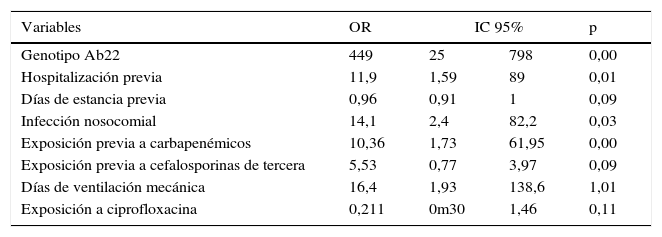
En el análisis bivariado inicial, los factores asociados con identificación de ABRC fueron: catéter venoso central (CVC) y días con CVC, presencia de sonda vesical (SV) y días con SV, días desde la primera cirugía, estancia hospitalaria previa, hospitalización previa, ingreso por cirugía general, exposición previa a carbapenémicos y cefalosporinas de tercera generación, por más de 3 días, e identificación del genotipo Ab22 (tablas 3 y 4). Las variables que permanecieron en el análisis de regresión logística fueron: exposición a carbapenémicos por más de 3 días, OR de 10,4 (IC 95%: 1,7–62) hospitalización previa, OR de 7,99 (IC 95%: 1,3–47,9), tiempo de ventilación mecánica en días, OR de 16,4 (IC 95%: 1,9–138), aislamiento de Ab22, OR 449 (IC 95%: 25–798), e IAAS, OR de 14,12 (IC 95%: 2,4–82,2) (tabla 5).
Variables demográficas de tipo categórico de pacientes con infección o colonización por A. baumannii resistente a carbapenémicos en 13 UCI de Bogotá (Colombia), entre abril de 2005 y abril de 2006
| Variables categóricas | A. baumannii sensible | A. baumannii resistente | OR | IC 95% | P | |
|---|---|---|---|---|---|---|
| Hombres | 62,86 | 58,33 | 1,21 | 0,528 | 2,85 | 0,628 |
| Hospitalización previa | 54,29 | 82,58 | 3,99 | 1,64 | 10 | 0,00 |
| Servicio de ingreso | ||||||
| Urgencias | 5 | 28 | 2,80 | 0,83 | 9,5 | 0,097 |
| Medicina interna | 5 | 16 | 1,60 | 0,45 | 5,6 | 0,46 |
| Cirugía general | 7 | 49 | 3,50 | 1,17 | 10,5 | 0,02 |
| UCI | 1 | 1 | 0,50 | 0,03 | 0,9 | 0,64 |
| Ortopedia | 3 | 4 | 0,67 | 0,12 | 3,6 | 0,64 |
| Otros servicios | 4 | 11 | 1,37 | 0,35 | 5,4 | 0,65 |
| Foco de infección | ||||||
| Colonización | 14 | 35 | - | - | - | - |
| Torrente sanguíneo | 7 | 16 | 0,66 | 0,22 | 2,01 | 0,47 |
| Intraabdominal | 4 | 23 | 1,66 | 0,47 | 5,84 | 0,43 |
| Vías aéreas bajas | 3 | 23 | 0,43 | 0,06 | 2,93 | 0,39 |
| Infección del sitio operatorio | 4 | 4 | 0,29 | 0,06 | 1,35 | 0,12 |
| Diagnóstico infeccioso | ||||||
| Colonización | 14 | 35 | - | - | - | - |
| Neumonía nosocomial | 10 | 27 | 0,26 | 0,05 | 1,30 | 0,10 |
| Bacteriemia secundaria | 3 | 24 | 0,76 | 0,12 | 5,01 | 0,78 |
| Sepsis | 1 | 12 | 1,14 | 0,09 | 1,40 | 0,92 |
| Peritonitis | 1 | 1 | 0,00 | 2,17 | 0,14 | |
| Infección del sitio operatorio | 1 | 6 | 0,57 | 0,04 | 7,44 | 0,67 |
| Bacteriemia por catéter | 1 | 5 | 0,48 | 0,04 | 6,35 | 0,58 |
| Enfermedad de base | 15 | 54 | 0,92 | 0,41 | 2,25 | 0,84 |
| Anemia | 3 | 16 | 1,03 | 0,40 | 2,64 | 0,94 |
| Cáncer | 3 | 12 | 1,07 | 0,27 | 6,24 | 0,92 |
| Desnutrición crónica | 2 | 7 | 0,92 | 0,17 | 9,53 | 0,92 |
| Diabetes | 3 | 18 | 1,68 | 0,45 | 0,95 | 0,42 |
| EPOC | 6 | 13 | 0,53 | 0,17 | 1,85 | 0,22 |
| Infección VIH/sida | 1 | 4 | 1,06 | 0,10 | 5,38 | 0,95 |
| Nefropatía crónica | 1 | 7 | 2 | 0,23 | 8,83 | 0,55 |
| Inmunosupresión | 1 | 5 | 1 | 0,14 | 7 | 0,79 |
| Antibiótico adecuado | 12 | 34 | 0,37 | 0,12 | 1,09 | 0,04 |
| Dispositivos invasivos | ||||||
| Catéter central corta duración | 31 | 128 | 4,13 | 0,72 | 2,32 | 0,04 |
| Línea arterial | 5 | 23 | 1,27 | 0,42 | 4,62 | 0,66 |
| Gastrostomía | 2 | 4 | 0,13 | 0,01 | 0,96 | 0,01 |
| Catéter hemodiálisis | 4 | 5 | 0,31 | 0,06 | 1,65 | 0,07 |
| Nutrición parenteral | 10 | 39 | 1,05 | 0,44 | 2,69 | 0,91 |
| Sonda vesical | 27 | 122 | 3,56 | 1,11 | 1,08 | 0,00 |
| Traqueostomía | 6 | 19 | 0,81 | 0,28 | 2,72 | 0,69 |
| Ventilación mecánica | 29 | 122 | 2,52 | 0,69 | 8,37 | 0,09 |
| Tubo orotraqueal | 29 | 122 | 2,52 | 0,69 | 8,37 | 0,09 |
| Tubo de toráx | 6 | 24 | 1,07 | 0,38 | 3,51 | 0,89 |
| Drenes | 4 | 14 | 0,92 | 0,26 | 4,11 | 0,89 |
| Procedimientos quirúrgicos | 25 | 106 | 1,63 | 0,62 | 4,06 | 0,26 |
| Abdominal | 11 | 61 | 1,87 | 0,80 | 4,59 | 0,12 |
| Neurocirugía | 6 | 16 | 0,67 | 0,22 | 2,27 | 0,43 |
| Toráx | 4 | 15 | 0,99 | 0,29 | 4,41 | 0,99 |
| Exposición previa a antibióticos | ||||||
| Aminoglucósidos | 6 | 29 | 1,88 | 0,69 | 5,98 | 0,19 |
| Carbapenémicos | 4 | 56 | 5,71 | 1,85 | 2,33 | 0,00 |
| Cefalosporinas de 1.ª y 2.ª | 5 | 30 | 0,77 | 0,24 | 2,93 | 0,64 |
| Cefalosporinas de 3.ª | 2 | 33 | 4,24 | 0,97 | 3,85 | 0,04 |
| Cefepima | 10 | 25 | 0,74 | 0,30 | 1,92 | 0,47 |
| Ampicilina-sulbactam | 10 | 30 | 0,74 | 0,30 | 1,94 | 0,49 |
| Ciprofloxacina | 6 | 28 | 0,60 | 0,20 | 2,06 | 0,33 |
| Piperacilina-tazobactam | 4 | 26 | 1,90 | 0,59 | 8,04 | 2,57 |
| Metronidazol | 2 | 8 | 1,06 | 0,20 | 1,08 | 0,94 |
| Otros antibióticos | 1 | 11 | 3,09 | 0,42 | 1,37 | 0,26 |
EPOC: enfermedad pulmonar obstructiva crónica; IC: intervalo de confianza; OR: odds ratio; UCI: Unidad de cuidado intensivo.
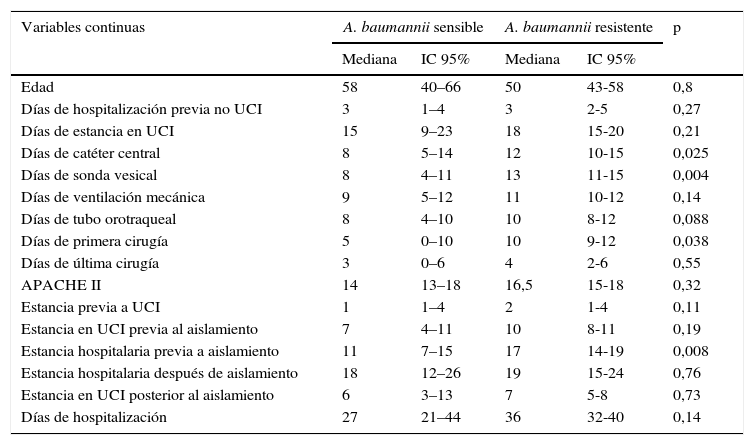
Variables demográficas de tipo continuo de pacientes con infección o colonización por A. baumannii resistente a carbapenémicos en 13 UCI de Bogotá (Colombia), entre abril de 2005 y abril de 2006
| Variables continuas | A. baumannii sensible | A. baumannii resistente | p | ||
|---|---|---|---|---|---|
| Mediana | IC 95% | Mediana | IC 95% | ||
| Edad | 58 | 40–66 | 50 | 43-58 | 0,8 |
| Días de hospitalización previa no UCI | 3 | 1–4 | 3 | 2-5 | 0,27 |
| Días de estancia en UCI | 15 | 9–23 | 18 | 15-20 | 0,21 |
| Días de catéter central | 8 | 5–14 | 12 | 10-15 | 0,025 |
| Días de sonda vesical | 8 | 4–11 | 13 | 11-15 | 0,004 |
| Días de ventilación mecánica | 9 | 5–12 | 11 | 10-12 | 0,14 |
| Días de tubo orotraqueal | 8 | 4–10 | 10 | 8-12 | 0,088 |
| Días de primera cirugía | 5 | 0–10 | 10 | 9-12 | 0,038 |
| Días de última cirugía | 3 | 0–6 | 4 | 2-6 | 0,55 |
| APACHE II | 14 | 13–18 | 16,5 | 15-18 | 0,32 |
| Estancia previa a UCI | 1 | 1–4 | 2 | 1-4 | 0,11 |
| Estancia en UCI previa al aislamiento | 7 | 4–11 | 10 | 8-11 | 0,19 |
| Estancia hospitalaria previa a aislamiento | 11 | 7–15 | 17 | 14-19 | 0,008 |
| Estancia hospitalaria después de aislamiento | 18 | 12–26 | 19 | 15-24 | 0,76 |
| Estancia en UCI posterior al aislamiento | 6 | 3–13 | 7 | 5-8 | 0,73 |
| Días de hospitalización | 27 | 21–44 | 36 | 32-40 | 0,14 |
IC 95%: intervalo de confianza del 95%.
Resultado de análisis multivariado para factores de riesgo de desarrollar resistencia asociados a infección o colonización por A. baumannii resistente a carbapenémicos en 13 UCI de Bogotá (Colombia), entre abril de 2005 y abril de 2006
| Variables | OR | IC 95% | p | |
|---|---|---|---|---|
| Genotipo Ab22 | 449 | 25 | 798 | 0,00 |
| Hospitalización previa | 11,9 | 1,59 | 89 | 0,01 |
| Días de estancia previa | 0,96 | 0,91 | 1 | 0,09 |
| Infección nosocomial | 14,1 | 2,4 | 82,2 | 0,03 |
| Exposición previa a carbapenémicos | 10,36 | 1,73 | 61,95 | 0,00 |
| Exposición previa a cefalosporinas de tercera | 5,53 | 0,77 | 3,97 | 0,09 |
| Días de ventilación mecánica | 16,4 | 1,93 | 138,6 | 1,01 |
| Exposición a ciprofloxacina | 0,211 | 0m30 | 1,46 | 0,11 |
IC: intervalo de confianza; OR: odds ratio.
El 43% de los pacientes no recibieron tratamiento antibiótico adecuado. El 78% tuvieron cirugías, el 43% abdominales. La mortalidad atribuible a infección por AB fue mayor cuando la terapia inicial no fue apropiada (datos no mostrados).
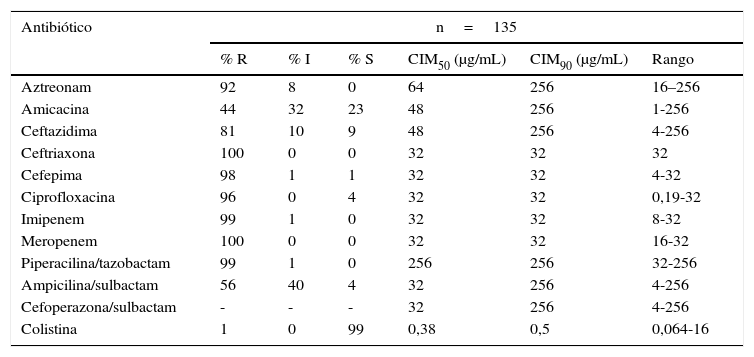
Caracterización fenotípicaSe evaluó la susceptibilidad de los 165 aislamientos sin realizar diferencia entre los causantes de colonización o infección, 30 fueron ABSC y 135 ABRC. De estos últimos, 83,7% (n=113) presentaron perfil de multirresistencia (tabla 6). El 35,8% de los aislamientos fueron identificados (por los sistemas automatizados MicroScan, MicroScan WalkAway y VITEK 2) como resistentes o con sensibilidad intermedia a imipenem o meropenem. Entre los aislamientos identificados como resistentes, con el sistema MicroScan WalkAway, se encontró que la concordancia en la identificación de la resistencia con el E-test fue: 100% con imipenem; 82,75% para meropenem; 76,6% para ciprofloxacina; 76,19% para piperacilina tazobactam; 65,71% para piperacilina tazobactam; 55,5% para aztreonam y 36,36% para amikacina.
Sensibilidad antimicrobiana de aislamientos de A. baumannii resistentes a carbapenémicos
| Antibiótico | n=135 | |||||
|---|---|---|---|---|---|---|
| % R | % I | % S | CIM50 (μg/mL) | CIM90 (μg/mL) | Rango | |
| Aztreonam | 92 | 8 | 0 | 64 | 256 | 16–256 |
| Amicacina | 44 | 32 | 23 | 48 | 256 | 1-256 |
| Ceftazidima | 81 | 10 | 9 | 48 | 256 | 4-256 |
| Ceftriaxona | 100 | 0 | 0 | 32 | 32 | 32 |
| Cefepima | 98 | 1 | 1 | 32 | 32 | 4-32 |
| Ciprofloxacina | 96 | 0 | 4 | 32 | 32 | 0,19-32 |
| Imipenem | 99 | 1 | 0 | 32 | 32 | 8-32 |
| Meropenem | 100 | 0 | 0 | 32 | 32 | 16-32 |
| Piperacilina/tazobactam | 99 | 1 | 0 | 256 | 256 | 32-256 |
| Ampicilina/sulbactam | 56 | 40 | 4 | 32 | 256 | 4-256 |
| Cefoperazona/sulbactam | - | - | - | 32 | 256 | 4-256 |
| Colistina | 1 | 0 | 99 | 0,38 | 0,5 | 0,064-16 |
% I: porcentaje de intermedios; % R: porcentaje de resistentes; % S: porcentaje de sensibles; CIM50: concentración inhibitoria mínima 50; CIM90: concentración inhibitoria mínima 90.
Se analizaron 15 aislamientos con el sistema MicroScan. La concordancia en la identificación de aislamientos resistentes con el sistema manual E-test fue: 100% ciprofloxacina; 100% piperacilina tazobactam; 84,6% imipenem; 70% meropenem; 50% cefepime; 50% amikacina y 40% aztreonam. Un total de 19 aislamientos fueron analizados con el sistema VITEK 2.
La concordancia en la identificación de aislamientos resistentes con el método E-test fue: 100% aztreonam; 93,75% imipenem; 88,89% meropenem; 88,89% ciprofloxacina; 81,81% piperacilina tazobactam; 60% cefepima y 0% amikacina. De todos los aislamientos con resistencia a los carbapenémicos, el E-test confirmó dicho perfil en 88,7%. Los otros fueron, en realidad, sensibles a carbapenémicos. La resistencia a otros antibióticos fue para amikacina 9,85%; aztreonam 30,9%; piperacilina tazobactam 40,8%; ciprofloxacina 60,56% y cefepime 81,7%. El cálculo de las CIM50 y CIM90 se realizó con las cepas tratadas mediante la prueba del E-test. La mayor sensibilidad fue a colistina (99%, n=134), excepto un aislamiento (CIM 16μg/mL) y amikacina (23%; n=31) (tabla 7) y 31 aislamientos fueron positivos para MBL.
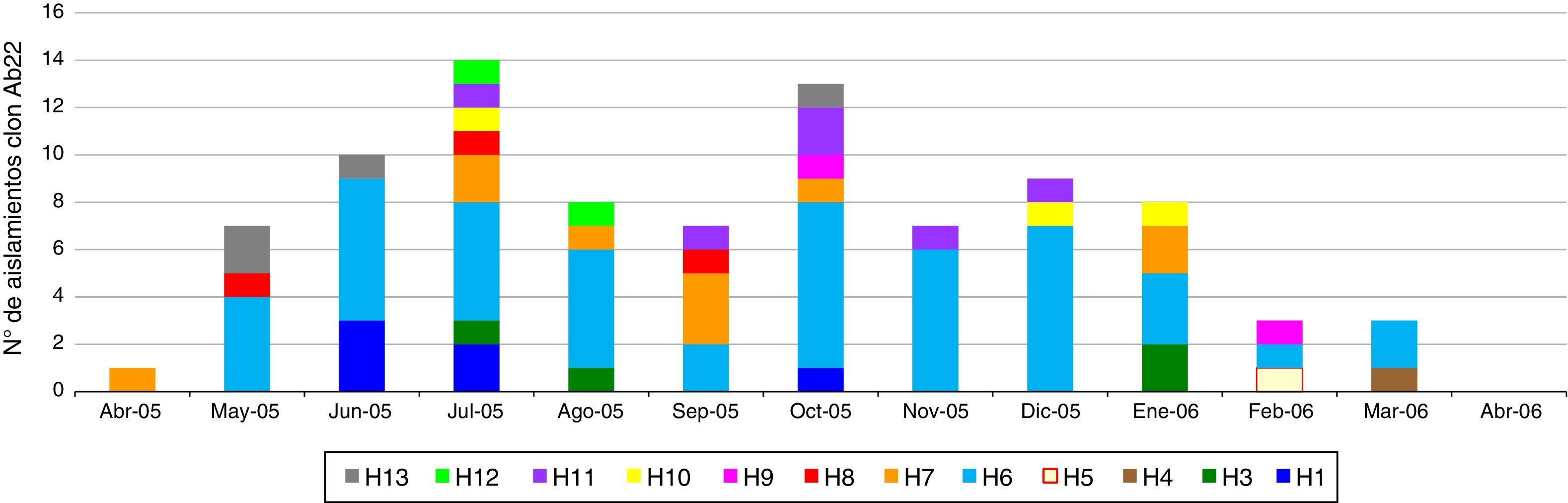
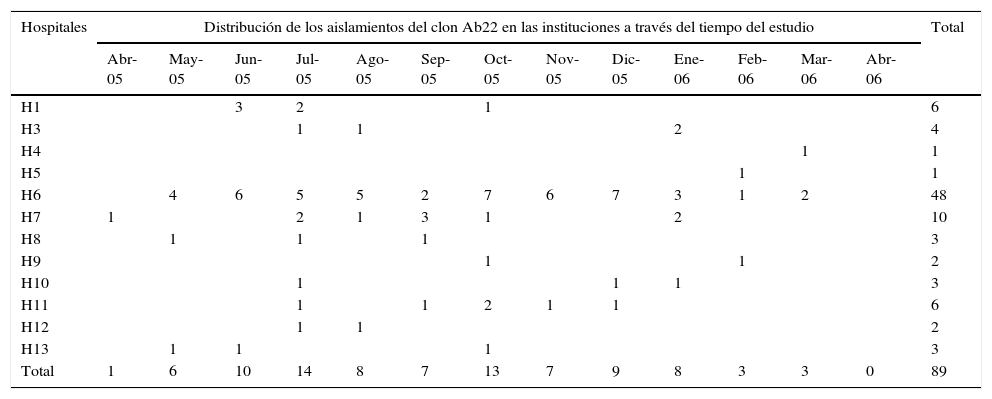
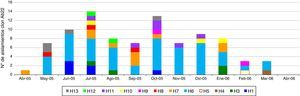
Distribución de los aislamientos del clon Ab22 en las instituciones a través del tiempo del estudio
| Hospitales | Distribución de los aislamientos del clon Ab22 en las instituciones a través del tiempo del estudio | Total | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Abr-05 | May-05 | Jun-05 | Jul-05 | Ago-05 | Sep-05 | Oct-05 | Nov-05 | Dic-05 | Ene-06 | Feb-06 | Mar-06 | Abr-06 | ||
| H1 | 3 | 2 | 1 | 6 | ||||||||||
| H3 | 1 | 1 | 2 | 4 | ||||||||||
| H4 | 1 | 1 | ||||||||||||
| H5 | 1 | 1 | ||||||||||||
| H6 | 4 | 6 | 5 | 5 | 2 | 7 | 6 | 7 | 3 | 1 | 2 | 48 | ||
| H7 | 1 | 2 | 1 | 3 | 1 | 2 | 10 | |||||||
| H8 | 1 | 1 | 1 | 3 | ||||||||||
| H9 | 1 | 1 | 2 | |||||||||||
| H10 | 1 | 1 | 1 | 3 | ||||||||||
| H11 | 1 | 1 | 2 | 1 | 1 | 6 | ||||||||
| H12 | 1 | 1 | 2 | |||||||||||
| H13 | 1 | 1 | 1 | 3 | ||||||||||
| Total | 1 | 6 | 10 | 14 | 8 | 7 | 13 | 7 | 9 | 8 | 3 | 3 | 0 | 89 |
Todos los aislamientos fueron positivos para OXA-51 (alelos OXA-66, OXA-69, OXA-95 y OXA-99). De los 135 aislamientos ABRC, en 129 se confirmó OXA-23, 5 fueron positivos únicamente para OXA-51 y uno amplificó OXA-24 (de modo que se confirmó OXA-72). Ningún aislamiento amplificó OXA-58, IMP ni VIM.
Electroforesis en gel de campo pulsadoPor EGCP se definieron 46 genotipos: 12 clones (aislamientos genéticamente relacionados) y 34 perfiles únicos (aislamientos no relacionados genéticamente con el resto) (tabla 1). El genotipo más grande fue Ab22 (n=89, aislamientos de ABRC–OXA-23) presentes en 12 instituciones, excepto H2 (tabla 1). El primer aislamiento de Ab22 se hizo en abril de 2005 en H7, y para mayo se realizó en H6, H8 y H13 (tabla 5; fig. 1). Los aislamientos Ab22 se detectaron en 11 de los 12 meses de estudio (tabla 5). El segundo genotipo más grande fue Ab12, presente únicamente en H4 (tabla 1).
DiscusiónA. baumannii es un agente potencialmente fatal de difícil tratamiento y erradicación en el entorno hospitalario. En este estudio, los factores de riesgo para infección/colonización por ABRC fueron: infección cruzada, hospitalización previa, clon (Ab22) y exposición previa a carbapenémicos por más de 3 días. La duración de la terapia antibiótica ha sido asociada previamente con el desarrollo de resistencia por Marra et al.15, quienes evidenciaron reducción en la frecuencia de aislamientos de AB resistente a imipenem, de 2,7 a 0,2 durante 1.000 días por paciente, al disminuir a 14 días la duración de esquemas de tratamiento antibiótico en UCI. Falagas et al.16 describieron como principal factor de riesgo el uso previo de antibióticos, principalmente carbapenémicos y cefalosporinas de tercera generación, seguido de fluoroquinolonas, aminoglucósidos y metronidazol.
Aunque en principio la exposición a carbapenémicos y cefalosporinas de tercera generación estuvo asociada en el análisis bivariado, en el multivariado la exposición previa a cefalosporinas de tercera generación no se mantuvo como factor de riesgo. Este resultado puede estar relacionado con el bajo poder obtenido, al encontrar una menor frecuencia de aislamientos a la esperada.
La hospitalización previa expone a los pacientes a uso de antibióticos y riesgo de colonización por gérmenes multirresistentes. Este fenómeno ha sido descrito recientemente en estudios de casos y controles en busca de factores de riesgo para resistencia en A. baumannii17,18. La identificación de un agrupamiento en común, definido como Ab22, favorece igualmente la teoría de la infección cruzada a partir de un foco de difícil erradicación y contaminación de superficies por una bacteria con alta capacidad de supervivencia en condiciones ambientales extremas. Por la metodología de este trabajo, no es posible determinar con seguridad los mecanismos de diseminación entre las diferentes instituciones, pero es posible que estos resultados puedan ser explicados por hallazgos de otros estudios de brote, con los que se identificó colonización de equipos, medio ambiente y manos de trabajadores de la salud como principal factor de riesgo17,18.
Se encontró que AB es resistente a carbapenémicos en más del 60% de la mayoría de las instituciones. La diseminación de AB a nivel mundial se asocia con los clones internacionales europeos I, II, III y el panamericano (WW5); este último incluye cepas colombianas19. Estos clones altamente exitosos se propagan fácilmente por infección cruzada. Al parecer, el proceso se inicia con presión antibiótica o selección desde un ancestro común7,20. En este estudio, el agrupamiento fue identificado principalmente en un hospital, el H7, donde tuvo un comportamiento endémico; esto indica que la diseminación en las UCI de Bogotá se asoció posiblemente a transmisión cruzada.
Al considerarse diseminación por infección cruzada, se propone registro previo al traslado de portadores de microorganismos de importancia epidemiológica21,22. Las medidas estrictas y tempranas de aislamiento fueron claves para contener la infección; en contraste, la reacción tardía hizo imposible erradicar el clon Ab22 en un hospital, con incidencia del 16%. Corbella y Van den Broek23,24 proponen que la contención temprana de brotes es fundamental para evitar la perpetuación endémica y el riesgo de que, una vez consolidado el brote, sea difícil identificar la fuente y controlarlo25,26. En este estudio se presentó otro agrupamiento de 13 cepas Ab12 restringido a un solo hospital. Su patrón de presentación indica pequeños focos de exacerbación de una cepa endémica de difícil control en este centro y su persistencia en el medio ambiente.
Más del 80% de los aislamientos fueron multirresistentes, con alta sensibilidad a polimixina, considerada una buena opción de tratamiento para ABRC2. Por otra parte, se considera que la tigeciclina también es una opción de tratamiento en infecciones que no incluyan el torrente sanguíneo y tracto urinario. Asimismo, la combinación terapéutica más eficaz es carbapeneme con polimixina intravenosa y micronebulizada, en algunos casos de neumonía nosocomial27,28. Sulbactam tiene actividad intrínseca frente a AB; su combinación a altas dosis con colistina tiene respuesta del 60% en neumonía27,28.
La cuarta parte de ABRC fueron positivos para MBL con E-test; sin embargo, la PCR mostró resultados negativos para VIM e IMP. Estos falsos positivos con E-test, que han sido previamente descritos29, recomiendan confirmar molecularmente estos resultados fenotípicos o utilizar pruebas con otros inhibidores de MBL, como el EDTA/mercapto acetato de sodio30.
En los ABRC del estudio, OXA-23 fue la enzima prevalente, ratificando lo descrito previamente a nivel mundial y en Colombia31–33. De acuerdo con la literatura, la diseminación de OXA-23 puede asociarse con la propagación de clones o la transferencia horizontal de esta carbapenemasa. Dicho evento se ha asociado con la presencia de la secuencia de inserción ISAba1, la cual puede localizarse en diferentes transposones como Tn200631,34. En Colombia estudios previos han detectado la presencia de ISAba132,33 asociada con OXA-23 y han identificado esta carbapenemasa tanto en cromosoma como en plasmido32. Aunque en nuestro estudio no determinamos la localización de OXA-23, podemos señalar que su diseminación se asoció con la propagación de un clon exitoso (clon Ab22) y en aislamientos no relacionados genéticamente, posiblemente con transferencia horizontal de OXA-23. Adicionalmente en esta investigación se identificó por primera vez OXA-7235; en un aislamiento de A. baumannii en Colombia, el cual presentó un patrón de campo pulsado único.
La mayor prevalencia de infecciones correspondió al torrente sanguíneo, contrario a lo reportado por Baran et al.36, quienes identificaron que el foco más frecuente es la infección del sitio operatorio y, en segundo lugar, el torrente sanguíneo. Este hallazgo alerta sobre la importancia de prevenir la infección asociada a CVC.
ConclusiónSe puede decir que la optimización de medidas de control de infecciones —en algunas instituciones participantes— se tradujo en una menor frecuencia de aislamientos de AB, hecho que impidió alcanzar el tamaño de muestra calculado. También dificultó identificar otros factores asociados. En contraste, permitió deducir que las medidas para prevenir infección cruzada (como higiene de manos, agrupamiento de pacientes, protocolos de limpieza y desinfección y uso racional de antibióticos) pueden controlar y hasta erradicar episodios de infección por ABRC, siempre y cuando se realice una intervención temprana1. Con los hallazgos descritos, se resalta la importancia de aplicar medidas efectivas para prevenir infecciones asociadas a la atención en salud especialmente la bacteriemia asociada a dispositivo y de usar prudentemente los antimicrobianos, con el fin de prevenir la selección y propagación de microorganismos resistentes a los antimicrobianos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl presente proyecto fue financiado por Colciencias CÓDIGO: 11010416355, Contrato 444 y la Universidad Nacional de Colombia código: 20201005279.
Conflicto de interesesLos autores participantes manifiestan no presentar ningún conflicto de interés.
A las instituciones participantes de GREBO:
Clínica de Occidente (Elkin Lemus, Norma Montoya, Marta Salinas, Francelina González, Edgar Sánchez); Clínica Jorge Piñeros Corpas (Geny Díaz, Carlos Barrios); Clínica Reina Sofía (Edilma Torrado, Diego Garzón); Clínica San Pedro Claver (Carlos Alquichire, Martha Ruiz, Gladis Ceballos, Pilar Hurtado, José Guillermo Ruiz Rodríguez); Fundación Cardioinfantil (Álvaro Arango, Patricia Bravo); Hospital Occidente de Kennedy (Romelia Villa, Nubia Escobar, Piedad Giraldo, Álvaro Jiménez); Hospital El Tunal (Marta Isabel Garzón, Julia Quijano, Rafael Pérez Yepes); Hospital Militar Central (Carlos Pérez, Matilde Méndez, María Nilse González, Diana Ferrucho, Juan Pablo Velásquez); Hospital Universitario San Ignacio (Carlos Álvarez, Beatriz Ariza); Hospital Simón Bolívar (Constanza Correa, Luz Janeth Márquez, William Clavijo); Hospital Santa Clara (José Roberto Tamara, Gloria Inés Gallo, Guillermo Ortiz); Hospital Universitario Clínica San Rafael (Marta Pulido, Rabel Lobelo); Hospital Universitario La Samaritana (Johana Osorio, Elsa Marina Zubieta, Emilio Rey); Instituto Nacional de Cancerología (Jorge Cortés, Claudia Patricia Arroyo, Luz Marina Martínez, Elizabeth Rodríguez, Clara Inés Gómez); Policlínico del Olaya (Johana Carol Estrada, Ana Isabel Sánchez, Carlos Hurtado Hurtado).