Determinar la frecuencia de formas parasitarias de Toxoplasma gondii (T. gondii) en diferentes tipos de carne de consumo humano comercializadas en Sincelejo-Sucre, mediante la amplificación del gen B1 por la técnica de reacción en cadena de la polimerasa (PCR).
Materiales y métodosSe realizó un estudio descriptivo que determinó la infección por Toxoplasma gondii, en 120 muestras de carnes de consumo humano, obtenidas en 2 tipos de expendios del municipio de Sincelejo. De cada sector se tomaron 60 muestras distribuidas así: 20 muestras de carne de res, 20 muestras de carne de cerdo y 20 muestras de carne de pollo. Estas muestras fueron sometidas a una extracción de ADN mediante el método de altas concentraciones de sales y a una PCR anidada para amplificar una región específica del material genómico de T. gondii correspondiente al gen B1.
ResultadosSe detectó ADN de Toxoplasma gondii en el 32% de las carnes analizadas. Dentro de este porcentaje se encontraron en proporciones similares, formas parasitarias de T. gondii en carne de pollo (35%), cerdo (32,5%) y res (27,5%), por lo cual no se observó diferencia estadística al realizar el análisis por tipo de carne. Así mismo se encontró una frecuencia de formas parasitarias de T. gondii de 36,6% en las muestras recolectadas en el mercado público y 26,7% en las muestras recolectadas en los supermercados de cadena.
ConclusionesEsta investigación demuestra la alta frecuencia de formas parasitarias de T. gondii en diferentes tipos de carne de consumo humano comercializados en el municipio de Sincelejo, e indica un elevado riesgo de infección por el parásito en la población.
To determine the frequency of infection by Toxoplasma gondii in different types of meat that is sold for human consumption in Sincelejo-Sucre, by PCR for B1 gene amplification.
Materials and methodsA total of 120 samples of meat for human consumption were obtained at 2 types of outlets (municipality public market and retail chain stores) in the city of Sincelejo. At each store, 60 samples of 3 different species were obtained: 20 beef samples, 20 pork samples and 20 chicken samples. These samples were submitted to DNA extraction procedures for tissues and to nested PCR to amplify B1 specific genomic region of T. gondii.
ResultsToxoplasma gondii DNA was detected in 32% of the analyzed meat. There were a slight higher frequency (36,6%) in samples collected at the municipality public market compared to retailed chain stores (26,7%) without statistical significance. The frequency of infection was similar between animal species: chicken (35%), pork (32,5%) and beef (27,5%).
ConclusionsThis work demonstrates a high frequency of T. gondii infection in different types of meat sold for human consumption in the town of Sincelejo, suggesting a high risk of infection by the parasite in the population.
Toxoplasma gondii (T. gondii) es un protozoario intracelular obligado de distribución mundial, que pertenece al Phylum apicomplexa1. Es el agente causal de la toxoplasmosis, una zoonosis que generalmente transcurre con síntomas clínicos leves no específicos en la mayoría de los pacientes. Además, es responsable de la pérdida de la visión en al menos un 1% de las personas infectadas, con alta morbilidad de fetos y pacientes inmunosuprimidos2,3.
Los felinos salvajes y domésticos son los hospedadores definitivos, que son quienes liberan en las heces la forma de resistencia del parásito, los ooquistes. Los seres humanos y prácticamente todas las especies de animales de sangre caliente son huéspedes intermediarios y pueden infectarse por ingestión de alimentos y agua infectada con ooquistes esporulados de T. gondii, por el consumo de quistes en los tejidos de animales infectados, o por transmisión congénita4,5.
La prevalencia de la infección por T. gondii a nivel mundial varía de acuerdo con factores culturales, geográficos, climáticos y de exposición5,6. Puede superar el 50% en perros, conejos y nutrias de mar; el 60% en ratones, ratas y aves silvestres y el 70% en gatos, osos y ciervos7. En los seres humanos oscila entre el 15 y el 85% de la población adulta, dependiendo de la región geográfica1.
Colombia es uno de los países con mayor prevalencia de toxoplasmosis en el mundo. Según el estudio nacional de salud de 1982, la seroprevalencia de infección por T. gondii en la población general es del 47%8, sin embargo, han sido pocos los estudios realizados para detectar ADN de T. gondii en alimentos, los cuales podrían constituir factores de riesgo de infección por el parásito9-11.
El material genético de T. gondii ha sido detectado en carne de animales de consumo humano como res, cordero, oveja, cerdo, cabra, conejo, pollo, caballo y animales de caza, razón por la cual se han identificado como fuentes de infección. Adicionalmente se ha evidenciado la infección por T. gondii en las carnes curadas y productos cárnicos, como salchichas crudas, salami y embutidos12,13.
En el municipio de Sincelejo no existen estudios que indiquen la presencia o ausencia de este protozoo en las carnes que diariamente consume la comunidad.
Esta falta de información permite que se expenda carne sin ningún tipo de control de calidad y que se coloque en riesgo la salud de los consumidores, especialmente de gestantes e inmunocomprometidos. Por lo tanto se hace necesario realizar estudios que ayuden a determinar la presencia de T. gondii en las carnes de consumo humano que se expenden en el municipio de Sincelejo.
En esta investigación se detectó ADN de T. gondii mediante la amplificación del gen B1 en muestras de carne de res, pollo y cerdo, expendidas en el municipio de Sincelejo. Su objetivo fue determinar la frecuencia de formas parasitarias de T. gondii en diferentes tipos de carne de consumo humano comercializadas en dicha ciudad.
Materiales y métodosTipo de estudioSe realizó un estudio descriptivo en el que se detectó ADN de T. gondii en muestras de carne de res, pollo y cerdo, obtenidas en diferentes expendios ubicados en el municipio de Sincelejo.
Área de estudioEste estudio fue realizado en la ciudad de Sincelejo, departamento de Sucre, ubicado al noroeste del país a 9° 18” de latitud norte, 75° 23” de longitud oeste del meridiano de Greenwich. Tiene una extensión total de 28.410,31 ha. La temperatura media anual está cercana a los 27,15°C ± 0,4; con una mínima promedio anual de 19,7°C y una máxima de 35,3°C14.
Muestra de estudioSe recolectaron 120 muestras de músculo esquelético en 2 lugares dedicados a la venta de productos para la canasta familiar: el mercado público y supermercados de cadena de la ciudad de Sincelejo. De cada sector se tomaron 60 muestras distribuidas así: 20 muestras de carne de res, 20 muestras de carne de cerdo y 20 muestras de carne de pollo. Cada una con un peso aproximado de 5 g. Estas muestras fueron empacadas en bolsas resellables, y transportadas desde el lugar de expendio hasta el Laboratorio de Investigaciones Biomédicas de la Universidad de Sucre donde fueron conservadas a −20°C por 24 h de forma previa a la manipulación.
Extracción de ADN genómicoLa extracción de ADN se llevó a cabo mediante el método de altas concentraciones de sales15. Se maceraron 150mg de la muestra en 500μL de buffer de lisis (SDS [sodium dodecyl sulfato, BioAmérica, Miami, EE. UU.] 0,1%, EDTA [disodium salt dihydrate, BioAmérica, Miami, EE. UU.] 1mM, Tris-HCl [BioAmérica, Miami, EE. UU.] 10mM) por 10 min. A la muestra homogenizada se le adicionaron 6,2μL de proteinasa K (proteinase K, Promega, Madison, EE. UU.); se incubó a 55°C por 4 h y se inactivó la enzima a 94°C por un minuto. Luego se adicionaron 150μL de NaCl (sodium chloride, Amresco Bioexpress, Ohio, EE. UU.) 6M y se centrifugó a 4°C y 12.000rpm durante 10 min. El sobrenadante de cada muestra fue depositado en un nuevo vial y a cada uno de ellos se le agregó el doble de su volumen en etanol absoluto (Merck, Alemania) y se almacenó a −20°C durante toda la noche, para precipitar el ADN total. Terminada la precipitación del ADN, se centrifugó a 4°C y 12.000rpm durante 10 min y se realizaron 3 lavados con 1.000μL de etanol al 70%. Finalmente el ADN se secó a 55°C por 20 min y se resuspendió el ADN en 100μL de tampón TE (Tris-HCl Bioamérica 10mM, EDTA Bioamérica 0,1mM).
Cuantificación y verificación de la integridad del ADN por reacción en cadena de la polimerasaLuego del proceso de extracción, se realizó la cuantificación del ADN obtenido en un espectrofotómetro Nanodrop 2000. A cada una de las muestras se le determinó su concentración y su pureza de acuerdo a la proporción OD 260nm/OD 280nm. Se obtuvo un promedio de concentraciones de 567 ng/μL y un promedio de proporción OD 260nm/OD 280nm de 1,75. Adicionalmente, se realizó una PCR convencional con el fin de verificar la integridad del ADN extraído, a través de la cual fue amplificado un fragmento de 359 pb de la región conservada del gen mitocondrial cyt b de vertebrados, utilizando los cebadores (cyt b1): 5’-CCA TCC AAC ATC TCA GCA TGA TGA AA-3’ y (cyt b2): 5’-GCC CCT CAG AAT GAT ATT TGT CCT CA-3’ sintetizados por Integrated DNA Technologies IDT.
Amplificación del gen B1La detección del ADN del parásito se realizó mediante una PCR anidada con el fin de aumentar la especificidad y sensibilidad de la técnica; para lo cual se emplearon 2 pares de cebadores, sintetizados por Integrated DNA Technologies IDT, que amplifican una región del gen B1 de T. gondii.
El proceso de amplificación se realizó en 2 etapas. La primera ronda consistió en la amplificación de un fragmento de 193 pb con los cebadores toxo N1 5¿-GGAACTGCATCCGTTCATGAG-3‘, toxo C1 5¿-TCTTTAAAGCGTTCGTGGTC-3‘, a una concentración de 0,4 pmol en una mezcla de reacción de 25μL. Esta mezcla también incluyó: agua filtrada estéril Quibi 10,05μL, buffer de PCR promega 1X 5μL, MgCl2 promega 1,25Mm 1,25μL, DNTPs bioline 0,25Mm 2,5μL, taq polimerasa 1 U promega 0,2μL y ADN 2μL. La segunda ronda consistió en la amplificación de un fragmento de 96 pb con los cebadores toxo N2 5¿-TGCATAGGTTGCCAGTCACTG-3¿ y toxo C2 5¿-GGCGACCAATCTGCGAATACACC-3¿, a una concentración de 0,8 pmol en una mezcla de reacción de 25μL. Esta mezcla también incluyó: agua filtrada estéril Quibi 6,05μL, tampón de PCR promega 1X 5μL, MgCl2 promega 1,25 Mm 1,25μL, DNTPs Bioline 0,25 Mm 2,5μL, taq polimerasa 1 U Promega 0,2μL y ADN 2μL.
Para evitar resultados falsos negativos se empleó como control positivo ADN de cepa RH de T. gondii y, como control negativo, un volumen de agua filtrada estéril Quibi que indica posibles contaminaciones. El proceso de amplificación se llevó a cabo en un termociclador Veriti® 96-Well Fas Applied Biosystems.
Visualización de los productos de reacción en cadena de la polimerasaLos productos de PCR fueron separados mediante una electroforesis en gel de agarosa Bioline al 2% en buffer TBE 0,5% (Tris Bioamérica, ácido bórico Gibcobrl, EDTA Bioamérica) a 80 voltios durante 40 min. Los resultados se visualizaron en un fotodocumentador Vilberlourmat, teñidos previamente con Gelstar® (Nucleic Acid Gel Stainfor DNA y RNA análisis). En cada electroforesis se utilizó un control positivo, un control negativo y un marcador de peso molecular 100 pb (Corpogen, Bogotá) con el fin de determinar el tamaño de los fragmentos amplificados.
Análisis de datosLos resultados obtenidos fueron introducidos en una base de datos diseñada en Microsoft Excel 2007, para su posterior análisis mediante el programa R versión 2.7.1. Se hallaron frecuencias de infección por tipo de carne, por lugar de recolección, intervalos de confianza y se realizó análisis de correspondencia múltiple.
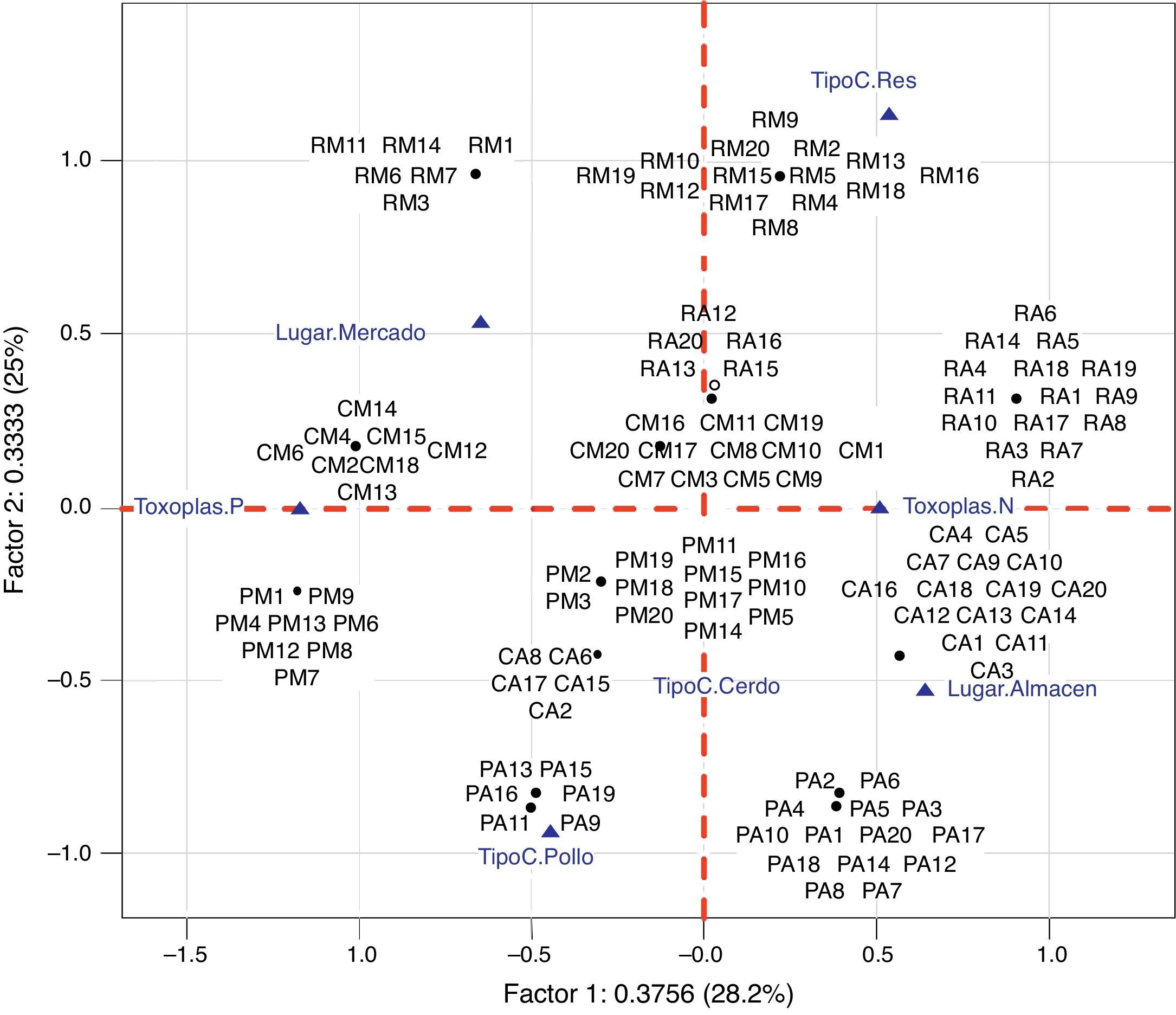
ResultadosDe las 120 muestras de carnes de cerdo, pollo y res analizadas mediante PCR anidada y después de visualizar los productos obtenidos en los geles de agarosa, fue posible detectar ADN del parásito T. gondii en 38 de las muestras (fig. 1), las cuales representan el 32% de la muestra de estudio. Esto permite afirmar con un 95% de confianza que en Sincelejo las carnes de consumo humano que se comercializan están infectadas por T. gondii en porcentajes que fluctúan del 23,6 al 40,8%.
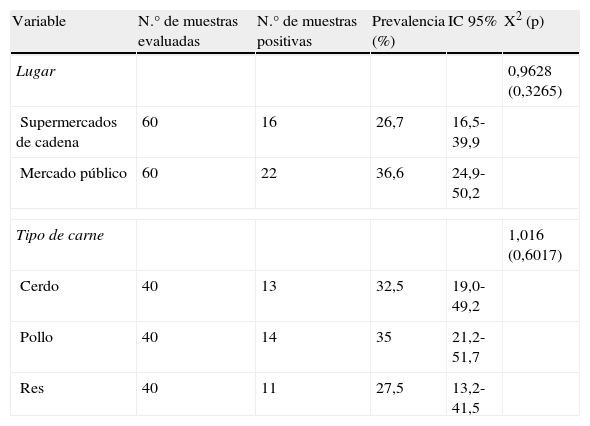
Teniendo en cuenta el lugar de recolecta, se obtuvo que en 36,6% (22 de 60) de las muestras recolectadas en el mercado público se detectó ADN de T. gondii y en los supermercados de cadena solo se encontraron 16 muestras positivas para la infección con el parásito de un total de 60 analizadas, lo que representa un 26,7%. Estos resultados no presentan diferencia estadísticamente significativa (tabla 1). Al realizar el análisis de independencia con un 95% de confianza, se obtuvo que la presencia de formas parasitarias de T. gondii en carnes es independiente del lugar de recolecta, es decir que se pueden consumir proporciones similares de carne infectada con el parásito procedente de ambos tipos de expendios (X2cal=0,9628; p = 0,3265 > 0,05).
Tabla de contingencia r x n para la frecuencia de infección por T. gondii, de acuerdo al sitio de expendio de carne y según el tipo de carne
| Variable | N.° de muestras evaluadas | N.° de muestras positivas | Prevalencia (%) | IC 95% | X2 (p) |
| Lugar | 0,9628 (0,3265) | ||||
| Supermercados de cadena | 60 | 16 | 26,7 | 16,5-39,9 | |
| Mercado público | 60 | 22 | 36,6 | 24,9-50,2 | |
| Tipo de carne | 1,016 (0,6017) | ||||
| Cerdo | 40 | 13 | 32,5 | 19,0-49,2 | |
| Pollo | 40 | 14 | 35 | 21,2-51,7 | |
| Res | 40 | 11 | 27,5 | 13,2-41,5 | |
IC: intervalo de confianza.
El análisis de proporciones realizado para la detección de formas parasitarias por lugar de recolecta mostró que, con un 95% de confianza, las carnes que se comercializan en el mercado público están infectadas con T. gondii en proporciones que van de 24,8 a 50,1%, en tanto las carnes que se comercializan en los supermercados de cadena están infectadas con el parásito en porcentajes que van de 16,4 a 39,8%.
Con relación al tipo de carne, se encontró que la carne de pollo fue la que presentó mayor porcentaje de infección por T. gondii, con un total de 14 muestras positivas, las cuales representan el 35%. En segundo lugar se encuentra la carne de cerdo, con 13 (32,5%) muestras positivas y por último la carne de res con 11 (27,5%) muestras positivas. Estos resultados no presentan diferencia estadística (tabla 1). Al realizar el análisis de independencia se obtuvo que, con un 95% de confianza, la detección de formas parasitarias de T. gondii es independiente del tipo de carne, es decir que en Sincelejo se pueden consumir proporciones similares de carnes de pollo, res y cerdo, infectadas con el parásito causante de la toxoplasmosis (X2=1,0; p = 0,6).
El análisis de proporciones, con un 95% de confianza, para los tipos de carne, mostró que en Sincelejo se puede consumir carne infectada de pollo en porcentajes que van de 21,1 a 51,7%, carne de cerdo en porcentajes que van de 19 a 49,2% y carne de res en porcentajes que van de 13,2 a 41,5%.
El análisis de correspondencia múltiple mostró que la presencia de T. gondii en los 3 tipos de carnes estudiados (cerdo, pollo y res) y los sitios de recolecta son independientes, lo que permite observar en forma agrupada, en el plano 1 de la figura 2, las muestras positivas de los 3 tipos de carne estudiados y de cualquiera de los puntos de recolecta. Además, sugiere que es posible encontrar el mismo porcentaje de carnes positivas para la infección por T. gondii en ambos lugares y en todos los tipos de carne aquí analizados.
DiscusiónLa carne infectada con T. gondii es una fuente importante de infección para los humanos y en Colombia se ha encontrado que puede ser la fuente de infección para el 25% de los casos de toxoplasmosis durante el embarazo12.
En este estudio se detectó ADN de T. gondii en el 32% de las carnes comercializadas para consumo humano en el municipio de Sincelejo, razón por la cual podrían constituir una fuente de infección importante para la población de esta ciudad, especialmente si se tiene el hábito de consumir la carne cruda o mal cocida. Dentro de este porcentaje se encuentra infectada, en proporciones similares, carne de pollo, cerdo y res. Estos resultados confirman la alta exposición de la población de Sincelejo al parásito.
Según estudios preliminares existe una baja frecuencia de infección por T. gondii en pollos, debido a las prácticas de manejo y condiciones de producción intensiva en que son criados estos animales12. Sin embargo, en la presente investigación se encontró que 14 de las 40 muestras estudiadas (35%) fueron positivas para la detección de formas parasitarias de T. gondii; cifras que son similares al resultado reportado por Lora et al.12 para el eje cafetero, en el que el 40% de las muestras estudiadas estaban infectadas (34 de 60).
El alto porcentaje de infección encontrado en pollos se puede explicar al evaluar las condiciones en las que probablemente fueron criados estos animales. Al ser criados en galpones, no están en contacto con heces de gatos, por lo que se reduce la posibilidad de contraer la infección por hábitos alimenticios, ya que toman el alimento directamente de comederos tubulares y no del suelo, que podría estar infectado con ooquistes. Además, la etología de Gallus gallus indica que no son aves de rapiña, por lo cual no pueden contraer la infección por consumir quistes tisulares de otros huéspedes intermediarios. La fuente de infección más probable para los pollos podría ser la ingesta de agua, ya que el líquido que se les suministra proviene de pozos, a los cuales pueden tener acceso los gatos. Además se sabe que el tratamiento que se realiza al agua va dirigido contra bacterias como salmonelas, coliformes y Pseudomonas16, tratamiento que no inactiva los ooquistes de Toxoplasma que pueda contener la misma.
Es importante también tener en cuenta que el consumo de agua en pollos de engorde es 1,8-2,3 veces el consumo diario de alimento17, razón por la cual el agua, que podría estar infectada con ooquistes, se vuelve una fuente de infección por T. gondii mucho más importante para estos animales.
Con respecto a la carne de cerdo, esta siempre ha sido considerada una fuente importante de infección por T. gondii teniendo en cuenta las condiciones higiénico-sanitarias en las que son criados18,19. En algunos estudios se ha detectado el parásito en órganos como retina, corazón, cerebro, músculos, pulmones y productos derivados de este tipo de carne como las salchichas, siendo la cantidad de quistes menor de uno por cada 50 g de tejido18.
La literatura indica que existe una relación entre la disminución de las tasas de infección por T. gondii en cerdos y los cambios en la forma de crianza de estos animales a través del tiempo. En la Unión Europea a finales de 1960 los cerdos vivían al aire libre y la tasa de infección era mayor o igual al 75%; sin embargo, con la aplicación de nuevos sistemas de producción, la tasa de infección se ha logrado disminuir a un porcentaje menor del 1%19,20.
En este estudio el 32,5% (13 de 40) de las muestras de cerdo analizadas por PCR resultaron positivas para la infección por T. gondii, lo cual confirma que esta especie es un factor de alto riesgo epidemiológico como fuente de infección para la población de Sincelejo.
La frecuencia de formas parasitarias de T. gondii en cerdo encontrada en este estudio difiere de la tendencia señalada para la Unión Europea, en donde es poco probable que el cerdo sea una fuente importante de infección20, y se puede aludir a las diferencias en las condiciones de crianza de cerdos utilizados en ambas área de estudio.
En el departamento de Sucre, no existen suficientes lugares destinados a la producción intensiva de cerdo, de modo que esta actividad se realiza mayoritariamente de forma artesanal y se lleva a cabo en los traspatios de fincas, donde los cerdos son criados en porquerizas con deficientes condiciones de higiene, predispuestos a contraer toxoplasmosis por contacto con heces de gatos. Adicionalmente, son alimentados con restos de cultivos y comida humana, a partir de los cuales también pueden contraer la infección.
Los resultados encontrados en este estudio, para la detección de ADN de T. gondii en cerdos, son similares a los publicados en el estudio de prevalencia en productos cárnicos realizado en Reino Unido por Aspinall et al.21 en el que se encontró una frecuencia de detección de formas parasitarias de T. gondii de 34,5% mediante PCR; y a los encontrados en salchichas de cerdo en São Paulo (Brasil), donde se reporta un 27,1%22. Sin embargo, la frecuencia de detección de ADN del parásito en carne de cerdo encontrada en este estudio es inferior a la reportada para el eje cafetero: 70% de 60 muestras estudiadas por PCR12.
El ganado vacuno, por su parte, es considerado un huésped deficiente para T. gondii. Sin embargo, han sido reportadas infecciones naturales y experimentales para este tipo de ganado23–25. También se sabe que la primoinfección en hembras gestantes es causa de abortos, lo cual trae consigo grandes pérdidas económicas24. En este estudio se encontró que 11 de 40 (27,5%) muestras de carne de res, analizadas por PCR fueron positivas para T. gondii, prevalencia inferior a la reportada en el eje cafetero (48,3%)12.
La infección en el ganado vacuno en el municipio de Sincelejo puede atribuirse al consumo de pastizales y agua infectados con ooquistes provenientes de heces de gatos. Pese a que en este estudio se reporta un porcentaje de infección relativamente inferior al resto de tipos de carnes estudiados, es importante tener en cuenta que la carne de res tiene especial preferencia para consumo humano26, por lo cual se puede considerar una fuente potencial de infección por T. gondii en la población.
Por otra parte, en esta investigación se encontró que los porcentajes de infección para los lugares en donde fueron recolectadas las muestras no presentan diferencias estadísticas, es decir, que pueden encontrarse proporciones iguales de carnes infectadas por T. gondii en ambos lugares. Esto también permite inferir que la infección de las carnes, en este municipio, no depende de las condiciones de manipulación y almacenamiento de la carne, sino que, probablemente está más relacionada con la forma y condiciones de crianza de los animales destinados para consumo humano.
Finalmente, los resultados reportados en este estudio, sumados a la condición real del manejo de las carnes en Sincelejo y en Sucre en general27, son realmente alarmantes y deben ser el objeto de muchas otras investigaciones que aporten conocimientos a la epidemiología de la toxoplasmosis, para contribuir en el establecimiento de un esquema de prevención y control de la infección por T. gondii en carnes de consumo humano, así como instrucciones para la manipulación y almacenamiento adecuados y, de esta manera, reducir el riesgo de infección oral en la población susceptible.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLa investigación fue financiada por Colciencias y los investigadores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosEste estudio fue realizado en el marco del proyecto código 112949326224 financiado por colciencias (contrato número 728-2009). Agradecemos al Grupo de Investigaciones Biomédicas de la Universidad de Sucre el apoyo brindado para la ejecución de este proyecto y a la docente Melva Liliana Vertel Morinsón por su asesoría en el análisis estadístico de los datos.