Las infecciones por Klebsiella pneumoniae productora de carbapenemasa (KPC) son un problema de salud pública mundial. Desde 2008 nuestra institución experimenta casos endémicos de infecciones por KPC posteriores a un brote cuyo caso índice fue un paciente de Israel admitido para trasplante hepático.
ObjetivoDescribir características clínicas y mortalidad en pacientes hospitalizados con infecciones nosocomiales por KPC.
MétodosEstudio observacional retrospectivo, descriptivo.
ResultadosUn total de 52 pacientes fueron incluidos, la edad media fue 45,7±27 años, 65,4% fueron hombres. Uso de inmunosupresores, cirugía gastrointestinal, hepatopatía crónica y trasplante de órgano sólido fueron las comorbilidades importantes. El 100% recibió antibióticos antes de la infección por KPC. Las principales infecciones fueron bacteriemia (30,7%), infección intraabdominal (23,1%) y neumonía (17,3%). El tratamiento fue dirigido por antibiograma en 50,7%. Tigeciclina fue administrada en el 51,9% y colistina en el 32,7%, ambas en terapia combinada con otros antibióticos. En el 15,4% se utilizó tigeciclina más colistina. La duración del tratamiento fue 15,7±7,5 días. El 51,9% desarrolló bacteriemia y falla renal aguda y el 76,9% requirió atención en UCI. La mortalidad fue 48,1% y fue significativamente mayor en pacientes con bacteriemia vs. sin bacteriemia (74,1 vs. 20%; p ≤ 0,01). No hubo diferencias significativas en mortalidad cuando se comparó uso de tigeciclina vs. colistina (45 vs. 52%; p=0,609).
ConclusiónLa inmunosupresión, cirugía gastrointestinal, tratamiento previo con antibióticos y estancia en UCI son factores importantes para la infección por KPC. La mortalidad es alta a pesar de la terapia dirigida, especialmente en pacientes con bacteriemia.
Carbapenemase-producing Klebsiella pneumoniae (KPC) infections are a worldwide public health problem. Since 2008, our institution has experienced endemic cases of KPC infection after an outbreak whose index case was a patient from Israel admitted for liver transplantation.
ObjectiveTo describe the clinical characteristics and mortality of inpatients with nosocomial KPC infections.
MethodsRetrospective, descriptive observational study.
ResultsA total of 52 patients were included, with an average age of 45.7±27 years; 65.4% were men. Use of immunosuppressants, gastrointestinal surgery, chronic liver disease and solid organ transplantation were significant comorbidities. All the patients had received antibiotics before the KPC infection. The primary infections were bacteraemia (30.7%), intra-abdominal infections (23.1%) and pneumonia (17.3%). Treatment was directed by antibiogram in 50.7% of cases. Tigecycline was administered in 51.9% of cases and colistin in 32.7%, both in combination therapy with other antibiotics. Colistin plus tigecycline was used in 15.4% of cases. The treatment duration was 15.7±7.5 days, with 51.9% of patients developing bacteraemia and acute renal failure and 76.9% requiring ICU care. Mortality was 48.1% and was significantly higher in the patients with bacteraemia compared with those without (74.1 vs. 20%, respectively, p ≤ 0.01). There were no significant differences in mortality between tigecycline and colistin use (45 vs. 52%, respectively, p = 0.609).
ConclusionImmunosuppression, gastrointestinal surgery, previous treatment with antibiotics and ICU stay are important factors for infection with KPC. Mortality is high despite targeted therapy, particularly in patients with bacteraemia.
Las infecciones causadas por enterobacterias productoras de carbapenemasas, especialmente Klebsiella pneumoniae, se han convertido en un problema de salud pública mundial. Los brotes iniciales de infecciones por K. pneumoniae productora de carbapenemasas (KPC) fueron localizados en Estados Unidos, sin embargo ahora se han extendido a todo el mundo, alcanzando características endémicas y se ha identificado este tipo de enterobacterias en 25 países en los 5 continentes1. Se caracterizan por tener enzimas codificadas genéticamente, que confieren resistencia a múltiples antimicrobianos, incluyendo los carbapenems2–6. Las carbapenemasas son codificadas por el gen blaKPC localizado en plásmidos, que hace que las bacterias que lo portan tengan la capacidad de compartir la información genética con otras especies y familias de bacterias, lo que facilita su propagación clonal y geográfica4,6,7. Adicionalmente, ligadas a esta capacidad de fácil extensión y diseminación, están las altas proporciones de fallos terapéuticos y mortalidad, que son variables y se acercan al 50%, especialmente en pacientes con bacteriemia2,8.
La descripción inicial de infecciones por gérmenes productores de KPC se produjo en Carolina del Norte (Estados Unidos) en 1996, donde se identificó un aislamiento de K. pneumoniae en cuidado intensivo (UCI), resistente a todos los betalactámicos, incluyendo carbapenems9; rápidamente varios casos fueron informados en hospitales de Estados Unidos10–12. Más tarde, en Nueva York, se documentan brotes epidémicos tanto por K. pneumoniae como por otras enterobacterias, confirmando la sospecha de la transferencia interespecies de este mecanismo de resistencia13.
El primer reporte internacional de infección por KPC fue documentado en París (Francia) en 2005, en un paciente previamente tratado en Nueva York, sin que se documentaran otros aislamientos similares en ese periodo de tiempo en dicho hospital. Fue, por tanto, considerado como trasmisión intercontinental de KPC14. Posterior a esta descripción hay varios reportes de casos de transmisión asociados a migración geográfica de pacientes, especialmente, en Israel y en Grecia15–19. El primer reporte de aislamientos de KPC en Latinoamérica se realizó en Medellín (Colombia) en 200520. Dos casos de infección por KPC, sin historia de viajes al exterior, fueron reportados; en dicha ocasión no fue posible demostrar nexos con los brotes de KPC en Norteamérica, pero sí se encontró similitud con el aislamiento francés: en el artículo se concluyó la importancia de la trasmisión geográfica de infección.
En 2008, el Hospital Pablo Tobón Uribe, un hospital universitario de atención de alta complejidad, donde se había descrito por primera vez la presencia de K. pneumoniae productora de KPC-2 en Latinoamérica20, presentó un brote epidémico de K. pneumoniae resistente a carbapenems, cuyo caso índice fue un paciente proveniente de Israel para el programa de trasplante hepático. Mediante estudios de polimorfismos en la longitud de los fragmentos de restricción y secuenciación, se confirmó la presencia de K. pneumoniae blaKPC-3, genéticamente similar a la cepa de Israel involucrada en múltiples brotes nosocomiales en ese país: constituyó un episodio adicional a la ya larga lista de episodios de epidemias de KPC atribuidos a diseminación intercontinental21. En menos de 3 años se documentaron 84 pacientes afectados entre colonizados e infectados con un aumento del 700% en la incidencia de infecciones KPC, que pasó del 1,9 al 19%. El Comité de Prevención de Infecciones inició el proceso de control del brote reforzando las medidas de higiene de manos y las de precaución estándar, cohortización geográfica de pacientes, asignación de personal médico y paramédico exclusivo para la atención de pacientes, ropa de uso único y búsqueda activa de colonizados; medidas que permitieron el control del brote.
En Colombia entre julio de 2009 y junio de 2010, el análisis de la prevalencia de bacterias gramnegativas portadoras del gen blaKPC en 6 hospitales de tercer nivel demostró que K. pneumoniae presentó la mayor prevalencia con el 19,1%, y fueron las unidades de cuidados intensivos pediátricas y neonatales las que aportaron el mayor número de casos22. Para el año 2011 la tendencia de la resistencia bacteriana en hospitales en Colombia reveló que las cepas de K. pneumoniae con resistencia a carbapenems tuvieron un cambio porcentual superior al 100%, probablemente asociado a brotes de KPC-323. Adicionalmente, en 2012 el análisis microbiológico en UCI también evidenció un significativo incremento en el número de aislamientos K. pneumoniae, generando el 15% de los casos de infección en UCI con un incremento promedio del 7% en la resistencia a carbapenems24.
Nuestro trabajo pretende complementar las descripciones realizadas previamente en nuestro hospital, haciendo énfasis en el comportamiento clínico y en la mortalidad de los pacientes con infección nosocomial por KPC.
MetodologíaSe desarrolló un estudio observacional retrospectivo, descriptivo, en el que se incluyó a los pacientes hospitalizados con infecciones nosocomiales por KPC entre enero de 2008 y enero de 2011, en el Hospital Pablo Tobón Uribe de Medellín (Colombia), hospital de enseñanza universitaria de alta complejidad de atención y centro de referencia de trasplantes en Colombia.
Los pacientes fueron identificados a través del sistema de información clínica hospitalaria y de la base de datos del Departamento de Microbiología. Se incluyó solo a pacientes infectados; no se incluyó a los pacientes colonizados. La identificación microbiológica fue realizada en el laboratorio de microbiología del hospital con los protocolos estandarizados a nivel internacional. Se utilizó el sistema automatizado Vitek® (bioMérieux Clinical Diagnostics). Se consideraron sospechosos de producción de carbapenemasa cuando, por el sistema automatizado, se documentó CIM para ertapenem en el rango de resistencia según las recomendaciones del Clinical and Laboratory Standards (CLSI) y, además, en el antibiograma expresaron resistencia a la mayoría de los antibióticos, conservando solo susceptibilidad a tigeciclina y colistina y en muy pocos casos a aminoglucósidos y quinolonas. La confirmación de KPC fue realizada mediante el test de Hodge modificado. Los aislamientos iniciales tuvieron, además, confirmación por biología molecular.
Se revisó la historia clínica de cada paciente y las variables demográficas, de comorbilidad, características clínicas y microbiológicas, de uso de antibióticos, de tratamientos, de complicaciones y de los resultados de atención fueron extraídas y consignadas en una base de datos de Excel, Microsoft Office.
La base de datos fue analizada en conjunto con la Unidad de Epidemiología e Investigación Clínica del hospital con el software SPSS versión 13.0. Las variables cuantitativas son presentadas como media, medianas y rangos intercuartílicos acordes con la distribución de los datos. Las variables cualitativas se presentan como frecuencias absolutas y proporciones. La prueba de chi cuadrado (χ2 test) de asociación fue usada para evaluar diferencias en tratamientos y mortalidad.
ResultadosEn el periodo de enero 2008 a enero de 2011, 52 pacientes fueron identificados con infección por K. pneumoniae resistente a carbapenems (KPC). El caso índice identificado fue un paciente proveniente de Israel y admitido para trasplante hepático. Los estudios de biología molecular realizados en nuestros pacientes mediante polimorfismos en la longitud de los fragmentos de restricción y secuenciación confirmaron la presencia de K. pneumoniae blaKPC-3, genéticamente similar a la cepa de Israel involucrada en múltiples brotes nosocomiales en ese país21.
Las características generales de la población se muestran en la tabla 1. El 92,4% de los pacientes fueron colombianos, el 7,6% fueron extranjeros (de Ucrania e Israel). La edad promedio fue 45,7 ± 27 años (rango 1 a 87). El 65,4% fueron hombres. El 19,2% de los pacientes tenían historia de tabaquismo y alcoholismo y el 3,8% antecedente de uso de drogas ilícitas. Las principales condiciones comórbidas fueron uso de inmunosupresores (63,5%), cirugía gastrointestinal (42,3%), enfermedad hepática crónica (30,8%) y trasplante de órgano sólido (25%). El 21,2% de los pacientes tuvo hospitalización previa en UCI y el 17,3% había requerido ventilación mecánica previa.
Características generales de los pacientes con infección por K. pneumoniae productora de carbapenemasas
| Características | Valor | Porcentaje o rango |
|---|---|---|
| Edad promedio en años | 47,5±27 | 1-87 |
| Menor de 15 años | 11 | 21,1 |
| Género | ||
| Hombre | 34 | 65 |
| Mujeres | 18 | 35 |
| Antecedentes | ||
| Tabaquismo | 10 | 19,2 |
| Alcoholismo | 10 | 19,2 |
| Uso de drogas inhaladas | 2 | 3,8 |
| Usuario de drogas iv | 2 | 3,8 |
| Comorbilidades | ||
| Cirugía gastrointestinal | 22 | 42,3 |
| Terapia inmunosupresora | 17 | 32,7 |
| Uso crónico de esteroides | 16 | 30,8 |
| Hepatopatía | 16 | 30,8 |
| Trasplante de órgano sólido | 13 | 25 |
| Neoplasia de órgano sólido | 13 | 25 |
| IRC | 8 | 15,4 |
| Diabetes mellitus | 5 | 9,6 |
| EPOC | 4 | 7,7 |
| EAOC | 3 | 5,8 |
| Hipoesplenismo | 3 | 5,8 |
| VIH | 2 | 3,8 |
| Insuficiencia cardiaca congestiva | 2 | 3,8 |
| Enfermedad reumatológica | 2 | 3,8 |
| TRRC | 2 | 3,8 |
| Antecedente previo de UCI | 11 | 21,1 |
| Antecedente previo de VM | 9 | 17,3 |
| Resultados de atención | ||
| Complicaciones | ||
| Bacteriemia secundaria | 27 | 51,9 |
| IRA | 27 | 51,9 |
| SDOM | 20 | 38,5 |
| Disfunción hepática | 13 | 25 |
| CID | 11 | 21,1 |
| SDRA | 10 | 19,2 |
| Atención en UCI | 40 | 76,9 |
| Ventilación mecánica | 38 | 73,1 |
| Antibiótico previo | 52 | 100 |
| Tratamiento | ||
| Dirigido | 30 | 57,7 |
| Empírico con posterior aislamiento | 22 | 42,3 |
| Características del tratamiento | ||
| Aprobado por la FDA | 25 | 48,1 |
| No aprobado por FDA pero con respaldo | 17 | 32,7 |
| No aprobado por FDA y sin respaldo | 10 | 19,2 |
| Antibiótico utilizado | ||
| Tigeciclina con otros AB | 27 | 51,9 |
| Colistina con otros AB | 17 | 32,7 |
| Tigeciclina más colistina | 8 | 15,4 |
| Duración del tratamiento en días | 15,7 ± 7,5 | 4-42 |
| Curación clínica | 29 | 55,8 |
| Falla microbiológica | 17/40 | 47,5 |
| Muerte | 25 | 48,1 |
CID: coagulación intravascular diseminada; EAOC: enfermedad arterial oclusiva crónica; EPOC: enfermedad pulmonar obstructiva crónica; FDA: Food and Drug Administration; IRA: insuficiencia renal aguda; IRC: insuficiencia renal crónica; SDOM: disfunción orgánica múltiple; SDRA: síndrome de distrés respiratorio agudo; TRRC: terapia de reemplazo renal continua; UCI: unidad de cuidados intensivos; VIH: virus de la inmunodeficiencia humana; VM: ventilación mecánica; AB: antibióticos.
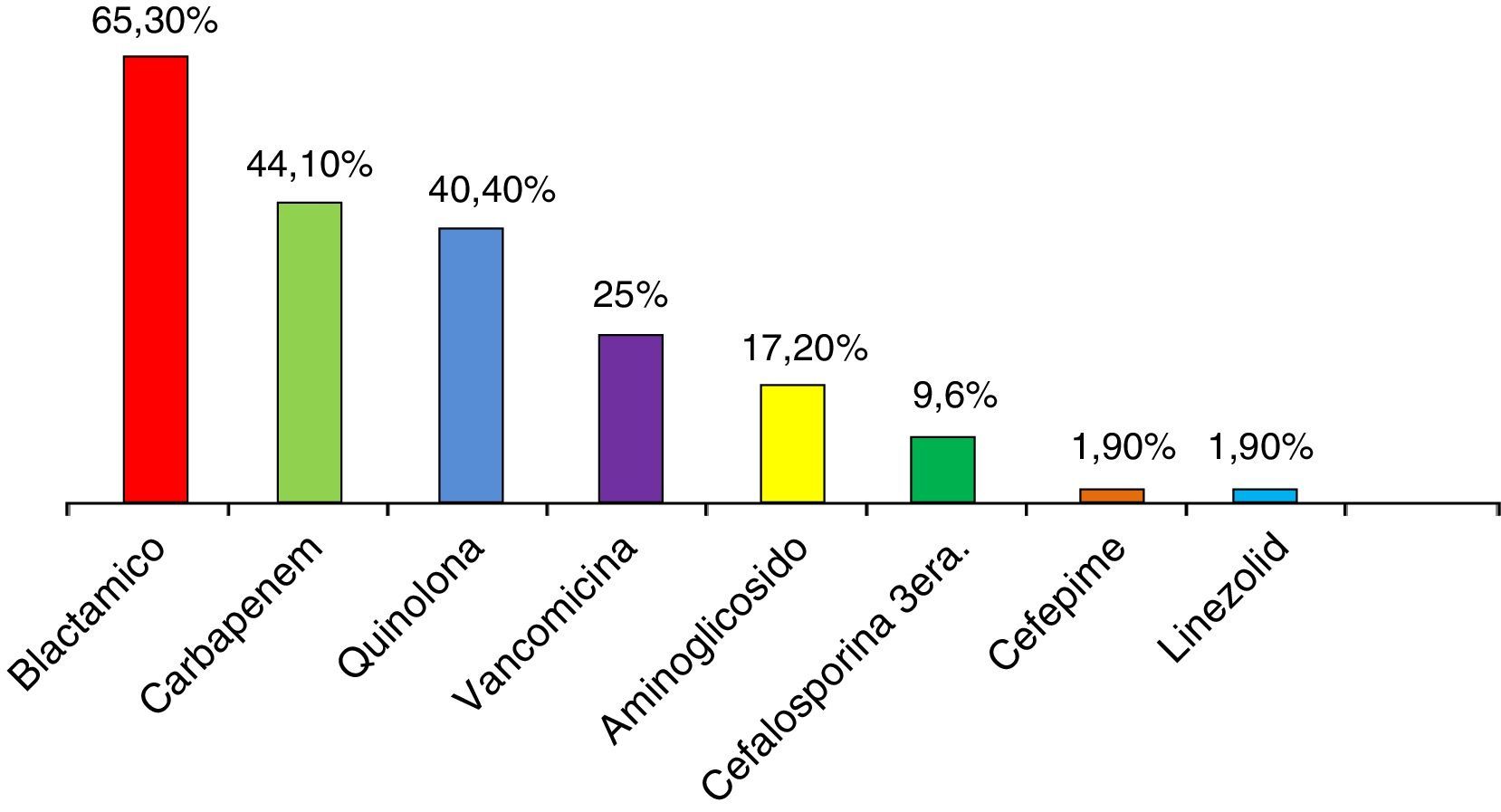
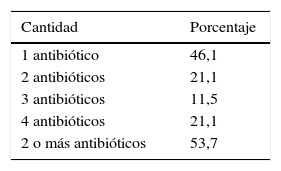
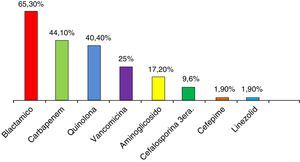
Todos los pacientes recibieron antibióticos previos a la documentación de infección por KPC. Los más utilizados fueron betalactámicos diferentes de carbapenems (65,3%), carbapenems (44,1%) y quinolonas (40,4%) (fig. 1). En el 53,7% de los casos se utilizaron 2 o más antibióticos (tabla 2).
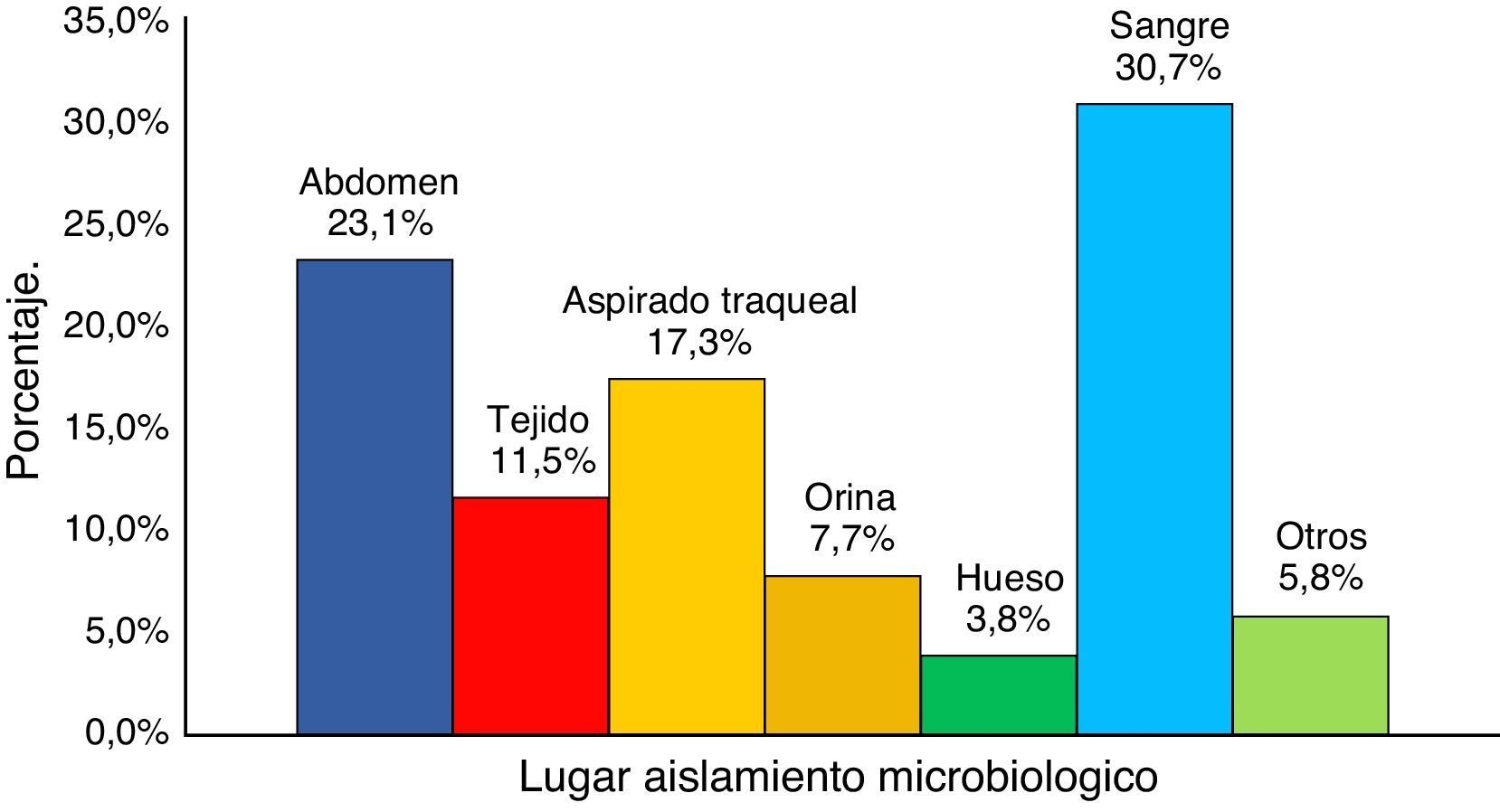
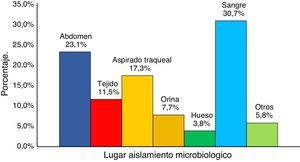
Las principales infecciones por KPC documentadas fueron bacteriemia (30,7%), infecciones intraabdominales (23,1%) y neumonía (17,9%) (fig. 2).
El tratamiento fue iniciado en forma dirigida por antibiograma en el 57,7% de los casos y de forma empírica y con aislamiento posterior en el 42,3%. Los antibióticos utilizados fueron tigeciclina en el 51,9% y colistina en el 32,7%, ambos se usaron concomitantemente con otros antibióticos especialmente con aminoglucósidos (26,9%), betalactámicos diferentes de carbapenems (25%), carbapenems (13,4%) y quinolonas (9,6%). En el 15,4% su utilizó terapia combinada de colistina más tigeciclina (tabla 3).
Antibióticos concomitantes utilizados con colistina o tigeciclina durante el tratamiento de la por KPC
| Nombre del agente | Porcentaje |
|---|---|
| Betalactámicos | 25 |
| Quinolonas | 9,6 |
| Carbapenémicos | 13,4 |
| Aminoglucósidos | 26,8 |
| Cefalosporina de tercera generación | 3,8 |
| Linezolid | 1,9 |
| Vancomicina | 5,8 |
| Tigeciclina más colistina sin otros antibióticos | 15,4 |
La duración media del tratamiento fue 15,7 ± 7,5 días (rango 4-42). La estancia promedio atribuible a la infección fue 46 días y la mediana 40 días. Durante la hospitalización, el 76,9% de los pacientes requirió atención en UCI y el 73,1% ventilación mecánica. Las principales complicaciones atribuidas a la infección fueron: bacteriemia secundaria (51,9%), insuficiencia renal aguda (51,9%) y disfunción orgánica múltiple (38,5%).
El tratamiento con tigeciclina y colistina fue clasificado acorde con las especificaciones de la Food and Drug Administration (FDA)25. En el 48,1% de los casos el uso fue aprobado por la FDA, en el 32,7% el uso no fue aprobado por FDA, pero había evidencia en la literatura que sustentaba su uso y en el 19,2% de los casos se utilizaron estos antibióticos a pesar de no existir ni aprobación FDA ni evidencia en la literatura de su uso.
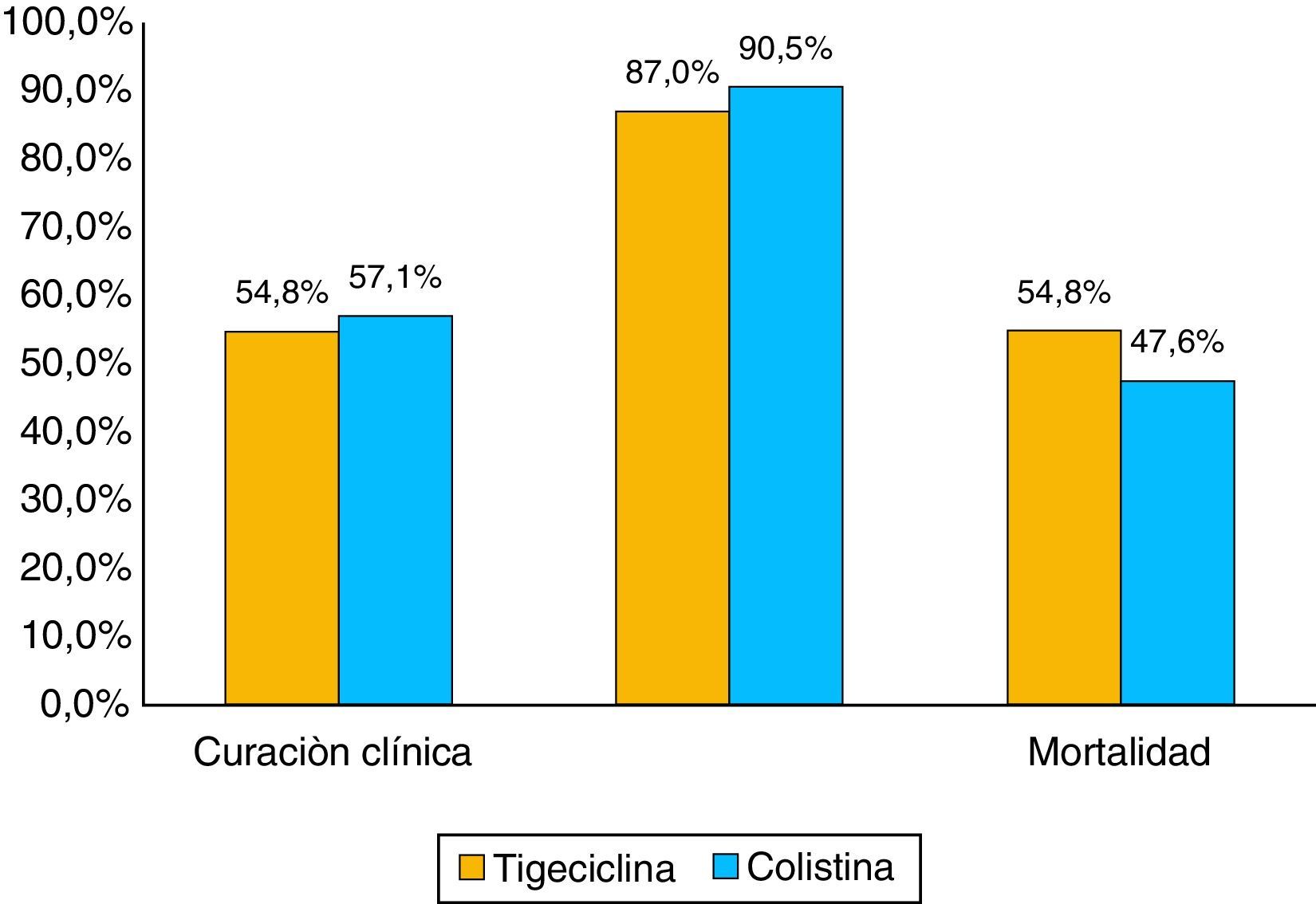
Se logró curación clínica en el 55,8% de los casos. Con respecto a la falla microbiológica entendida como persistencia del aislamiento microbiológico en el sitio de infección después de más de 72 h de terapia efectiva y dirigida, en el 23,8% de los pacientes no fue posible establecerla por carencia de la información, pero en 19 de 40 pacientes en los que contamos con esta información la infección persistió a pesar del tratamiento; es decir, en el 47,5% de los casos se puede considerar falla microbiológica.
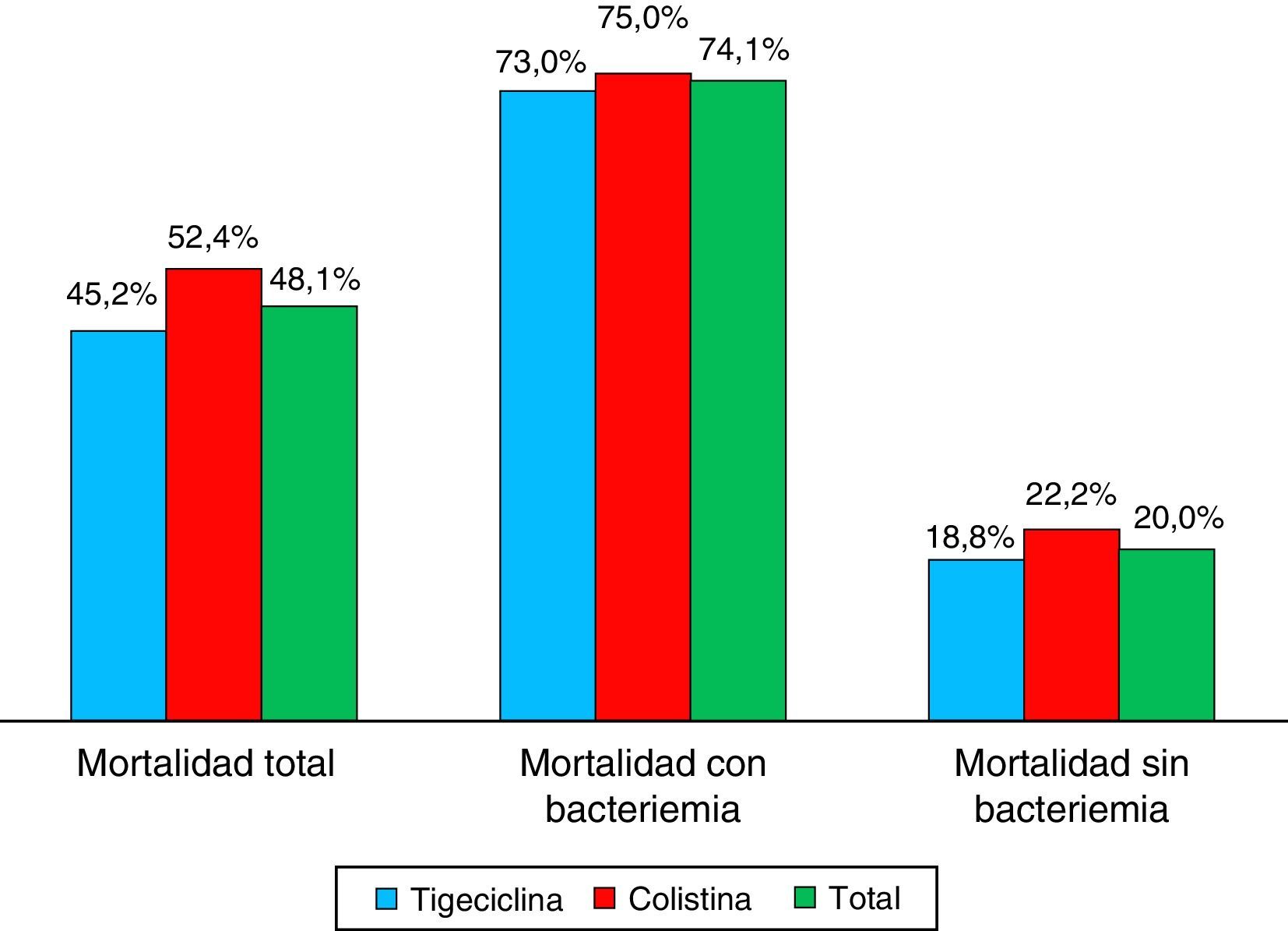
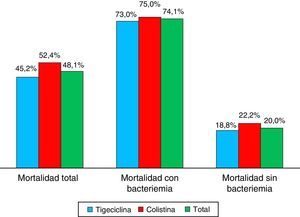
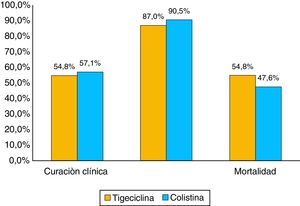
La proporción de mortalidad fue del 48,1% y el tiempo medio entre el diagnóstico de la infección por KPC y la muerte fue de 33 días. La mortalidad en los pacientes con bacteriemia fue 74,1 versus 20% en los pacientes sin bacteriemia, con diferencias estadísticamente significativas p ≤ 0,01 (tabla 4 y fig. 3). Cuando la mortalidad se analizó de acuerdo con el tratamiento utilizado, no se observaron diferencias significativas entre tigeciclina y colistina en la mortalidad general (45,2 vs. 52,4%; p=0,609). Tampoco se observaron diferencias significativas entre tigeciclina y colistina cuando se compararon curación clínica y calificación del tratamiento según FDA (fig. 4). La mortalidad fue mucho más alta en el año 2008, fecha en la cual surgió el brote por KPC, con un 58,6%, y fue mucho menor en el 2009 con 22,2%.
El brote de infección por KPC en nuestra institución se suma a la lista de transmisión intercontinental y geográfica de gérmenes multifarmacorresistentes; el comportamiento endémico después del brote es indiscutible en la mayoría de los países donde esto ha sucedido. En nuestra serie se corrobora que las condiciones que generan inmunosupresión, uso previo de antibióticos y estancia en UCI son factores que pueden predisponer a la infección por KPC, hallazgos similares a los descritos por otros autores1,2,6,7,11,15–19. Diferente de estas condiciones, una alta proporción de nuestros pacientes fueron sometidos a cirugía de tracto gastrointestinal antes de documentar la infección por KPC.
En nuestros pacientes las principales infecciones fueron bacteriemia, infección intraabdominal e infección respiratoria, diferente de lo reportado por otros centros de trasplante como el grupo de Barcelona, donde la principal infección fue la urinaria26.
En nuestra serie la totalidad de los pacientes recibieron antibióticos previos a la infección, con un uso llamativo de carbapenems, motivado por que una de las infecciones de comportamiento endémico en años previos a la detección de KPC fue causada por gérmenes productores de BLEE, especialmente K. pneumoniae y E. coli.
Aunque la proporción de pacientes que requirieron UCI de forma previa fue relativamente baja, la estancia promedio de nuestros pacientes en UCI durante el episodio de infección fue 54 días, situación ya descrita como uno de los riesgos importantes para desarrollar infecciones por KPC. Riesgo este que se incrementa de 2 a 30,3% cuando la estancia es mayor a 18 días.
La proporción de mortalidad en nuestra serie se acerca al 50%, similar a la descrita por otros autores2,6,15. Sin embargo, debemos hacer énfasis en que en el 57,7% de los casos el tratamiento fue iniciado después de tener el informe microbiológico y fue dirigido por antibiograma, lo cual lleva implícita una demora de al menos 72 h en el inicio del tratamiento efectivo, situación que pudo impactar en la morbilidad asociada y la mortalidad. Adicionalmente a esto, el porcentaje de pacientes con bacteriemia fue mucho mayor que en otras series, ya sea como evento inicial o como complicación durante la infección2. En nuestros pacientes, en el tratamiento de la infección siempre se utilizó terapia combinada, dentro de la cual se incluía colistina o tigeciclina como medicamento activo asociado a aminoglucósidos, carbapenems o quinolonas. Se observó un alto porcentaje de fallos terapéuticos y no encontramos diferencias significativas en mortalidad cuando comparamos los 2 medicamentos considerados base del tratamiento: tigeciclina y colistina.
El presente estudio muestra las características clínicas y el comportamiento de las infecciones por KPC en nuestra institución. A pesar de haber documentado aislamientos previos de KPC20, la causa del brote y posterior comportamiento endémico de la cepa de K. pneumoniae portadora de KPC-321 refleja diferencias drásticas del potencial epidémico, de transmisibilidad y de mortalidad.
En la experiencia de nuestro hospital reportada previamente, se observa que, a pesar de protocolos estrictos de vigilancia, de búsqueda activa de colonizados, de reforzar los protocolos de aislamiento e higiene de manos, de implementar medidas de cohortización geográfica conformando unidades de aislamiento especial para KPC, asignación de salud específico para este tipo de pacientes, el control de los brotes y la contención de la expansión o diseminación de la infección es difícil de lograr20,27,28.
Un interesante ejemplo del comportamiento epidemiológico y cambio en la prevalencia de K. pneumoniae después de aislamiento de cepas productoras de KPC en nuestra ciudad es la determinada por la red del Grupo de Estudio para la Resistencia a Antibióticos en Medellín (GERMEN), que incluye 5 laboratorios clínicos y 20 hospitales, que pone de manifiesto que la sensibilidad de K. pneumoniae a carbapenems ha disminuido sustancialmente desde el periodo 2007-2009 hasta el 201229.
Los brotes de K. pneumoniae KPC o de otras enterobacterias productoras de KPC, si bien pueden estar asociados a transmisión clonal por pacientes previamente colonizados o infectados que migran entre las diferentes instituciones en nuestro país o que migran geográficamente por la globalización de la medicina generando la transmisión intercontinental, también están relacionados con el uso no apropiado de antibióticos y la presión selectiva que ellos ejercen, la estancia en UCI y la comorbilidad de los pacientes, especialmente en condiciones que generen inmunosupresión. Este tipo de infecciones tienen una elevada proporción de mortalidad y pocas opciones de manejo con antibióticos. Las medidas implementadas en el control y la expansión de gérmenes portadores de KPC, si no son adoptadas de manera conjunta por todas las instituciones, no permitirán el control de los brotes ni lograrán contener la expansión a lo largo del territorio nacional. En Colombia estamos en mora de implementar medidas desde el nivel nacional para contener la expansión de la multifarmacorresistencia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses ni recibieron dinero de ninguna institución. El Hospital Pablo Tobón Uribe ofreció al grupo investigador todo el apoyo logístico necesario para llevar a cabo la recolección de datos, análisis estadístico y elaboración del artículo de investigación.
Consideraciones bioéticasEl desarrollo de la investigación cumplió con los principios médicos y éticos de respeto por las personas, beneficio y justicia, siempre protegiendo la privacidad de los sujetos involucrados en el estudio. Este estudios fue sometido a valoración fue y aprobado por el Comité de Ética e Investigación del hospital Pablo Tobón Uribe y, de acuerdo con el artículo 11 de la resolución 008430 de 1993 del Ministerio de Salud, es una investigación que no requiere de consentimiento informado.
Aprobación éticaEl trabajo de investigación fue aprobado por el Comité de Ética e Investigación del Hospital Pablo Tobón Uribe.
Especial agradecimiento a los integrantes del Grupo de Investigación en Enfermedades Respiratorias e Infecciosas que participaron en algunas de las fases del estudio.
Viviana M. Palacio Castaño, Luz E. Pérez Jaramillo, Humberto Zapata, Melissa Mejía, Natalia Salazar Valderrama, Luisa Naranjo, Luisa Guarín H.
Institución donde se efectuó la investigación: Hospital Pablo Tobón Uribe (HPTU). Medellín (Colombia).