La mucormicosis es una infección micótica sistémica y oportunista; la del tipo gastrointestinal es la menos común (2–11%) y el diagnóstico ante mórtem se hace solo en el 25–50% de los casos. Presentamos el caso de una mujer con diabetes mellitus tipo 2, insuficiencia renal crónica, nefrectomía derecha y obesidad extrema, con una lesión pustulosa en labio mayor izquierdo que evoluciona a absceso en glúteo y muslo requiriendo drenaje y desbridamiento; se inició antibioticoterapia de amplio espectro, fue trasladada a la unidad de cuidado intensivo, donde se agrega antimicótico; posteriormente, se realiza colostomía más resección de una porción de intestino delgado, que presentaba 3 úlceras necróticas en las que se evidenció la infección micótica; la paciente fallece secundario a un infarto agudo de miocardio. Los pacientes diabéticos son más susceptibles, pues presentan disfunción de neutrófilos, monocitos y células fagocíticas, además de menor capacidad inhibitoria del suero contra el crecimiento de los hongos. La mucormicosis gastrointestinal es rara y altamente mortal, su presentación clínica es muy inespecífica y el diagnóstico es histopatológico. El tratamiento actual con anfotericina B no reporta resultados satisfactorios, y el posaconazol se presenta como una buena opción; los resultados positivos dependen de un diagnóstico temprano y el tratamiento oportuno de las comorbilidades.
Mucormycosis is an opportunistic systemic fungal infection, gastrointestinal type being the less common (2–11%). The ante-mortem diagnosis is made in only 25–50% of cases. We describe a case of a woman with type 2 diabetes mellitus, chronic renal failure, right nephrectomy and extreme obesity, with a pustulous lesion on the left labia majora that progressed into a gluteal and thigh abscess requiring drainage, debridement, and broad-spectrum antibiotic therapy. She was transferred to ICU where antifungal treatmment was added. A colostomy plus resection of a portion of small bowel was subsequently performed, which showed three necrotic ulcers with the fungal infection. The patient died secondary to acute myocardial infarction. Diabetic patients are more susceptible, as they present dysfunction of neutrophils, monocytes, and phagocytic cells, as well as lower serum inhibitory action against the growth of fungi. Gastrointestinal mucormycosis is rare and highly lethal, its clinical presentation is nonspecific and the diagnosis usually relies on histopathology. Current therapy with amphotericin B does not report satisfactory resultsusually relies on histopathology. Posaconazole is presented as a good option Positive outcomes depend on an early diagnosis and prompt treatment of comorbidities.
La mucormicosis es una infección micótica sistémica y oportunista, usualmente fatal1. Después de la aspergilosis y la candidiasis, es la tercera causa más frecuente de infección oportunista invasora por hongos2, observándose sobre todo en individuos con inmunodeficiencias tales como diabetes mellitus, tumores malignos de origen hematológico o de órgano sólido, receptores de trasplantes, pacientes neutropénicos o en terapia con esteroides3. Sus principales vías de transmisión incluyen inhalación, ingestión y exposición cutánea. La contaminación de heridas, quemaduras y sitios de trauma con dehiscencia de la piel son algunos de los modos más importantes de transmisión en inmunocompetentes. En cambio, la transmisión de persona a persona aún no ha sido reconocida4.
Se han descrito 6 formas de manifestación con base en la presentación clínica y el compromiso de alguna parte del cuerpo en particular5. La más común es la rino-órbito-cerebral (40–49%), siendo ésta la más frecuente en pacientes diabéticos; seguida de la cutánea (10–16%), la pulmonar (10–11%), que se ve frecuentemente en los afectados por enfermedades hematológicas malignas, la diseminada (6–11%) y en último lugar, la gastrointestinal (2–11%)6,7. El diagnóstico de mucormicosis es raramente sospechado, y se realiza de manera ante mórtem solo en el 25–50% de los casos8,9. A continuación, se presenta un caso de mucormicosis del tipo gastrointestinal en una paciente diabética diagnosticada ante mórtem por el examen una pieza quirúrgica de intestino delgado un día antes de su fallecimiento.
Caso clínicoIngresa en el Hospital Universitario de Santander una paciente femenina de 47 años, con antecedentes de diabetes mellitus tipo 2, insuficiencia renal crónica, nefrec-tomía derecha por litiasis e infección y obesidad extrema (índice de masa corporal 58,3). La paciente presentaba cuadro clínico de 5 días de evolución de lesión pustulosa en labio mayor izquierdo que evolucionó a absceso localizado en glúteo y muslo izquierdo. Asociado a la terapia antibiótica establecida con piperacilina-tazobactam 2,25gramos cada 6h intravenosa y vancomicina 1 gramo intravenosa cada 3 días, se decidió realizar drenaje de la lesión obteniéndose 800 cc de material purulento, y se evidenció infección necrotizante de tejidos blandos que comprometía la porción inferior del glúteo izquierdo y la proximal del muslo; en este procedimiento no se tomó muestra para estudio histopatológico. Durante el procedimiento, la paciente presenta paro cardiorrespiratorio, el cual responde a las maniobras de reanimación avanzadas e inmediatamente es trasladada a la unidad de cuidado intensivo, donde con posterioridad se agrega a la antibioticoterapia meropenem y fluconazol y se retira piperacilina-tazobactam ante la pobre respuesta al tratamiento previamente instaurado.
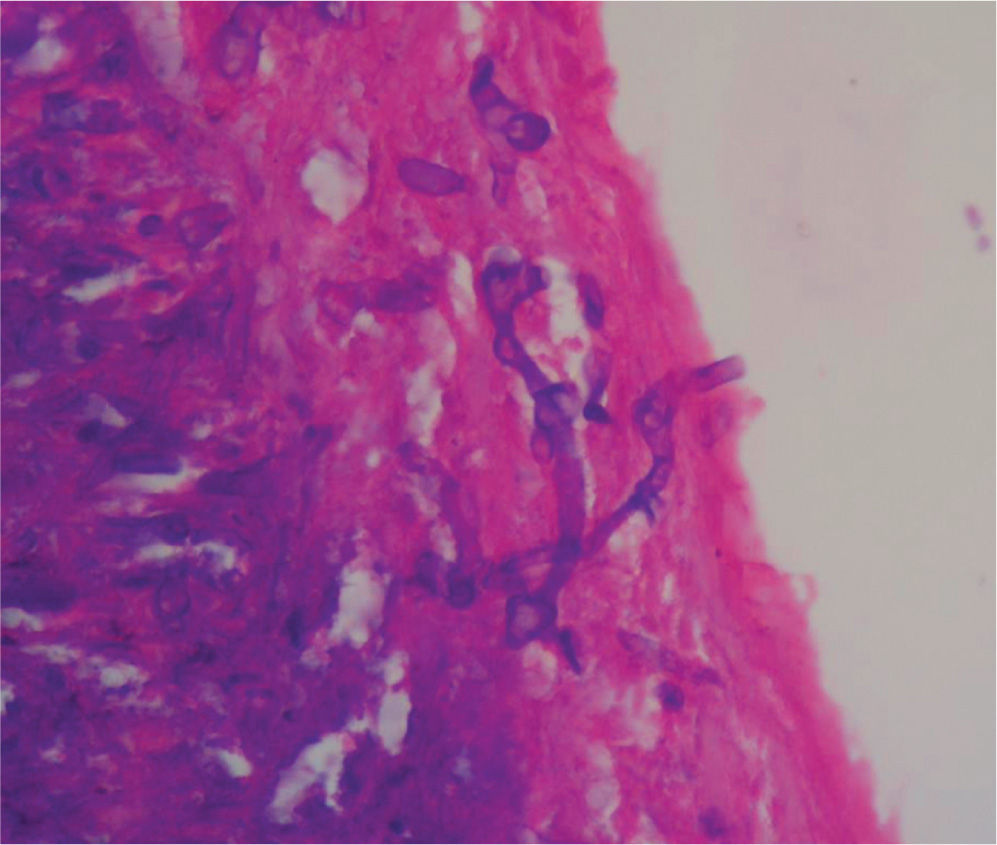
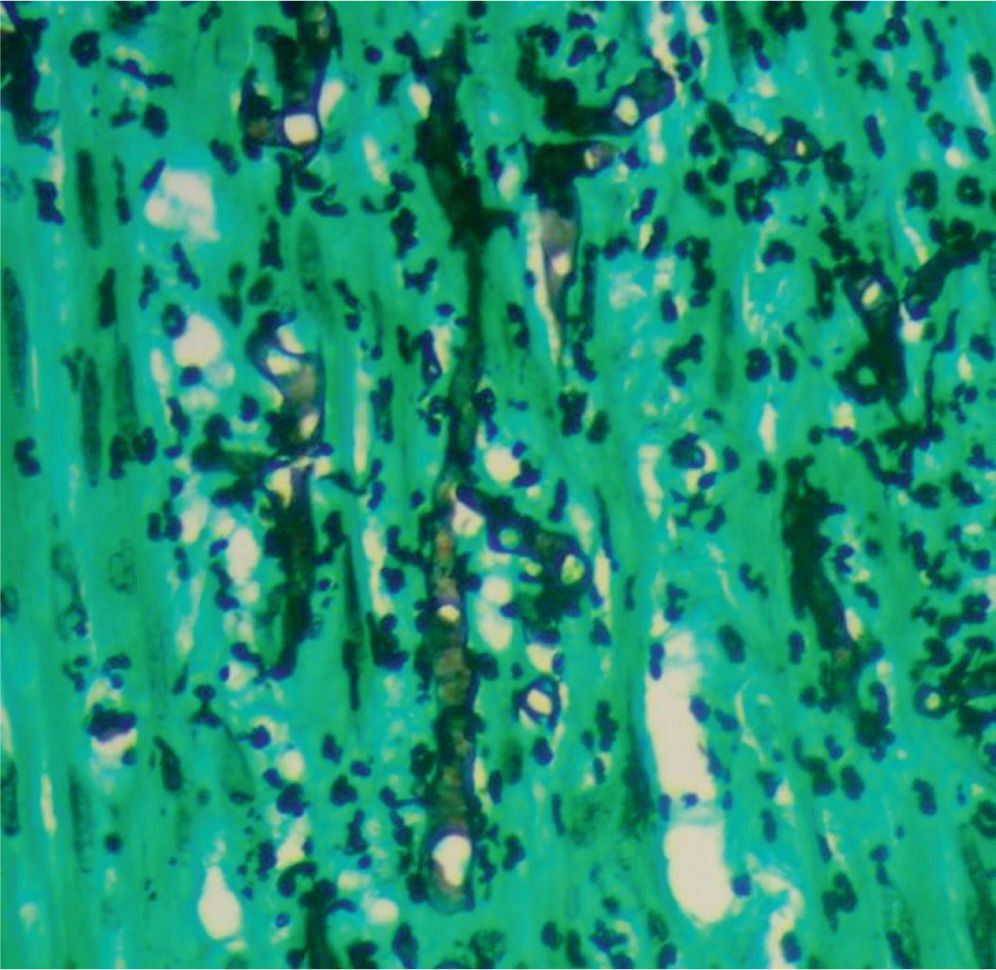
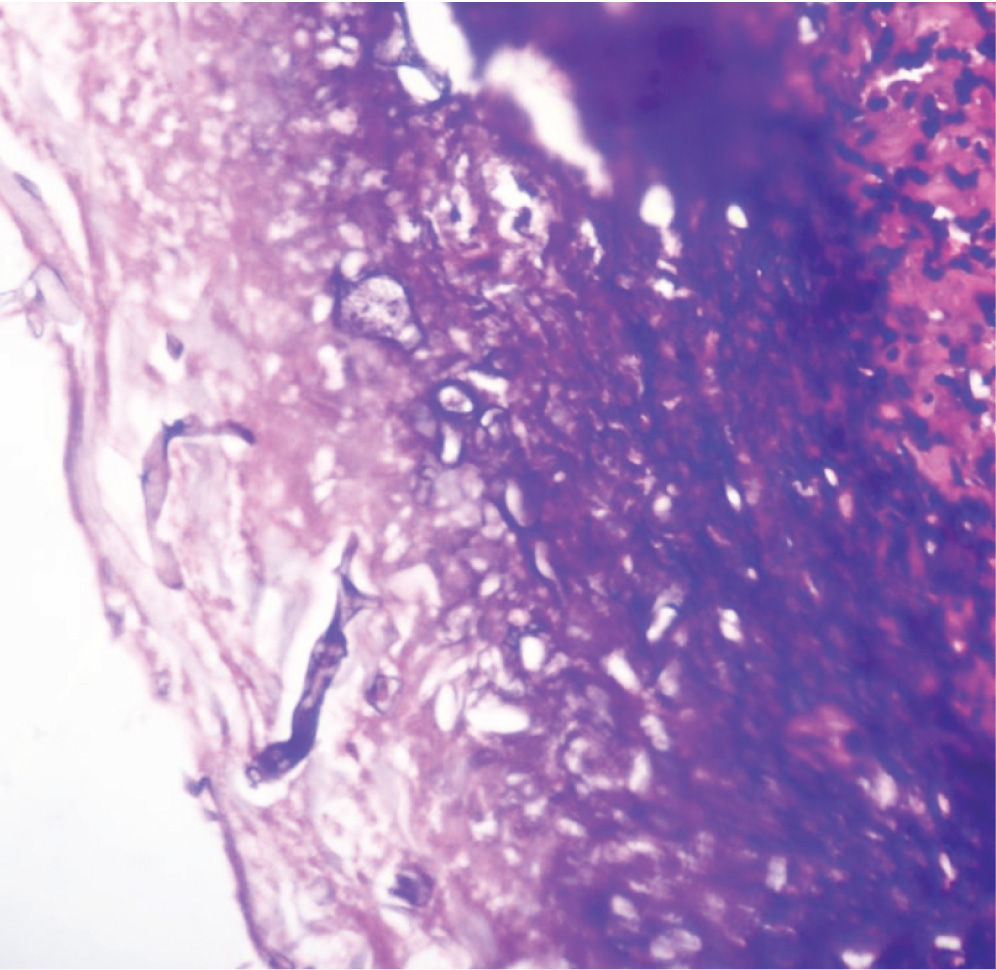
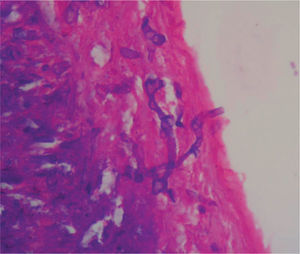
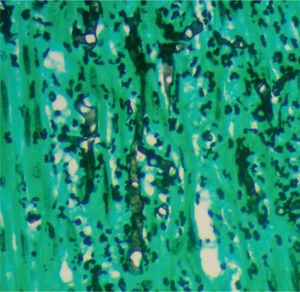
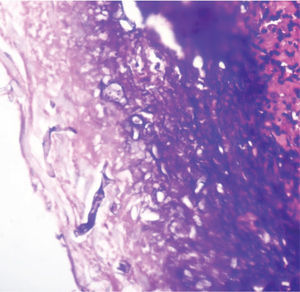
En un segundo procedimiento quirúrgico, se realiza colostomía por el alto riesgo de contaminación con materia fecal de los tejidos blandos expuestos en glúteo y muslo izquierdo; durante el procedimiento se realiza la resección de 30cm de intestino delgado pues presentaba 3 úlceras necróticas, que se enviaron a patología para su estudio. Al análisis macroscópico se recibe segmento de intestino delgado que mide 28cm de longitud x 4,5cm de diámetro mayor transverso, en cuya serosa se identifican 3 grandes áreas necrosadas, crateriformes, de color verde, la mayor de las cuales mide 5cm de diámetro, que comprometían todo el espesor de la pared. Al examen microscópico de estas lesiones en cortes teñidos con hematoxilina-eosina, se observó pared de intestino delgado con infarto hemorrágico transmural, asociado a focos de necrosis licuefactiva con abundantes estructuras micóticas compatibles con mucormicosis (fig. 1). Con el anterior hallazgo se hizo el diagnóstico de pared de intestino delgado con inflamación aguda severa e infarto hemorrágico transmural asociado a mucormicosis. Los elementos micóticos también fueron evidenciados en cortes histológicos teñidos con plata metenamina y ácido periódico de Schiff para hongos (figs. 2 y 3).
Durante su estancia en la unidad de cuidado intensivo, la paciente presenta cambios en el electrocardiograma compatibles con infarto agudo de miocardio de cara posteroinferior, elevación de enzimas cardíacas, asociado a falla renal y falla respiratoria, causando su muerte 24h después del diagnóstico final, por lo que no fue posible iniciar terapia con anfotericina B (AMB).
DiscusiónLa mucormicosis es una enfermedad causada por hongos zigomicetos de la orden de los mucorales, dentro de los cuales los patógenos que comúnmente afectan a los humanos son los Rhizopus, Mucor y Rhizomucor10. Estos hongos son filamentosos, ubicuos y se encuentran como mohos en el suelo, plantas, estiércol y material putrefacto. Adoptan forma de hifas en los tejidos. Una vez que las esporas comienzan a crecer, las hifas penetran directamente y crecen a través de la pared de los vasos sanguíneos (vasculotropismo) por ser estos la mejor fuente de oxígeno, lo que produce isquemia local, necrosis e infarto del tejido, que produce, además, un nido para la diseminación hematógena y genera un gran riesgo de trombosis10,11. Lo anterior se asocia a su capacidad de recoger hierro libre del huésped utilizando quelantes de hierro de bajo peso molecular o permeasas de hierro de alta afinidad12, siendo la interacción entre el hierro y las esporas la determinante en la tasa de reproducción y supervivencia11.
Entre los factores de riesgo para el desarrollo de la infección (tabla 1), la diabetes mellitus es la más común (36-88%)4,13,14, seguida por tumores malignos (17%), trasplante de órganos sólidos (7%), terapia con deferoxamina (6%) y trasplante de médula ósea (5%)6. En menor proporción están el uso de nuevos inmunosupresores, cambios en los procedimientos de trasplante, el uso de vorico-nazol para la profilaxis de infecciones micóticas oportunistas, quemaduras, úlceras gástricas y abuso de drogas intravenosas10,15,16.
Factores predisponentes para mucormicosis
| Diabetes mellitus |
| Cetoacidosis diabética |
| Diabetes mellitus no controlada |
| Acidosis metabólica crónica |
| Falla renal |
| Intoxicación crónica con salicilatos |
| Terapia con deferoxamina |
| Sobrecarga de hierro |
| Inmunosupresión |
| Neutropenia (por tumores malignos o quimioterapia) |
| Terapia con corticosteroides |
| Trasplante de células hematopoyéticas o de órgano sólido |
| Infección por VIH |
| Daño de la piel o tejidos blandos |
| Quemaduras |
| Trauma |
| Herida quirúrgica |
| Misceláneo |
| Abuso de drogas intravenosas |
| Neonatos prematuros |
| Desnutrición |
| Uso prolongado de antimicrobianos de amplio espectro |
VIH: virus de la inmunodeficiencia humana.
Igualmente, se conocen condiciones predisponentes como la acidosis metabólica, que interfiere en la capacidad de unión de la transferrina al hierro, generando un aumento en las concentraciones de este en los tejidos y favoreciendo el crecimiento de los hongos17. Los pacientes con diabetes mellitus o en tratamiento inmunosupresor son susceptibles porque estas condiciones producen una disfunción de los neutrófilos y monocitos. Los corticosteroides inhiben la fagocitosis realizada por neutrófilos, y la ciclosporina inhibe la producción de linfocinas. El uso de azatioprina a dosis mayores de 2mg/kg predispone a las infecciones en pacientes receptores de trasplantes18, que de por sí tienen mayor riesgo, sobre todo luego del tratamiento del rechazo agudo con pulsos de esteroides, muromonab-CD3 o globulina antimicótica9,19. También se han reportado algunos casos sin factores predisponentes identificables20.
En cuanto a los pacientes con diabetes mellitus, son más susceptibles aquellos con hiperglucemia sostenida, particularmente si presentan cetoacidosis5,21, aunque también se puede observar en pacientes diabéticos controlados22. Un estudio demostró que la acidosis detiene la actividad inhibitoria del suero contra el crecimiento de los hongos por la interrupción de la capacidad de la transferrina de unirse al hierro de los mismos, dando lugar a un defecto importante en la defensa del huésped contra los zigomicetos17. Tanto la disminución del número de neutrófilos como la función anormal de las células fagocíticas en el sitio de la infección inducida por la cetoacidosis diabética juegan, probablemente, un papel en la patogénesis de la mucormicosis en pacientes diabéticos23.
La mucormicosis gastrointestinal, descrita originalmente por Paltouf en 188524, es la forma más rara de presentación de la infección, constituyendo solo entre el 2–11% de todos los casos6,25, y tiene una mortalidad superior al 85%6. Todas las porciones del tracto gastrointestinal son vulnerables a la infección, pero las más comúnmente afectadas son el estómago (57,5%), seguido por el colon (32,3%) y el íleon (6,9%)3, y con menor frecuencia, el hígado, bazo y páncreas4. Menos de 20 casos de mucormicosis gastrointestinal con afectación del colon en pacientes adultos se encuentran publicados en la literatura médica de las últimas 2 décadas3. Las condiciones identificadas como predisponentes para mucormicosis gastrointestinal son: desnutrición, ingestión persistente de sustancias no nutritivas, úlcera gástrica, pelagra, uremia, colitis amebiana, fiebre tifoidea, enfermedad sistémica grave, edades extremas e inmunosupresión10,26. Antecedentes de importancia como son tuberculosis pulmonar y abuso de alcohol, encontrados con cierta frecuencia en pacientes diabéticos y que predisponen a la aparición de otras enfermedades, no han mostrado ser un riesgo subyacente mayor para el desarrollo de mucormicosis gastrointestinal en este tipo de pacientes27.
La infección del tracto gastrointestinal puede surgir por la ingestión de esporas de hongos en alimentos contaminados, como leche o pan fermentados, o contacto con esputo4, especialmente en aquellos pacientes con úlcera gástrica26. Existen informes de casos con afectación intestinal exclusiva donde el mecanismo de entrada del hongo fue la ingesta de tabletas de alopurinol y alimentos empacados contaminados28; también se han reportado brotes nosocomiales asociados al uso de bajalenguas de madera29.
Inicialmente, pueden presentarse síntomas muy inespecíficos como dolor, distensión abdominal, fiebre y diarrea. Si hay compromiso extenso del intestino con múltiples úlceras causadas por la infección, puede manifestarse con hemorragia de vías digestivas e incluso perforación visceral en presentaciones tardías3,25. Mediante la endoscopia se evidencia una mucosa erosionada, hemorrágica y edematosa. También puede verse una masa blanda fúngica verduzca en forma de hongo con una base angosta unida a la pared del intestino, cubierta por una costra negra3. La tomografía computarizada puede mostrar una masa asociada al tracto gastrointestinal.
El diagnóstico depende del examen histopatológico, observándose la presencia de hifas anchas, predominantemente sin septos, con bulbos focales y ramificaciones no dicotómicas, ocasionalmente en ángulo recto30, asociadas a infarto y angioinvasión en más del 94% de las muestras31. El estudio histopatológico del tejido puede ser evaluado mediante una tinción de rutina con hematoxilina-eosina, pero los hongos pueden verse mejor con tinción plata-metenamina de Gomori, ácido periódico de Schiff o blanco de calcoflúor5,32. A pesar de que el cultivo permanece como la forma predominante por la cual se pueden identificar las especies de hongos, solo son positivos en un 52% en los casos de autopsias y en un 30% de las muestras quirúrgicas. Esto sucede porque la infección puede estar localizada y no es posible detectarla en todas las porciones del espécimen enviado a cultivo33. El aislamiento de mucorales de un sitio estéril o cultivos positivos repetidos de un sitio no estéril en pacientes con factores predisponentes pueden considerarse como de alto riesgo para la adquisición de mucormicosis. Cultivos positivos de sitios no estériles deben ser interpretados con precaución y deberán relacionarse con los hallazgos y la condición clínica del paciente4. También podrían tomarse cultivos gástricos y de materia fecal, pero estos rara vez son positivos, por lo que no son de mucha utilidad26.
Se han intentado desarrollar pruebas serológicas para el diagnóstico por detección de antígenos o anticuerpos, ediante pruebas de ELISA, técnicas de doble difusión34 o análisis de inmunotransferencia35. Sin embargo, estas pruebas serológicas no pueden recomendarse mientras no se realicen nuevas evaluaciones clínicas y no están disponibles para su uso rutinario en este momento. Se ha tratado de mejorar la capacidad diagnóstica mediante la detección del ácido nucleico del hongo en suero por reacción en cadena de la polimerasa o mediante técnicas de hibridación in situ, utilizándose como una herramienta para confirmar la presencia del hongo cuando a pesar de una histología positiva los cultivos son negativos10.
El manejo de la mucormicosis intestinal depende en gran medida del diagnóstico oportuno, la intervención de las condiciones predisponentes subyacentes, el desbridamiento quirúrgico precoz y el inicio rápido de un adecuado tratamiento antimicótico sistémico. La terapia antimicótica recomendada es AMB en dosis de 1 a 1,5mg/kg/día. La dosis total administrada durante el transcurso de la terapia es generalmente 2,5 a 3g, y suele durar entre 4 y 6 semanas, con el riesgo de nefrotoxicidad a dosis altas. La AMB liposomal puede ser una mejor opción, pues tiene mejores índices de eficacia y menor riesgo de nefrotoxicidad que la presentación usual, lo que permite su uso en dosis más altas (5 a 15mg/kg/día)10,27.
Nuevas terapias incluyen posaconazol y deferiprona que actúan inhibiendo la absorción de hierro por parte de Rhizopus, con aparente mejoría en la supervivencia de pacientes en los que se ha utilizado en casos refractarios11,36. Estudios han informado de tasas de éxito con posaconazol del 50–70%, mientras que la AMB y su forma liposomal tienen una tasa de éxito de solo el 25%, lo que sugiere que el posaconazol podría llegar a ser el medicamento de elección para mucormicosis, aunque aún es necesario realizar investigaciones adicionales37. Los agentes antimicóticos comúnmente utilizados en profilaxis como el fluconazol o el itraconazol no tienen actividad contra hongos del orden de los mucorales38.
Existen otras intervenciones no farmacológicas que se han utilizado con una efectividad limitada como tratamiento adyuvante, como por ejemplo, la terapia con oxígeno hiperbárico39 y nuevos quelantes de hierro40. Aparte del diagnóstico temprano, la corrección de los factores predisponentes reversibles como rectificar la cetoacidosis diabética, suspender el uso de deferoxamina, o reducir los niveles de inmuno-supresión son primordiales en el manejo de estos pacientes.
ConclusiónLa mucormicosis intestinal es una enfermedad poco común y altamente mortal que afecta a pacientes inmunocomprometidos; su presentación es muy inespecífica, pero hay que diagnosticarla y tratarla tempranamente y de forma agresiva para tratar de conseguir mejores resultados. Los antimicóticos disponibles presentan bajas tasas de respuesta, por lo que es necesaria más investigación en el campo.
FinanciaciónNo se utilizaron fuentes de financiamiento para la realización del artículo.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses de ningún tipo en el trabajo realizado.