La conversión de glicerol a dihidroxiacetona (DHA) se realizó mediante un proceso fed-batch, con concentraciones de glicerol de 50 y 100g/l, utilizando la bacteria Gluconobacter oxydans. La fermentación se realizó durante 72h, un pH de 5.3 y una temperatura de 30°C, bajo un flujo de aireación de 1.66 vvm. La cantidad de DHA producida y el glicerol consumido se determinaron aplicando cromatografía de gases y espectrofotometría UV-VIS. Se obtuvo un rendimiento producto/sustrato de 91% para una concentración de glicerol de 50g/l y 79% para una concentración de glicerol 100g/l. Estos números demuestran que el fenómeno de inhibición se da a altas concentraciones de sustrato y también se observó un menor crecimiento de biomasa. Estos hallazgos demuestran que es viable la producción de dihidroxiacetona a partir de glicerol a un bajo costo, además de solucionar el importante problema de acumulación y contaminación, que el glicerol representa en la producción industrial de biodiesel.
The objective of this work was the convertion of glycerol to dihydroxyacetone (DHA) by a fed-batch process at different glycerol concentrations, 50 and 100g/l, using Gluconobacter oxydans. The fermentation was conducted during 72h, at a pH 5.3 and 30°C under a flow of 1.66 vvm aeration. The amounts of produced DHA and consumed glycerol, were determined using gas chromatography and UV-VIS spectrophotometry. Product-substrate yields were obtained to 91% and 79% for concentrations of glycerol 50g/l and 100g/l, respectively, which showed the inhibition phenomenon to high substrate concentrations and reduced biomass growth. This research shows that the production of dihydroxyacetone from glycerol is feasible and inexpensive Therefore, it is possible to solve, future problems about pollution and accumulation of glycerol.
En la actualidad se buscan combustibles renovables que reemplacen a los combustibles fósiles que se agotan rápidamente, los cuales afectan la economía y son el principal promotor de la contaminación ambiental. Una alternativa sostenible es la producción de biodiesel, un combustible amigable con el ambiente. Las estadísticas de producción de biodiesel en Colombia re- flejan una capacidad de producción total de 581 mil toneladas al año, con una producción para el año 2013 de 503337 T/año, presentando un crecimiento anual de 2.8% (Hancock, 2005; Hederich, 2010). De igual forma, en México la demanda estimada de biodiesel se proyecta para el año 2014 en 80 millones de barriles por día para la mezcla B-20 (Canales et al., 2006). En el proceso de síntesis de biodiesel se obtiene como subproducto glicerol con una relación de 1kg por cada 10kg de biodiesel producido; de acuerdo con la producción anual de Colombia esta relación proyecta una cantidad considerable de glicerol, superior a 50333.7 T/año, la cual debe aprovecharse para la elaboración de sustancias químicas valiosas y así disminuir costos en eliminación y disposición de este subproducto (Bendeck, 2010; Cárdenas et al., 2006). Por esta razón, muchos investigadores intentaron la transformación del glicerol a productos con valor agregado mediante diversos procesos catalíticos tales como oxidación selectiva, reformado, hidrogenólisis, deshidratación y esterificación, entre otros (Zhu et al., 2013). Actualmente la producción microbiana de la dihidroxiacetona (DHA) es de gran interés debido al alto precio de la dihidroxiacetona con respecto al glicerol (Bauer et al., 2005; Hekmat et al., 2007).
Del glicerol se pueden obtener productos intermedios, tales como: epiclorhidrina, 1.3-dihidroxiacetona, 1.3-propanodiol, ácido propiónico, polihidroxialcanoatos, eritritol, ácido cítrico, hidrógeno, 2.3-butanodiol, ácido succínico, etanol, ácido 3-hidroxipropiónico y ácido glicérico (Cárdenas et al., 2006). De estos se destaca la dihidroxiacetona (DHA), por ser el componente principal de muchos productos de aplicación en medicina, la industria alimenticia, química y farmacéutica (Gupta et al., 2001). La dihidroxiacetona se obtiene por síntesis química o biotecnológica usando la bacteria Gluconobacter oxydans. Esta ruta se considera como la mejor opción por su bajo costo, mayor selectividad y facilidad de purificación y separación de la dihidroxiacetona (DHA) (Cárdenas et al., 2006). Sin embargo, el crecimiento microbiano presenta problemas de inhibición por sustrato y producto. Numerosas investigaciones se desarrollan para mejorar el rendimiento de DHA y lograr el escalamiento a nivel industrial. Algunos estudios son: manipulación de la actividad metabólica de la bacteria, variación del flujo de aireación (Cardeño et al., 2011), inmovilización de la bacteria (Zhong et al., 2011), selección de un biocatalizador inmovilizado más estable y con menos inhibición para la oxidación de glicerol a DHA (Rock et al., 2014) y modo de alimentación, utilizando cepas mutantes de Gluconobacter oxydans (Ming et al., 2010).
El objetivo de esta investigación consiste en el estudio de la producción de DHA a partir de glicerol mediante transformación con G. oxydans, en un proceso fed-batch. El bioproceso se separó en dos etapas: en primer lugar, se establecen las condiciones de cultivo utilizando un proceso batch para determinar el tiempo de alimentación. En segundo lugar, se opera en un biorreactor semicontinuo en el que se buscaron las condiciones adecuadas para la producción de DHA. En este estudio se muestra que es viable la producción microbiana de dihidroxiacetona controlando el flujo de aireación, tiempo de fermentación y condiciones adecuadas de operación en un sistema fed-batch. Por tanto, es posible solucionar en un futuro problemas de acumulación y contaminación del glicerol.
Materiales y procedimento experimentalEl microorganismo y los medios de cultivoGluconobacter oxydans es una bacteria Gram negativa perteneciente a la familia Acetobacteraceae, aerobio obligado, usa el oxígeno como aceptor de electrones en su metabolismo respiratorio (Hekmat et al., 2007). La cepa G. oxydans se compró a la Colección Española de Cultivos Tipo – Universidad de Valencia, identificada como CECT 360 y se seleccionó por su capacidad oxidativa frente a sustratos como el glicerol. Se conservó a 4°C tanto en cajas Petri como en agar inclinado, con repiques bimensuales. Se activó en un medio sólido para bacterias ácido acéticas, rico en fuente de carbono: glucosa, 100g; extracto de levadura, 10g; CaCO3 20g y agar 15g, disueltos en un litro de agua destilada. Como medio de adaptación se empleó glicerina 20g/l; extracto de levadura, 10g/l y agar 20g/l. En ambos medios el pH se ajustó a 6.0 con tres días de incubación a 30°C. El medio de producción se preparó con: glicerol 50 y 100g/l, extracto de levadura 2.5g/l, NH4SO4 2g/l, K2HPO4 0.11g/l, KH2PO4 0.9g/l, sorbitol 10g/l, CaCl2 1.5g/l (Cardeño et al., 2011). Se midió el pH inicial hasta alcanzar un valor de 5.3±0.01. Todos los medios se esterilizaron en autoclave por 20 minutos a 121°C.
Preparación del inóculoEl inóculo se preparó con los reactivos utilizados en el medio de fermentación para un volumen de 40ml de agua destilada con pH 5.3. Posteriormente se esterilizó en autoclave por 20 minutos. Después se hizo el pasaje celular de la cepa activada y por último se procedió a la incubación en un Shaker (Modelo: IN-666. GEMMYCO), a 30°C, con 150rpm de agitación durante 24h.
Cultivo por lote en matraz ErlenmeyerSe realizó en 10 matraces Erlenmeyer con capacidad de 100ml, se utilizó un volumen de 25ml y un matraz Erlenmeyer de 250ml con 100ml de medio de fermentación para hacer peso seco. Antes de inocularlos se ajustó el pH a 5.3±0.01 y se esterilizaron a 121°C, 15min y a la presión normal. Luego a cada matraz Erlenmeyer se le agregaron 0.8ml de inóculo (Claret et al., 1992), exceptuando el matraz Erlenmeyer de 250ml, al cual se le agregaron 3.2ml de inóculo. Posteriormente, se colocaron en el agitador orbital para mantener las condiciones del proceso, temperatura 30°C y agitación 150rpm durante un tiempo de 72h. La toma de muestras se realizó por duplicado, con un lapso de tiempo de 12h.
Descripción del equipoEl reactor aireado donde se realizaron los ensayos se basó en un matraz Erlenmeyer de 1000ml con desprendimiento lateral para salida de aire y alimentación del medio rico en sustrato, dos reguladores de flujo, uno para el suministro de oxígeno al medio, y otro para la toma de muestras. Una bomba se usó con flujo de oxígeno máximo de 34.2 l/h, con un flujo de oxígeno suministrado de 25.6 l/h. Este reactor se instaló dentro de un Shaker, que garantizó la estabilidad del proceso fermentativo, manteniendo la temperatura constante y una agitación adecuada.
Cultivo fed-batchEl volumen inicial del cultivo fed-batch fue de 300ml y se hizo el pasaje celular con un inóculo cultivado durante 24h. Las condiciones del proceso fermentativo fueron: agitación de 150rpm, flujo de aireación 1.66 vvm, pH de producción 5.3±0.01, temperatura 30°C durante 72 horas, y con alimentación constante de 30ml del medio hasta alcanzar un volumen final de 450ml cada 12 horas. Se determinó la cantidad de DHA obtenida en cada experimento por duplicado, estableciendo el rendimiento producto/sustrato (Cardeño et al., 2011).
Métodos analíticosEl consumo de glicerol y la producción de DHA se analizaron por cromatografía de gases (GC), en el equipo (AGILENT 4890DGC), inicialmente se realizaron las curvas de calibración de glicerol y DHA para concentraciones de 0-100g/l. Estas curvas y las lecturas del cromatógrafo de gases, proporcionaron los datos del consumo de glicerol y la formación de producto (DHA) (Lijuan et al., 2010).
La biomasa celular en (g/l) se estimó por densidad óptica a 578nm en una celda de 2ml, usando un espectrofotómetro (UV-VIS Scanning Spectrophotometer. Model: Spectro UV-2650. Marca: LABOMED. INC). Con estos datos se generó una curva de calibración de biomasa para la G. oxydans, relacionando la absorbancia con la concentración. La cinética de crecimiento de la bacteria se realizó por el método de peso seco (Hekmat et al., 2003). También, la dihidroxiacetona se determinó por colorimetría en el espectrofotómetro UV-VIS a una longitud de onda de 550nm, con solución de DNS (3.5 ácido dinitrosalicílico) (Claret et al., 1992). La presencia de DHA se detectó por el color anaranjado presente en las muestras al reaccionar con la solución de ácido dinitrosalicílico (Priscilla et al., 2009).
La separación de DHA del medio líquido se realizó agregando alcohol etílico al medio líquido, donde se suspendió la dihidroxiacetona en el medio y se separó por centrifugación a 2500rpm por 30min; el producto obtenido mostró una apariencia pastosa y color blanco hueso. Además se caracterizó de manera cualitativa en un espectrofotómetro UV-VIS y de forma cuantitativa en un cromatógrafo de gases (GC) (AGILENT 4890DGC) y mediante un análisis de FTIR se identificaron los diferentes grupos funcionales característicos de la dihidroxiacetona patrón (Da Silva et al, 2009) y la obtenida en la presente investigación. El rendimiento producto/sustrato se determinó con los resultados iniciales y finales obtenidos de DHA y el consumo de glicerol por parte de la bacteria.
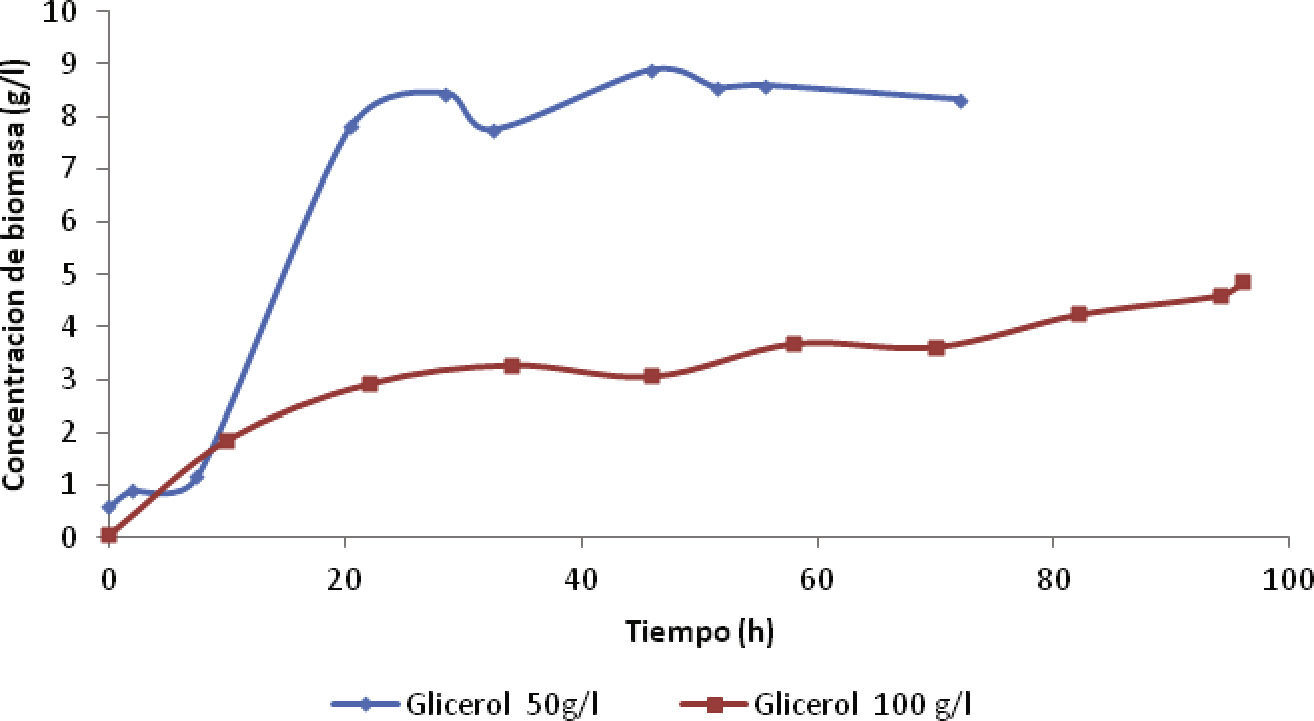
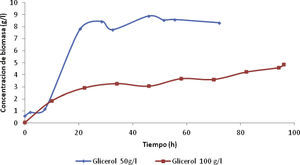
Resultados y discusiónCinética de crecimientoLa cinética de crecimiento de la cepa G. oxydans se determinó por densidad óptica en un espectrofotómetro UV-VIS. Estos resultados proporcionaron el tiempo de alimentación para pasar de un proceso discontinuo a un proceso semicontinuo. En la figura 1 se aprecia cómo la curva de crecimiento de la bacteria para una concentración de glicerol de 50g/l se pronunció más en comparación con la curva de crecimiento para una concentración de glicerol de 100g/l, donde la máxima concentración de biomasa que se alcanzó fue de 8.32 y 4.61g/l, respectivamente.
En la figura 1 se observa el lapso de tiempo que duró la fase exponencial, la cual estuvo entre las primeras horas de la fermentación, para las concentraciones de glicerol de 50 y 100g/l. La fase exponencial se presentó desde las 0 hasta las 22h, debido a la inoculación previa, el tiempo óptimo para la alimentación se determinó entre las 12 y 15h por ser la parte más pronunciada de las curvas para ambas concentraciones; por tanto, el tiempo de alimentación elegido fue de 12h.
Cultivo fed-batchEl cultivo fed–batch se llevó a cabo bajo las mismas condiciones del proceso batch, con alimentación continua de medio fresco rico en glicerol y el oxígeno transferido al medio de cultivo mediante una bomba de aire (Elite 802), suministrando un flujo de 25.65 l/h. Se escogió un tiempo de alimentación de 12 horas, basado en la figura 1, y tiempo de fermentación por 72 horas.
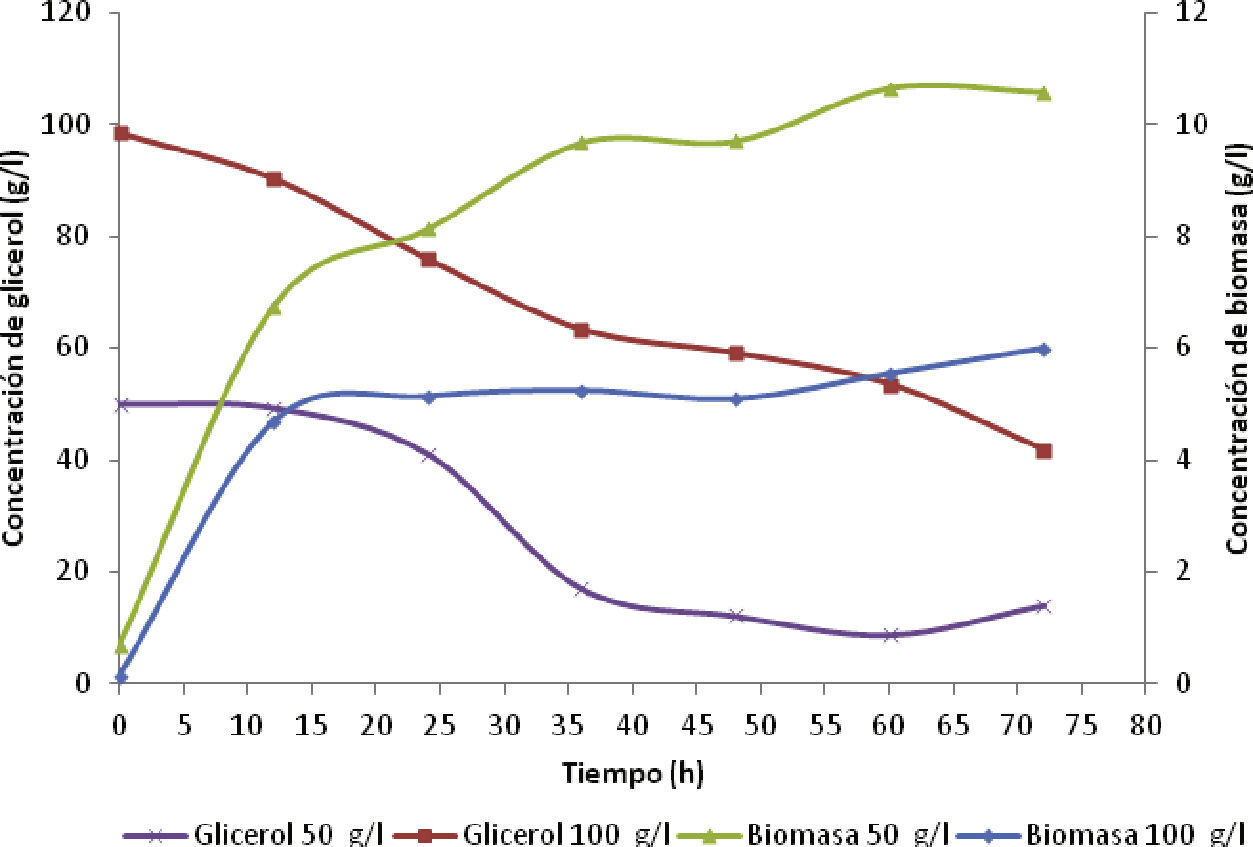
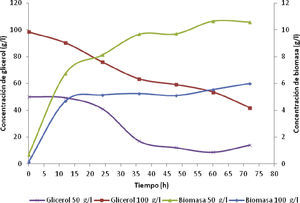
Crecimiento celular y parámetros cinéticosEn la figura 2, se observa la curva de crecimiento de biomasa para una concentración de glicerol de 50g/l y 100g/l. La concentración de biomasa se duplicó para la primera alimentación en 4.5g/l a las 12 horas de fermentación, porque hubo mayor asimilación del sustrato. Sin ambargo, disminuyó a la mitad con la segunda alimentación a 2.0g/l. Durante las primeras 24h, el consumo de glicerol por parte de la cepa alcanzó 72% para una concentración inicial de glicerol de 50g/l, y se redujo casi a la mitad (42%) para una concentración inicial de 100g/l; por consiguiente, a altas concentraciones de glicerol la bacteria disminuye su velocidad de consumo debido al efecto inhibitorio del sustrato (Acevedo et al., 2015), ya que altas concentraciones de sustrato dificultan la permeabilidad de la membrana, lo cual limita la entrada de nutrientes (Bories et al., 1991).
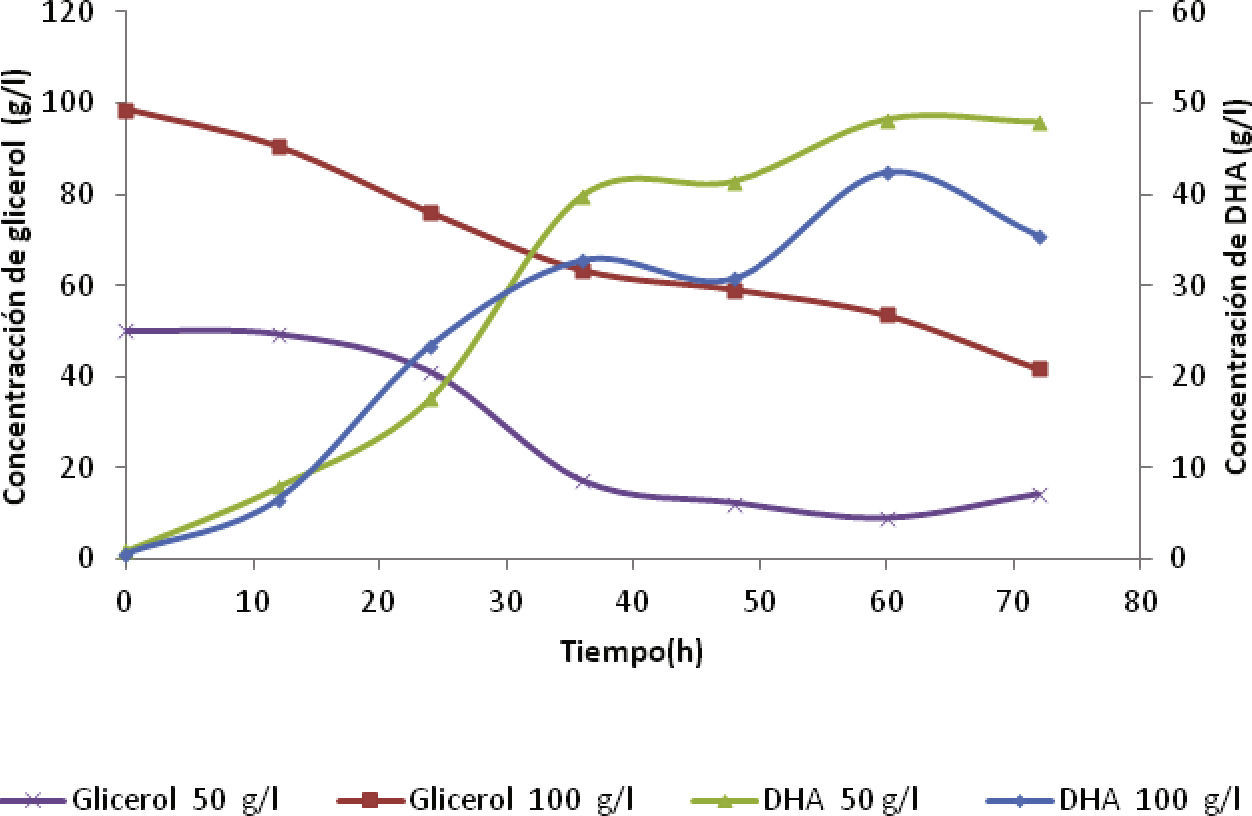
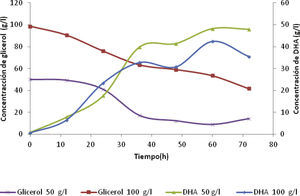
Concentración de DHA y rendimiento producto / sustratoPara comprobar que las concentraciones determinadas por el espectrofotómetro UV-VIS se consideren concentraciones reales de DHA, se analizaron las muestras en un cromatógrafo de gases (GC), lo cual confirmó la formación del producto de interés, DHA. La figura 3 muestra que la bacteria desde las primeras 12h fue capaz de producir DHA con las concentraciones iniciales de glicerol de 50 y 100g/l, obteniendo valores de 8 y 6.5g/l, respectivamente. La generación del producto presentó altos y bajos entre las 48 y 72h para ambas curvas, debido a que la alimentación del medio fresco aumentó el volumen del caldo de fermentación y la dilución de la dihidroxiacetona en el medio de cultivo. La mayor concentración de DHA alcanzó valores de 47.93 y 42.40g/l para concentraciones iniciales de glicerol de 50 y 100g/l, respectivamente. Asimismo, el consumo de sustrato después de transcurridas las 72h fue de 72 y 57%. Por consiguiente, la producción de DHA al igual que la concentración de biomasa fue inversamente proporcional a la concentración de sustrato, debido al desajuste entre el crecimiento y la producción de DHA, es decir, cuando las células permanecen por mucho tiempo en presencia de altas concentraciones de DHA, la células pierden la habilidad para crecer (Bories et al.,1991).
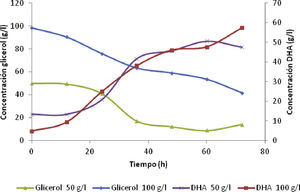
Las figuras 3 y 4 indican los métodos aplicados para la determinación de la producción de DHA y el consumo de glicerol. En la figura 3 para la concentración inicial de glicerol de 50g/l, el sustrato disminuyó rápidamente en la primera alimentación respecto a la concentración inicial de glicerol de 100g/l. Además, se observa que a mayor consumo de sustrato las concentraciones de DHA aumentaron de forma rápida en el transcurso de las primeras 36 horas, aunque la velocidad de formación del producto fue casi constante para ambas concentraciones de sustrato alimentado
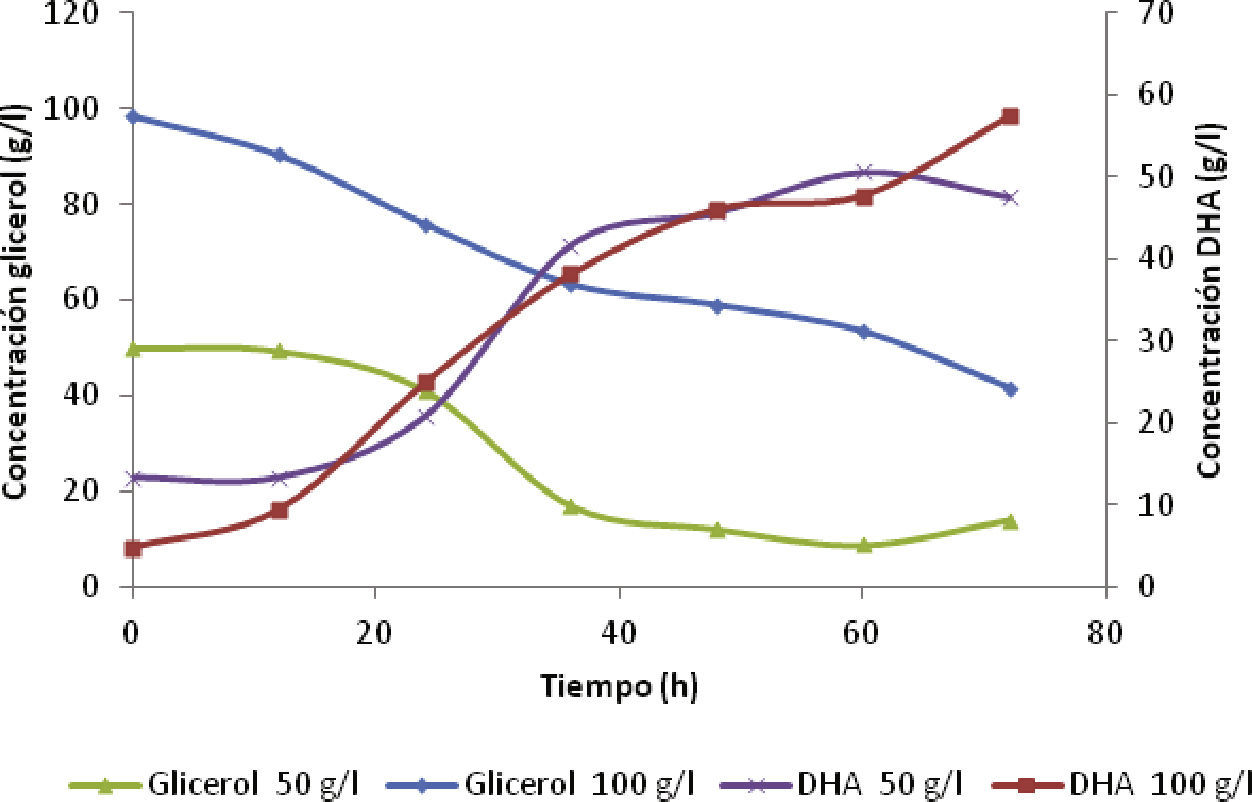
En la figura 4 los cromatogramas de las muestras por GC tomadas a las 60 horas, para concentraciones iniciales de glicerol de 50 y 100g/l, alcanzaron valores muy cercanos de 56.8 y 58.09g/l de DHA, pero la conversión de glicerol a DHA se detuvo en 9.3 y 42.68g/l de sustrato residual, respectivamente. Por lo tanto, la concentración de DHA tuvo mayor impacto sobre el crecimiento, que sobre la formación del producto a partir de glicerol (Bories et al., 1991). Además las altas concentraciones de sustrato son inhibitorias para las funciones celulares, debido a la reducción en la actividad del agua y el aumento en la viscosidad del caldo de fermentación, que limitan el crecimiento y la actividad de la enzima glicerol deshidrogenasa (GDH) (Lijuan et al., 2010; Rock et al.,2014).
Comparando ambos métodos UV-VIS y GC para la determinación de la dihidroxiacetona, los resultados se acercaron con pequeñas diferencias en las muestras tomadas a las 48 y 72 horas. Para una concentración inicial de glicerol de 50g/l ambos métodos alcanzaron concentraciones de 45.71 y 47.58g/l de DHA, sin embargo para una concentración inicial de glicerol de 100g/l, las concentraciones fueron de 46.08 y 57.35g/l, respectivamente. Los resultados obtenidos son satisfactorios, utilizando el proceso fed-batch con aireación.
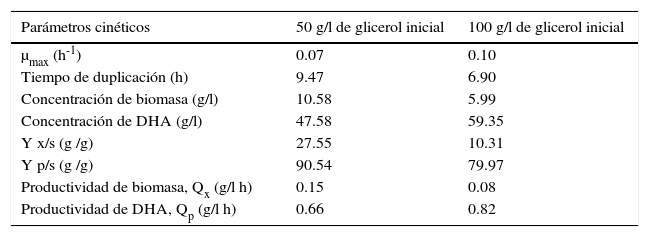
En la tabla 1 se presentan los parámetros de crecimiento de biomasa y producción de DHA, calculados a partir de las curvas de crecimiento de biomasa, consumo de glicerol y producción de DHA reportados en las figuras 2, 3 y 4. Se calcularon los parámetros cinéticos, como: velocidad específica de crecimiento, rendimiento biomasa/sustrato, velocidad de crecimiento, tiempo de duplicación, rendimiento producto/ sustrato y productividad.
Parámetros cinéticos obtenidos en el proceso fed- batch
| Parámetros cinéticos | 50 g/l de glicerol inicial | 100 g/l de glicerol inicial |
|---|---|---|
| μmax (h-1) | 0.07 | 0.10 |
| Tiempo de duplicación (h) | 9.47 | 6.90 |
| Concentración de biomasa (g/l) | 10.58 | 5.99 |
| Concentración de DHA (g/l) | 47.58 | 59.35 |
| Y x/s (g /g) | 27.55 | 10.31 |
| Y p/s (g /g) | 90.54 | 79.97 |
| Productividad de biomasa, Qx (g/l h) | 0.15 | 0.08 |
| Productividad de DHA, Qp (g/l h) | 0.66 | 0.82 |
De la tabla 1, cuando la concentración inicial de glicerol fue de 50g/l, hubo un aumento en el rendimiento producto/sustrato de 91%, por otro lado, para una concentración alimentada de 100g/l fue de 80%, debido a que altas concentraciones iniciales de glicerol reducen la actividad metabólica de la bacteria; por tanto, una mayor concentración de sustrato afecta el rendimiento y la velocidad de producción de DHA. Este resultado es similar a lo reportado por Claret y colaboradores, quienes emplearon diferentes concentraciones de glicerol (51–129g/l), y obtuvieron un rendimiento producto/sustrato de 92–82%), respectivamente, debido a que el rendimiento varió de forma inversa al contenido de sustrato alimentado. Este fenómeno se atribuyó a una inhibición del crecimiento por aumento en la concentración de sustrato (Claret et al., 1992; Bauer et al., 2005). Además, altas concentraciones de glicerol (100g/l) modifican todos los parámetros cinéticos, como la velocidad específica de crecimiento, los rendimientos y las productividades, debido a que la acción del sustrato sobre la actividad biológica no es selectiva (Bories et al., 1991). Estos resultados demuestran el efecto inhibitorio del sustrato durante el transcurso de la fermentación fed-batch. El aumento en la velocidad específica de crecimiento para una concentración de sustrato de 100g/l, se debe a que las bacterias tuvieron menor tiempo de duplicación y crecieron con mayor facilidad por el aumento en la actividad enzimática. Claret y colaboradores (1992) indicaron que a mayores concentraciones de glicerol, la máxima velocidad de consumo de sustrato se alcanza en un menor tiempo, y luego permanece constante.
La productividad de DHA aumentó para una concentración de glicerol de 100g/l, por la gran cantidad de sustrato disponible a degradar por parte de la bacteria logrando una velocidad específica de crecimiento mayor. Esto significó una rápida duplicación celular, pero la cantidad de biomasa fue mayor cuando se utilizó una concentración de glicerol de 50g/l, en contraste, la fase exponencial se alcanzó a las 36h para ambas concentraciones. Esto confirma la mayor productividad de G. oxydans en la producción de DHA aplicando otros procesos de fermentación (Bories et al., 1991; Claret et al., 1992; Hekmat et al., 2007; Lijuan et al., 2010; Zhong et al., 2011).
La tabla 1 muestra que la mejor producción de DHA se obtuvo a una concentración inicial de glicerol de 50g/l, debido a que los parámetros cinéticos μmax 0.07 h-1; Yx/s=25.55g/g; Yp/s=90.54g/g; Qx 0.15g de biomasa/lh; Qp 0.66g de producto/lh, son mejores para esta concentración de sustrato alimentado, por la mayor bioconversión de glicerol a DHA y el alto consumo de sustrato por parte de la bacteria.
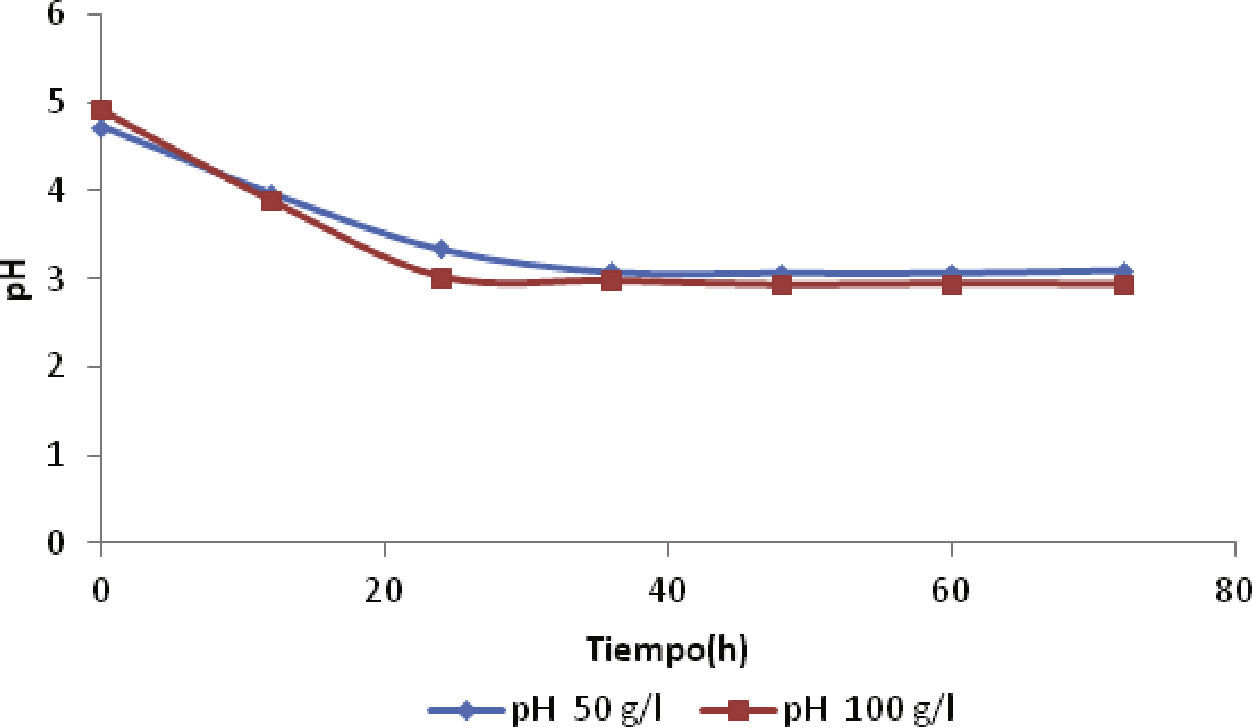
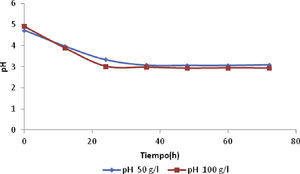
Comportamiento del pHLa figura 5 muestra el comportamiento del pH durante las 72 horas de fermentación. El pH inicial se ajustó a 5.3, pero la acidez aumentó con la producción de DHA. El pH se acidificó debido al aumento en la concentración de DHA durante las primeras 36h, pero después se observó que el pH se mantuvo entre 3.1 y 2.9 unidades, para 50 y 100g/l de glicerol, respectivamente. Este comportamiento del pH manejando altas concentraciones de sustrato fue similar a la caída del pH para un proceso batch, según lo reportado por Acevedo et al. (2014), debido a que la oxidación incompleta del sustrato se favoreció con altas concentraciones de sustrato. Además, el pH es un parámetro importante en procesos industriales, ya que influye en el metabolismo celular y en la permeabilidad de la membrana. Hekmat et al. (2003) informaron que un pH bajo favorece la producción de DHA y aumenta el rendimiento producto/sustrato para la fermentación con G. oxydans.
Inhibición por producto (DHA) y sustrato (glicerol)En la figura 3 se observa que durante las primeras 60 horas, para los 50g/l alimentados la concentración de DHA aumentó y permaneció constante hasta terminada la fermentación. Para la segunda alimentación de 100g/l, la producción de DHA fue menor y después disminuyó. Este comportamiento se debió a que las bacterias dejaron de producir DHA, porque parte del producto se degradó en CO2 y H2O, debido a la baja concentración de biomasa en el medio, dando inicio a la fase de muerte de las bacterias en el proceso fermentativo.
Se descartó la disponibilidad de glicerol para degradarse como una explicación para la inactividad metabólica, debido a que la última alimentación de sustrato se realizó a las 60h; por tanto, quedó glicerol disponible para seguir produciendo DHA. La razón para detener la producción de DHA fue la disminución en el número de bacterias presentes; esto se verificó en las curvas de biomasa para ambas corridas; en la figura 2 esta pausa del crecimiento bacteriano se presentó en ambos ensayos para concentraciones de DHA entre los 45 y 50g/l y fue provocado por la alta concentración alcanzada de DHA. A este fenómeno se le llama inhibición por producto. La inhibición se presentó debido a que el DHA juega un papel importante en el crecimiento lento de la bacteria, atribuido a la degeneración morfológica de la célula por la pérdida de estabilidad de la enzima glicerol-deshidrogenasa y al bloqueo continuo en la conversión del glicerol (Bories et al., 1991).
Se observa en las figuras 2 y 4 que el perfil de concentración para sintetizar DHA concuerda con las curvas de biomasa, este empezó a disminuir luego de las 60h de fermentación y la pendiente de la curva de concentración de DHA decayó, es decir, la velocidad de producción de DHA se limitó por la muerte de las bacterias en ese lapso de tiempo. La fase estacionaria para la curva de crecimiento de la biomasa comenzó a las 36h para ambas concentraciones iniciales de glicerol, y la velocidad de crecimiento aumentó a 0.1005 h-1 para 100g/l en comparación con la de 50g/l que fue de 0.0732 h-1. La concentración de biomasa para una alimentación inicial de glicerol de 50g/l alcanzó un valor de 10.6g/l mientras que para 100g/l disminuyó a 5.98g/l. Estos datos indicaron que a mayor concentración de glicerol se presenta el fenómeno de inhibición por sustrato.
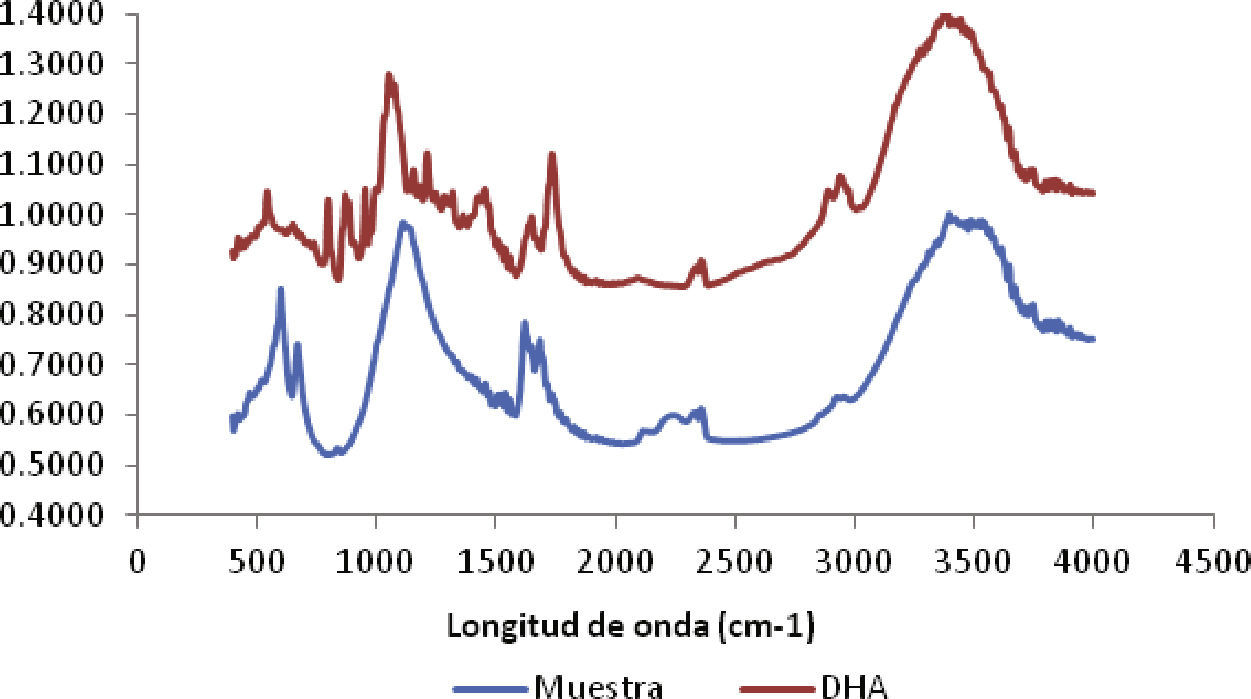
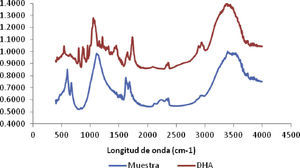
Análisis FTIR de la muestra patrón y de la muestra obtenida de DHAEsta prueba se hizo con el propósito de comparar no sólo el espectro de una muestra patrón de DHA y la muestra obtenida en la presente investigación, sino también la identificación y confirmación de la presencia de dihidroxiacetona. En la figura 6 se muestran los resultados arrojados por el espectrofotómetro infrarrojo FTIR, con el que se realizó la identificación de los grupos funcionales presentes en la muestra patrón de DHA y la obtenida en la presente investigación.
Al comparar la muestra patrón con la muestra obtenida se observan las bandas de frecuencia más representativas de DHA, confirmándose así su presencia. Por otro lado, el análisis reveló que en la muestra se presentaron bandas menores de sustancias ajenas a la DHA. Tales sustancias son residuos de la separación incompleta de la DHA del caldo de fermentación, posiblemente biomasa, nutrientes del medio de cultivo y etanol.
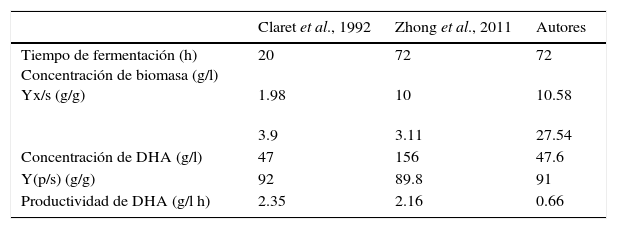
Comparación de parámetros cinéticos con otros estudios(Claret et al., 1992) reportaron un rendimiento biomasa/sustrato de 3.9% para las siguientes condiciones de operación: agitación 800rpm, temperatura 28°C, pH de 6, aireación de 1 vvm y un tiempo de fermentación 20 horas. En esta investigación se alcanzó un rendimiento de 27.54%, con temperatura de 30°C, pH 5.3, tiempo de fermentación 72h y la velocidad de agitación y el flujo de aire se controlaron a 150rpm y 1.66 vvm. Ohrem y Harald (1995) analizaron que la cantidad de oxigeno consumido por la bacteria es directamente proporcional a la tasa de oxidación de glicerol y a la velocidad de formación de producto. Por tanto, a mayor producción de biomasa mayor será el rendimiento biomasa/sustrato. El aumento en el rendimiento, se atribuyó al modo de operación fed-batch, el cual tuvo mayor flujo de aireación y tiempo de fermentación (tabla 2).
Parámetros cinéticos de diferentes investigaciones
| Claret et al., 1992 | Zhong et al., 2011 | Autores | |
|---|---|---|---|
| Tiempo de fermentación (h) Concentración de biomasa (g/l) Yx/s (g/g) | 20 1.98 3.9 | 72 10 3.11 | 72 10.58 27.54 |
| Concentración de DHA (g/l) | 47 | 156 | 47.6 |
| Y(p/s) (g/g) | 92 | 89.8 | 91 |
| Productividad de DHA (g/l h) | 2.35 | 2.16 | 0.66 |
Zhong et al. (2011) reportaron un rendimiento biomasa/sustrato de 3.11%, con las siguientes condiciones de fermentación: agitación 400rpm, temperatura 30°C, pH 5, aireación de 1.5 vvm y 72h de fermentación alcanzando un rendimiento biomasa/sustrato de 24.44%, aunque las condiciones en las que se realizó la fermentación fueron muy parecidas, exceptuando la agitación que fue casi el triple de la manejada en el proceso fed-batch. La disminución en el rendimiento se debió a la presencia de glicerol disponible para la degradación y la baja concentración de biomasa alcanzada en el proceso fermentativo. Como resultado alcanzaron una concentración de DHA de 156g/l, a una concentración inicial de glicerol de 180g/l y un rendimiento producto/sustrato de 89.8%, solo 1.2% por debajo del obtenido en la presente investigación (tabla 2).
Bories et al. (1991) y Lijuan et al. (2010) manejaron condiciones experimentales idénticas respecto al pH 6 y temperatura de 28°C, pero variaron agitación y aireación a 800rpm y 1vvm; 500rpm y 6 vvm para una cepa mutante, respectivamente. Existe mayor conversión del glicerol a DHA cuando se aumenta la cantidad de oxígeno disuelto en el medio de cultivo, lo cual favoreció las necesidades de oxígeno de la bacteria. El rendimiento producto/sustrato que se logró en la investigación fue de 91%, el cual coincide con Lijuan y colaboradores (2010).
Aunque la cantidad de DHA producida se determinó por cromatografía de gases, su productividad fue baja comparada con los resultados reportados por (Claret et al., 1992; Zhong et al., 2011), el rendimiento biomasa/sustrato y producto/sustrato se mejoró, debido a los factores físico-químicos utilizados: medio de cultivo, aireación, pH, agitación y temperatura que favorecieron el crecimiento de la célula y la síntesis de producto.
ConclusionesEl glicerol es un sustrato adecuado y económico para la producción microbiana de DHA en fermentación con G. oxydans. Se determinó que para la síntesis de DHA es necesario mantener un pH ácido, ya que la mejor producción se dio a pH 3 con un rendimiento producto/sustrato de 91%. La producción de DHA a partir de glicerol, depende del flujo de aireación, el tiempo de fermentación y las condiciones de operación. Se seleccionó una alimentación de 50g/l para mayor aprovechamiento del sustrato con una concentración de DHA de 47.58g/l, un rendimiento de 27.54 gramos de DHA por gramo de glicerol consumido, un rendimiento de 91%, una agitación de 150rpm a temperatura de 30°C y pH de 5.3. Con una baja alimentación de glicerol se evita el efecto inhibitorio por sustrato. Se observó que un aumento en la aireación permite incrementar la producción de DHA y mejora la estabilidad del proceso fed-batch. Estos resultados muestran que es viable la producción de DHA a partir de glicerol a un bajo costo. Por lo tanto, es posible solucionar los problemas de acumulación y contaminación del glicerol como subproducto de la síntesis del biodiesel.
A la Universidad de Cartagena, Laboratorio de Biotecnología del programa de Ingeniería Química, Laboratorios de Ingeniería de alimentos y Química y Farmacia, que permitieron la realización de este proyecto con resultados satisfactorios.
Citación estilo Chicago
Citación estilo ISO 690
Gezira De Avila-Montiel. Docente asistente en el programa de ingeniería química de la Universidad de Cartagena, Colombia. MSc. en ingeniería química de la Universidad Nacional de Colombia, Sede Bogotá, Colombia. Ingeniera química por la Universidad de Antioquia, Medellín, Colombia. Sus áreas de investigación se centran en biomateriales modificados con nanopartículas para aplicaciones antimicrobiana y antifúngica; aprovechamiento de biomasas y residuos agroindustriales; biopolímeros para remoción de contaminantes y obtención de biocombustibles.
Álvaro Realpe-Jiménez. Director y docente asistente del programa de ingeniería química de la Universidad de Cartagena, Cartagena, Colombia. Ingeniero químico por la Universidad del Atlántico, Barranquilla, Colombia, 1998. En 2002 obtuvo el grado de M.Sc en ingeniería química por la Universidad de Puerto Rico. En 2007 obtuvo el grado de Ph.D. en ingeniería química por la Universidad de Puerto Rico. Sus áreas de investigación incluyen membranas poliméricas para celdas de combustible, energías renovables, modelación de procesos industriales y tecnología de partículas.
Jhon Edward Duran-Ariza. Ingeniero Químico orientado a la ingeniería de procesos y producción con experiencia en industria de fertilizantes Industriales, control de procesos en tratamiento de aguas, así como labores QA/QC en manufactura de guantes de vinilo. Actualmente labora como Ingeniero de servicios técnicos para equipos de cromatografía de alta gama. Desarrolló su tesis en investigación para aprovechamiento del Glicerol, logros curriculares como elaboración de proyectos de tratamiento de agua.
María Teresa Acevedo-Morantes. Docente asistente del programa de ingeniería química de la Universidad de Cartagena, Colombia. Ingeniera química por la Universidad Industrial de Santander, Bucaramanga, Colombia, en 1999. En 2005 obtuvo su M.Sc. como ingeniera química en la Universidad de Puerto Rico. Sus áreas de investigación se orientan a membranas poliméricas para procesos electrolíticos, separación de dióxido de carbono y celdas de combustible. Además, ha desarrollado otras investigaciones con aplicaciones médicas como encapsulamiento de drogas médicas y síntesis de polianhídridos para tratamiento de cáncer.
Heidy Yaneth Bonfante-Álvarez. Ingeniera química de la Universidad de Cartagena, año 2013. Participó como joven investigadora de COLCIENCIAS durante el periodo 2013-2014. Sus áreas de investigación se orientan en la obtención de productos biotecnológicos y en biomateriales para la adsorción de metales pesados.