En esta investigación se compararon las abundancias microbianas presentes en el lodo granular de dos reactores anaerobios de manto de lodo con flujo ascendente (UASB): el primero alimentado con aguas de producción de petróleo liviano (31.1−39.0°API), provenientes de la región zuliana (Venezuela) (APP) y el segundo con glucosa. En tal sentido, se monitorearon las poblaciones de bacterias fermentadoras de glucosa (BFG), bacterias acetogénicas (BAC), metanógenos (MET), bacterias sulfato-reductoras (BSR), bacterias nitrato-reductoras (BNR) y heterótrofos, usando medios de cultivo selectivos. La densidad de los grupos microbianos estuvo correlacionada con los parámetros fisicoquímicos: pH, alcalinidad total, DQO, SO4=, NO3−, así como con los porcentajes de CH4, CO2 y de N2 en el biogás. Los resultados exhiben diferencias significativas entre la diversidad microbiana de ambos reactores, con una proporción de BFG > BSR > MET > BAC > BNR para el reactor con glucosa y de MET > BNR > BAC > BSR > BFG para las APP. La abundancia de bacterias en el reactor con glucosa estuvo en el orden de 108, mientras queen el reactor con APP fue de 105, lo cual resulta de la composición orgánica y mineral de los afluentes. Los resultados presentados en este estudio aportan evidencias sobre la dinámica poblacional en lodos de reactores anaerobios UASB, durante el tratamiento de aguas de producción petrolera.
In the present investigation the microbial abundances in the granular sludge of two upflow anaerobic sludge blanket reactors (UASB) were compared: the first one fed with production waters of light oil (31.1−39.0° API), from the zuliana region (Venezuela) (APP) and the second one with glucose. To this respect, the populations of glucose fermenting bacteria (BFG), acetogenic bacteria (BAC), metanogens (MET), sulfate-reducing bacteria (BSR), nitrate-reducing bacteria (BNR) and heterotrophic bacteria were monitored, using selective culture media. The microbial density was correlated with physicochemical parameters: pH, total alkalinity, COD, SO4=, NO3−, as well as with the percentages of CH4, CO2 and N2 in the biogas. The results exhibit significant differences between the microbial diversity of both reactors, with a proportion of BFG > BSR > MET > BAC > BNR for the glucose reactor and of MET > BNR > BAC > BSR > BFG for the APP. The abundance of bacteria in the glucose reactor was in the order of 108, whereas in the APP reactor was of 105, which ensues from the organic and mineral composition of effluents. The results presented in this study reach evidences on the population dynamics in sludge of UASB reactors, during the treatment of oilfield produced waters.
Venezuela es uno de los países con las mayores reservas mundiales de petróleo. La explotación de este recurso trae como consecuencia una elevada generación de efluentes líquidos, entre los que se encuentran las aguas de producción petroleras (APP) (Peña y Colina, 2000). La preocupación de la industria petrolera venezolana por el tratamiento y reutilización de dichas aguas promueve la búsqueda constante de tecnologías que proporcionen alternativas viables para la degradación de los contaminantes contenidos en ellas, entre los que se encuentran metales, hidrocarburos (alifáticos y aromáticos), fenoles, etcétera (Gutiérrez et al., 2009; Kemmer y McCallion, 1998), los cuales pueden impactar gravemente al ambiente.
La digestión anaerobia en reactores de manto de lodo con flujo ascendente (UASB), ha sido evaluada satisfactoriamente a escala de laboratorio, como alternativa real para el tratamiento de estas aguas de producción, mostrando la factibilidad técnica para su biodegradabilidad anaerobia (Díaz et al., 2005; Rincón et al., 2003; Rincón et al., 2002). Una gran variedad de microorganismos coexisten en el lodo de estos reactores anaerobios y la combinación apropiada de los mismos es necesaria para una eficiente transformación de la materia orgánica a gas metano (Hori et al., 2005). Estos procesos metanogénicos sólo pueden ser realizados por grupos funcionales especializados de microorganismos (Roest, 2007). Tanto el conocimiento de la abundancia de las poblaciones como el entendimiento de los procesos bioquímicos asociados a la biodegradación anaerobia, podrían ayudar a predecir y vislumbrar las acciones a tomar durante la operación de estas unidades a escala real, con la finalidad de maximizar las remociones de los contaminantes presentes.
El objetivo de esta investigación consistió en comparar las abundancias de los grupos bacterianos presentes en el lodo granular de reactores UASB alimentados con APP y con glucosa (sustrato altamente biodegradable), con la finalidad de aportar herramientas en la predicción y optimización de la eficiencia de dichos sistemas de tratamiento.
DesarrolloDescripción de los reactores UASBPara los ensayos se utilizaron dos reactores UASB a escala de laboratorio, con volumen útil de 4000mL, inoculados con 1200mL (23.8% del volumen total) de lodo granular anaerobio proveniente de un reactor UASB de una industria cervecera de la localidad. Fueron alimentados a flujo continuo por 60d (2.5mL/ min), utilizando bombas peristálticas y aplicando un tiempo de retención hidráulica (TRH) de 24h, a una temperatura de operación de 29±2°C. Durante los primeros 7d se empleó un afluente sintético, preparado con glucosa (1g/L) (HIMEDIA®) como fuente de carbono, de acuerdo a lo sugerido por Chacín (1993). Luego de este periodo de aclimatación, uno de los reactores se alimentó con APP provenientes de la extracción de petróleo liviano (31.1−39.0°API), las cuales contenían una demanda química de oxígeno (DQO) de 712.83±146.87mg/L. Estas APP fueron recolectadas de forma aleatoria-simple a la salida de los tanques de deshidratación de crudo de patios de tanques del Estado Zulia, Venezuela, y transportadas al laboratorio en recipientes de 20L de capacidad. El segundo reactor se continuó alimentando con el afluente sintético durante todo el periodo experimental.
Parámetros fisicoquímicosDiariamente se monitorearon los siguientes parámetros fisicoquímicos: temperatura, pH, alcalinidad total y DQO, en el efluente de los dos reactores UASB, aplicando métodos estándares (APHA et al., 1998). Tres veces por semana se analizaron las concentraciones de NO3− y SO4=, así como los porcentajes de CH4, N2 y de CO2 en el biogás. Se empleó la técnica de cromatografía iónica (cromatógrafo DIONEX CD20, columna analítica DIONEX AS4A y detector de conductividad) para cuantificar estos aniones (nutrientes) y la cromatografía gaseosa (cromatógrafo PERKIN ELMER Autosystem XL, columna de vidrio empacada con 20% TCEP PAWS 80/100 y detector FID) para los gases. De igual manera, los afluentes de los reactores (APP y sintético con glucosa), eran caracterizados desde el punto de vista fisicoquímico.
Preparación de las muestras para análisis microbiológicosCuando se observó una estabilidad en los parámetros fisicoquímicos evaluados en los efluentes finales de los reactores, se procedió a colectar muestras del lodo anaerobio para los análisis microbiológicos. Se realizaron muestreos simultáneos del lodo de ambos reactores cada semana, para un total de seis muestreos (12 muestras en total). En cada muestreo se colectaron 3g de lodo anaerobio, de los cuales se pesó 1g de muestra para los análisis microbiológicos. Este lodo fue homogenizado en un mortero e inoculado con jeringas estériles y agujas hipodérmicas en las soluciones amortiguadoras que contenían agentes reductores, de acuerdo con cada protocolo.
Todos los procedimientos aplicados durante la cuantificación de los grupos funcionales fueron realizados bajo condiciones anaeróbicas, empleando una cámara de atmósfera controlada marca PLAS LABS (Lansing, MI, USA), cuyo gas de alimentación estaba compuesto por N2, H2 y CO2 (84.22, 10.79 y 4.99%, respectivamente), a una temperatura interna de 35±2°C.
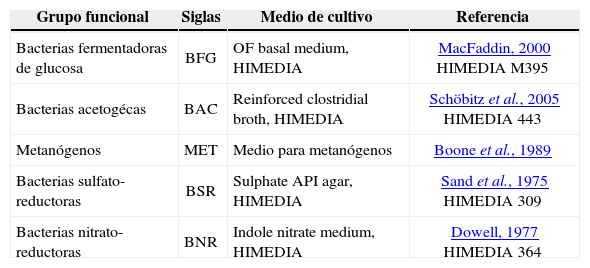
Cuantificación de los grupos funcionales de anaerobiosEl recuento de los grupos funcionales fue realizado por la técnica de tubos múltiples (APHA et al., 1998), estimándose el número más probable de microorganismos por cada 100g de muestra (NMP/100g). Los grupos funcionales estudiados, así como los medios de cultivo empleados se especifican en la tabla 1.
Grupos funcionales y medios de cultivos selectivos empleados durante la cuantificación de la diversidad microbiológica del lodo anaerobio
| Grupo funcional | Siglas | Medio de cultivo | Referencia |
|---|---|---|---|
| Bacterias fermentadoras de glucosa | BFG | OF basal medium, HIMEDIA | MacFaddin, 2000 HIMEDIA M395 |
| Bacterias acetogécas | BAC | Reinforced clostridial broth, HIMEDIA | Schöbitz et al., 2005 HIMEDIA 443 |
| Metanógenos | MET | Medio para metanógenos | Boone et al., 1989 |
| Bacterias sulfato-reductoras | BSR | Sulphate API agar, HIMEDIA | Sand et al., 1975 HIMEDIA 309 |
| Bacterias nitrato-reductoras | BNR | Indole nitrate medium, HIMEDIA | Dowell, 1977 HIMEDIA 364 |
Para la cuantificación se realizaron diluciones seriadas desde 10−4 hasta 10−8. Estas diluciones fueron inoculadas en los medios selectivos estériles, cuyos tubos de cultivo estaban sellados con tapones de caucho de butilo y tapas de baquelita debidamente perforadas, lo cual permitió el uso de jeringas para agregar las muestras (Díaz et al., 2002).
También se realizó el conteo de heterótrofos en el lodo por la técnica de vertido en placas, con la finalidad de cuantificar las unidades formadoras de colonias anaerobias por gramo de muestra (UFCa/g) (APHA et al., 1998), empleando dos medios de cultivo comerciales: plate count agar (HIMEDIA®) y anaerobic agar (Brewer) (HIMEDIA®) (Brewer, 1942).
Todos los medios de cultivo inoculados fueron incubados en condiciones anaerobias (jarras anaerobias de MERCK® con sobres de Anaerocult® A y con Anaerotest®) y mesofílicas a 35±2°C. El tiempo de incubación para el conteo de heterótrofos fue de 10d y para los grupos funcionales de acuerdo al tiempo requerido por cada grupo.
Análisis estadístico de datosSe realizó un análisis de varianza (ANOVA) de una vía con la finalidad de determinar las diferencias significativas en los parámetros fisicoquímicos y microbiológicos evaluados, considerando el tipo de sustrato (glucosa Vs. APP). Antes de realizar el ANOVA se comprobaron tanto la homogeneidad de las varianzas (Test de Bartlett) como la distribución normal de los residuos (Test de Kolmogorov-Smirnov). Adicionalmente, se estableció un estudio de correlación simple entre las diferentes variables de estudio en cada reactor, tomando n=6; p<0.05 y rteórico=0.754.
Discusión y análisis de resultadosComportamiento de los parámetros fisicoquímicosEn la tabla 2 se muestran los valores de los parámetros fisicoquímicos evaluados durante la operación de los reactores UASB. Estos datos muestran que las APP (afluente) no cumplen con la normativa venezolana para la descarga a cuerpos de aguas naturales (Decreto 883, 1995), particularmente debido a la DQO (máx. 350mg/L). El comportamiento del pH y de la alcalinidad total durante el tratamiento fue relativamente estable y dentro de los rangos adecuados para la biodegradación anaerobia de la materia orgánica contenida en las APP (Henze y Harremoes, 1983).
Valores medios (n=19) de los parámetros fisicoquímicos evaluados en los reactores UASB alimentados con glucosa y aguas de producción petroleras (APP)
| Parámetro | Reactor glucosa Xa±DEb | Reactor APP Xa±DEb | ||
|---|---|---|---|---|
| Afluente | Efluente | Afluente | Efluente | |
| pH | 7.52±0.16 | 7.11±0.18 | 8.11±0.44 | 8.13±0.18 |
| Alcalinidad total (mgCaCO3/L) | 659.3±59.6 | 632.3±68.2 | 1828.4±141.5 | 1815.5±144.7 |
| DQO (mg/L) | 997.18±176.47 | 164.33±48.74 | 712.83±146.87 | 199.10±81.78 |
| Temperatura (°C) | 29.15±2.18 | 29.44±1.24 | 29.52±1.68 | 29.09±1.08 |
Los valores de pH en los efluentes finales de ambos reactores revelaron diferencias significativas (p<0.001) (tabla 2). En la digestión anaeróbica el pH es, en general, amortiguado por el bicarbonato, dependiendo así de la capacidad buffer expresada en alcalinidad total. Por tanto, es posible inferir que la diferencia en el pH de los efluentes tratados sea debida a la composición de las APP, las cuales tienen una gran capacidad amortiguadora resultante de la concentración de iones carbonatos y bicarbonatos (Rincón et al., 2003). La alcalinidad total media en el efluente de los reactores UASB alimentados con glucosa y APP fue de 632.3±68.2 y 1815.5±144.7mgCaCO3/L, respectivamente.
En cuanto a la DQO, las concentraciones medias de entrada (afluente) se ubicaron en 997.18±176.47 y 712.83±146.87mg/L para los reactores con glucosa y APP (tabla 2), respectivamente. Durante el tratamiento se obtuvieron porcentajes medios de remoción de materia orgánica, medida como DQO, de 83% para la glucosa y de 75% para las APP. Estos resultados sugieren una alta actividad metanogénica de la biomasa activa presente en el lodo granular de los reactores (Tabatabaei et al., 2010), fenómeno particularmente relacionado con las APP, tomando en cuenta su compleja composición orgánica que incluye la presencia de hidrocarburos aromáticos tóxicos como el fenol (Rincón et al., 2008). Así, las concentraciones medias finales de materia orgánica, medida como DQO, fueron de 164.33±48.74 y 199.10±81.78mg/L para los reactores alimentados con glucosa y APP, respectivamente. Estos valores resultaron inferiores al máximo permisible de 350mgDQO/L, establecido en la norma venezolana para la descarga a cuerpos de aguas naturales (Decreto 883, 1995).
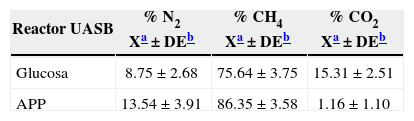
La tabla 3 muestra los porcentajes medios de N2 CH4 y CO2 en el biogás de los reactores UASB. En el reactor con APP se encontró una correlación significativa inversa entre CH4 y CO2 (r=−0.768; p<0.05), la cual está asociada con la abundancia de los grupos bacterianos involucrados en la generación de estos gases, en función de las rutas metabólicas empleadas (Huang et al., 2005). La proporción de CH4 en el reactor con APP (86%) fue mayor que la del reactor que presentaba glucosa (76%), lo cual denota la eficiencia de la comunidad microbiana anaerobia en la transformación de las fuentes de carbono presentes en las APP (notablemente hidrocarburos) a CH4. Los resultados de APP también indican una correlación significativa (r=0.814; p<0.05) del porcentaje de CH4 con respecto a la DQO del afluente (entrada). La producción de N2 fue menor para la glucosa (8.75±2.68%) con respecto a las APP (13.54±3.91%), lo cual se relaciona con la abundancia de BNR en virtud de la reducción NO3− por la vía desasimilatoria (desnitrificación), produciendo N2 como producto final (Huang et al., 2005; Karakashev et al., 2005).
Valores medios (n=10) porcentuales de la producción de nitrógeno, metano y dióxido de carbono en los reactores UASB alimentados con glucosa y aguas de producción petroleras (APP)
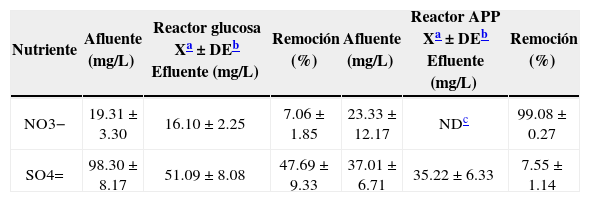
Las concentraciones medias de NO3− y SO4= a la salida y entrada de los reactores, así como su porcentaje de remoción durante el tratamiento aplicado, se presentan en la tabla 4. Los porcentajes de remoción de estos nutrientes estuvieron en función de la abundancia de los grupos microbianos presentes en el lodo anaerobio (particularmente de las BNR y BSR), lo cual será discutido a continuación en el presente estudio. El reactor con APP mostró una alta remoción de NO3− (99.08±0.27%) con respecto al reactor con glucosa (7.06±1.85%), mientras que el SO4= fue removido más eficientemente en el afluente con glucosa (47.69±9.33%). Este comportamiento también fue dependiente de la disponibilidad de los nutrientes en el afluente, cuya concentraciones se ubicaron en 19.31±3.30 y 23.33±12.17mg/L y en 98.30±8.17 y 37.01±6.71mg/L, para NO3− y SO4= en los reactores con glucosa y APP, respectivamente.
Concentraciones medias (n=10) de NO3− y SO4= presentes en los reactores UASB alimentados con glucosa y aguas de producción petroleras (APP)
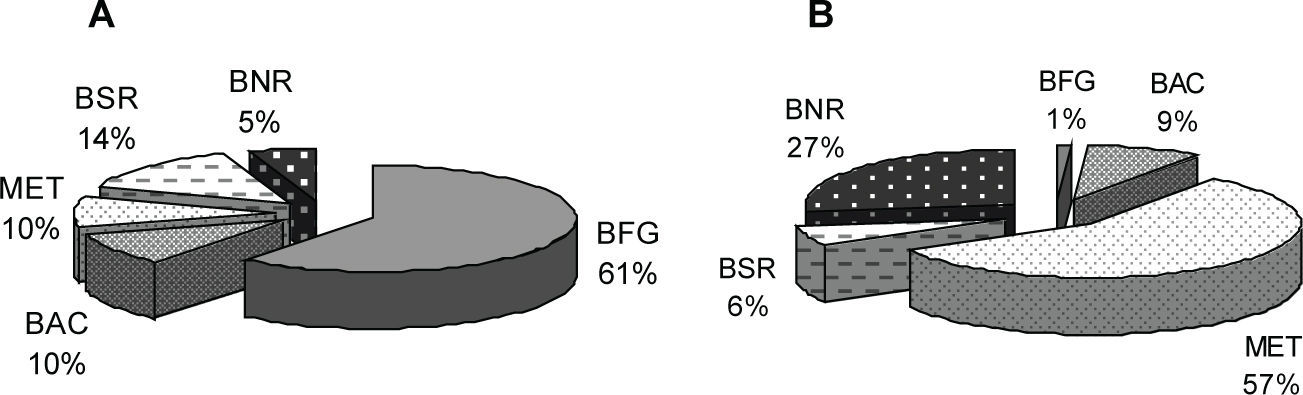
Las densidades de los diferentes grupos microbianos estudiados durante la etapa de estabilidad en los reactores UASB alimentados con glucosa y APP fueron significativamente diferentes (p<0.05), exceptuando a las BNR (figura 1). El orden de abundancia de los grupos funcionales fue mayor para la glucosa (108) que para las APP (105), lo cual pudiera ser un indicativo de la inhibición del crecimiento debido a la presencia de compuestos tóxicos en las APP, de acuerdo con lo reportado en otros estudios (Chen et al., 2008; Liu et al., 2008; Rincón et al., 2003).
Distribución porcentual de los grupos funcionales presentes en el lodo anaerobio de los reactores UASB alimentados con glucosa (A) y aguas de producción petroleras (B). BFG: bacterias fermentadoras de glucosa, BAC: bacterias acetogénicas, MET: metanógenos, BSR: bacterias sulfato-reductoras, BNR: bacterias nitrato-reductoras
La densidad de BFG fue significativamente diferente en los dos reactores (p=0.028), con valores de 1.35±2.02×109 y de 4.10±3.14×104 NMP/100g de lodo para la glucosa y las APP, lo cual representa 61 y 1% de los grupos funcionales evaluados (figura 1), respectivamente. Esta desigualdad está directamente influenciada por la composición del afluente utilizado, siendo la glucosa poco disponible en las APP a diferencia del reactor glucosa que contenía este carbohidrato como única fuente de carbono. No obstante, las BFG transforman los productos de la hidrólisis en ácido acético y otros compuestos intermediarios como ácidos grasos volátiles (ácidos láctico, propiónico, fórmico y butírico), además de H2 y CO2, de manera que ciertos compuestos orgánicos presentes en las APP pudieran ser fermentados bajo las condiciones del presente estudio, contribuyendo con ese 1% encontrado para este grupo bacteriano. Según Rincón et al. (2003) y Díaz et al. (2005), las APP contienen gran variedad de hidrocarburos entre los que se encuentran los fenoles, los cuales pueden ser biodegradados empleando distintas rutas metabólicas. El fenol, por ejemplo, puede ser usado como fuente de carbono por un cierto número de microorganismos. En este sentido, algunos investigadores han demostrado que cultivos de Pseudomonas sp. y Spirillum sp. degradan fenol en ausencia de oxígeno libre, mediante su reducción a ciclohexanol, el cual posteriormente es deshidrogenado a ciclohexanona, para finalmente producir n-caproato por fisión hidrolítica del anillo alicíclico (Evans & Fuchs, 1988). También ha sido reportada la degradación anaerobia de fenol vía inicial carboxilación a ácido 4-hidroxibenzoico (Evans y Fuchs, 1988).
La abundancia de BAC fue de 10 y 9% para los afluentes de glucosa y APP (figura 1) (2.27±0.74×108 y 3.20±3.02×105 NMP/100g de lodo), respectivamente. Estas bacterias oxidan los productos de la fermentación a acetato, H2 y CO2, pero son inhibidas a ciertas presiones parciales de H2, de manera que su proliferación depende de la eliminación de este gas por parte de otros grupos microbianos. De acuerdo con lo anterior, densidades significativas de BAC pueden ser observadas cuando se encuentran asociadas a un organismo consumidor de H2, tales como MET o BSR (Mosey, 1983; Widdel, 1986; Wen-Tso et al., 2002). En este sentido, el valor significativo de correlación negativa obtenido entre la abundancia de BAC y la DQO del efluente final en el reactor con glucosa (r=–0.883; p<0.05), sugiere el establecimiento de esta relación sintrófica entre BAC y MET. Así, es posible inferir que la presencia del grupo funcional BAC asegura la materia prima (acetato, CO2 y H2) para los MET, degradándose eficientemente la materia orgánica para producir CH4 y, por tanto, disminuyendo la DQO de salida.
Los MET representaron 57% para las APP y 10% para la glucosa (figura 1), lo cual correspondió con las cantidades de CH4 encontradas en el biogás de los reactores (86.35±3.58 y 75.64±3.75%, respectivamente) (tabla 3). Estos resultados demuestran la eficiencia de estos microorganismos en la utilización de los productos hidrocarbonados presentes en las APP como fuentes de carbono, para su bioconversión a CH4. Dicho proceso es posiblemente gracias a que en ambientes con baja concentración de SO4= (como los observados en las APP, tabla 4), los MET tienden a dominar por sobre otros grupos funcionales (Wen et al., 2002; Stams et al., 2005). La degradación de los constituyentes del petróleo mediada por MET ha sido reportada en diversos estudios (Watanabe et al., 2002; Satoh et al., 2006).
Las BSR, por su parte, se presentaron en una proporción de 6% (2.21±2.08×105 NMP/100g de lodo) en las APP, mientras que en el reactor alimentado con glucosa se ubicaron en 14% (3.17±3.51×108 NMP/100g de lodo) (figura 1). Los resultados muestran correlaciones significativas entre las BSR y las concentraciones de SO4= del afluente y del efluente para las APP (r=0.824 y 0.772; p<0.05; respectivamente), mostrando que el crecimiento de estas bacterias depende de la disponibilidad de dicho anión en el medio, el cual es utilizado como aceptor final de electrones durante las reacciones de degradación de la materia orgánica para formar H2S (Millán et al., 1996; Shabir et al., 2008). La baja remoción de SO4= en el reactor que presentaba APP (7.55±1.14%, tabla 3), resulta de la menor densidad de BSR presentes en el lodo. En reactores anaerobios con baja concentración de SO4=, se ha reportado que la población de BSR podría acoplarse a la de BAC, debido al metabolismo fermentativo de este grupo, por lo que la transferencia interespecífica de H2 se llevaría a cabo entre BSR, BAC y MET, donde las BAC producen H2 y los MET o las BSR lo consumen (Zhou y Fang, 1998; Valdez et al., 2004).
Las densidades poblacionales de BNR fueron de 27 y 5% para los reactores con APP y glucosa, respectivamente. Es notorio que estos resultados están influenciados por la disponibilidad y utilización de NO3− como aceptor final de electrones, lo cual sugiere una remoción de este ión por parte del grupo funcional. En general, como parte fundamental de su metabolismo estas bacterias convierten el NO3− a formas más reducidas del nitrógeno, como N2O, NO y N2. Considerando que estos productos gaseosos de la reducción del nitrato se pierden con facilidad del medio, dicho proceso es llamado desnitrificación (Zwolinski et al., 2001). La producción de N2 fue de 13.54±3.91 y 8.75±2.68%, respectivamente, para APP y glucosa, indicando el desarrollo del proceso biológico de desnitrificación en ambos reactores, lo cual contribuye a la remoción de materia orgánica en presencia de NO3−. Tanto la desnitrificación como la metanogénesis ocurren dentro de los reactores UASB, contribuyendo a la degradación demateria orgánica acompañado de rápidas tasas de granulación (Huang et al., 2005).
La tabla 5 presenta los resultados del conteo de heterótrofos anaerobios comparando su abundancia en: agar conteo en placa (ACP) y en el medio para anaerobios de Brewer. El análisis de varianza mostró que existen diferencias significativas (p<0.001) entre la proporción de bacterias en los medios para ambos reactores. En ACP las abundancias fueron de 106 y 107 UFCa/g para APP y glucosa, respectivamente, mientras que en el medio de Brewer fueron de 104 (APP) y 107 UFCa/g (glucosa). A partir de estos resultados se puede inferir que los tipos de sustratos disponibles (glucosa y APP), influyen significativamente en el crecimiento poblacional (Ahring et al., 1993). Esta aseveración fue confirmada mediante la correlación significativa de la cantidad de heterótrofos del reactor con glucosa en el medio ACP con la concentración de DQO del afluente (r=0.861) (p<0.05). De igual manera, para las APP se obtuvo correlación inversa significativa entre el conteo de dichos microorganismos en medio ACP con la DQO del efluente (r=−0.887) (p<0.05). Adicionalmente, la diferencia entre las magnitudes microbianas obtenidas en ambos medios de cultivo (mayor para ACP), también es debida a la composición de dichos medios, obteniéndose sólo bacterias anaerobias estrictas en el agar Brewer cuando es incubado en anaerobiosis (Brewer, 1942), mientras que en ACP pueden crecer incluso bacterias aerotolerantes (APHA et al., 1998).
Valores medios (n=10) para el contaje de heterótrofos mesofílicos anaerobios, expresados en UFCa/g, presentes en el lodo inicial y en los reactores UASB alimentados con glucosa y aguas de producción petroleras (APP)
La elevada remoción de materia orgánica medida como DQO obtenida para APP (75.77±7.40%) indica que la digestión anaerobia, mediante el uso de reactores UASB, es un tratamiento viable para la disminución de fracciones orgánicas de hidrocarburos presentes en este tipo de muestras. La eficiencia de remoción para la glucosa fue de 83.86±4.41%.
Los resultados muestran diferencias significativas entre las densidades de los grupos microbianos evaluados en ambos reactores, con una proporción de BFG > BSR > MET > BAC > BNR para la glucosa y de MET > BNR > BAC > BSR > BFG para APP, obteniéndose además una producción de metano de 86.35±3.58% para APP y de 75.64±3.75% para la glucosa, lo cual evidencia el dominio de los MET en el reactor alimentado con APP. Las características fisicoquímicas de los efluentes de los reactores garantizaron el desarrollo de una comunidad microbiana mixta para degradar los sustratos orgánicos presentes.
La abundancia de los distintos grupos microbianos en el lodo de los reactores estuvo en función de las características nutricionales de los afluentes (glucosa Vs. APP). De igual manera, la composición de los medios de cultivo empleados (agar conteo y Brewer) determinó la magnitud de los heterótrofos mesófilos anaerobios cuantificados, siendo mayor para el agar conteo.
Este estudio fue financiado parcialmente por el Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) de Venezuela.
Licenciada en biología (Universidad del Zulia, 2007), Magister Scientiarum en ciencias ambientales (Universidad del Zulia, 2010). Área de investigación: ciencias ambientales.
Citación estilo Chicago Cajacuri, María Patricia, Nancy Rincón, Ismenia Araujo, Elisabeth Behling, Gilberto Colina, Julio César Marín-L. Diversidad microbiológica del lodo anaerobio durante el tratamiento de aguas de producción petroleras venezolanas. Ingeniería Investigación y Tecnología, XIV, 03 (2013): 325–334.
Citación estilo ISO 690 Cajacuri M.P., Rincón N., Araujo I., Behling E., Colina G., Marín-L. J.C. diversidad microbiológica del lodo anaerobio durante el tratamiento de aguas de producción petroleras venezolanas. Ingeniería Investigación y Tecnología, volumen XIV (número 3), julio-septiembre 2013: 325–334.
Ingeniera civil (Universidad del Zulia, 1991), Magister Scientiarum en ingeniería ambiental (Universidad del Zulia, 1996), doctora en ingeniería de procesos y del medio ambiente (INSA-Narbonne, Francia, 2002). Profesora titular a dedicación exclusiva de La Universidad del Zulia (Venezuela). Miembro del programa de estímulo a la innovación e investigación (PEII) del Ministerio de Ciencia, Tecnología e Industrias Intermedias de Venezuela. Área de investigación: ingeniería ambiental.
Ingeniera civil (Universidad del Zulia, 1991), Magister Scientiarum en ingeniería ambiental (Universidad del Zulia, 1996), Doctora en ingeniería ambiental (Universidad del Zulia, 2010). Profesora titular a dedicación exclusiva de La Universidad del Zulia (Venezuela). Miembro del programa de estímulo a la innovación e investigación (PEII) del Ministerio de Ciencia, Tecnología e Industrias Intermedias de Venezuela. Área de investigación: ingeniería ambiental.
Licenciado en educación mención química (Universidad del Zulia, 1989), Magister Scientiarum en ciencias ambientales (Universidad del Zulia, 1996), Doctor en ingeniería ambiental (Universidad del Zulia, 2011). Profesor asociado a dedicación exclusiva de La Universidad del Zulia (Venezuela). Miembro del programa de estímulo a la innovación e investigación (PEII) del Ministerio de Ciencia, Tecnología e Industrias Intermedias de Venezuela. Área de investigación: química ambiental, ciencias ambientales.
Licenciado en biología (Universidad del Zulia, 1996), Magister Scientiarum en ciencias ambientales (Universidad del Zulia, 2000), Doctor en fisiología, biología de organismos, poblaciones e interacciones (Université de Caen-Basse Normandie, Francia, 2007). Profesor titular a dedicación exclusiva de La Universidad del Zulia (Venezuela). Miembro del programa de estímulo a la innovación e investigación (PEII) del Ministerio de Ciencia, Tecnología e Industrias Intermedias de Venezuela. Área de investigación: ecología acuática, ciencias ambientales.
Licenciada en ciencias biológicas (Universidad del Zulia, 1968), Magister Scientiarum en microbiología (University of Georgia, USA, 1983). Profesora titular a dedicación exclusiva de La Universidad del Zulia (Venezuela). Miembro del programa de estímulo a la innovación e investigación (PEII) del Ministerio de Ciencia, Tecnología e Industrias Intermedias de Venezuela. Área de investigación: microbiología ambiental.