Nanoestructuras de Rh se sintetizaron a partir del precursor (acetilacetonato) (1,5-ciclooctadieno) de rodio(I), [Rh(acac)(1,5-C8H12)] bajo atmósfera de H2 (3bar) en medio orgánico con el fin de estudiar el efecto de la concentración de los ligantes contenidos en el medio de reacción después de la síntesis (acetilacetonato, ciclooctadieno y 2,4-pentanodiol) en la estabilización de las nanoestructuras obtenidas. Adicionalmente, se estudió el efecto de la adición al medio de reacción de dos estabilizantes clásicos, un polímero, polivinilpirrolidona (PVP) y una alquil amina, 1-hexadecilamina (HDA) en la estabilización de las nanoestructuras. Finalmente, las nanoestructuras de Rh obtenidas se caracterizaron por Microscopia Electrónica de Transmisión (MET).
Rh nanostructures were synthesized from [Rh(acac)(1,5-C8H12)] under hydrogen atmosphere (3bar) in organic media with the aim to study the effect of ligands concentration in the reaction media (composed by acetylacetonate, 1,5-cyclooctadiene and 2,4-pentanediol) on the stabilization of the obtained nanostructures. Moreover, the effect of the addition of classic stabilizers such as polyvinylpyrrolidone (PVP) and hexadecylamine (HDA) was also studied. Finally, the obtained Rh nanostructures were characterized by Transmission Electron Microscopy (TEM).
En la literatura el número de publicaciones relacionadas con la síntesis de nanopartículas de rodio en disolución es relativamente limitado, a pesar del creciente interés de la aplicación en catálisis de este metal (reacciones de hidrogenación, carbonilación, hidroformilación, etcétera). La razón está ligada en gran medida al elevado costo de este metal. No obstante, un gran número de trabajos mencionan el interés de los coloides de Rh como catalizadores solubles o catalizadores heterogéneos para la hidrogenación de compuestos aromáticos (Dyson, 2003). Algunas publicaciones mencionan la preparación de nanopartículas de rodio sobre soportes para la obtención de catalizadores heterogéneos (Díaz et al., 2001; Grass et al., 2009; Barthe et al., 2009; Pélisson et al., 2012), así como sistemas coloidales en medio bifásico son igualmente descritos. Más recientemente, se han empleado nanopartículas de rodio soportadas en nanotubos de carbono o en materiales a base de carbono como electrocatalizadores en reacciones de electro-oxidación de alcoholes de bajo peso molecular (Cantane et al., 2012; Suo et al., 2011) y en sensores de gases (Leghrib et al., 2011).
Entre los métodos de síntesis de nanopartículas de rodio descritos en la literatura, el método que consiste en la reducción de una sal metálica RhCl3 3H2O, es el más frecuentemente utilizado en presencia de surfactantes, iones, ligantes o polímeros como agentes estabilizantes (Fonseca et al., 2003; Papp et al., 2004). El agente reductor varía según el método empleado. Otros métodos como la vaporización metálica, la sonoquímica, o la descomposición térmica también se han descrito en la literatura pero de manera escasa. La síntesis de nanopartículas de rodio por el método de vaporización metálica reportada por Devenish se lleva a cabo mediante la condensación de vapores metálicos de rodio en un solvente orgánico conteniendo un polímero como agente dispersante. El tamaño de las partículas obtenidas se encuentra entre 1 y 3 nm (Devenish et al., 1996).
La metodología de síntesis por ultrasonido en medio acuoso, por otra parte, puede igualmente conducir a la obtención de partículas metálicas de diferentes metales (Okitsu et al., 1996). El principio de la técnica es la reducción de sales metálicas por radicales producidos en el medio por la influencia del ultrasonido. En este trabajo se menciona que es necesario adicionar un agente reductor, el metanoato de sodio, para sintetizar partículas de Rh a partir de RhCl3 3H2O por este método. En este caso, el agente estabilizante es un surfactante o un polímero. Otros trabajos reportados han permitido la obtención de partículas de rodio por reducción electroquímica del precursor RhCl3 3H2O en solución de acetonitrilo y en presencia de una sal cuaternaria de amonio R4N Br como estabilizante (Reetz et al., 1995).
Por otro lado, la obtención de soluciones coloidales de Rh por reducción alcohólica de la sal RhCl3 3H2O en reflujo en una mezcla de agua/metanol y en presencia de alcohol de polivinilo (APV) como agente dispersante ha sido también reportada. La reducción de Rh(III) a Rh(0) está acompañada por la oxidación del metanol a formaldehído. Así, se forman partículas de 7 nm de tamaño promedio. La solución coloidal obtenida es eficaz para la hidrogenación de ciclohexeno. Este método por reducción alcohólica es muy efectivo; por esta razón, ha inspirado a numerosos autores a emplear este método con ciertas variantes. Recientemente, la obtención de nanopartículas de Rh de 2 nm de diámetro estabilizadas por polivinilpirrolidona (PVP) se han obtenido en condiciones de alta presión y temperatura (Masafumi et al., 2005). La PVP se ha empleado como estabilizante para la obtención de soluciones coloidales de Rh (con tamaños de partícula de aproximadamente 6 nm a partir de RhCl3 3H2O en una mezcla de agua/etanol (Hashimoto et al., 1998). Otros autores reportaron tamaños de partícula menores (1-3.5 nm) empleando diferentes polímeros (polióxido de etileno; polietilénimina; PVP y poli(2-etil-2-oxazolina)) como agentes estabilizantes por el mismo método de reducción alcohólica (Busser et al., 1999).
Estos trabajos han mostrado la influencia del polímero y en particular la fuerza de la interacción del polímero con los iones rodio, en el tamaño de las partículas. La PVP y la poli(2-etil-2-oxazolina) mostraron ser los mejores polímeros desde el punto de vista del control de tamaño de las nanopartículas obtenidas. Otros autores obtuvieron soluciones coloidales de Rh homogéneas (tamaño de partícula entre 1 y 2 nm) por descomposición térmica de RhCl3 3H2O en solución acuosa de NaOH a 160¿C en etilenglicol. La particularidad de esta síntesis reside en la estabilidad de las soluciones coloidales obtenidas a pesar de que no se agregó ningún agente estabilizante al medio de reacción (Wang et al., 2000).
Otro ejemplo de la obtención de partículas de Rh a partir de la sal RhCl3·3H2O fue reportado por Liu y colaboradores (Tu et al., 2000). La sal se disolvió en una mezcla agua/metanol en presencia de NaOH empleando PVP como agente estabilizante. El medio expuesto a irradiación de microondas favorece un calentamiento rápido y homogéneo.
Otros autores han reportado la utilización de partículas de Rh sintetizadas por reducción alcohólica según el método de Hirai para aplicaciones en catálisis homogénea o heterogénea en soportes tales como γ-Al2O3, SiO2 y TiO2 (Huang et al., 2002; Ma et al., 2003) para reacciones de hidrogenación de olefinas (Borsla et al., 2001) y piruvato de etilo (Huang et al., 2001). Una propuesta interesante acerca de la síntesis de coloides de elementos de transición es mediante la adición lenta de soluciones de las sales metálicas sobre silanos como el (EtO)3SiH y Me2(EtO)SiH (Lewis et al., 1989). La reacción genera H2 que puede afectar la estabilidad de los coloides de Rh y conducir a la formación de rodio metálico. Este inconveniente se ha resuelto adicionando al medio de reacción un aceptor de H2 como el ciclohexeno que se reduce en ciclohexano.
Otra alternativa de síntesis es la hidrogenación de compuestos aromáticos mediante la obtención de soluciones coloidales de rodio en medio bifásico a partir de RhCl3·3H2O reducido bajo atmósfera de H2 y en presencia de trioctilamina como agente de transferencia de fase (Fache et al., 1995; Nasar et al., 1994). El empleo de hidrógeno como agente reductor de RhCl3·3H2O ha sido empleado por otros autores (Yu et al., 1998; Yonezawa et al., 1996). Las nanopartículas de Rh obtenidas fueron estabilizadas por el APV y diferentes aminas terciarias (tri-n-pentilamina, tri-n-octilamina, tri-n-decilamina y tri-n-dodecilamina). Otros sistemas de nanopartículas de Rh empleando como agente reductor H2 se han obtenido en el líquido iónico hexafluorofosfato de 1-butil-3-metilimidazolio a 75¿C y 4 bar de presión de H2 (Díaz-Auñon et al., 2001). Se ha descrito en la literatura especializada, la síntesis de nanopartículas de Rh de tamaño entre 3 y 5 nm obtenidas por reducción de RhCl3·3H2O en atmósfera de H2 o por hidracina en medio bifásico en presencia de surfactantes o de polímeros (Boutonnet et al., 1982). Aunado a lo anterior, coloides de Rh de un tamaño aproximado de 2 nm, obtenidos por reducción de RhCl3·3H2O en tetrahidrofurano (THF) en atmósfera de H2 en presencia de una amina terciaria, [N(C8H17)3]. El agente estabilizante empleado es una sal cuaternaria de amonio formada durante la reducción del precursor a partir de la amina y del HCl liberado (Bönnemann et al., 1996; Bönnemann et al., 1992).
Trabajos más recientes describen la dispersión de RhCl3·3H2O en una microemulsión supercrítica de agua en CO2 en presencia de una mezcla de surfactantes que después de la exposición en atmósfera de H2 conducen a la obtención de nanopartículas de Rh dispersas en la fase de CO2. Estas partículas son activas para la reacción de hidrogenación de sustratos aromáticos en el CO2 supercrítico (Ohde et al., 2002).
El empleo del precursor Rh(OAc)2 también se ha reportado para llevar a cabo la síntesis de nanopartículas de Rh por reducción en medio acuoso de la sal correspondiente bajo la acción de hidracina o de trietilborohidruro de litio (Antonietti et al., 1996). El crecimiento de las nanopartículas y su posterior estabilización se aseguró por la presencia de copolímeros en solución de tolueno. Se han reportado (Larpent et al., 1988) resultados interesantes acerca de la hidrogenación de substratos olefínicos en medio bifásico obtenidos a partir de un medio de reacción constituido por RhCl3·3H2O disuelto en agua en presencia de trifenilfosfina trisulfonato de sodio (TPPTS) y sometido a 1 bar de H2 a 25¿C. Ambos medios contenían partículas de Rh, responsables de la actividad catalítica observada. Más tarde, estos autores emplearon ligantes alquílicos trisulfonados (R-C(pC6H4SO3Na)3) conteniendo sustituyentes polares y no polares muy solubles en agua para la estabilización de coloides de Rh destinados a reacciones de hidrogenación de alquenos a temperatura ambiente y presión atmosférica (Larpent et al., 1991). También se han obtenido coloides de Rh por reducción en medio acuoso de RhCl3·3H2O por borohidruro de sodio (NaBH4) y estabilizados por el APV, que se emplearon como catalizadores para la reacción de hidrogenación de 1-octeno obteniéndose exitosos resultados (Larpent et al., 1992; Larpent et al., 1997).
Otros autores tienen el reconocimiento de la síntesis de coloides de Rh en medio acuoso de aplicación en catálisis bifásica. Este método de síntesis está basado en la reducción de la sal RhCl3·3H2O en agua bajo la acción del NaBH4. Los estabilizantes empleados son surfactantes de cadena larga de sales de hidroxietilamonio de fórmula [N+(CH) (CH CH HO)((CH) CH)]X donde n = 11 a 17 y X = Cl–; Br-; I–; CH SO – y BF –), que son solubles en agua y forman micelas (Schulz et al., 1999; Schulz et al., 2002; Roucoux et al., 2003; Hubert et al., 2009; Guyonnet et al., 2011). El tamaño de las partículas obtenidas es del orden de 3.5 nm (Larpent et al., 1992; Schulz et al., 2000). Las soluciones coloidales preparadas se activan en la reacción de hidrogenación de benceno y sus derivados, tales como el fenol, anisol, etilbenceno, anilina, entre otros. Adicionalmente, las partículas coloidales pueden ser reutilizadas varias veces sin pérdida de actividad (Schulz et al., 2002; Roucoux et al., 2003; Mévellec et al., 2004).
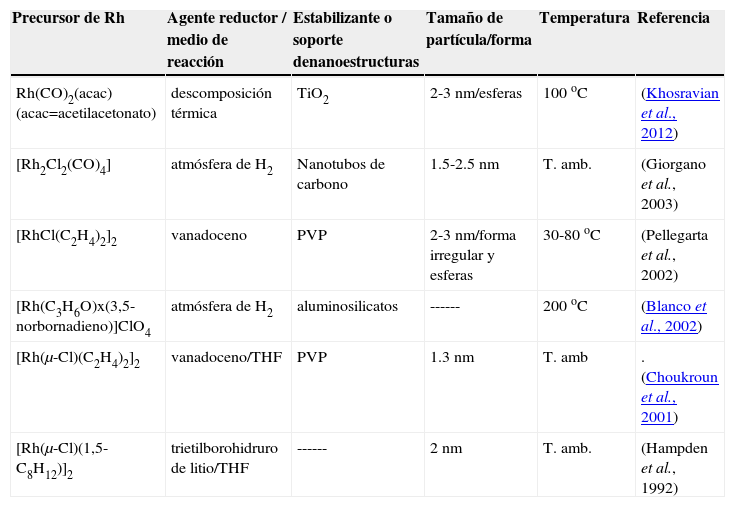
En la literatura existen pocos estudios de la síntesis de nanopartículas de Rh a partir de precursores organometálicos (tabla 1). Se muestran algunos ejemplos en la tabla 1.
Condiciones de síntesis de algunos sistemas de nanopartículas de rodio obtenidas a partir de precursores organometálicos
| Precursor de Rh | Agente reductor / medio de reacción | Estabilizante o soporte denanoestructuras | Tamaño de partícula/forma | Temperatura | Referencia |
|---|---|---|---|---|---|
| Rh(CO)2(acac) (acac=acetilacetonato) | descomposición térmica | TiO2 | 2-3 nm/esferas | 100 oC | (Khosravian et al., 2012) |
| [Rh2Cl2(CO)4] | atmósfera de H2 | Nanotubos de carbono | 1.5-2.5 nm | T. amb. | (Giorgano et al., 2003) |
| [RhCl(C2H4)2]2 | vanadoceno | PVP | 2-3 nm/forma irregular y esferas | 30-80 oC | (Pellegarta et al., 2002) |
| [Rh(C3H6O)x(3,5-norbornadieno)]ClO4 | atmósfera de H2 | aluminosilicatos | ------ | 200 oC | (Blanco et al., 2002) |
| [Rh(μ-Cl)(C2H4)2]2 | vanadoceno/THF | PVP | 1.3 nm | T. amb | .(Choukroun et al., 2001) |
| [Rh(μ-Cl)(1,5-C8H12)]2 | trietilborohidruro de litio/THF | ------ | 2 nm | T. amb. | (Hampden et al., 1992) |
Trabajos precedentes en el grupo de Chaudret y colaboradores consistieron en obtener partículas de Rh por reducción en atmósfera de H2 en medio orgánico a partir de (acetilacetonato)(1,5-ciclooctadieno) de rodio (I), [Rh(acac)(1,5-C8H12)]. Este complejo es de interés debido a que el acetilacetonato coordinado al metal se cree participa en la estabilización de las partículas, hecho observado previamente en sistemas de rutenio (Pelzer et al., 2003).
Con estos resultados en mente, la propuesta de este trabajo es estudiar el efecto de la presencia del acetilacetonato en la reproducibilidad de la síntesis de nanopartículas de rodio. Si el acetilacetonato se descompone en una atmosfera reductora en acetilacetona o en 2,4-pentanodiol, estos compuestos pueden modificar la organización del medio de reacción y/o actuar como estabilizantes. En el caso de Ru, por ejemplo, el único producto formado a partir de la descomposición del precursor Ru(1,5-C8H12)(1,3,5-C8H10) es el ciclooctano, que no puede coordinarse en la superficie de las partículas. Algunas pruebas llevadas a cabo adicionando ciclooctano en el medio de reacción evidenciaron la influencia de este alcano en la organización del medio. Se encontró que existe la formación de nano-gotas de ciclooctano que constituyen “nano-reactores” dentro de los cuales se forman las partículas de rutenio (Pelzer et al., 2003). El tamaño de los “nano-reactores” varía con la cantidad de ciclooctano en el medio y por lo tanto el tamaño de las nanopartículas. Este fenómeno es similar al del crecimiento de partículas en medio micelar (Lisiecki et al., 2003). En el caso de nanopartículas de rodio, no existe evidencia concluyente en este sentido. Estudios previos no permitieron la diferenciación entre acetilacetona y 2,4-pentanodiol, mediante cromatografía de gases.
Por lo tanto, en este trabajo se incluyen los resultados obtenidos del estudio de la influencia de la acetilacetona, del 2,4-pentanodiol y del ciclooctano en la estabilización, la forma y la dispersión de las nanopartículas de Rh obtenidas a partir del complejo [Rh(acac) (1,5-C8H12)]. De igual manera, se efectuaron experimentos con algunos agentes estabilizantes clásicos.
La microscopia electrónica de transmisión (MET) constituyó la técnica principal de caracterización para dar seguimiento a la formación de las partículas de Rh en función de las condiciones de reacción.
Metodología experimentalSíntesis del precursor [Rh(acac)(1,5-C8H12)]La síntesis de [Rh(acac)(1,5-C8H12)] ocurre a partir del dímero di-cloro-bis(η4-1,5-ciclooctadieno di-rodio) (Beckhaus, 2000). Este dímero se obtiene a partir de RhCl3·3H2O, según Duward (1979). [Rh(acac)(1,5-C8H12)] se obtiene entonces de una mezcla del dímero, acetilacetona en medio básico y en atmosfera inerte.
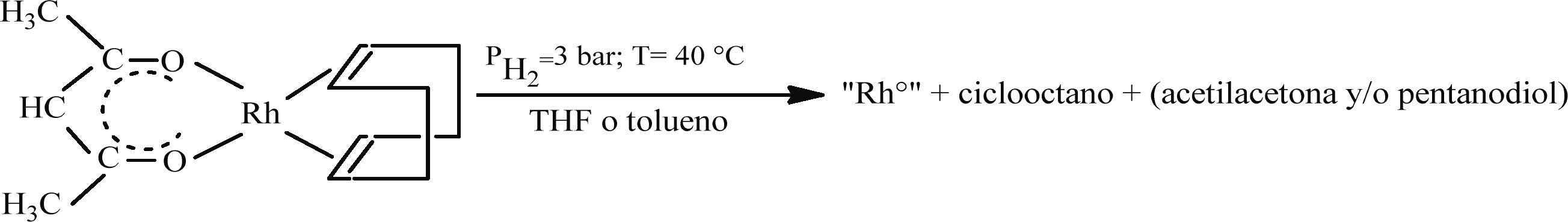
Síntesis de nanopartículas de RhSíntesis de nanopartículas de Rh sin la adición de estabilizantesLas nanopartículas de Rh se obtienen por descomposición de [Rh(acac)(1,5-C8H12)] en medio orgánico (Figura 1) en un reactor Fisher-Porter con atmósfera de H2 (3 bar) según la reacción de la figura 1.
El tiempo de reacción depende del disolvente orgánico empleado: 20 h en el caso de THF (EURISO-TOP, 99.5%) y 60 h si se emplea tolueno (SDS, 99.3%). Ambos disolventes fueron destilados previamente en atmosfera de N2 y desgasificados por congelación en N2 líquido y ciclos de vacío y argón.
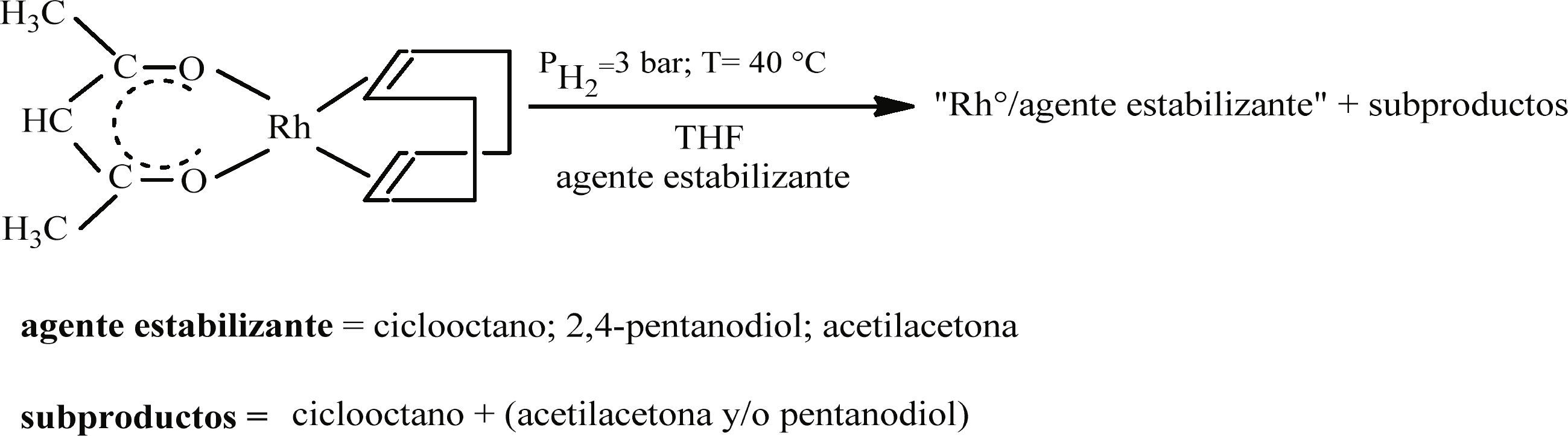
Síntesis de nanopartículas de Rh con la adición de ciclooctano, 2,4-pentanodiol y acetilacetonaLas mismas condiciones de reacción se emplearon en síntesis en las que además se adicionaron diferentes compuestos como estabilizantes. Estos fueron: ciclooctano (Aldrich, 99%), 2,4-pentanodiol (Aldrich, 98%) o acetilacetona (Aldrich, 99%) en cantidades de 2 y 20 equivalentes respecto a la cantidad de rodio contenido en el precursor y se introdujeron en el medio de reacción antes de la etapa de descomposición (figura 2).
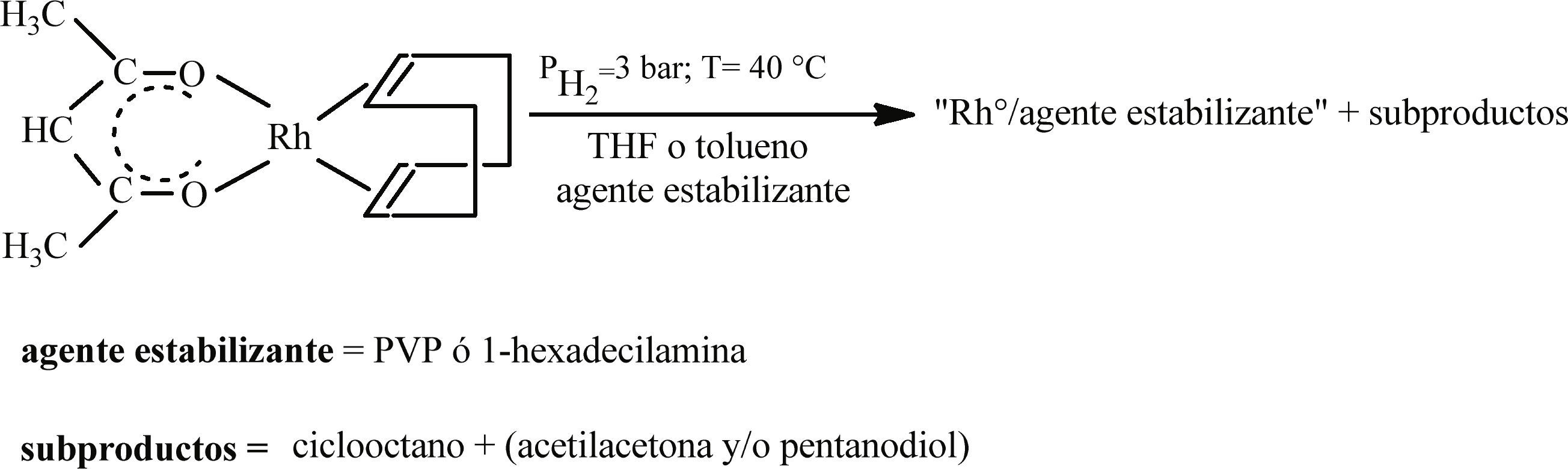
Síntesis de nanopartículas de Rh con la adición de estabilizantes “clásicos”Los experimentos en presencia de estabilizantes clásicos se llevaron a cabo en las mismas condiciones establecidas en las dos secciones anteriores. PVP (Aldrich, K30-PVP) se empleó en una relación en peso metal/ PVP de 4% mientras que se introdujeron 2 y 20 equivalentes de HDA (1-hexadecilamina, Fluka, 99%) respecto a la cantidad de Rh (figura 3).
Caracterización por MET de los sistemas coloidales obtenidosEl análisis por MET se llevó a cabo en un microscopio JEOL JEM 200 CX con resolución de 4.5 Å operando a 200 kV. Después de cada síntesis, dos gotas de la solución coloidal obtenida se depositaron sobre una rejilla de Cu recubierta con carbono. Posterior a la evaporación del disolvente, se llevó a cabo el análisis por MET.
Resultados y discusiónEfecto del disolvente en la formación de las nanopartículas de RhLas primeras síntesis para la obtención de nanoestructuras de Rh empleando como medio THF y tolueno se llevaron a cabo sin la adición de algún estabilizante. Esto, primero, con el objetivo de comparar la influencia de un disolvente coordinante, el THF y uno nocoordinante como el tolueno. Los resultados de estos experimentos mostraron que el tipo de disolvente tiene una influencia en el tiempo de la reacción de descomposición del precursor. Se observó, que la descomposición del precursor en presencia de un disolvente no-coordinante, tolueno, se lleva a cabo más lentamente (60 h), que en presencia de un disolvente coordinante, THF (20 h).
Las soluciones coloidales obtenidas en THF permanecieron homogéneas durante más tiempo (3 días) que las obtenidas en tolueno (1 día). Esta evidencia demuestra que el tolueno no participa eficazmente en la estabilización de las nanoestructuras. Experimentos posteriores se llevaron a cabo exclusivamente en medio de THF.
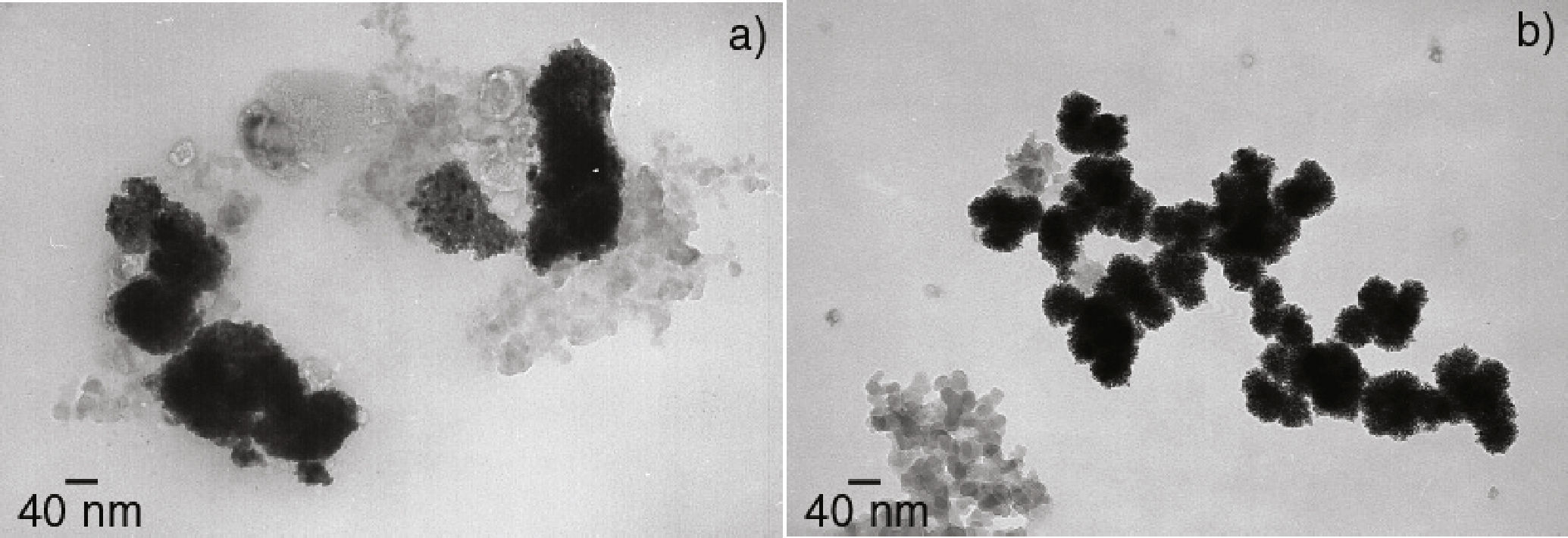
Las síntesis en THF bajo las condiciones de reacción antes citadas arrojaron resultados no reproducibles con una amplia variación en el tamaño de partícula. Por ejemplo, en la figura 4a se presenta una de las micrografías de MET obtenidas, en donde se observan partículas de gran tamaño (entre 85 y 95 nm). En contraste, en la figura 4b se presentan los resultados obtenidos de otra síntesis efectuada en las mismas condiciones. En este último caso, se observan partículas muy homogéneas en tamaño, 40 nm de diámetro promedio.
En los dos casos, las partículas presentaron una morfología semiesférica de apariencia esponjosa en su superficie y una mala dispersión entre ellas. Este aspecto esponjoso de las partículas puede atribuirse a una estabilización poco eficaz que favorece la formación de agregados de cristales. Este fenómeno se ha observado en el caso de rutenio, paladio (Ramirez et al., 2004) y recientemente en nanoestructuras también de rodio obtenidas por una metodología diferente a partir de RhCl3 (Gacem et al., 2013). En este último, se sugiere que la formación de este tipo de estructuras se lleva a cabo en dos etapas, la primera en la reducción rápida de Rh3+ con la adición de NaBH4 y la segunda, durante el ensamblaje de los átomos de Rh en organizaciones esféricas. En el caso particular de nuestro sistema, no se tiene la adición de NaBH4, sin embargo, también se sugiere que la formación de este tipo de organizaciones esféricas obtenidas se lleve a cabo en dos etapas: i) liberación rápida de los átomos de Rh de su esfera de coordinación gracias a la acción del H2 en la reacción y ii) ensamblaje de los átomos de Rh en organizaciones esféricas por la acción coordinante del disolvente, THF.
Efecto del ciclooctanoLos experimentos efectuados en presencia de 2 equivalentes de ciclooctano condujeron a la obtención de un sistema polidisperso de entre 140 y 230 nm (figura 5). Estas partículas son mucho más grandes que las preparadas en el THF puro. La forma de las partículas es igualmente esférica; sin embargo, su apariencia es menos esponjosa y su aspecto es denso.
En el caso de la adición de 20 equivalentes de ciclooctano al medio de reacción, se obtuvieron dos poblaciones de partículas diferentes en tamaño. Por un lado, se observaron partículas grandes de 87 nm de diámetro promedio (figura 6a) y pequeñas de 17 nm (figura 6b). Para cada organización de partículas, la dispersión en tamaño es relativamente homogénea. La presencia de un gran exceso de ciclooctano parece inducir una heterogeneidad del medio de reacción en donde “nano-reactores” de dos diferentes tamaños deben haberse formado, provocando el crecimiento de partículas correspondiente a estos dos tamaños. En lo que respecta a las partículas más pequeñas, estas no presentan una apariencia esponjosa, contrariamente a las más grandes, aunque son mucho menos esponjosas que las obtenidas en THF puro sin la adición de ciclooctano. Este aspecto denso y de forma esférica de las estructuras de Rh formadas, podría confirmar que la presencia de ciclooctano induce la formación de “nanoreactores” (forma esférica).
Micrografías MET de los sistemas de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de 20 eq. de ciclooctano que muestran las 2 organizaciones diferentes de partículas observadas, organización de partículas de diferentes diámetros promedio: a) 90 nm y b) 20 nm.
La adición de 2 y 20 equivalentes de acetilacetona en el medio de reacción genera partículas con una distribución de tamaños más amplia de 40 a 140 nm y de 80 a 150 nm, respectivamente (figura 7). En ambos casos, las partículas son polidispersas y de gran tamaño; sin embargo, se mantienen aisladas unas de otras, no se observan partículas aglomeradas. La morfología está bien definida; son menos densas que las obtenidas en presencia de ciclooctano pero menos esponjosas que las preparadas en THF puro. La acetilacetona en el medio de reacción (20 eq.), tiene un efecto notorio en la formación de partículas más pequeñas. Los grupos cetona estabilizan parcialmente las partículas de Rh, ya que permiten su crecimiento incluso en presencia de un exceso de acetilacetona en el medio. No obstante, la forma esférica de las partículas obtenidas confirma que aunque la estabilización es parcial, la acetilacetona si contribuye a mantener aisladas las partículas evitando su aglomeración.
Efecto del 2,4-pentanodiolEl 2,4-pentanodiol posee dos grupos hidroxilos, los cuales podrían asistir en la estabilización de las partículas, actuando como un ligante de manera comparable a los alcoholes, que algunas veces intervienen como estabilizantes de partículas (Pelzer et al., 2003).
Las partículas obtenidas en estas condiciones no están bien dispersas, se encuentran aglomeradas (figura 8). La adición de 2 eq. de 2,4-pentanodiol favorece la formación de pequeñas partículas formando organizaciones esféricas de apariencia esponjosa de entre 40 y 50 nm de tamaño promedio presentando aglomeración (figura 8a). En el caso de 20 eq. (figura 8b) se observa la formación de entidades fuertemente aglomeradas en donde la forma no está bien definida. Son aglomerados de pequeñas partículas en donde el tamaño individual es difícil de estimar.
Con la adición de 2,4-pentanodiol, no se observó ningún control sobre la estabilización de las partículas. Una cantidad más grande de 2,4-pentanodiol parece favorecer la formación de entidades más pequeñas y que tienden a estar mejor dispersas; sin embargo, a pesar de eso no presentan una buena estabilización. La mala dispersión de especies formadas sugiere una modificación de la organización del medio de reacción bajo el efecto de la introducción del 2,4-pentanodiol. La adición de 2,4-pentanodiol parece alterar la formación de “nano-reactores” en el medio de reacción.
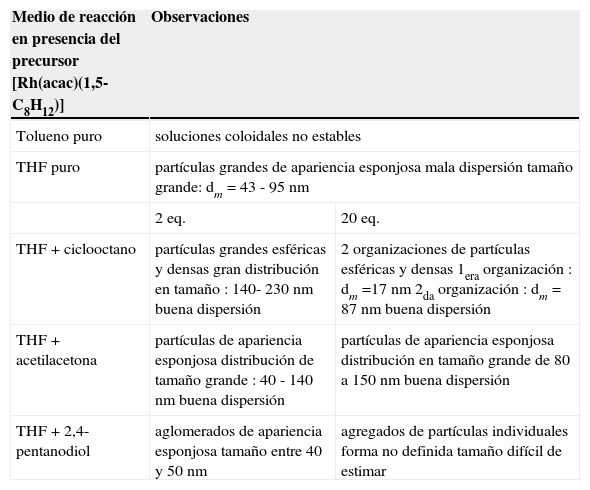
Un resumen de la evidencia experimental discutida hasta el momento se concentra en la tabla 2.
Resumen de los resultados obtenidos en la síntesis de nanoestructuras de Rh
| Medio de reacción en presencia del precursor [Rh(acac)(1,5-C8H12)] | Observaciones | |
|---|---|---|
| Tolueno puro | soluciones coloidales no estables | |
| THF puro | partículas grandes de apariencia esponjosa mala dispersión tamaño grande: dm = 43 - 95 nm | |
| 2 eq. | 20 eq. | |
| THF + ciclooctano | partículas grandes esféricas y densas gran distribución en tamaño : 140- 230 nm buena dispersión | 2 organizaciones de partículas esféricas y densas 1era organización : dm =17 nm 2da organización : dm = 87 nm buena dispersión |
| THF + acetilacetona | partículas de apariencia esponjosa distribución de tamaño grande : 40 - 140 nm buena dispersión | partículas de apariencia esponjosa distribución en tamaño grande de 80 a 150 nm buena dispersión |
| THF + 2,4-pentanodiol | aglomerados de apariencia esponjosa tamaño entre 40 y 50 nm | agregados de partículas individuales forma no definida tamaño difícil de estimar |
Los resultados obtenidos sugieren que con la adición de ciclooctano, acetilacetona y 2,4-pentanodiol en el medio de reacción no existe un control satisfactorio del tamaño de las partículas. A partir de las micrografías obtenidas por MET, la presencia de ciclooctano y de acetilacetona parece permitir una mejor dispersión de partículas en el THF puro.
Adición de un estabilizante clásicoEstabilización de nanopartículas de Rh en presencia de PVPEn la literatura se reportan buenos resultados obtenidos por el empleo de polímeros para la estabilización de partículas metálicas gracias a los efectos estéricos que se generan y a la influencia que tienen sobre el control del tamaño de las partículas limitando su crecimiento durante su formación (Papp et al., 2004; Gacem et al., 2013).
La descomposición del precursor [Rh(acac)(1,5-C8H12)] se llevó a cabo en THF en presencia de la PVP (relación en peso Rh/PVP= 4%). El tiempo de reacción necesario para una descomposición total en atmosfera de H2 fue 78 h (verificación por cromatografía en una columna de silicio). La solución final obtenida presentó una coloración marrón claro y una consistencia viscosa que resultó difícil de purificar.
Los análisis en MET revelan zonas donde las partículas se encuentran aglomeradas (figura 9a) y zonas que presentan buena dispersión en la matriz polimérica (figura 9b) y de tamaño homogéneo con diámetro promedio de 14.7 nm evaluado a partir de un conjunto de 237 partículas.
Utilizando la PVP como estabilizante, se observó una marcada disminución en el tamaño de las partículas. El sistema [Rh(acac)(1,5-C8H12)]/PVP generó mejores resultados en comparación con los sistemas precedentes. El tamaño aproximado de las partículas fue 15 nm, sin embargo, la muestra no es homogénea en cuanto a la dispersión de las partículas en la matriz polimérica.
Estudios anteriores con el empleo de la PVP en la estabilización de partículas de Rh obtenidas a partir de RhCl3 mostraron una fuerte interacción entre la superficie de las nanopartículas de Rh y el grupo carbonilo en la PVP (Gacem et al., 2013). La PVP es una molécula anfifílica con grupos amino en los anillos de la pirrolidona como grupos hidrofílicos y las cadenas de hidrocarburos como grupos hidrofóbicos. Por lo tanto, existen muchos tipos de interacción en las soluciones coloidales de nanopartículas de Rh, tales como la interacción de las moléculas del disolvente con los grupos hidrofóbicos e hidrofílicos de la PVP, así como la interacción hidrofóbica entre las cadenas de hidrocarbonos de las moléculas de la PVP.
Estabilización de nanopartículas de Rh en presencia de HDAEl ligante seleccionado como agente estabilizante fue la HDA, una alquil amina de cadena larga (16 átomos de carbono) que se esperaba permitiera mantener aisladas a las partículas unas de otras. Además, el grupo funcional amina, generalmente se considera débil en la superficie de las partículas, este no debería modificar demasiado las propiedades de superficie de las partículas como fue observado para el caso de nanopartículas de níquel estabilizadas con HDA, que exhibieron propiedades magnéticas sin que la presencia de la amina las afectara (Cordente et al., 2001).
Los experimentos efectuados en presencia de 2 equivalentes de esta amina no permitieron la estabilización de las partículas, solo se observaron aglomerados de partículas. La presencia de 20 equivalentes de HDA pareció mejorar la estabilización; sin embargo, las partículas continuaron aglomeradas. El tamaño promedio de estas partículas fue entre 40 y 50 nm (figura 10).
Una síntesis con las mismas condiciones pero llevada a cabo en tolueno en presencia de 2 equivalentes de HDA condujo a la obtención de partículas aglomeradas, organizadas en forma de superestructuras parecidas a dendritas (figura 11a). En presencia de 20 equivalentes de HDA, se obtuvieron partículas con una aglomeración más importante y sin una organización particular (figura 11b).
Estos resultados indican que la amina tiene un efecto que varía en función del disolvente, lo que sugiere una organización diferente de la amina según el disolvente. En particular, las superestructuras observadas en presencia de 2 eq. de HDA, empleando tolueno como disolvente, sugieren una segregación del medio.
ConclusionesLa obtención de nanopartículas de Rh obtenidas a partir del precursor Rh(acac)(1,5-C8H12) en medio orgánico y sin la adición de estabilizantes resulta ser no reproducible debido a la complejidad del medio durante la descomposición del precursor. Se cree que esta complejidad se genera por la presencia del acetilacetonato y del 2,4-pentanodiol, ambos formados a partir de la acetilacetona, y el ciclooctano, formado a partir del ciclooctadieno por acción del H2, lo cual provoca una solución tipo emulsión, en la que gotas suspendidas de ciclooctano de diferentes tamaños parecen actuar como pequeños reactores en el seno de los cuales se forman las nanopartículas.
El hecho de adicionar estos compuestos (acetilacetona y/o 2,4-pentanodiol y ciclooctano) al medio de reacción para conocer sus efectos, indicó cambios en el tamaño, dispersión y apariencia de las partículas obtenidas. La adición del ciclooctano y de la acetilacetona generó partículas de mayor tamaño y una mejor dispersión. La apariencia de las partículas fue más densa comparada con las partículas obtenidas en THF puro. El principal efecto de la adición de acetilacetona fue la obtención de partículas con buena dispersión, sin embargo, de gran tamaño (40 a 140 nm y de 80 a 150 nm). Esto sugiere que el aumento en la concentración, tanto del ciclooctano como de la acetilacetona, hace crecer los pequeños reactores en el seno del medio de reacción y este confinamiento dentro del cual crecen las partículas, parece también favorecer la apariencia compacta y densa de las partículas obtenidas. Por otra parte, la adición de 2,4-pentanodiol parece alterar la formación de los “nano-reactores” en el medio de reacción y favorecer el aspecto esponjoso de las partículas, así como su aglomeración.
En una segunda etapa, empleando estabilizantes clásicos, la presencia de la PVP dio origen a nanopartículas monodispersas de 15 nm. Se observaron además fuertes aglomerados de nanopartículas aunque en un menor porcentaje. Estudios posteriores con otro tipo de polímeros podrían conducir a la homogenización del sistema. Por otra parte, la presencia de HDA en el sistema, empleando como medio de reacción THF, generó partículas con una marcada aglomeración y en presencia de exceso de HDA se obtuvieron partículas de entre 50 y 60 nm de apariencia esponjosa. A utilizar tolueno como medio de reacción se observaron aglomerados en forma de superestructuras parecidas a dendritas. Esto último mostró nuevamente que el THF asiste la estabilización de las nanoestructuras de manera mucho más eficaz que el tolueno. Actualmente se realizan estudios para la obtención de nanopartículas con precursores de rodio alternativos, tales como el Rh(η3-C3H5)3 y [Rh(μ-Cl)(1,5-C8H12)]2 para evitar medios complejos generados por la presencia de ligantes contenidos en el precursor. El objetivo final de estos experimentos es la obtención de nanopartículas de Rh monodispersas para su aplicación en electrocatálisis.
AgradecimientosLos autores agradecen a los técnicos V. Collière y L. Datas de la Universidad Paul Sabatier por los análisis MET, al CONACyT por la beca de doctorado de Esther Ramírez-Meneses, al Laboratorio de Química de Coordinación de Toulouse.
Este artículo se cita:
Citación estilo Chicago
Ramírez-Meneses, Esther, Karine Philippot, Bruno Chaudret. Influencia del medio de reacción en la estabilización de nanoestructuras de Rodio. Ingeniería Investigación y Tecnología, XVI, 02 (2015): 225-237.
Citación estilo ISO 690
Ramírez-Meneses E., Philippot- K., Chaudret- B. Influencia del medio de reacción en la estabilización de nanoestructuras de Rodio. Ingeniería Investigación y Tecnología, volumen XVI (número 2), abril-junio 2015: 225-237.
Semblanzas de los autores
Esther Ramírez-Meneses. Ingeniero químico industrial por la Escuela Superior de Ingeniería Química e Industrias Extractivas, ESIQIE-IPN. Maestría en ingeniería metalúrgica por la ESIQIE-IPN. Doctorado en fisicoquímica de elementos de transición por la Universidad Paul Sabatier, Toulouse III, Francia. Actualmente es profesorinvestigador SNI 1 en el Departamento de Ingeniería y Ciencias Químicas de la Universidad Iberoamericana.
Karine Philippot. Doctora en Química supramolecular con especialidad en síntesis y catálisis por la Universidad Paul Sabatier, Tolouse III, Francia. Actualmente dirige el grupo de Nanoestructuras y química organometálica en el Laboratorio de Química de Coordinación del CNRS en Toulouse, Francia.
Bruno Chaudret. Doctor por el Imperial College de Londres. En la década de los 80 desarrolló un método de síntesis para la obtención de nanopartículas metálicas y de óxidos metálicos a partir de precursores organometálicos. Actualmente es Director del Laboratorio de física y química de nano-objetos en el Instituto Nacional de Ciencias Aplicadas en Toulouse, Francia.








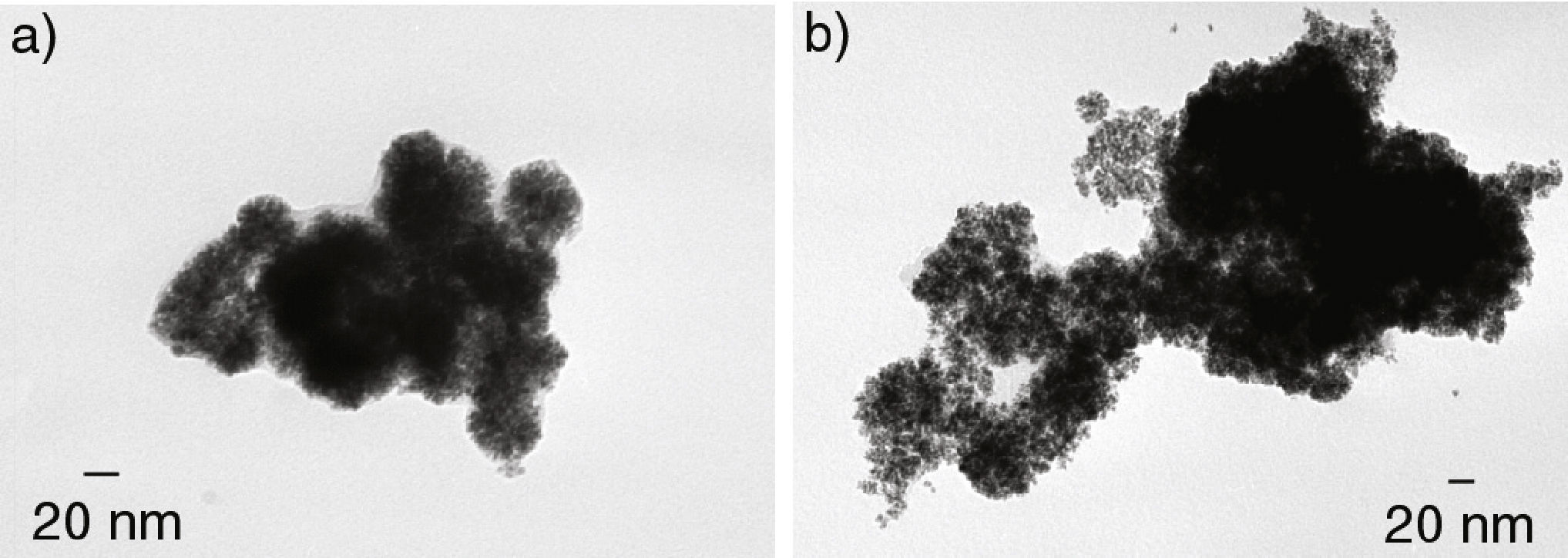





![Micrografias MET de los sistemas de nanoestructuras de Rh obtenidas a partir del precursor [Rh(acac)(1,5- C8H12)] en atmósfera de H2 y en THF. Micrografias MET de los sistemas de nanoestructuras de Rh obtenidas a partir del precursor [Rh(acac)(1,5- C8H12)] en atmósfera de H2 y en THF.](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Micrografía MET del sistema de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac) (1,5-C8H12)] en atmósfera de H2 y en THF en presencia de 2 eq. de ciclooctano. Micrografía MET del sistema de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac) (1,5-C8H12)] en atmósfera de H2 y en THF en presencia de 2 eq. de ciclooctano.](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Micrografías MET de los sistemas de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de 20 eq. de ciclooctano que muestran las 2 organizaciones diferentes de partículas observadas, organización de partículas de diferentes diámetros promedio: a) 90 nm y b) 20 nm. Micrografías MET de los sistemas de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de 20 eq. de ciclooctano que muestran las 2 organizaciones diferentes de partículas observadas, organización de partículas de diferentes diámetros promedio: a) 90 nm y b) 20 nm.](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr6.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![(a-b) Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de 2 y 20 eq. de acetilacetona, respectivamente. (a-b) Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de 2 y 20 eq. de acetilacetona, respectivamente.](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr7.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de: a) 2 eq. y b) 20 eq. de 2,4-pentanodiol, respectivamente. Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de: a) 2 eq. y b) 20 eq. de 2,4-pentanodiol, respectivamente.](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr8.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![(a-b) Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de PVP mostrando las dos zonas de partículas generadas a partir de esta síntesis (relación en peso: Rh/PVP=4%). (a-b) Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de PVP mostrando las dos zonas de partículas generadas a partir de esta síntesis (relación en peso: Rh/PVP=4%).](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr9.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de: a) 2 eq. y b) 20 eq. de HDA. Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en THF en presencia de: a) 2 eq. y b) 20 eq. de HDA.](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr10.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en tolueno en presencia de: a) 2 eq. y b) 20 eq. de HDA. Micrografías MET de nanopartículas de Rh obtenidas a partir del precursor [Rh(acac)(1,5-C8H12)] en atmósfera de H2 y en tolueno en presencia de: a) 2 eq. y b) 20 eq. de HDA.](https://static.elsevier.es/multimedia/14057743/0000001600000002/v1_201505070153/S1405774315000086/v1_201505070153/es/main.assets/thumbnail/gr11.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)