El IV Taller de Inmunoquímica, auspiciado por la Sociedad Española de Inmunología, consistió en la realización de una serie de comparaciones interlaboratorio para evaluar la homogeneidad de los métodos analíticos en Inmunoquímica (IQ). El objetivo de los Talleres de IQ es desarrollar herramientas de control de calidad y guías de trabajo que permitan estandarizar los distintos procedimientos analíticos, empleados en el diagnóstico clínico.
MétodosEn el Taller 2005, en 21 laboratorios se valoraron los parámetros IQ: Inmunoglobulinas IgG, IgA, IgM, total IgE, cadenas ligeras κ y λ, C3, C4, FR, PCR y ASLO en muestras de Controles Comerciales. También se analizaron las paraproteínas en muestras de suero y orina y por vez primera se incorporó el estudio de bandas oligoclonales en líquido cefalorraquídeo y suero homólogo; todos ellos se evaluaron con los métodos habituales de diagnóstico clínico y los resultados se remitieron a los coordinadores del Taller, que presentaron los resultados en el XXXI Congreso de la SEI.
ResultadosEn el estudio de todos los parámetros IQ estandarizados por la IFCC se encontró elevada homogeneidad, lo cual demuestra la utilidad de la normalización por Organismos Internacionales. Los parámetros IFCC muestran la utilidad de la estandarización. Los resultados relativos a parámetros analíticos no estandarizados por la IFCC mostraron una mayor heterogeneidad. El estudio interlaboratorio de las paraproteínas reveló un alto grado de consenso, aunque en los especímenes con una menor incidencia clínica disminuye. En los estudios de las bandas oligoclonales los ocho laboratorios mostraron resultados concordantes.
ConclusionesLos estudios interlaboratorio son útiles para estandarizar los métodos analíticos entre distintos laboratorios. Este estudio demuestra la utilidad de los procedimientos de normalización por Organismos Internacionales y la necesidad de los controles de calidad, evaluación de los suministradores y la elaboración de procedimientos de consenso en los grupos de trabajo.
The IV Immunochemistry Workshop supported by the “Sociedad Española de Inmunología” (SEI), consisted in a series of interlaboratory comparative studies to evaluate the homogeneity of the analytic methods in immunochemistry. The objective was to develop quality control tools to standardise diagnostic analytic procedures.
Methods21 centres have participated in the Workshop. It comprised the quantification of IgG, IgA, IgM, and total IgE κ and λ light chain Immunoglobulin; Complement C3 and C4; Rheumatoid Factor (RF); C-reactive protein (CRP), and Antiestreptolysin O (ASL) in commercial control serum samples. Monoclonal immunoglobulins present in serum and urine samples were also characterized. For the first time, the study of LCR oligoclonal bands in the serum and cerebrospinal fluid was incorporated. The study was performed using the routine methods currently used in each laboratory. The participant laboratories sent the records of the results to the workshop coordinators that proceeded to analyse them. Conclusions were presented at the XXXI Congress of the SEI.
ResultsAnalytical parameters standardised by the International Federation of Clinical Chemistry (IFCC) showed a good homogeneity. Analytical parameters not standardised by IFCC showed higher heterogeneity. The identification of the monoclonal proteins in serum and urine was highly homogeneous. The quantitative results of monoclonal isotypes were more heterogeneous than those of polyclonal immunoglobulins. The results on oligoclonal bands reported in serum and cerebrospinal fluid were homogeneous.
ConclusionsComparative studies are very useful to investigate the homogeneity among different laboratories. These results demonstrate the utility of standarization procedures developed by International Organizations, but also the need of quality controls, the evaluation of suppliers, and the elaboration of consensus working procedures.
El objetivo de los Talleres que se desarrollan por la Sociedad Española de Inmunología (SEI; www.inmunologia.org) es, mediante el intercambio de muestras, poner a disposición de los laboratorios asociados herramientas para el asegurar la calidad de los laboratorios analíticos, como un elemento valioso de comparación, dentro del proceso de estandarización. El IV Taller de Inmunoquímica (IQ), se ha desarrollado en el ámbito del XXXI Congreso de la SEI (Córdoba, 2005).
En el laboratorio diagnóstico, algunos de los problemas más comunes son la disparidad entre especimenes idénticos valorados con distintos procedimientos analíticos y la definición de intervalos de confianza en los diversos biomarcadores, ya que un trabajo inadecuado puede originar errores en la interpretación de los resultados que pueden tener consecuencias en la práctica médica.
En esta línea, la SEI lleva varios años realizando Talleres en las distintas disciplinas de la Inmunología: Histocompatibilidad, Autoinmunidad, Inmunidad Celular e Inmunoquímica. En la misma línea trabajan organismos internacionales: WHO (World Health Organization, www.who.int); FDA, (U.S. Food and Drug Administration, www.fda.gov); AACC (American Association for Clinical Chemistry; www.clinihem.org); CAP (College of American Pathologists, www.cap.org); FOCIS (Federation of Clinical Immunology Societies, www.focisnet.org); AOAC (Association of Official Analytical Chemistry, www.aoac.org) e instituciones internacionales de estandarización y metrología como la ISO (International Organization for Standardization, www.iso.org); EPTIS (European information System on Proficiency Testing Schemes, www eptis.bam.de); IFCC (International Federation of Clinical Chemistry and Laboratory Medicine, www.ifcc.org); NIST (National Institute of Standards and Technology, www.nist.gov); IRMM (Institute for Reference Materials and Measurements, www.irmm.jrc.be); BCR (Community Bureau of Reference, www.rsc.org); CLSI/NCCLS, (Clinical and Laboratory Standards Institute, http://www.techstreet.com/info/clsi.tmpl) así como los organismos nacionales ENAC (Entidad Nacional de Acreditación, www.enac.es) y AENOR (Asociación Española De Normalización y Certificación, www.aenor.es) y las múltiples Sociedades Científicas que colaboran en mantener la excelencia en las áreas de la Inmunología clínica. En todos se aplican los procedimientos del ICRMP, International Conventional Reference Measurement Procedure del International System (SI).
Al objeto de minimizar las diferencias en los procedimientos relativos a determinados parámetros analíticos, la International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) desarrolló un nuevo estándar compartido por los fabricantes de reactivos y material de control de calidad que es aplicable a una serie de 14 parámetros analíticos, en el ámbito de la Inmunoquímica y Bioquímica Clínica (1). En el año 2008, el Institute for Reference Materials and Measurements, (IRMM) certificó un nuevo suero humano, (material de referencia ERM/IFCC-DA470K) que valora 12 proteínas en suero humano(2), semejante a la muestra original de la IFCC.
El grupo de IQ de la SEI comenzó la realización de los Talleres en el año 2002, habiéndose publicado los resultados del III Taller(3), y presentándose comunicaciones del III, IV Taller(4) y V Taller-2006(5) en formato póster, que ayudan a consolidar los objetivos iniciales del grupo. En nuestro anterior trabajo(3) los laboratorios españoles demostraron una elevada homogeneidad en el estudio de los parámetros IQ y de las paraproteínas. A raíz de aquella publicación se planteó abordar el estudio de parámetros IFCC y no IFCC, junto con el análisis de las casas comerciales con las cuales trabajan habitualmente los participantes en el Taller. También quisimos conocer nuestra resolución en el estudio de paraproteínas poco frecuentes, y por vez primera abordamos los requisitos óptimos para el análisis de bandas oligoclonales (BOC) en líquido cefalorraquídeo (LCR), definidos en laboratorios de centros hospitalarios con experiencia demostrada, no desarrollados en anteriores Talleres.
En el Taller 2005, se han cuantificado los siguientes parámetros IQ: Inmunoglobulinas (Igs) IgG, IgA, IgM; factores del complemento C3 y C4, los reactantes séricos de fase aguda factor reumatoide (FR), proteína C reactiva (PCR) y antiestreptolisina O (ASLO), e IgE total en muestras de controles comerciales de referencia (CC). Se buscaron posibles diferencias entre los parámetros estandarizados por la IFCC y aquellos que no lo están. En una segunda prueba, se evaluó la presencia de paraproteínas o componentes monoclonales (CM) en muestras de sueros y orinas. En el tercer ejercicio se analizaron las bandas oligoclonales en muestras pareadas de LCR y suero homólogo. Los laboratorios participantes realizaron todas las determinaciones del Taller 2005 con los métodos analíticos habituales en la práctica clínica.
En las determinaciones cuantitativas se realizó un estudio estadístico de los resultados remitidos por los responsables de los centros participantes, correspondientes a cada una de las muestras y de los parámetros analizados. En todos ellos se evaluó el porcentaje del coeficiente de variación (% CV), medida muy útil para valorar la homogeneidad de los resultados analíticos. En los parámetros con mayor dispersión se aplicó la prueba estadística de Grubbs, que elimina los resultados extremos, y se calculó el % CV estadísticamente modificado(6, 7).
Los coordinadores del IV Taller prepararon y distribuyeron las muestras biológicas correspondientes a los CC, los sueros, las orinas y los LCR, de acuerdo con los ejercicios de intercambio propuestos. Una vez estudiadas las muestras, los laboratorios remitieron sus resultados a los coordinadores del estudio, que tras su análisis estadístico, los presentaron en el XXXI Congreso de la SEI celebrado en Córdoba del 10 al 13 de mayo de 2005. En la presente publicación se describen los resultados de los distintas pruebas interlaboratorios.
MATERIALES Y MÉTODOSLaboratorios participantes y responsables del Taller 2005En los ejercicios participaron 22 laboratorios, actuando cuatro de ellos como coordinadores. Todos los laboratorios recibieron las muestras con los códigos definidos para cada ejercicio y remitieron sus resultados a los coordinadores. La información se devolvió junto con un número de identificación propio del laboratorio, lo que permitió valorar de manera confidencial e individual sus datos, respecto al conjunto de los participantes en los ejercicios.
Listado de responsables y laboratorios participantesSe indican a continuación todos los laboratorios participantes en el Taller 2005, ordenados por el orden alfabético de las Comunidades autónomas de Andalucía, Cantabria, Cataluña, Comunidad de Madrid, Extremadura, Galicia, Islas Baleares, Islas Canarias y Región de Murcia, junto con los nombres, correo electrónico de los profesionales responsables del Taller pertenecientes a sus respectivos centros y servicios hospitalarios.
Andalucía- 1.
Ángel León Lara: aleon@aehh.org
Aurora Jurado Roger: aurora.jurado.sspa@juntadeandalucia.es.
Servicio de Hematología. Hospital del Servicio Andaluz de Salud (SAS). Carretera de Circunvalación s/n.11407. Jerez de la Frontera.
- 2.
Nieves Fernández Arcas: nieves.Fernández.sspa@juntadeandalucia.es
Antonio Alonso Ortiz.
Servicio Inmunología. Hospital "Carlos Haya". Málaga.
Cantabria- 3.
Marcos López Hoyos: inmlhm@humves.
Servicio de Inmunología. Hospital Universitário Marqués de Valdecilla. Santander.
- 4.
Montserrat Alsina Donadeu: malsina@egarlab.com
Hospital Mutua de Terrassa. Terrassa. Barcelona.
- 5.
Cándido Juárez Rubio: cjuarez@hsp.santpau.es
Inmunología. Hospital de Sant Pau. Barcelona.
- 6.
Eva Ma Martínez Cáceres: evammc@ns.hugtip.scs.es
Inmunología. Hospital Universitario Germans Trias i Pujol. Badalona. Barcelona.
- 7.
María José Amengual Guedan: mjamengual@cspt.es UDIAT-CD. Corporació Sanitaria Parc Taulí. Sabadell. Barcelona.
- 8.
María José Rodrigo Anoro: mjrodrigo@vhebron.net
Inmunología. Hospital Vall d'Hebrón. Barcelona
- 9.
Jordi Yagüe: JYAGUE@clinic.ub.es
Servicio de Inmunología. Hospital Clínic. Barcelona.
Comunidad de Madrid- 10.
Luisa Ma Villar Guimerans: lvillar.hrc@salud.madrid.org
Pedro González Porqué: pgonzalez.hrc@salud.madrid.org
Servicio de Inmunología Hospital Ramón y Cajal. Madrid.
- 11.
Pilar Varela Peña: pvarela@h12o.es
Luis Allende Martínez
Inmunología. Hospital 12 de Octubre. Madrid.
- 12.
Julia Sequí Navarro: jsequi.hciii@salud.madrid.org (Inmunología) Ma José Sentchordi Izquierdo y Luis Montesano Sánchez (Bioquímica)
Hospital Carlos III. Madrid.
- 13.
Carmen Jiménez Garófano: mjimgar@oc.mde.es
Inmunología. Hospital Central de la Defensa. Madrid.
- 14.
Cecilia Muñoz Calleja: cmunoz.hlpr@salud.madrid.org
Servicio de Inmunología. Hospital de la Princesa. Madrid.
- 15.
Margarita López Trascasa: mlopeztrascasa.hulp@salud.madrid.org
Servicio de Inmunología. Hospital Universitario "La Paz". Madrid.
- 16.
Juan José Rodríguez Molina: jrodriguezmo.hgugm@salud.madrid.org
Joaquín Navarro Caspistegui: jnavarro.hgugm@salud.madrid.org
Servicio de Inmunología. Hospital General Universitario "Gregorio Marañón". Madrid.
- 17.
Rosa García Delgado: RGarcia@fjd.es
Servicio de Inmunología. Fundación Jiménez Díaz. Madrid.
Extremadura- 18.
Carmen Cámara Hijón
Luis Fernández Pereira: kkk3@hotmail.com
Inmunología (Laboratório de Análisis Clínicos). Hospital San Pedro de Alcántara. Cáceres.
- 19.
Pilar Sanchez Mozo: smozo@canalejo.org
Laboratorio de Inmunología. Complejo Hospitalario Universitario Juan Canalejo. La Coruña.
- 20.
Joana Ferrer Balaguer: jferrer@hsd.es; joanaf@arrakis.es.
Inmunología. Hospital Son Dureta. Palma de Mallorca. Baleares.
- 21.
Inmaculada Alarcón Torres: ialator@gobiernodecanarias.org Servicio
Análisis Clínicos. Hospital de Gran Canaria "Dr. Negrín". Las Palmas Gran Canaria.
- 22.
Rocío Álvarez López: mdrocio.alvarez@carm.es
María Montes Casado: m.montescasado@terra.es
Servicio de Inmunología Hospital Virgen Arrixaca. Murcia.
Juan José Rodríguez Molina. Inmunología. Hospital General Universitario Gregorio Marañón. Madrid.
Julia Sequí Navarro. Inmunología. Hospital Carlos III. Madrid.
Luisa María Villar Guimerans. Inmunología. Hospital Ramón y Cajal. Madrid.
Cándido Juárez Rubio. Inmunología. Hospital de Sant Pau. Barcelona.
Metodología del Taller 2005Se realizaron por los laboratorios participantes tres ejercicios (mencionados en el texto como A, B y C). En la Tabla I se describen todas las muestras estudiadas. En el primer ejercicio (A: A1, A2, A3) se estudió la cuantificación de parámetros básicos en el campo de la IQ, agrupados en tres bloques de analitos. En el ejercicio A1, se cuantificaron en cuatro muestras de suero de Controles Comerciales de Referencia (CCA1) las Igs (IgG, IgA, IgM) y los factores del complemento C3 y C4. En el ejercicio A2, se cuantificaron en tres muestras de suero de Controles Comerciales de Referencia (CCA2) el factor reumatoide (FR), la proteína C reactiva (PCR) y la antiestreptolisina O (ASLO); en el ejercicio A3, se cuantificó la IgE total en tres muestras de suero de Controles Comerciales de Referencia (CCA3).
Descripción de ejercicios, muestras enviadas a los laboratorios y determinaciones realizadas en el IV Taller de Inmunoquímica de la SEI.
| Ejercicio/Parámetros | Tipo de Muestra(*)/ NoIdentificación: Procedencia | Determinaciones realizadas (**) |
| A1. Cuantificación IgG, IgA, IgM, C3, C4 (Parámetros IFCC) | Control comercial (*1)50101: Beckman50102: Vitro50103: Beckman diluido (95%)50104: Dade-Behring | IgG, IgA, IgM, C3, C4 (23) |
| A2. Cuantificación FR, PCR (Parámetros IFCC) y ASLO | Control comercial (*1)50201: Dade-Behring50202: Beckman50203: Vitro | FR (18)PCR (15)ASLO (10) |
| A3. IgE Total (Parámetro OMS)?? | Control comercial (*1)50301: Pharmacia50302: Pharmacia50303: Pharmacia | Cuantificación IgE (20) |
| B1. Estudio de paraproteínas séricas | Suero/Inmunología: Hospital (*2)50401: Carlos III50402: Gregorio Marañón50403: Gregorio Marañón50404: Carlos III50405: Arrixaca | Análisis componente monoclonalIdentificación cualitativa (21)Cuantificación IgG, IgA, IgM (18)Cuantificación CL κ y λ (7) |
| B2. Estudio de Paraproteínas en Orina Proteínas de Bence Jones. | Orina / Inmunología: Hospital (*3)50501: Gregorio Marañón50502: Gregorio Marañón50503: Gregorio Marañón50504: Gregorio Marañón | Análisis componente monoclonalIdentificación cualitativa (20)Líquido cefalorraquídeo y Suero/Inmunología: Hospital (*4)Cuantificación CL κ y λ (8) |
| C. Estudio de Bandas oligoclonales en Líquido cefalorraquídeo. | 50601: Ramón y Cajal50602: Ramón y Cajal50603: Ramón y Cajal | Bandas oligoclonales en LCR (8) y Suero (SLCR) (8) |
El segundo ejercicio (B: B1 y B2) consistió en el estudio de las paraproteínas presentes en cinco muestras de suero (Ejercicio B1) y en el análisis de las Proteínas de Bence Jones (PBJ) en cuatro muestras de orina (Ejercicio B2). En todas ellas se realizó el análisis inmunoelectroforético y la cuantificación de las Igs y/o las cadenas ligeras (CL).
En el Taller 2005 se aborda, por primera vez, la caracterización de Bandas oligoclonales (BOC) en tres muestras de LCR y los sueros homólogos (Ejercicio C).
Muestras de los ejercicios interlaboratorio. Procedencia de las muestrasEn la Tabla I se describe la procedencia y las determinaciones realizadas en todas las muestras valoradas en el Taller 2005. En el análisis de los parámetros IQ, correspondientes a los ejercicios A1, A2 y A3, las muestras procedían de controles comerciales (CC). Dichos controles habían sido estandarizados por las propias compañías a partir de materiales de referencias primarios de parámetros homologados, en su mayoría, por la IFCC (IgG, IgA, IgM, C3, C4, PCR) y parámetros no-IFCC (FR, ASLO, IgE total). Los CC fueron aportados por las compañías IZASA SA, Dade-Behring, VITRO SA y Pharmacia Diagnostic.
El estudio de las paraproteínas séricas (Ejercicio B1), se realizó en cinco muestras de suero obtenidos de las serotecas de los Servicios de Inmunología del Hospital General Universitario Gregorio Marañón (HGUGM), del Hospital Carlos III de Madrid y del Hospital Virgen de la Arrixaca de Murcia. El análisis de las Proteínas de Bence Jones (PBJ) en las muestras de orina (Ejercicio B2), se llevó a cabo en tres especímenes facilitados por el Servicio de Inmunología del HGUGM. La identificación de bandas oligoclonales (BOC, Ejercicio C), se realizó en tres muestras pareadas de LCR y suero procedentes del Servicio de Inmunología del Hospital Ramón y Cajal de Madrid.
Preparación y distribución de las muestrasLas muestras de estudio de los parámetros de IQ (Ejercicios A1, A2, A3) y de las paraproteínas (Ejercicios B1, B2), se procesaron y distribuyeron de forma centralizada desde el Servicio de Inmunología del HGUGM. Se añadió azida sódica (0,1%) a las muestras seleccionadas, que fueron numeradas, alicuotadas y etiquetadas con las referencias de Taller de IQ 2005, ejercicio y número de muestra correspondiente. Los paquetes de alícuotas de los ejercicios A y B se remitieron a los respectivos laboratorios a temperatura ambiente y de forma simultánea. Se enviaron a cada uno de los laboratorios participantes 10 alícuotas de CC, 5 de suero y 4 de orina. Las muestras alicuotadas para la caracterización de bandas oligoclonales en LRC y suero (Ejercicio C), se remitieron congeladas desde el Servicio de Inmunología del Hospital Ramón y Cajal y se identificaron de igual modo que las anteriores (año, ejercicio y número de muestra). Se enviaron de manera simultánea 3 alícuotas de LCR y los 3 sueros de los respectivos pacientes.
Descripción de las muestrasEn la Tabla I se describen todas las muestras enviadas. Las muestras seleccionadas para cuantificar los parámetros IQ (Ejercicio A1): IgG, IgA, IgM, factores del complemento C3 y C4 (parámetros IFCC) consisten en CC secundarios codificados como 50101 (CC-Beckman); 50102 (CC-Vitro); 50103 (corresponde al CC 50101 de Beckman diluido al 95% en Solución Salina) y 50104 (CC- Dade-Behring). El diseño del par de muestras 50101 y 50103 obedecía al interés adicional de establecer un estudio de reproducibilidad intralaboratorio.
Las muestras enviadas para cuantificar los reactantes séricos (Ejercicio A2), PCR (Parámetro IFCC), FR (Parámetro no-IFCC) y ASLO (Parámetro no-IFCC), consisten en CC codificados como 50201 (CC-Dade-Behring); 50202 (CC-Beckman) y 50203 (CC-Vitro). En la cuantificación de los niveles de IgE (Ejercicio A3, Parámetro IFCC), las muestras de los CC se identificaron como 50301, 50302 y 50303, todos ellos cedidos por los laboratorios Pharmacia Diagnostic.
Las cinco muestras de suero (Ejercicio B1), remitidas a los laboratorios para el estudio de paraproteínas séricas han sido codificadas como 50401 (Inmunología. Hospital Carlos III); 50402 (Inmunología. HGUGM); 50403 (Inmunología. HGUGM); 50404 (Inmunología. Hospital Carlos III) y 50405 (Inmunología. Hospital Virgen de la Arrixaca).
Las muestras de orina (Ejercicio B1), fueron codificadas como 50501, 50502, 50503 y 50504; todas ellas procedían del Servicio de Inmunología del HGUGM.
Las muestras para el análisis de bandas oligoclonales en LCR (Ejercicio C), fueron remitidas con los códigos 50601- LCR1, 50602-LCR2 y 50603-LCR3 y los sueros respectivos SLCR1, SLCR2 y SLCR3, todas ellas procedentes del Servicio de Inmunología del Hospital Ramón y Cajal.
Análisis de las muestrasLos responsables de las áreas de IQ de los laboratorios participantes, a la recepción de las alícuotas, procedieron a realizar las determinaciones analíticas, constitutivas del
Taller 2005; según las condiciones establecidas en los procedimientos habituales del diagnóstico clínico (Tablas II, III, IV, V, VI y VII).
Cuantificación de parámetros inmunoquímicos. Descripción de los equipos, casas comerciales, métodos y parámetros estudiados en el Taller IQ 2005 (Ejercicios A1 y A2).
| Método de estudio (Antisueros) | Equipo/Casa Comercial | Parámetros (*) |
| Nefelometría Punto final (Behringwerke) | BNII/Dade Behring | IgG, IgA, IgM (13)C3, C4 (13)FR (10)PCR (8)ASLO (4) |
| Nefelometría Cinética (Beckman Institute) | IMMAGE/Beckman-Coulter | IgG, IgA, IgM (7)C3, C4 (7)FR (6)PCR (5)ASLO (5) |
| Turbidimetría (Sistema) | Modular/Roche | IgG, IgA, IgM (2)C3, C4 (2)FR (2)PCR (2)ASLO (1) |
| Turbidimetría Olimpus DACE | Olimp Turb | IgG, IgA, IgM (1)C3, C4 (1) |
Cuantificación de IgE total. Descripción de los métodos de análisis, equipos empleados y número de laboratorios participantes. Taller IQ 2005 (Ejercicio A3).
| Métodos | Equipo (Casa comercial) | No de laboratorios |
| CAP | AUTOCAP / UNICAP (Pharmacia) | 8 |
| Nefelometría Punto Final | BNII (Dade-Behring) | 8 |
| Enzima Inmunoensayo | Access (Beckman-Coulter) | 1 |
| Turbidimetría | Modular (Roche) | 1 |
| Quimioluminiscencia | Immulite/ Quimio (DPC) | 2 |
Estudio de paraproteínas y proteínas de Bence Jones. Métodos de análisis inmunoelectroforéticos y equipos empleados en el estudio cualitativo en el Taller IQ 2005.
| Métodos | Equipo (Casa comercial) | Paraproteínas séricas (Ejercicio B1) Número de laboratorios | Proteínas de Bence Jones (Ejercicio B2) Número de laboratorios |
| Inmunofijación | Hydrasis (Sebia) | 16 | 14 |
| Inmunofijación | Paragon (Beckman) | 1 | 2 |
| Inmunofijación | Agarosa (Helena) | 2 | 3 |
| Inmunoelectroforesis | Manual | 1 | 1 |
| Electroforesis capilar inmunosustractiva | CZE/Hydrasis (Izasa/ Beckman/Coulter) | 1 |
Paraproteínas en muestras de sueros. Descripción de métodos, equipos, parámetros y número de laboratorios participantes en el estudio cuantitativo. Taller IQ 2005.
| Técnica | Equipo(Casa comercial)/Antisueros | Parámetros | Laboratorios Participantes* |
| Nefelometría Punto Final | BNII (Dade-Behring)/Behringwerke | IgG, IgA, IgM | 9 |
| CLT (κ y λ) | 3 | ||
| Nefelometría Cinética | IMMAGE (Beckman-Coulter)/Beckman Institute | IgG, IgA, IgM | 7 |
| CLT (κ y λ) | 3 | ||
| Turbidimetría | Olimp Turb (Roche)/Sistema | IgG, IgA, IgM | 2 |
| CLT (κ y λ) | 1 |
Estudio cuantitativo de proteínas de Bence Jones en muestras de orina. Descripción de métodos, equipos, antisueros, parámetros estudiados y número de laboratorios participantes en el Taller IQ 2005 (Ejercicio B2).
| Método | Equipo / (Casa comercial) | Antisueros | Parámetros (*) |
| Nefelometría punto final (6) | BNII / (Dade-Behring) | Behringwerke NCS / | CLT ¿ y λ (3) |
| New Scientif Company | CLL ¿ y λ (3) | ||
| Nefelometría cinética (3) | IMMAGE /(Beckman-Coulter) | Beckman Institute NCS/ | CLT ¿ y λ (1) |
| New Scientif Company | CLL ¿ yλ (2) |
CLT: Antisueros anti-cadenas ligeras totales; CLL: Antisuero anti-cadenas ligeras libres.
Estudio de bandas oligoclonales en muestras de LCR y sueros homólogos. Descripción de métodos, equipos, antisueros, parámetros estudiados y número de laboratorios participantes. Taller IQ 2005 (Ejercicio C).
| Método | Antisueros | Fabricante geles | No Laboratorios |
| Isoelectroenfoque y western blot | Anti IgG FA (Jackson) | Método manual | 1 |
| Isoelectroenfoque y western blot | Anti IgG FA (Jackson) | Helena | 1 |
| Isoelectroenfoque y western blot | Anti IgG PO (Helena) | Helena | 5 |
| Isoelectroenfoque e inmunofijación | Anti IgG (Sebia) | Sebia | 1 |
Los laboratorios realizaron las cuantificaciones de las Inmunoglobulinas (Igs) IgG, IgA, IgM, los factores del complemento C3 y C4 y los reactantes FR, PCR y ASLO en las muestras descritas en la Tabla I.
Se utilizaron los métodos de Nefelometría a Punto Final (NefPF) con los equipos BN II (Dade-Behring), los métodos de Nefelometría Cinética (NefC) con los equipos IMMAGE (Beckman/Coulter), y los métodos de Turbidimetría con los equipos Olimpus Turb y Modular/Roche. Cada laboratorio utilizó su método habitual de trabajo, con los respectivos antisueros establecidos por los proveedores. Los métodos, equipos y antisueros empleados se describen en la Tabla II.
Estudio de la cuantificación de IgE total en muestras de controles comerciales (Ejercicio A3)La cuantificación de IgE total (Ejercicio A3) se realizó en los tres CC descritos en la Tabla I. En el ejercicio participaron un total de 20 laboratorios. Los métodos, equipos y reactivos utilizados se muestran en la Tabla III.
Estudio de las paraproteínas en muestras séricas (Ejercicio B1)El análisis de paraproteínas en las 5 muestras séricas del Ejercicio B1, consistió en la identificación del componente monoclonal (CM) y su análisis cualitativo.
La identificación de los CM fue realizada con los equipos descritos en la Tabla IV, participando 21 laboratorios. Se emplearon las técnicas siguientes: Inmunofijación (IF) (19 laboratorios), electroforesis capilar sustractiva (ECS) (1 laboratorio) e inmunoelectrofóresis (IEF) (1 laboratorio). Los antisueros empleados en el reconocimiento de las Igs y de las cadenas ligeras (CL), proceden de los respectivos proveedores del material técnico de los equipos.
El análisis cuantitativo de las paraproteínas séricas se llevó a cabo con los métodos, equipos y antisueros descritos en la Tabla V. Los parámetros cuantitativos valorados en el estudio de las paraproteínas séricas son la cuantificación de las Igs (IgG, IgA e IgM), de las cadenas ligeras totales de tipo k y λ (CLT) y el cálculo del cociente k/λ . La cuantificación de los isotipos de las Igs (IgG, IgA e IgM; Tabla XII) fue analizada en 18 laboratorios (muestra-50401), 17 laboratorios (muestra-50402), 13 laboratorios (muestra-50403), 18 laboratorios (muestra-50404) y 17 laboratorios (muestra-50405). Se empleó en 9 laboratorios el método de NefPF, en 7 laboratorios el método de NefC y en 2 laboratorios el método Turbidimétrico (Tabla V).
Además se cuantificaron las CLT k y λ en 7 laboratorios (muestra-50401), 5 laboratorios (muestra-50402), 2 laboratorios (muestra-50403), 7 laboratorios (muestra-50404), y 6 laboratorios (muestra-50405). De ellos, 3 laboratorios emplean el método de NefPF, otros 3 el método de NefC y 1 el método Turbidimétrico (Tabla V). Los 7 laboratorios emplean antisueros anti-CLT, los cuales reconocen las CL libres (CLL) y las ligadas a las cadenas pesadas.
Estudio de Proteínas de Bence Jones (PBJ) en muestras de orina (Ejercicio B2)El estudio de las PBJ en muestras de orina del Ejercicio B2, consistió en la identificación y análisis cuantitativo de las CL en las cuatro muestras remitidas. El análisis cualitativo del CM de las PBJ en las muestras de orina fue realizado en 20 laboratorios con los métodos, equipos y antisueros descritos en la Tabla IV.
Los métodos y antisueros empleados en el estudio cuantitativo se describen en la Tabla VI. La cuantificación en orina de las CL k y λ se realizó en 9 laboratorios, en todos ellos con métodos nefelométricos, 6 laboratorios con NefPF y 3 con NefC. Las CLT se estimaron en 4 laboratorios y las CLL libres en 5 laboratorios. En 4 laboratorios se estimaron las CLT k y λ, de ellos 3 emplearon antisueros anti-CLT de Behringwerke (equipos Dade-Behring) y 1 del Instituto Beckman (equipo IMMAGE, Beckman-Coulter). En 5 laboratorios se valoraron las CLL κ y λ, todos ellos con antisueros anti CLL k y λ, de NCS (New Scientific Company) (3 con los equipos de Dade y 2 con IMMAGE), de NCS.
Estudio de bandas oligoclonales (BOC) en líquido cefalorraquídeo (LCR) (Ejercicio C)El análisis de las BOC en LCR del ejercicio C se estudio en 8 laboratorios, con los métodos, equipos y antisueros descritos en la Tabla VII.
La valoración de las bandas oligoclonales se realizó contrastando la presencia de bandas en el LCR y en el suero homólogo; los patrones fueron clasificados como "Positivo" si se detecta la presencia de al menos dos BOC en LCR, con un patrón policlonal en la muestra pareada de suero; el patrón "Más que" indica la presencia de BOC en suero con al menos dos bandas adicionales en LCR; el patrón en "Espejo" indica la presencia del mismo patrón de bandas en LCR y suero; por último el patrón "Negativo" se observa cuando se detecta IgG policlonal en LCR y suero. Los dos primeros patrones indican la existencia de síntesis intratecal de IgG; en los dos siguientes se da la ausencia de la misma. En la Figura 1 se muestra un ejemplo de los tres patrones.
LCR: Distintos patrones de IgG que se observan cuando muestras pareadas de suero (S) y líquido cefalorraquídeo se estudian mediante isoelectroenfoque e inmunodetección. (I) Patrón policlonal: no se detectan bandas oligoclonales (BOC ni en suero ni en líquido cefalorraquídeo (LCR); (II) Patrón en espejo: se detecta el mismo patrón de bandas en LCR y en la muestra pareada de suero; (III) Patrón "Más que": se detectan BOC en suero y LCR, con al menos dos bandas adicionales en la muestra de LCR al compararla con el suero; (IV) Patrón positivo: se detectan BOC en LCR y un patrón policlonal en la muestra pareada de suero. Los patrones III y IV implican síntesis intratecal de IgG.
En el análisis estadístico de la cuantificación de los parámetros IQ se valoró la media de los resultados (x) y el coeficiente de variación (% CV) interlaboratorio. El criterio de homogeneidad se estableció sobre el valor del % del CV, clasificando los resultados como concordantes si el % CV era menor del 10%, discordantes entre un 10 y un 20% y muy discordantes si el % era mayor de 20. En las series de resultados se aplicó la prueba estadística de Grubbs(6-8) para descartar los valores discrepantes. En los ejercicios con paraproteínas se realizó el estudio de homogeneidad en los resultados cuantitativos y en los datos cualitativos se comparó la descripción de los CM.
RESULTADOS. EJERCICIOS TALLER 2005Cuantificación de los parámetros inmunoquímicos (IQ) IgG, IgM, IgA, C3 y C4, en muestras de Controles Comerciales (CC) (Ejercicio A1)Las valoraciones estadísticas de los valores medios (x), coeficiente de variación (CV) y CV modificado por el estadístico de Grubbs)(6, 7) relativas al estudio de IgG, IgM, IgA, C3, C4, analizados en las cuatro muestras de los CC (Tabla I) del Ejercicio A1, se detallan en la Tabla VIII.
Cuantificación de Parámetros Inmunoquímicos. Descripción de los Valores Medios (x), % Coeficiente de Variación (CV) y modificaciones con la aplicación del estadístico de Grubbs. Taller IQ 2005 (Ejercicio A1).
| Muestra | IgG (n23) (*22) | IgA (n23) (*22) | Parámetro (n) (*) IgM (n23) (*22) | C3 (n23) (*22) | C4 (n23) (*22) |
| 50101 | |||||
| x (CV %) | 1132 (7,7) | 248,9 (10,7) | 104 (10,0) | 179,9 (9,0) | 45,7 (13,5) |
| Grubbs: x (CV %) (a/b) | 249 (7) (21a/2b) | 105 (9,6) (22a/1b) | 44 (9,6) (21a/2b) | ||
| 50102 | |||||
| x (CV %) | 694 (4,5) | 126,9 (5,0) | 86,6 (6,9) | 68 (5,7) | 15 (6,9) |
| Grubbs: x (CV %) (a/b) | |||||
| 50103 | |||||
| x (CV%) | 1084 (5,0) | 235 (10,2) | 98 (11,0) | 168,9 (9,0) | 42 (10,6) |
| Grubbs: x (CV %) (a/b) | 240,5 (7) (21a/2b) | 99 (9) (22a/1b) | 41,6 (9,9) (22a/1b) | ||
| 50104 | |||||
| x (CV %) | 1198 (5,9) | 239,7 (7,0) | 95 (6,8) | 179 (9,0) | 29,6 (9,5) |
| Grubbs: x (CV %) (a/b) |
(n) Número de determinaciones realizadas.
En cada uno de los parámetros y muestras analizadas se detalla el Valor Medio (x) y el CV (%) del conjunto de los laboratorios participantes. En todos se aplicó el estadístico de Grubbs, si la prueba descarta algún valor se detalla el Valor Medio x, el CV (%) modificado y el cociente (a)/(b): (a) Número total de laboratorios participantes/(b) Número de laboratorios excluidos al aplicar la prueba estadística de Grubbs.
En la cuantificación de las Igs se observa una buena concordancia (CV<10%) en los resultados correspondientes a la IgG en todos los CC (n, 4) analizados, e igualmente a las IgA e IgM de los CC50102 y CC50104, sin embargo los resultados relativos a las IgA e IgM de los CC50101 y CC50103 fueron discordantes (10 %<CV<20 %). La aplicación del estadístico de Grubbs a las cuantificaciones de IgA e IgM (CC50101 y 50103, CV >10 %), señala que la eliminación de los resultados de los laboratorios discrepantes, que fueron dos laboratorios en las determinación de IgA en los CC50401 y CC50403 y un laboratorio en la determinación de IgM en los CC50401 y CC50403, de un total de 23 valoraciones (22 laboratorios), mejora los % CV y a todos ellos los sitúa en porcentajes inferiores al 10 % (Tabla VIII).
El análisis estadístico de los niveles del componente C3 del complemento, muestra una buena concordancia (CV<10 %) en los 4 CC estudiados. La cuantificación de los niveles del factor C4 indica discordancia con un CV >10 % en los CC50101 y CC50103 y la aplicación del estadístico de Grubbs permitió descartar respectivamente el valor de las determinaciones de dos y uno de los laboratorios participantes y en todos los hace inferiores al 10 % (Tabla VIII).
No se analizaron los resultados agrupados según las metodologías de NefC (7, laboratorios), NefPF (13, laboratorios) y Turbidimetría (3, laboratorios) al ser muy pocos los laboratorios participantes, en especial respecto a la aplicación de métodos turbidimétricos (Tabla II).
Estudio de Reproducibilidad. Comparación de las muestras 50101 y 5010El análisis comparativo de las cuantificaciones de los parámetros IgG, IgA, IgM, C3 y C4 de los CC50101 y CC50103 (CC50101 diluido al 95%), de todas las valoraciones realizadas (23, determinaciones) en los laboratorios participantes (22, laboratorios) nos muestra diferencias que no sobrepasan la discrepancia del 0,5% entre los dos CC (Tabla VIII). Los participantes pueden evaluar su imprecisión intralaboratorio como prueba de validación interna de técnicas de cada uno de los parámetros en su tabla de reproducibilidad personal (datos no mostrados).
Cuantificación de los parámetros PCR, FR y ASLO, en muestras de Controles Comerciales (CC) (Ejercicio A2)Las valoraciones estadísticas de los valores medios (x), coeficiente de variación (CV) y CV modificado por el estadístico de Grubbs)(6, 7) relativas al estudio y el análisis de los parámetros PCR, FR y ASLO, analizados en las tres muestras de los CC del ejercicio A2, se detallan en la Tabla IX.
Cuantificación de Parámetros Inmunoquímicos. Descripción de los valores medios (x), % coeficiente de variación (CV) y modificaciones con la aplicación del estadístico de Grubbs. Taller IQ 2005 (Ejercicio A2).
| Muestra | PCR (n, 15) | Parámetro (n) ASLO (n, 10) | FR (n, 18) |
| 50201 | |||
| x (CV %) | 5 (10,6) | 292 (39,0) | 166,7 (18,0) |
| Grubbs: x (CV %) (a/b) | 4,9 (7,0) (14a/ 1b) | ||
| 50202 | |||
| x (CV %) | 7,5 (8,0) | 410,5 (18,7) | 157 (23,9) |
| Grubbs: x (CV %) (a/b) | 7 (5,7) (14a/ 1b) | ||
| 50203 | |||
| x (CV %) | 4,4 (9,8) | 234 (30,7) | 85,7 (27,9) |
| Grubbs: x (CV %) (a/b) | 4,3 (7,8) (14a/ 1b) |
(n) Número de Laboratorios participantes.
En cada uno de los parámetros analizados se muestre el Valor Medio (x) y el CV (%). En los parámetros en los que la prueba estadística de Grubbs descartó valores se detalla el valor medio x y el CV (%) modificado. Cociente (a)/(b): (a) Número total de laboratorios participantes /(b) Número de laboratorios excluidos, después de aplicar el estadístico de Grubbs.
El parámetro PCR (15 laboratorios) (estándar-IFCC) muestra una concordancia buena o intermedia en los tres CC valorados (% CV: 10,6; 8 y 9,8), todos mejoran al aplicar el estadístico de Grubbs (% CV: 7; 5,5 y 7,8), únicamente se eliminan los resultados de un laboratorio, que usa el método IMMAGE/MODULAR, no así el resto de los usuarios de los métodos de NefC/ IMMAGE (4 laboratorios), NefPF/ DADE (8 laboratorios) y Turbidimetría (2 laboratorios) (Tabla II).
Los parámetros FR (18 laboratorios) y ASLO (10 laboratorios) muestran una alta discrepancia (% CV>18) en los 3 CC estudiados. Además, el % CV no mejora con la aplicación del estadístico de Grubbs (Tabla IX). Al ser parámetros aun no estandarizados por la IFCC, la falta de homogeneidad en la cuantificación del FR y el ASLO en los 3 CC valorados puede estar asociada a las distintas estandarizaciones empleadas en la preparación de los CC por los tres fabricantes de reactivos (CC50201-Dade Behring, CC50202-Beckman y CC50203-Vitro).
Cuantificación de IgE total en Controles Comerciales de Pharmacia Diagnostic (Ejercicio A3)En la Tabla X se detallan las medias (x) y los % CV, de la cuantificación de IgE total realizada en los tres CC de Pharmacia Diagnostic (Tabla I). En el estudio se observa una concordancia buena a intermedia en los 3 CC valorados (% CV: 17,7; 9,54 y 13,85); los % CV de los CC-50301 y CC- 50302 mejoran con la aplicación del estadístico de Grubbs (% CV: 10,81 y 7,07 y 13,85) con las cinco metodologías (CAP; NefPF; Enzima Inmunoensayo, Turbidimetría y Quimioluminiscencia) y los seis equipos empleados (Tabla III). La mayor dispersión corresponde al CC50303 con los niveles mayores de IgE.
Cuantificación de IgE Total. Descripción de los Valores Medios (x), % Coeficiente de Variación (CV) y modificaciones al aplicar el estadístico de Grubbs. Taller IQ 2005 (Ejercicio A3).
| Muestra | IgE Total (n, 20) |
| 50301 | |
| x (CV%) | 19,41(17,77) |
| Grubbs: x (CV %) (a/b) | 20,02 (10,81) (19a/1b) |
| 50302 | |
| x (CV%) | 91,37 (9,54) |
| Grubbs: x (CV %) (a/b) | 92,70 (7,07) (19a/1b) |
| 50303 | |
| x (CV%) | 423,17 (13,85) |
| Grubbs: x (CV %) (a/b) | - |
(n) Número de laboratorios participantes.
En cada uno de los parámetros analizados se muestre el Valor Medio (x) y el CV (%). En los parámetros en los que la prueba estadística de Grubbs descartó valores se detalla el valor medio x y el CV (%) modificado. Cociente (a)/(b): (a) Número total de laboratorios participantes /(b) Número de laboratorios excluidos, después de aplicar el estadístico de Grubbs.
El estudio de las cinco paraproteínas séricas remitidas a los participantes (Tabla I) incluye la identificación del CM (Tabla XI) y la evaluación cuantitativa de IgG, IgA, IgM y las CL κ y λ ( Tabla XII), empleando los equipos y antisueros descritos en las Tablas IV y V.
Valores Medios y Coeficiente de Variación (CV %) de la cuantificación de Igs (IgG, IgM, IgA) y cociente κ/λ en las muestras de paraproteínas séricas. Taller IQ 2005 (Ejercicio B1).
| Muestra | IgG | IgA | IgM | Cociente κ/λ | Paraproteína Consenso |
| 50401 (n, 18) | |||||
| x (CV %) | 1727,5 (4,1) | 199,1 (17,2) | 4346,2(*) (34,5) | κ/λ =2,29 (n, 7) | Cadenas μ |
| I50402 (n, 17) | |||||
| x (CV %) | 1108,2 (*) (5,6) | 96,1 (11,5) | 127,3 (7,7) | κ/λ=4,95 (n, 7) | IgG κ |
| 50403 (n, 13) | |||||
| x (CV %) | 2781,0 (5,8) | 75,5 (11,9) | 87,1 (10,4) | κ/λ=4,74 (n, 7) | IgG policlonal |
| 50404 (n, 18) | |||||
| x (CV %) | 1262,2 (5,4) | 443,1(*) (11,8) | 195,8 (7,3) | κ/λ=1,61 (n, 7) | IgAλ |
| 50405 (n, 17) | |||||
| x (CV %) | 1075,5 (*) (5,5) | 109,9 (5,9) | 100,3 (25,1) | κ/λ=1,85 (n, 7) | IgG λ |
Parámetros: x=Valor Medio de las cuantificaciones. CV %=Coeficiente de Variación expresado en porcentaje de las cuantificaciones de los parámetros estudiados.
(n) Número de laboratorios participantes. La cuantificación de Igs fue realizada en un número máximo de 18 laboratorios y de CLT (κ y λ) en 7 laboratorios. En las columnas se detalla el promedio de la cuantificación de las Igs (IgG, IgM, IgA) y el cociente κ/λ.
Los resultados de la identificación de los CM de las cinco disproteinemias estudiadas en el IV Taller de IQ se describen en la Tabla XI. Las muestras remitidas por los Servicios de Inmunología de los Hospitales Gregorio Marañón y Carlos III de Madrid y Virgen de la Arrixaca de Murcia se refieren en la Tabla I y los métodos de inmunofijación empleados se detallan en la Tabla IV. Todos los laboratorios (n=21) muestran una alta homogeneidad en la identificación del CM en las cinco paraproteínas estudiadas.
Estudio de paraproteínas séricas. Descripción de los Componentes Monoclonales. Taller IQ 2005 (Ejercicio B1).
| Muestra (n) | Identificación Inmuno electroforética (*) Descripción de la disproteinemia identificada |
| 50401 (n 21) | Cadenas pesadas μ (20*), Asociado a:IgAκ (3*)λ débil (1*)Actividad de piroglobulina (2*)No detecta paraproteína (1*) |
| 50402 (n 21) | IgG κ (21*) |
| 50403 (n 20) | IgG Policlonal (11*)λ libre (5*)IgG κλ Biclonal ( 2*)IgGλ/λ libre Biclonal (1*)Muestra insuficiente (1*) |
| 50404 (n 21) | IgA λ (19*) Asociado a:IgM λ (3*)Cadenas pesadas . (1*)No detecta paraproteína (1*) |
| 50405 (n 21) | IgG λ (21*) |
(n) Número total de laboratorios participantes en la identificación de la muestra.
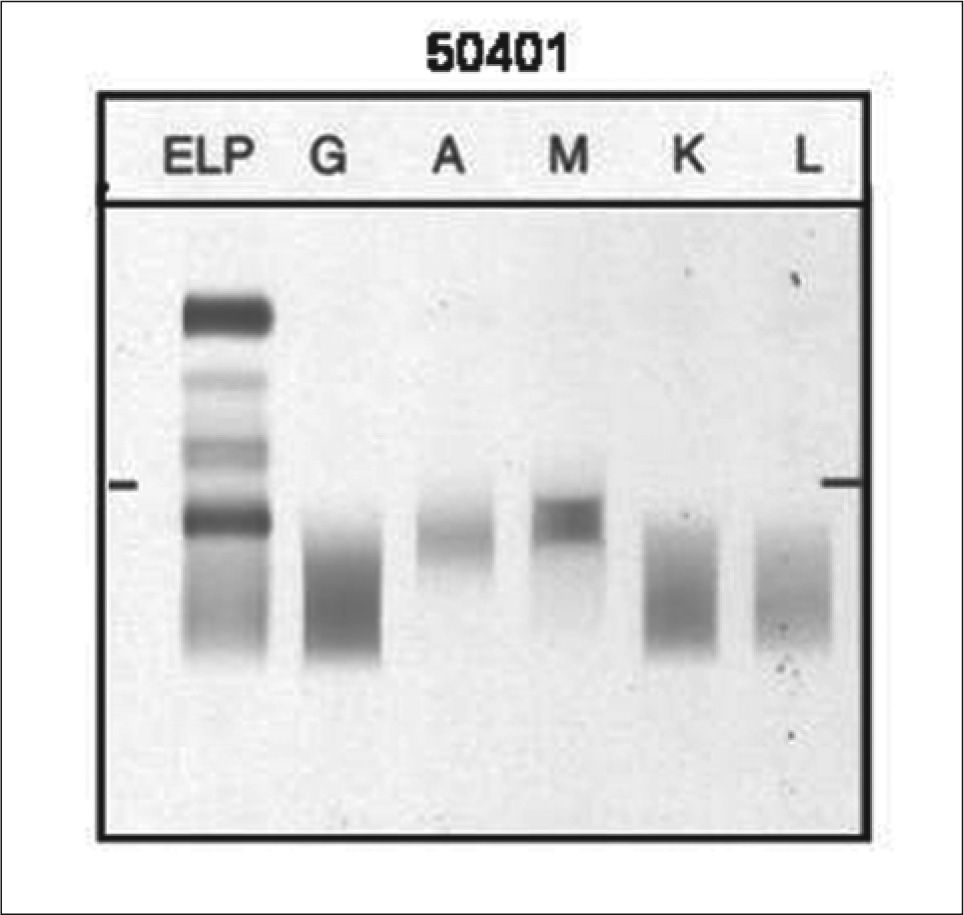
La muestra 50401 (Tabla I) procedía de una muestra remitida por el laboratorio emisor (Hospital Carlos III, Madrid) con el diagnóstico de enfermedad de cadenas pesadas μ y que además presentaba actividad de piroglobulina. La propiedad de piroglobulina la presentan ciertas proteínas que cuando se calientan a 56°C durante 30 minutos, dan lugar a su precipitación irreversible(9). Los estudios cualitativos se realizaron en un total de 21 laboratorios (Tabla XI). En 20 laboratorios fue detectada la cadena pesada μ, 3 laboratorios lo asocian además con la presencia de IgAκ y 1 laboratorio a CLλ. En 1 laboratorio no se detectó la presencia de la
paraproteína y 2 laboratorios demuestran la actividad de piroglobulina. El CM de la piroglobulina se definió por inmunofijación y se confirmó por inmunoblot en SDS-PAGE (datos no mostrados). La Inmunodetección con las técnicas de Inmunofijación y los equipos de Sebia del suero 50401 se detallan en la Figura 2.
Inmunofijación de la paraproteína sérica 50401. La muestra se aplicó sobre los marcos señalados en el gel, las proteínas se separan por electroforesis. Los antisueros mono específicos anti-IgG, IgA, IgM, ¿ y λ, se vierten en los cinco marcos para su unión inmune. Tras la fijación, el gel de inmunoelectroforesis se lava y las proteínas se tiñen. EPS o SPE: Electroforesis de las proteínas séricas. La inmunofijación del suero 50401 revela la presencia de cadenas pesadas μ
La muestra 50402 (Tabla I), procedía de una muestra remitida por el laboratorio emisor (Hospital Gregorio Marañón, Madrid). Los estudios cualitativos (Tabla XI) se realizaron en 21 laboratorios y en todos ellos se identificó una banda monoclonal IgGκ en absoluta concordancia con el laboratorio de referencia. En la Figura 3 (gel 1) se muestra el patrón de la Inmunofijación del suero 50402.
Inmunofijación de las paraproteínas séricas de las muestras 50402, 50403, 50404 y 50405.
Las muestras 50402, 50403, 50404 y 50405 se aplican sobre los marcos señalados en los geles respectivos (1, 2, 3 y 4), y las proteínas se separan por electroforesis. Los antisueros monoespecíficos anti-IgG, IgA, IgM, ¿ y λ se vierten en los marcos para su unión inmune. Tras la fijación, los geles de inmunoelectroforesis se lavan y las proteínas se tiñen. El análisis del gel 1 (muestra 50402) contiene una proteína monoclonal IgG¿ El análisis del gel 2 (muestra 50403) revela un aumento policlonal de la proteína IgG. El análisis del gel 3 (muestra 50404) revela una proteína monoclonal IgAλ El análisis del gel 4 (muestra 50405) revela una proteína de cadenas monoclonal IgGλ EPS o SPE: Electroforesis de las proteínas séricas.
La muestra 50403 (Tabla I), procedía de un patrón sérico remitido por el laboratorio emisor (Hospital Gregorio Marañón, Madrid), caracterizado como una hipergammaglobulinemia policlonal (Tabla XI). Los estudios cualitativos se realizaron en un total de 20 laboratorios, siendo los resultados recogidos muy variados: 11 laboratorios identificaron IgG policlonal, 5 laboratorios λ libre, 2 laboratorios IgG κλ biclonal, 1 laboratorio IgG λ/λ libre de tipo biclonal y en 1 laboratorio la muestra fue insuficiente . En la Figura 3 (gel 2) se muestra el patrón de la Inmunofijación del suero 50403.
Análisis individualizado de la paraproteína 50404La muestra 50404 (Tabla I), procedía de un patrón sérico definido por el laboratorio emisor (Hospital Carlos III, Madrid) y caracterizada como proteína monoclonal IgAλ (Tabla XI). Los estudios cualitativos por métodos de inmunofijación se realizaron en 21 laboratorios. En 19 laboratorios se detectó IgAX y 3 laboratorios lo asociaron a IgM λ. En un laboratorio se informó de cadenas pesadas • y un laboratorio no demostró la presencia de la proteína monoclonal. En la Figura 3 (gel 3) se muestra el patrón de Inmunofijación del suero 50404.
Análisis individualizado de la paraproteína 50405En la muestra 50405 (Tabla I) todos los laboratorios participantes identificaron una paraproteína IgGλ (Tabla XI).
Los estudios cualitativos con la inmunofijación de la muestra 50405 se realizaron en 21 laboratorios, en todos se identificó una banda monoclonal IgGλ. En la Figura 3 (gel 4) se muestra el patrón de Inmunofijación del suero 50405.
Estudio de las cuantificaciones de las paraproteínas séricas del Taller 2005En la Tabla XII se detallan las valoraciones estadísticas de las medias y los coeficientes de variación (% CV) de las cuantificaciones de las Igs (IgG, IgA e IgM) y el cociente κ /λ de las CLT, en las cinco paraproteínas estudiadas (Tabla I). En un máximo de 18 laboratorios se realizó la cuantificación de las Igs que mostró % CV muy variados. La cuantificación de CLT κ y λ únicamente se realizó en 7 laboratorios.
Análisis cuantitativo de la muestra 50401Los estudios cuantitativos de la muestra 50401 se realizaron en 18 laboratorios (Tabla XII). Los valores medios de la cuantificación de IgG, e IgM muestran aumento de los niveles séricos en las dos Igs, especialmente IgM. En la cuantificación del CM IgM, 2 laboratorios, que emplean el sistema Turbidimétrico (Modular/Roche) observaron niveles muy bajos. En IgG la correlación (% CV: 4,1) fue buena, mientras que en IgA (% CV: 17,2) e IgM (% CV: 34,5) fue baja, aunque la mayor discrepancia fue en la cuantificación del CM IgM. El cociente κ /λ (n=7) es de 2,29.
Análisis cuantitativo de la muestra 50402Los estudios cuantitativos de la muestra 50402 (Tabla I) se realizaron en 17 laboratorios (Tabla XII). Los valores medios y los % CV de la cuantificación de las Igs IgG, IgA, IgM (% CV: 5,6; 11,5; 7,7) muestran buena correlación. El cociente κ /λ=4,95 (n=7), muestra aumento de cadenas ligeras κ, en concordancia con el tipo de CL asociada al isotipo G del CM.
Análisis cuantitativo de la muestra 50403Los estudios cuantitativos de la muestra 50403 se realizaron en 13 laboratorios (Tabla XII). Los valores medios y los % CV (% CV: 5,8; 11,9; 10,4) de la cuantificación de las Igs, muestran buena correlación, aunque 1 laboratorio que trabaja con Modular Roche, reporta la cuantificación de IgA e IgM, ligeramente alta. Los niveles de IgG de la muestra están elevados. El cociente κ/λ=4,74; (n=7) muestra aumento de las cadenas ligeras κ.
Análisis cuantitativo de la muestra 50404Los estudios cuantitativos de la muestra 50404 se realizaron en 18 laboratorios (Tabla XII). Los valores medios y los % CV (% CV: 5,4; 11,8; 7,3) muestran buena correlación. Los niveles de IgG e IgA muestran aumentos en especial el CM (IgA). El cociente κ /λ=1,61 (n=7), señala aumento de cadenas ligeras λ, como corresponde al tipo de CL asociada al isotipo A del CM.
Análisis cuantitativo de la muestra 50405Los estudios cuantitativos de la muestra 50405 se realizaron en 17 laboratorios (Tabla XII). Los valores medios y los % CV de la cuantificación de las Igs, IgG, IgA y el cociente κ /λ, muestran buena correlación, aunque 1 laboratorio reporta la cifra de la cuantificación de IgM muy baja (Dade). Los valores medios de la cuantificación de las Igs, IgG, IgA muestran niveles en el rango de las Igs séricas, la correlación de los % CV es buena en el CM IgG, en la IgA, y muestra discordancia en la IgM (% CV 25,1). El cociente κ/λ=1,85 (n=7), señala aumento de cadenas ligeras λ asociada al isotipo G del CM.
Análisis cuantitativo de las CLT κ y λLos estudios cuantitativos de las CLT κ /λ de las cinco disproteinemias se realizaron en 7 laboratorios. Los resultados de los valores medios y % CV de la cuantificación de las CLT (κ y λ) no se presentan por ser pequeño el número de participantes. Tampoco se pudieron agrupar al emplear distintos métodos de estudio y equipos (3 laboratorios emplean Inmage, 3 Dade, 1 Modular Roche) (Tabla V). El análisis de homogeneidad de las CLT (κ y λ) muestra resultados discrepantes debido fundamentalmente a los diferentes procedimientos de estandarización de los tres fabricantes (Beckman-Coulter, Dade-Behring y Roche) que aportan los reactivos.
En cada una de las muestras se valoró el cociente κ /λ,que presenta un valor mayor de 2 en los especímenes de la proteína monoclonal IgGK 50402 y de la IgG policlonal 50403, e inferior de 2 en los CM IgAλ 50404 e IgGλ-50405. En el suero 50401 el cociente κ /λ no sirve de ayuda para el diagnóstico de la cadena pesada μ (Tabla XII).
Estudio de las Proteínas de Bence Jones (PBJ) en muestras de orina (Ejercicio B1).Los resultados de la identificación cualitativa de las PBJ en las cuatro orinas estudiadas (Tabla I) se muestran en la Tabla XIII. Los 20 laboratorios participantes identifican el componente monoclonal de la PBJ con los ensayos de inmunoelectrofóresis descritos en la Tabla IV. La inmunodetección con las técnicas de Inmunofijación y los equipos de Sebia de las PBJ, se detallan en la Figura 4. Las cuatro muestras de orina se caracterizaron en el laboratorio emisor como 50501-PBJλ (gel 1), 50502-PBJλ (dilución de 50501) (gel 2); 50503-PBJκ (gel 3) y 50504-PBJκ (gel 4) (dilución de 50503). En las muestras 50501 y 50502 los 20 laboratorios participantes identificaron PBJλ, y 1 laboratorio lo asoció a IgMλ. En las muestras 50503 y 50504, todos los laboratorios identificaron PBJκ, y se asoció en 2 laboratorios a IgGκ. En las cuatro muestras no existieron discrepancias o fueron menores exclusivamente en las muestras más concentradas (50501, 50503) probablemente debidas a un efecto prozona.
Descripción cualitativa de las proteínas de Bence Jones (PBJ) analizadas en las muestras de orina. Taller IQ 2005 (Ejercicio B2).
| Muestra (n) | Identificación Inmuno electroforética (*)Descripción de la disproteinemia identificada |
| 50501 (n, 19) | Bence Jones λ (18)Asociado a IgM λ(1) |
| 50502 (n, 20) | Bence Jones λ(20) |
| 50503 (n, 20) | Bence Jones κ (18)Asociado a IgG κ (2) |
| 50504 (n, 20) | Bence Jones κ (20) |
(n) Número de total de laboratorios participantes en la identificación de la muestra.
Inmuno-fijación de Proteínas de Bence Jones en muestras de orina. Las muestras 50501, 50502,50503 y 50504 se aplican sobre los marcos señalados en los geles respectivos (1, 2, 3 y 4), las proteínas se separan por electroforesis. Los antisueros monoespecíficos anti-IgG, IgA, IgM, ¿ y λ se vierten en los cinco marcos para su unión inmune. Tras la fijación, el gel de inmunoelectroforesis se lava y las proteínas se tiñen. El análisis del gel 1 (muestra 50501) revela una proteína BJλ. El análisis del gel 2 (muestra 50502) revela una proteína BJλ. El análisis del gel 3 (muestra 50503) revela una proteína BJ¿. El análisis del gel 4 (muestra 50504) revela una proteína BJ¿. EPS o SPE: Electroforesis de las proteínas de la orina
Los métodos y antisueros empleados en el estudio cuantitativo de las PBJ se describen en la Tabla VI. En cuanto a la cuantificación de las PBJ, en las muestras PBJλ (50501) y PBJλ (50502) se demostró aumento del respectivo tipo de CLλ. En las muestras PBJκ (50403) y PBJκ (50404), la cuantificación de la cadena κ fue mayor. En las muestras 50502 y 50504, diluciones respectivas de las muestras 50501 y 50503, los niveles de las PBJλ y PBJκ fueron muy bajos debido al bajo nivel de CM en las alícuotas finales.
Los escasos laboratorios (n=9) (Tabla VI) que reportaron resultados cuantitativos mostraron una gran dispersión debido a las metodologías empleadas, lo cual refleja los distintos procedimientos de estandarización, métodos de estudio y antisueros empleados en la cuantificación de CLT o CL (datos no mostrados).
Resultados del Estudio de bandas oligoclonales (BOC) en líquido cefalorraquídeo (LCR) (Ejercicio C)Los resultados del estudio de bandas oligoclonales en tres pares de muestras de líquido cefalorraquídeo (LCR) y suero se muestran en la Tabla XIV. A pesar de la heterogeneidad en las técnicas empleadas (Tabla VII), se obtuvo un 100% de concordancia entre los ocho laboratorios participantes en cuanto a la presencia o ausencia de síntesis intratecal de IgG. En este sentido, todos los laboratorios calificaron la muestra 50601 como positiva y las muestras 50602 y 50603 como negativas.
Descripción de los Patrones del estudio de Bandas Oligoclonales en LCR y suero homólogo. Taller IQ 2005 (Ejercicio B1).
En cuanto a la descripción de los patrones de bandas, los resultados fueron más heterogéneos. La muestra 50601 fue definida como patrón positivo (Bandas presentes exclusivamente en LCR) por siete laboratorios, mientras que otro la definió como patrón "más que" (bandas presentes en suero y al menos dos bandas adicionales en la muestra pareada de LCR). En la muestra 50602 fue donde se encontró la mayor heterogeneidad. Cuatro laboratorios la definieron como policlonal (Ausencia de bandas en LCR y suero), mientras que otros cuatro la definieron como patrón en espejo (El mismo patrón de bandas en suero y LCR). Finalmente, seis laboratorios informaron la muestra 50603 como policlonal, y los dos restantes como patrón en espejo.
DISCUSIÓN. TALLER 2005La publicación de nuestro anterior Taller 2004(3) nos demostró la capacidad de los laboratorios españoles en la consecución de los objetivos primordiales del mismo: el análisis de los parámetros IQ y la definición de las paraproteínas básicas. A la vista de los resultados de dicho Taller, el grupo de IQ de la SEI se planteó abordar en el Taller 2005 el estudio diferencial de los parámetros IQ homologados y no homologados por la IFCC. En el estudio de las paraproteínas del Taller 2005, se abordó el estudio de algunas paraproteínas raras con distinta incidencia y frecuencia. Además, en ese taller se incluyó, por primera vez, el estudio interlaboratorio de las bandas oligoclonales en LCR.
Los ejercicios interlaboratorio de cuantificación de parámetros IQ se han analizado según las normas internacionales de estandarización y metrología (ISO, www.iso.org; EPTIS, www.eptis.bam.de; AOAC, www.aoac.org) para estudios en colaboración(8), con idénticos criterios a los llevados a cabo en el Taller 2004(3).
Los estudios de los parámetros IQ en las muestras séricas, abordados en el Taller 2005, muestran muy buena homogeneidad, especialmente en los parámetros estandarizados por la IFCC (IgG, IgA, IgM, C3, C4, y PCR), exceptuando la valoración de los parámetros IgA, IgM y el componente C4 del complemento. La leve desviación de los parámetros anteriores se corrigió eliminando los valores discrepantes con la aplicación de la prueba estadística de Grubbs(6-8). La cuantificación de los reactantes séricos FR y ASLO, parámetros IQ no estandarizados por la IFCC, muestran falta de homogeneidad. No se valoró si podría mejorar al agrupar los resultados por equipos y métodos, dado el bajo número de participantes (n<20), lo cual nos impide aplicar valoraciones estadísticas. En futuros Talleres sería conveniente realizar estudios de estos dos parámetros con los distintos métodos analíticos y con un número más amplio de participantes.
La cuantificación de IgE muestra homogeneidad, si exceptuamos la comparabilidad en la muestra con niveles altos(9). El grupo de IQ piensa incorporar, en posteriores Talleres, la cuantificación de IgE específica a los antígenos más solicitados en los laboratorios clínicos.
El análisis estadístico de los parámetros IQ demuestra la necesidad y utilidad de la realización de ejercicios interlaboratorio, así como la aplicación de los controles de calidad intralaboratorio que permitan el reconocimiento y la detección precoz de estas situaciones. Los estudios de cuantificación de los parámetros IQ resaltan la importancia de la Metrología clínica, y las ventajas de emplear materiales estandarizados, a partir de los controles internacionales de referencia IFCC para las proteínas plasmáticas(1, 2), de acuerdo con las normas de calidad ISO y las guías de estudios interlaboratorio CLSI /NCCLS (www.clsi.org).
En el estudio de las paraproteínas séricas del Taller 2005 se observó una gran homogeneidad de resultados en dos de las muestras, IgGκ-50402, e IgGλ-50405, y en menor grado en tres que presentaban, respectivamente, aumento policlonal de IgG-50403, IgAλ-50404 y CP μ-50402. El estudio interlaboratorio de la CP μ-50401 permitió abordar el análisis de esta paraproteína de gran interés por la rareza de la enfermedad de CP μ(10). En todos los laboratorios se identificó la CP μ y sólo uno no la detecta; esto pudo ser debido al método de cuantificación turbidimétrico empleado en el citado laboratorio(11, 12).
Mención especial requiere la caracterización de la actividad de piroglobulina presente en la CP μ-50401. Sólo dos laboratorios muestran el hallazgo, y esto se debe a que en los análisis habituales de paraproteínas no se estudia sistemáticamente esta propiedad(13, 14) lo que nos hizo cuestionar la relevancia de estudiar dicha actividad en este tipo de muestras. El reconocimiento del fenómeno de las piroglobulinas tiene importancia como factor de confusión en aquellos ensayos que requieren calentamiento, así en los estudios de inactivación del complemento o en la determinación de niveles del fibrinógeno. Las piroglobulinas son Igs que precipitan irreversiblemente formando un gel cuando el suero es calentado a 56°C durante 30 minutos, a diferencia de la precipitación reversible de las PBJ en condiciones idénticas de calentamiento. Las piroglobulinas constituyen el <1% de las gammapatías monoclonales y un 6% de la macroglobulinemia de Waldenstrom(14). El espécimen estudiado en este Taller procedía de un paciente con enfermedad de CP μ con actividad de piroglobulina, asociado a un linfoma de la zona marginal del bazo.
En el Taller 2005, la cuantificación de las Igs de las cinco muestras disproteinemias muestra homogeneidad en los niveles de IgG, se encuentre en forma de CM o policlonal. En la cuantificación de IgA e IgM los resultados son menos homogéneos, en concordancia con lo descrito en la literatura(11, 12), y es de señalar los de la muestra de CP μ con actividad de piroglobulina, en especial en los dos laboratorios que emplean el método turbidimétrico.
En las cuantificaciones de las CLT κ y λ de las cinco paraproteínas no se pudieron obtener resultados significativos, por el bajo número de laboratorios participantes. La evaluación del cociente κ /λ como marcador de malignidad no aporta datos significativos en las muestras de las CP μ o con aumento policlonal de IgG. Datos recientes continúan debatiendo y ponen de manifiesto el poder predictivo de los niveles séricos de CL libres en el seguimiento de las denominadas paraproteínas de significado incierto(15-17), por lo que sería interesante aumentar el número de laboratorios que emplean este parámetro clínico, en próximos Talleres.
En los laboratorios clínicos el algoritmo de análisis de las disproteinemias incluye la caracterización, el reconocimiento del CM, la cuantificación del isotipo y la alteración del cociente κ /λ, herramientas muy útiles para la identificación y monitorización de las paraproteínas. Los resultados encontrados en los estudios interlaboratorio nos exigen estudiar si las distintas muestras pueden también mostrar la presencia de CL libres, o CP libres. En la actualidad en muchos laboratorios se está implantando el análisis cuantitativo del CM, con el fin de ayudar en el diagnóstico diferencial del mieloma múltiple (10% de los canceres hematológicos) y la denominada gammapatía monoclonal de significado incierto (MGUS), que afecta al 3% de la población >50 años y que evoluciona a mieloma u otras malignidades relacionadas a una tasa del 1% por año(18). En los pacientes con Mieloma Múltiple el nivel del pico monoclonal es un predictor de respuesta beneficiosa en el tratamiento con transplante autólogo(19). En el futuro, los miembros del Grupo de IQ de la SEI debemos realizar un esfuerzo para implantar en un número amplio de laboratorios la cuantificación por densitometría de los CM, como método de estudio en las disproteinemias(11, 18, 19).
La identificación de los componentes monoclonales de las PBJ en orina fue homogénea en todos los laboratorios participantes, aunque dos lo acompañan de la presencia respectiva de IgMλ e IgGκ. Los resultados de la cuantificación de las CLL (κ y λ) en orina muestran discrepancias. El estudio se realizó en nueve laboratorios, que emplean distintos métodos y antisueros. Una posible explicación podría ser que los tres fabricantes de reactivos adjudican distintos valores a las cadenas ligeras en sus respectivas estandarizaciones. En este Taller 2005 no se pudieron realizar estudios estadísticos, al igual que ocurrió en el Taller 2004(3). En las cuantificaciones de las PBJ por métodos nefelométricos, también pueden influir factores tales como son el exceso de antígeno, la posible dimerización de las CLL, su corta vida media y la rápida degradación de las CL en orina, lo que hace aún más difícil la estandarización y realización de los ejercicios.
El apartado de bandas oligoclonales se incluyó por primera vez en este Taller, constituyendo un importante esfuerzo por homogeneizar los resultados, con esta técnica de reciente implantación, que tiene gran utilidad clínica en distintas enfermedades neurológicas y principalmente en el diagnóstico de esclerosis múltiple(20). Los resultados fueron óptimos en cuanto a la concordancia de resultados positivos y negativos, que fue del 100%, superior a la descrita en otros estudios similares(21). Esto es de la mayor importancia de cara a su uso a nivel diagnóstico. En cuanto a los patrones, en las muestras 50601 y 50603 se obtuvo una alta concordancia. En la muestra 50602 se observó mayor disparidad, ya que el 50% de los laboratorios la definieron como patrón en espejo y el otro 50% como patrón policlonal. Estos datos confirman la dificultad en la identificación de los dos patrones negativos ya descrita por otros autores(21). Su identificación de forma homogénea por distintos grupos contribuirá a evaluar su interés como ayuda al diagnóstico de distintas enfermedades neurológicas.
Finalmente, en este Taller concluimos que las pruebas de inter-comparación son una excelente herramienta en los procesos de aseguramiento de la calidad en nuestros laboratorios. Además sirven para asegurar la correcta implantación de nuevas técnicas y para la elaboración de protocolos de trabajo consensuados. En futuros Talleres las líneas de trabajo del grupo de IQ pretenden desarrollar guías de estudio de proteínas plasmáticas.
CONFLICTO DE INTERÉSLos cuatro coordinadores han participado en el Taller sin conflicto de intereses.
A todo el personal técnico de los laboratorios y profesionales participantes por su colaboración en la realización del estudio y a los laboratorios IZASA SA/ Beckman/ Coulter y DadeBehring por el soporte logístico en la distribución de las muestras a los Laboratorios participantes. A las compañías IZASA SA, Dade-Behring, VITRO SA y Pharmacia Diagnostic por la aportación de reactivos control empleados como controles comerciales.